zur
Erlangung der Doktorwurde
der
Naturwissenschaftlich-Mathematischen
Gesamtfakultat
der
Ruprecht-Karls-Universitat
Heidelberg
vorgelegt von
Dipl.-Phys. Malte Wachsmuth
aus Stade
Tag der mundlichen Prufung: 19.Juli 2001
Entwicklung eines Prototyps,
Theorie und Messung der Beweglichkeit
von Biomolekulen im Zellkern
Gutachter: Prof. Dr. Jorg Langowski
Prof. Dr. Dr. Christoph Cremer
Theorie und Messung der Beweglichkeit
von Biomolekulen im Zellkern
Zusammenfassung
Die Theorie der Fluoreszenzkorrelationsspektros kopie (FCS) wird fur Anwendungen in le-
bendenZellenerweitert.Zellenenthaltenstatistisch organisierte Polymere,Membransyste-
me und geschlossene Kompartimente, die zu behinderter oder anomaler Diusion fuhren.
Es wird gezeigt, wie der Einuss von Bindungan zellulare Strukturen in FCS-Messungen
berucksichtigtwerdenkann.Desweiterenwird einAufbauzurkombiniertenFCSundkonfo-
kalenLaserscanningmikroskopie(CLSM)vorgestellt,dasFluoreszenzuktuationsmikroskop
(FFM).Eswird imHinblickauf AuosungsvermogenundAbbildungseigenschaftencharak-
terisiert. Anschlieende FCS-Messungen von EGFP und einer EGFP-Chimare in Zellen
zeigenbehinderteDiusionvorallemimKernmiteinerimVergleichzuWasseretwa4fach
hoheren intrazellularen Viskositat. Aus weiteren Experimenten mit angefarbtem Chroma-
tinundTestmolekulenverschiedener Groefolgt, dassderEinussdesChromatins aufdie
Diusion von der Teilchengroe abhangt. Auch die Beweglichkeit funktioneller Proteine
wirdanhand des Transkriptionsterminationsfaktors TTF-I untersucht.Erist imNukleolus
gebundenund im RestdesKernsbeweglich.DieLebensdauer des gebundenen Zustands be-
tragt ca. 27s.
Fluorescence uctuation microscopy:
Design of a prototype,
theory and measurements of the mobility
of biomolecules in the cell nucleus
Abstract
The theory of uorescence correlation spectroscopy (FCS) is expanded for the application
in livingcells. Cells contain statistically organized polymers, membranes, and closed com-
partments leading to obstructed or anomalous diusion. Theimpact of binding to cellular
structures on FCS is also considered. In addition, an experimental setup combining FCS
and confocal laser scanning microscopy (CLSM) is presented, the uorescence uctuation
microscope (FFM). Resolution and imaging properties are characterized. Subsequent FCS
experiments of EGFPand an EGFP chimera in cells show obstructed diusion mainly in
the nucleus with an approximately 4fold larger intracellular viscosity compared to water.
Further experiments with labeled chromatin and tracer molecules of various sizes reveal
that the impact of chromatin on diusion properties depends on the size of the tracer. Fi-
nally, the mobility of a functional protein, the transcription termination factor TTF-I, is
investigated. Bound in the nucleolus, it is freely mobile in the remainder of the nucleus.
Thelife time of the bound state is about 27s.
1 Einleitung 1
2 Biologische Grundlagen 3
2.1 Der Zellkern . . . 3
2.1.1 Die Verpackungdes Genoms . . . 4
2.1.2 Interphase-Chromosomen . . . 5
2.1.3 WeiterestrukturelleElemente desKerns . . . 7
2.1.4 Beweglichkeit undDiusion inZellen. . . 9
2.2 Das GreenFluorescent ProteinGFPundMutanten. . . 9
2.2.1 Die Strukturvon wtGFPundEGFP . . . 9
2.2.2 Molekulare ZustandeundEigenschaften derFluoreszenz . . . 10
2.2.3 GFP-VariantenundAFPsmitabweichendenspektralenEigenschaften 12 3 Theoretische Grundlagen 15 3.1 KonfokaleFluoreszenzanregung und-detektion . . . 15
3.1.1 Beleuchtung {Fluoreszenz{ Detektion. . . 16
3.1.2 VerschiedeneStrahlgeometrien . . . 17
3.1.3 Fokusgroe undraumlicheAuosung . . . 20
3.2 GrundlagenderFluoreszenzkorrelationsspektroskopie . . . 20
3.2.1 Die KorrelationsfunktioneinerSpezies . . . 21
3.2.2 Freie Diusion . . . 22
3.2.3 Vergleich von Auto- undKreuzkorrelation . . . 24
3.2.4 Triplettkorrektur . . . 25
3.2.5 Berucksichtigung vonPhotobleaching . . . 27
3.2.6 Korrelation mitUntergrundund Ubersprechen . . . 28
3.2.7 Korrelation mehrererSpezies . . . 29
3.3 Untersuchung von behinderterDiusion inderFCS. . . 31
3.3.1 Diusion instatistisch organisiertenSystemen. . . 31
3.3.2 ZusatzlicheBindung . . . 34
3.3.3 Einuss von Grenzachen . . . 36
3.3.4 HarmonischesPotenzial . . . 39
3.4 Untersuchung von intramolekularenFluktuationen inderFCS. . . 42
3.4.1 NichtstrahlendeZustandeamBeispielEGFP . . . 42
3.4.2 Lange Makromolekule . . . 44
3.5 Andere MethodenderFluoreszenzuktuationsspektroskopie . . . 46
3.5.1 AnalysederPhotonenverteilung. . . 46
3.5.2 Raumliche Korrelationsspektroskopie . . . 47
3.5.3 Photobleaching-basierte Methoden . . . 47
3.6 Grundlagender konfokalen Laserscanningmikroskopie . . . 51
3.6.1 Eigenschaften derAbbildung . . . 51
3.6.2 Optisch-mechanische KonzeptioneinesCLSM . . . 52
4 Das konfokale Fluoreszenzuktuationsmikroskop 55 4.1 Anforderungsprol . . . 56
4.2 Konzeptiondes optischenStrahlengangs . . . 57
4.3 Technische Umsetzung . . . 59
4.3.1 Auslegungder Optik . . . 59
4.3.2 MechanischerAufbau . . . 63
4.3.3 DieElektronik zurSteuerungundDatennahme . . . 63
4.4 Software . . . 65
4.4.1 DasMikroskopprogrammFFM . . . 65
4.4.2 Analyseder Korrelationsfunktionen . . . 69
5 Justage und Charakterisierung 71 5.1 Konfokale Justage . . . 71
5.2 Charakterisierung. . . 72
5.2.1 Linearitat derGalvanometerscanner . . . 72
5.2.2 Abbildungsmastab . . . 74
5.2.3 Genauigkeit undReproduzierbarkeitderPositionierung . . . 74
5.2.4 Auosung undTransmissionsprol . . . 75
6 Intrazellulare Diusionsmessungen 79 6.1 Beweglichkeit inerterMolekule imZellkern. . . 79
6.1.1 EGFPundEGFP--GalactosidaseinCOS-7- undAT-1-Zellen . . . 79
6.1.2 DextraneinHeLa-Zellen . . . 89
6.1.3 Alexa568in LCLC-103H-Zellen . . . 93
6.1.4 DsRedin COS-7-Zellen . . . 94
6.2 BindungundBeweglichkeit funktionellerProteine imZellkern . . . 99
6.2.1 DerTranskriptionsterminationsfaktorTTF-IinHeLa-Zellen . . . 99
7 Zusammenfassung 103
Literaturverzeichnis 105
2.1 Vereinfachtes SchemaeinerZelle . . . 4
2.2 LehrbuchdarstellungderDNA-Kompaktierung . . . 5
2.3 Schematische DarstellungdesZellkerns . . . 6
2.4 ModellederInterphasechromosomen . . . 7
2.5 Proteinstrukturvon wtGFP . . . 10
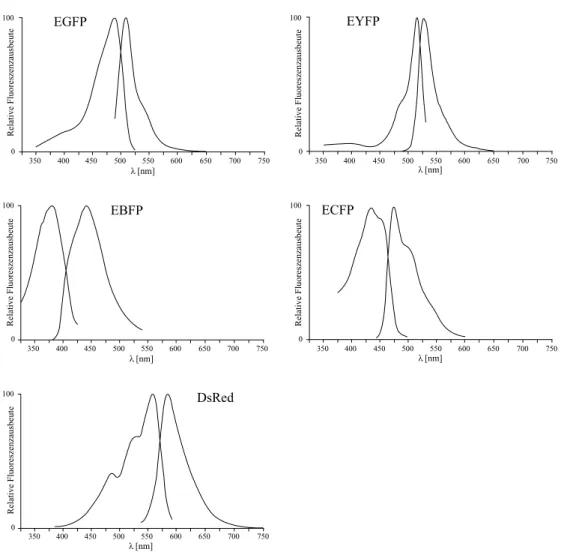
2.6 Anregungs-undEmissionsspektrenvon wtGFP . . . 11
2.7 Struktur,Zustandeund UbergangedeswtGFP-Chromophors . . . 12
2.8 Anregungs-undEmissionsspektrenverschiedenerAFPs . . . 13
3.1 Das konfokalePrinzip . . . 16
3.2 PSFundMDEfurverschiedeneStrahlgeometrien . . . 19
3.3 VerschiedenetheoretischeAutokorrelationsfunktionen . . . 24
3.4 TypischesTermschema einesFluorophors . . . 25
3.5 SimuliertezweidimensionaleRandom Walks . . . 32
3.6 FreieundbehinderteDiusion . . . 34
3.7 GrenzachenundFallenim Fokus . . . 36
3.8 KorrelationsfunktionenbeiDiusionnaheGrenzachen . . . 38
3.9 Ein- undzweidimensionaleKorrelationsfunktionen . . . 39
3.10 KorrelationsfunktionenbeiDiusionineinem harmonischenPotenzial . . . 42
3.11 Vereinfachtes Termschemades EGFP-Chromophors. . . 43
3.12 Diusioneines langenMakromolekuls . . . 44
3.13 Photobleaching-Zerfallskurve desFluoreszenzsignals . . . 49
3.14 Das PrinzipdeskonfokalenLaserscanningmikroskops . . . 52
3.15 Telezentrischer StrahlengangundF-Theta-Objektiv . . . 53
4.1 Strahlengangvon Mikroskop, ScanningeinheitundFCS-Modul . . . 58
4.2 Ansicht vonMikroskop,ScanningeinheitundFCS-Modul . . . 59
4.3 Das Scanobjektiv . . . 60
4.4 Die Galvanometerscanner . . . 61
4.5 KonfokaleJustage desFCS-Moduls . . . 62
4.6 NachweiseÆzienzder APDsundeektive TransmissionderKanale . . . 62
4.7 Schaltschema derSteuer- undMesselektronik . . . 64
4.8 Das FFM-Programm . . . 69
5.1 Linearitat derGalvanometerscanner . . . 73
5.2 Rasterkraft-unduoreszenzmikroskopischesBildderReferenzprobe . . . . 74
5.3 Positioniergenauigkeit und-stabilitat . . . 75
5.4 Autokorrelation einerAlexa488-Probe . . . 76
5.5 LateralesProlvon Fokusgroe undFluoreszenzsignal . . . 77
5.6 Axiales ProlvonDiusionszeit undFluoreszenzsignal . . . 78
6.1 Plasmidkartender Vektoren furEGFP- undEGFP-lacZ-Transfektion. . . . 80
6.2 Anregungs-undEmissionsspektrumvon zellularemEGFP . . . 81
6.3 pH-Abhangigkeitder EGFP-Fluoreszenz . . . 81
6.4 Normierte Autokorrelation von EGFPinLosung . . . 82
6.5 Normierte Autokorrelationenvon EGFPin vivo . . . 83
6.6 FCS-Scan durch eine EGFP-exprimierendeAT-1-Zelle . . . 84
6.7 FCS-Scan durch eine EGFP-exprimierendeCOS-7-Zelle . . . 85
6.8 FCS-Scan durch eine EGFP--gal-exprimierendeAT-1-Zelle . . . 86
6.9 FCS-Scan durch eine EGFP--gal-exprimierendeCOS-7-Zelle . . . 87
6.10 FCS-Scan durch einen 10kDa-Dextrane enthaltenden HeLa-Kern . . . 90
6.11 FCS-Scan durch einen 10kDa-Dextrane enthaltenden HeLa-Kern . . . 92
6.12 FCS-Scan durch einen 70kDa-Dextrane enthaltendenHeLa-Kern . . . 93
6.13 Diusionsbehinderungvon Alexa568 alsFunktion derH2A-ECFP-Intensitat 95 6.14 PlasmidkartedesDsRed-Vektors . . . 95
6.15 FCS-Scan durch eine H2B-EGFP- undDsRed-exprimierendeHeLa-Zelle . . 96
6.16 FCS-Scan durch eine H2B-EGFP- undDsRed-exprimierendeHeLa-Zelle . . 97
6.17 PlasmidkartedesEGFP-TTF-I-Vektors . . . 100
6.18 FLIP undFCS ineinerTTF-I-EGFP-exprimierenden HeLa-Zelle . . . 101
4.1 Die optomechanischenEigenschaftender M2-Scanner. . . 61
4.2 Die verwendeten FilterundStrahlteiler . . . 63
4.3 Die Grenzender Bildparameter . . . 67
5.1 Linearitat derGalvanometerscanner . . . 73
5.2 Experimentelle undtheoretische ParameterdesFokusvolumens . . . 76
6.1 VerhaltnisderDiusionskoeÆzientenin vivo. . . 87
6.2 In vivo-Viskositaten und-Anomalieparameter von Dextranen . . . 91
Einleitung
Papa arbeitet.
Jule Sophie
TrotzderErfolgebeiderSequenzaufklarungdesGenoms vielerLebewesenwirftdieraum-
liche Struktur der Erbsubstanz weiterhin zahlreiche Fragen auf. Insbesondere auf einer
Groenordnung zwischen 30 und 500nm gibt esnur wenige experimentelleHinweise
auf die raumliche Organisation in vivo. Eshat sich dieAuassung durchgesetzt, dass die
ZellkernarchitekturinderInterphaseu.a.einewichtigeRollebeiderGenregulationspielt.
Die zugrundeliegendenMechanismensindjedochzum groenTeilunbekannt.
Alle im Zellkern stattndenden Prozesse { Transkription der Gene, Replikation der
DNA, Reparatur von DNA-Schaden und -Mutationen oder Prozessierung der RNA { er-
forderneineneÆzientenTransportvonMolekulenundKomplexenverschiedensterGroen
innerhalbdes Kerns, in denKern hinein und ausihm heraus. Wie beeinusstdie dreidi-
mensionaleOrganisationdesInterphasezellkernsFunktionundMobilitatvonBiomolekulen
verschiedenerGroe unddie Zuganglichkeitgenomischer Bereiche fursie?
Daneben steht die Frage nach molekularen Wechselwirkungen { Komplexbildung von
Proteinen,Protein-DNA-WechselwirkungenoderRezeptor-Liganden-Bindungen{imZen-
trumvieler biologischer Arbeiten. Eine Charakterisierung inForm desspezischenNach-
weises von Bindungspartnern und der Bestimmung von Bindungskonstanten ist essen-
ziell fur das Verstandnis biologischer, physikalischer und chemischer Vorgange in Zel-
len. Vielfaltige Methoden sind dafur entwickelt worden, die oft jedoch fur eine in vivo-
Verwendung nicht geeignet sind. So wird bei vielen Verfahren ein System gezielt gestort
undanschlieendbeobachtet,wieesineinthermischesGleichgewichtrelaxiert. Auerdem
benotigenviele MethodenrelativhoheKonzentrationenundProbenmengen.
Einen Losungsansatz gerade im Hinblick auf intrazellulare Anwendungen bietet die
Fluoreszenzkorrelationsspektroskopie(FCS).SieberuhtaufderAnalysederzeitlichenTeil-
chenzahluktuationenvonMolekulenineinemmikroskopischenBeobachtungsvolumen.Ur-
sachendieserFluktuationenkonnenBrown'scheBewegungoderchemischeReaktionensein.
AusdenAmplitudendieser FluktuationenunddemzeitlichenVerlaufihrer Korrelationen
konnen makroskopische Groen wie die Teilchenkonzentration und DiusionskoeÆzien-
ten abgeleitet werden: Beispielsweiseverweilen groe, frei in Losung bendliche Komple-
xe langer im Beobachtungsvolumen als kleineund daher schnelle Proteine. Ein Komplex
zeigt also langer korrelierte Fluktuationen als seine einzelnen Bausteine. Daruberhinaus
ist der zeitliche Verlauf der Fluktuationen direkt mit ihrer Ursache verknupft: So zeigen
Molekule, deren Mobilitat durch statistisch verteilte Hindernisseeingeschrankt wird,eine
zeitabhangige Verzogerung ihrer Bewegung, die anhand der Korrelationen charakterisiert
werden kann.
Die Fluktuationen werden nachgewiesen, indem die untersuchten Molekule in einem
mikroskopischen, voneinem starkfokussiertenLaserbeleuchteten Fokus zurEmissionan-
geregt werden.Dies erfordert eineFluoreszenzmarkierung dieser Molekule, nutzt aberdie
hoheSelektivitat undEÆzienz der Fluoreszenzanregungaus. Damit erschlieen sich Teil-
chenkonzentrationenim nano- undpicomolarenBereich,wie sie oft unterphysiologischen
Bedingungen vorliegen. Auch andere, die Fluoreszenz beeinussende Prozesse konnen zu
Signaluktuationenfuhren undanalysiertwerden.
DieVerwendungeineskonfokalenStrahlengangsundderOptikeinesgutenLichtmikro-
skopsermoglichenMessungen inlebendenZellen.Vielebiologischrelevante Molekulesind
invivonichtfreibeweglich,sondernbendensichineinemdurchihreFunktionbestimmten
Bindungsgleichgewicht. Die Kombination miteiner Scanningeinheiterlaubt es, dieseBin-
dungenzusatzlichraumlichzucharakterisierenunddieStrukturmoglicherimmobilisierter
Bindungspartnersichtbarzumachen.EinezuverlassigeundschnellePositionierungdesFo-
kus relativzurProbe erreicht manambesten,indemman dasBeobachtungsvolumen, wie
in der konfokalen Laserscanningmikroskopie
ublich, mittels geeigneter optomechanischer
Komponenten in derProbe bewegt. Das detektierte Fluoreszenzsignal wirddann mitder
Ortsinformationzueinem Bildzusammenfugt.
Eineoftunerwunschte EigenschaftvonFluoreszenzfarbstoenist Photobleaching,d.h.
dieirreversiblephotochemischeUmwandlungderFarbstomolekuleineinenichtstrahlende
Spezies.DiesenEektkannmansichaberauchzunutzemachen:Sinduoreszenzmarkierte
Molekulenurteilweisegebunden,sounterscheidensichdieAufenthaltsdauerndergebunde-
nenundderbeweglichenFraktionunddamitauchdieWahrscheinlichkeitdesAusbleichens
wesentlich. Mitdem zeitlichenVerlaufdesFluoreszenzsignals konnendaher diejeweiligen
Anteileundihr Austausch analysiertwerden.
Die zu untersuchenden Molekule weisen i.a. nur schwache intrinsische Fluoreszenz
auf,sodass sie durch geeignete biochemische ReaktionenmitFluoreszenzfarbstoenmar-
kiert werden mussen. Auerdem ist es moglich, autouoreszierende Proteindomanenmit
gentechnischen Methoden an zu untersuchende Proteine zu koppeln und so ein in vivo-
Fluoreszenzsignalzuerhalten.DieseskanndanninlebendenZellennahezustorungsfreifur
diegenanntenMethodenverwendetwerden.
ZieldieserArbeitwares,denEinussdesdreidimensionalenAufbausdesZellkernsauf
molekulareMobilitat zuuntersuchen. Dazuwurden diegenannten MethodenzurFluores-
zenzuktuationsmikroskopie (FFM) zusammengefuhrt. Die biologischen Grundlagen, die
diese Arbeit motivieren, sind in Kapitel 2 dargestellt. Die theoretischen Grundlagen der
FCS wurden erweitert undauf intrazellulareAnwendungen angepasst (Kapitel 3), da die
experimentellenBedingungenineinerZellei.a.sehrheterogenundnichtidealsind.Derbe-
stehende experimentelleFCS-Aufbauwurde umeine Scanningeinheiterweitert, umhoch-
auosende Fluoreszenzmikroskopie mit ortsaufgeloster FCS zu verbinden. Kapitel 4 be-
schreibtAuslegungundAufbaudesExperiments.DessenCharakteristikawerdeninKapi-
tel5dargestellt,wahrendinKapitel6intrazellulareBeweglichkeitsmessungen beschrieben
unddiskutiertwerden.
Biologische Grundlagen
2.1 Der Zellkern
DieZelleistdiekleinstebiologischeEinheit,diealleKriteriendesLebenswieStowechsel,
Wachstum, Fortpanzung, Reizbarkeit und Fortbewegung erfullt. Hohere Lebewesen wie
Panzen und Tiere (Eukaryonten) bestehen aus zahllosen Zellen, die sich sehr vielfaltig
ausdierenziert haben. Ihre Form und Funktion wird durch die Aufgabe bestimmt, die
sie { oft im Verband mit anderen Zellen { zu erfullen haben. Jedoch besitzen alle Zel-
len grundlegende gemeinsameMerkmale, deren aualligstes die Unterscheidungzwischen
dem Zellkern (Nukleus, 6{10% des Zellvolumens) und dem umgebenden Zytoplasma ist
(Abb. 2.1).
Die AufgabendesZellkerns lassensichin folgendenPunktenzusammenfassen:
Sichere Speicherung des Tragers der genetischenInformation, des Genoms, inForm
mehrererDNA-Molekule. Dazugehoren eineschutzende,hoch kompaktierende Ver-
packungunddieReparaturvon Schaden, diedurch mechanische, biochemischeoder
Strahlungseinwirkungentstehen.
Kontrollierte Vervielfaltigung desGenoms (Replikation).
ReguliertesAblesendesgenetischenCodes(Transkription)und
Ubertragungaufdas
primareGenprodukt,die RNA.
BearbeitungderprimarenGenprodukte(RNA-Prozessierung und-Spleien).
StrukturelleUmorganisation zurZellteilung.
Umgeben ist der Zellkern von einer Kernhulle, die wie alle biologischen Membranen
auseinerPhospholipid-Doppelschichtbesteht.Die Kernhullebildeteine topologische Ein-
heit mit dem Membransystem des endoplasmatischenRetikulums (ER), das das gesamte
Zytoplasma durchziehenkann undteilweise mitRibosomen belegt ist (rauhes ER,rER).
Ribosomen bestehen aus RNA-Protein-Komplexen und sind die Orte der Proteinbiosyn-
these.DurchAbschnurungendesERkonnenmembranumschlosseneVesikelentstehen, die
zur Speicherung oder Sekretion bestimmteEnzyme undHormone enthalten konnen. Ein
System aus gestapelten Membranvesikeln, der Golgi-Apparat, ist fur den Transport die-
serMakromolekuleinSpeichervesikel(Lysosomen,Peroxisomen)oderausderZellehinaus
verantwortlich (sekretorische Vesikel). Daruberhinaus gibt es membranumschlossene Or-
ganellen wie die Mitochondrien, in denen die universellen zellularen Energietrager, die
Zellkern Nukleolus Nukleolus
ER Golgi Golgi
Mitochondrien Mitochondrien
Zytoskelett Vesikel
Zytoplasma Zytoplasma
Plasmamenbran Plasmamenbran
Abbildung 2.1: Vereinfachtes
Schema einer hoheren tieri-
schen Zelle nach [148].
Nukleotidtriphosphate, unter Verbrauch von Fett- und Kohlenhydrate-Abbauprodukten
synthetisiert werden. Die gesamte Zelle ist von einer Plasmamenbran umgeben undwird
mechanisch durch ein Zytoskelett stabilisiert, das aus dynamisch organisierten Interme-
diarlamentenbesteht.
2.1.1 Die Verpackung des Genoms
Die genetische Information ist auf langen Polymermolekulen gespeichtert, der Desoxyri-
bonukleinsaure (DNA), die in vivo Doppelhelizes aus zwei gegenlaugen Einzelstrangen
bilden. Die Codierung erfolgt dabei mit Hilfe der Monomere, die eine der Basen Adenin
(A), Guanin (G), Thymin (T) und Cytosin (C) enthalten und jeweils einen spezischen
Bindungspartner(A-T,G-C)amkomplementarenStranghaben.ImGenomeinermensch-
lichen Zelle sind ca. 33000 Gene auf mehr als 610 9
Basenpaare (bp) in 46 einzelnen
DNA-Molekulen verteilt.Diese sog.Chromosomen habeneine Gesamtlange von
uber2m,
so dass bei einem typischen Zellkernradius von 10m schon aus geometrischen Grunden
eine
auerstkompakte Verpackung erforderlichist (Abb.2.2).
Nukleosomen: Der erste Kompaktierungsschritt erfolgt, indem die DNA 1,8 mal um
ein Proteinoktamergewickelt wird.Die dafurnotwendigen146bpergeben zusammenmit
einem Zwischenstuck, der Linker-DNA, eine durchschnittliche Wiederholungslange von
200bp, auf denen ein Protein-DNA-Komplex gebildet wird. Ein solches Nukleosom be-
steht aus je zwei Kopienvon vier evolutionar hochkonservierten Proteinen,den Histonen
H2A, H2B, H3 undH4.
Chromatin: Aufnochungeklarte,mehroderwenigerregelmaigeWeisewerdendieNu-
kleosomen zu einer Fiber von 30nm Durchmesser aufgewickelt [53 , 163], dabei sind das
Histon H1 und weitere chromosomale Nicht-Histon-Proteine beteiligt undmoglicherweise
fur unterschiedliche Kompaktierungsgrade verantwortlich. Das gleiche gilt fur reversible
ModizierungendernukleosomalenHistone(z.B.Acetylierung).DerKompaktierungsgrad
desChromatinsbeeinusstauchdieZuganglichkeitgenetischerBereichefurTranskriptions-
komplexe, und in der lebenden Zelle kommt die DNA auch in allenbisher beschriebenen
Zustanden vor. Chromatin lasst sich daher in kompaktes Heterochromatin mit wenigen
Abbildung 2.2: Lehrbuchdarstellung der DNA-
Kompaktierung mit dem Solenoidmodell der 30nm-
Fiber [3].
Chromosomen: DienachsthohereOrganisationsformndetaufderEbeneganzerChro-
mosomenstatt,diezellzyklusabhangigihreStrukturwesentlichandern:WahrendderZell-
teilung(Pro-,Meta-,Ana-undTelophase)sindsiehochkondensiertundimLichtmikroskop
erkennbar.ZurInterphase(G1-,S-undG2-Phase)dekondensierensieundverteilensichim
Zellkernauf bisheute nichtvollstandiggeklarteWeise. DiedreidimensionaleOrganisation
derChromosomenimInterphasezellkernerfulltFunktionenderGenregulationundwirdim
folgendenAbschnitt genauer betrachtet.
2.1.2 Interphase-Chromosomen
ImGegensatzzurBasensequenzundderChromatinstrukturistdiedreidimensionaleOrga-
nisationder Chromosomeninder Interphase noch recht unbekannt. In einerVielzahlvon
UntersuchungenkonntenjedocheinigeEigenschaftenbeobachtetundbestatigtwerden,die
imRahmen phanomenologischerundquantitativerModelleeinzuordnensind.
Experimentelle Beobachtungen
DieChromosomenbesetzenbegrenzteundnurgering
uberlappendeTeilvolumendesKerns
[33 ,171 ],chromosomaleDomanenbzw.Territorien(CT).ObKorrelationenderPositionen
der Territorien (z.B. von homologen Chromosomen) untereinander oder mit Parametern
wiederGendichte bestehen, bleibtungeklart [32 ].
Eine Farbemethode mitotischer Chromosomenmacht ein Bandenmuster sichtbar, das
auch im dekondensierten Zustandchromosomaler Territorienerhalten bleibt.G-C-reiche,
lockererorganisiertesog.R-BandenwerdenfruhinderS-Phaserepliziertundsindgenreich,
wahrendA-T-reiche,kompaktereG-BandensichdurcheinegeringeGendichteauszeichnen
und eher spater repliziert werden [3 ]. An der Peripherie des Kerns (mit Ausnahme von
Kernporen) und des Nukleolus bendet sich vorwiegend kompakteres Heterochromatin,
ansonstensinddeutlicheVariationenderChromatindichte
uberallim Kernzubeobachten
(a) (b)
Abbildung2.3:(a)KonfokalesFluoreszenzbilddesKernseinerEGFP-H2B-exprimierenden
HeLa-Zelle (der markierte Streifen unten ist durch einenFCS-Scan ausgebleicht worden),
(b) Schematische Darstellungdes Zellkerns nach [3 ].
Unterhalb ganzer Chromosomen werden Strukturen von 1Mbp genomischer
Lange und 400{800nm Durchmesser beobachtet, die abgesehen von eingeschrankter
Brown'scher Bewegung raumlich und zeitlich recht gut erhalten bleiben [170] und auch
als jeweils gleichzeitig replizierter Bereich betrachtet werden konnen [75 ]. Die chromoso-
malenArmezeigenin derInterphase nurgeringe
Uberlappung[91 ].
NebenderReplikationscheintauchdieTranskriptiontrotzwiderspruchlicherBeobach-
tungen an vielen Positionen gleichzeitig und vor allem in Bereichen geringerer Chroma-
tindichte stattzunden [155]. Die lokale Kompaktierung scheint dabei denZeitpunkt der
ReplikationunddieWahrscheinlichkeitder Transkription zubestimmen.
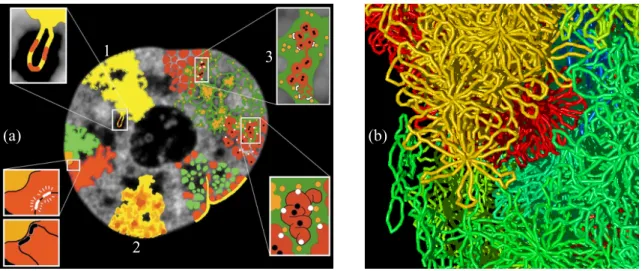
Daraus entwickelte Modelle
AufGrundlagederExperimentepostuliertdasICD-(interchromosomaldomain)bzw.CT-
IC-Modell(chromosometerritory{interchromosomalspace,Abb.2.4a)[33,32 ]eineOber-
ache derchromosomalenTerritorien, wasdieExistenzeines
"
Zwischenraums\ impliziert.
Genregulationerfolgtdann
uberdieZuganglichkeitfurTranskriptionskomplexevoncodie-
renden und regulatorischen Elementen, die im Falle aktiver Gene dem ICD-Raum zuge-
wandt sind. Kleine Molekule hingegen konnen in CT eindringen. Der ICD-Raum besitzt
einekomplizierteStruktur,dievongroenVoluminabiszuengenKanalenvonwenigennm
Durchmesser reicht. Die Topologie muss in ausdierenzierten Zellen fur ein gewunschtes
Muster an aktiven und repremierten Genen erhalten bleiben.Der ICD-Raum ist der Ort
furalleweiteren AktivitatenwieRNA-SpleienoderTransportprozesse.
Einen quantitativen Ansatz stellt das MLS-Modell (multiloop subcompartment) dar,
dasdieFaltungvon 1Mbplangen Bereichender30nm-Fiberzu Rosettenaus120kbp
groenSchleifenannimmt[92 ].EinChromosombesteht ausmitkurzenChromatinstucken
(a) (b) 1
2
3
Abbildung 2.4: Modelle der Interphasechromosomen: (a) CT-IC- oder ICD-Model nach
[32 ], 1 { Oberache eines CT, 2 { Variationen der Chromatindichte, 3 { mitotischen
Bandenentsprechende subchromosomale Strukturen(rot) mitaktiven(wei)und inaktiven
Genen (schwarz) und deren Lage zum ICD-Raum (grun),(b) Peripherie einessimulierten
Kernsnachdem MLS-Modell,verschiedeneFarbenmarkieren verschiedeneChromosomen,
dieausderinRosettengefalteten30nm-Fiberbestehen(Groenmastablich,T.A.Knoch,
Abt. Biophysik der Makromolekule, Deutsches Krebsforschungszentrum, Heidelberg) [92 ,
91 ].
verknupftenRosetten.DieSimulationvonChromosomenundganzenKernenergibtVaria-
tionenderChromatindichtesowiedieErhaltungvonCTundsubchromosomalenStruktu-
ren, in
Ubereinstimmung mitexperimentellen Ergebnissen [91 ]. Sich im Kernbewegende
Molekule undKomplexe nehmen dieChromatinberals mehroderwenigerdichtes Netz-
werkvonHindernissenwahr,wobeizwischenintra-undinterchromosomalenBereichenkein
qualitativerUnterschiedbesteht (Abb.2.4b).
2.1.3 Weitere strukturelle Elemente des Kerns
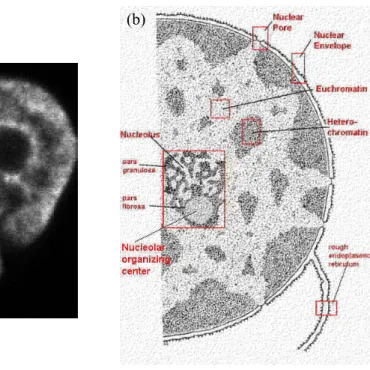
Nukleolus: Nukleoli (dunkle zentrale Bereiche in Abb. 2.3a, 2.4a und markiert in
Abb. 2.3b) sind die aualligsten Kompartimente von Zellkernen [3 , 133, 23 , 25 ]. Sehr
dynamisch organisiert, sindsie die Orte der Synthese der Ribosomenuntereinheiten. Fur
ribosomale RNA (rRNA) codierende Gene benden sich beim Menschen auf 10 Chro-
mosomen inForm von zahlreichen geclustertenKopien mitdazwischenliegenden nichtco-
dierenden Sequenzen(tandem repeats).Sie bildendie kompakten Nukleolusorganisatoren
im brillarenZentrum(FC). Die Transkription erfolgt vermutlich am
Ubergangzwischen
dem FC und der dichten brillarenKomponente (DFC). Die dort synthetisierten rRNA-
VorlauferbindenausdemZytoplasmaindenKerntransportierteribosomaleProteineund
kleineribosomaleRNAs(snoRNA)undwerdenprozessiert,wobeidieRibosomenunterein-
heiten entstehen. Wahrend dieses Vorgangs wandern die Komplexe aus der DFC an die
PeripherieindielockereraufgebautegranulareKomponente(GC).DurchaktivenKernpo-
rentransportwerdensieindasZytoplasma verbracht,wosiezu fertigenRibosomenreifen.
Strukturell auallig ist an den Nukleoli, dass spezische Makromolekule sich dort anrei-
durch lokal konzentrierte Bindungsstellen zustande zu kommen. Wahrend der Zellteilung
stoppt dieTranskription,unddie Nukleoli losen sichauf. Nach derTelophase bildensich
an den 10 Nukleolusorganisatoren kleine Vorlaufer, die zu einem oder wenigen Nukleo-
li verschmelzen. Ob auch Strukturproteine oder ob nur Bindungen funktionellerProteine
selbstorganisiertam Aufbaubeteiligt sind,ist noch ungeklart.
Speckles und Kernkorper: Neben dem Nukleolus unddem Chromatin benden sich
im Zellkern viele kleine Korper, die zum Teil schon lange bekannt sind, deren Funktion
abernochrecht unklarist[83 ].DazugehorenCoiledoderCajalBodies(CB,vermutlichan
derReifungvonstabilenkleinenRNA-Protein-Komplexen,snRNPs 1
,beteiligt),PML Bo-
dies (vermutlich in Transkriptionsregulation involviert), Perichromatinbrillen (brillare
Strukturenausheterogenangesammelten,neusynthetisiertenRNA-Molekulen)undInter-
chromatinGranuleCluster (IGC, Akkumulation von Spleifaktoren).
Kernmembranund Kernporen: DieDoppelmembranderKernhulleumgibtdenZell-
kern und trennt ihn damit topologisch vom Zytoplasma. Sie ist von zahlreichen Kern-
porenkomplexen (NPCs) durchzogen, uber die der aktive und spezische Transport von
Proteinen undNukleinsaurenindenundausdem Kernstattndet[146]. Dieser Komplex
besteht aus100 statisch unddynamisch eingebauten Proteinen (Nukleoporine)undbe-
sitzteinen ringformigen membranstandigen, einenbrillarenzytoplasmatischenundeinen
korbahnlichen kernseitigen Teil. Der freie Durchmesser der Pore betragt 9nm, so dass
kleineMolekulediusiv hindurchtretenkonnen. Groere Molekule undKomplexe mussen
eineKernlokalisierungssequenz(NLS)oderKernexportsequenz(NES)besitzen,umvonIm-
undExportproteinen(Im-,Exportine)gebundenzuwerden.Nurdannkann derTransport
unterGTP-Hydrolyse erfolgen[2 ].
LaminaundKernmatrix: DieKernhulleistwahrendderInterphaseaufderInnenseite
mit einem stabilisierendenNetzwerk aus Intermediarlamenten ausgekleidet, der Lamina
[147]. Die Filamentproteine lassen sich in zwei Gruppen einteilen (Lamin A und B), die
sich in ihrer Struktur und ihrem Polymerisierungsverhalten beim Aufbau der Kernhulle
unterscheiden[89 ].WahrendderZellteilungbendensiesichbeweglichundinmono- oder
oligomerer Form in der ganzen Zelle, danach bauen sie zusammen mit Membranen und
Kernporen die Kernhulle wieder auf. Sie sind stabil
uber membranstandige Proteine mit
derHulleverknupft,undesgibtHinweise,dassauchChromatinuber vermittelndeProteine
an dieLaminagebunden seinkonnte [50 ,147].
Auch innerhalb des Interphasekerns werden Lamine gefunden, vor allem in Form von
globularen Aggregaten,die am Aufbaueiner Kernmatrixbeteiligt sein, aber auch nurals
Reservoir furdie Laminadienenkonnten. Auf jeden Fall stehensie mit Replikationskom-
plexenraumlichundfunktionellinVerbindung[147].
Die Existenz einer dem Zytoskelett vergleichbaren Kernmatrixist weithin kontrovers
[107,108 , 95 ],insbesonderedadie beteiligtenMakromolekule (ProteineebensowieRNA)
noch nicht eindeutig identiziert werden konnten. Auerdem erfordern bestehende Mo-
delle desInterphasezellkerns (s.o.) kein solchesGerust, nicht zuletzt weilnichtcodierende
Sequenzen desGenoms strukturelleFunktionen
ubernehmenkonnen.
1
2.1.4 Beweglichkeit und Diusion in Zellen
Die Entwicklung von vor allem uoreszenzbasierten Methoden (FCS, FRAP oder FLIP)
zurUntersuchung molekularer Beweglichkeitenund Bindungenhat zu einer rasantenZu-
nahme von Experimenten in lebendenZellen gefuhrt. Wahrend FRAP und FLIP bereits
furnurzum Teilquantitative Analysenverwendetwird,hatdie Verwendungvon FCS als
sensitiveres Verfahren noch vielmethodische Entwicklungerfordert [17 , 18 ,138,46 ].
Die hydrodynamischenEigenschaften des Zytoplasmas sindbisher amausfuhrlichsten
untersuchtworden,inersterLiniemitPhotobleaching-basiertenMethoden[79,77 ,78 ,61,
76 ,149,150 ,141 ]:AbgesehenvonenthaltenenOrganellen,z.B.Mitchondrien[104 ],besteht
dasZytoplasmaauseinerimVergleichzutypischenProteinengrobenMatrix,umgebenvon
kleinen und von Makromolekulen in einer ussigen Phase. Letztere erscheinen fur kleine
Molekule als Hindernisse, fur groere tragen sie zur Viskositat bei, die insgesamt etwa
2,5{10fach hoherals dievon Wasserist.
Aus bisherigen Messungen der Beweglichkeit im Zellkern [162 , 141, 118 , 117 , 80 ], die
auchInhaltdieserArbeitsind,kannabgeleitetwerden,dassdieBewegunginerterMolekule
auchim Kerndurch Diusionzustandekommt. ZahlreichefunktionelleProteine hingegen
stehen in einem Bindungsgleichgewicht, und der ungebundene Anteil ist frei beweglich
[1 ,115,87 ].Molekulewiez.B.TranskriptionsfaktorenscheinendenKerndiusivnach po-
tenziellenBindungspartnern
"
abzuscannen\, und viele im Mikroskop statisch anmutende
Strukturen, die eine starke Lokalisierung bestimmter Molekule aufweisen, sind sehr viel
dynamischer aufgebaut [86]. Eine ausfuhrliche Betrachtung des Einusses der Kernarchi-
tekturaufdieBeweglichkeitstehtnochaus.Diusionist einverbreiteter,daschnellerund
eÆzienter Transportprozess.
2.2 Das Green Fluorescent Protein GFP und Mutanten
Der Wildtyp des grun uoreszierenden Proteins wtGFP (green uorescent protein) ent-
stammt der nordpazischen QualleAequorea victoria undwandeltin diesem Organismus
dasblaueLichtdeschemilumineszentenProteinsAequoriningruneFluoreszenzum[154 ].
Obwohles weitere autouoreszierendeProteine (AFPs) aus anderenOrganismengibt,ist
GFPmitAbstandambesten charakterisiert.Neben derPrimar-bisQuartarstruktursind
die spektralen Eigenschaften und die am gesamten Fluoreszenzprozess beteiligten elek-
tronischenund Konformationszustandeausfuhrlich untersucht worden.Es konnte gezeigt
werden, dass die Expression des Gens in anderen Organismen ebenfalls uoreszente Mo-
lekule erzeugt, ohnedass Aequorea-spezische Enzyme erforderlich sind. Durch Mutation
bestimmter Aminosauren konnten die spektralen Eigenschaften von GFP verandert wer-
den. Daruberhinaus wurde in der indopazischen Seeanemone Discosoma striata ein rot
uoreszierendesProtein von nurca. 25%Sequenzhomologie, abersehr
ahnlicherStruktur
entdeckt,dasdasSpektrumderverfugbarenAFPsdeutlicherweitert.DieKonstruktionvon
ChimarenbestimmterProteine mitAFPsndetinKombinationmituoreszenzmikrosko-
pischenMethodenzunehmende Verwendung inderMolekular- undZellbiologie[38 , 172].
2.2.1 Die Struktur von wtGFP und EGFP
DaswtGFPunddieindieserArbeitvorwiegendverwendeteMutanteEGFP(F64L,S65T)
[28 ]bestehenaus238 AminosaurenbeieinemMolekulargewichtvon 27kDa.Esbildetsich
einezylindrischeStrukturvonca.3nmDurchmesserund4nmHoheaus11-Strangenso-
Abbildung 2.5: Proteinstruktur von
wtGFP: Rote Bander stehen fur -
Helizes, blaue fur -Faltblatter und
Stabchen fur kovalente Bindungen.
ManerkenntdiezylindrischeStruktur,
in derenMitteder Chromophoreinge-
bettet ist.
wiezwei-HelizesunterhalbundeineinnerhalbdesZylindersaus,sieheAbb.2.5.DerChro-
mophor, grun markiertinAbb.2.7a,ist durchzahlreicheWasserstobrucken geschutztin
dasZentrumdes Zylinderseingebettet.Erbesteht ausdem aromatischenRing desTyr66
undeinerzyklischenStruktur, dieautokatalytisch ausderCarboxylgruppe vonSer65 und
derAminogruppedesGly67 entsteht.DurchanschlieendeOxidationunddieBindungei-
nigerraumlichnaher,aberinderSequenzentfernterAminosauren
uberWasserstobrucken
geht dasMolekulindieuoreszente Konguration
uber.DieMutanteEGFPkennzeichnet
eineeÆzientereFaltungbei37 Æ
C,wasderMutationF64Lzugeordnetwird,undveranderte
spektraleEigenschaftendurchThr65[154].
Unter physiologischen Bedingungen scheinen wtGFP und EGFP als Monomer vor-
zuliegen und sehr stabil gegen Temperatur- und pH-
Anderungen, Proteaseaktivitat und
Detergenzien zu sein. Der DiusionskoeÆzient betragt bei Raumtemperatur in wassriger
Losung 8; 710 11
m 2
s 1
, dies entspricht einem hydrodynamischem Radius von 2,82nm
[151].
2.2.2 Molekulare Zustande und Eigenschaften der Fluoreszenz
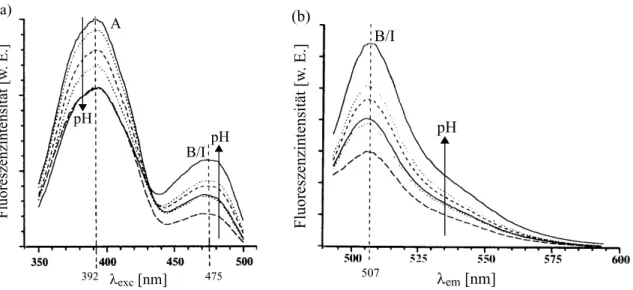
DasAbsorptions-unddasFluoreszenzanregungsspektrumvon wtGFPzeigenMaxima bei
ca. 395 und 475nm, deren Verhaltnis sich mit zunehmendem pH zugunsten des langer-
welligen Peaks verschiebt, wiein Abb. 2.6a dargestellt[151, 54 ]. Das Emissionsspektrum
ist nahezu unabhangig von der Anregungswellenlange und zeigt eine der Anregung ent-
sprechendepH-Abhangigkeit.EGFPweistein sehr
ahnlichesAbsorptions-undEmissions-
verhalten auf,jedoch verschwindet dasAnregungsmaximum bei395nm[65 ]. Interpretiert
man denEinussdes pH alsProtonierungsgleichgewicht,erhalt maneinen pK
a
-Wert von
ca.6 [98 , 65 ].
DiezeitaufgelosteBeobachtungderFluoreszenzeinzelnerimmobilisierterMolekule[116,
Fluoreszenzintensität [w . E.]
λ exc [nm]
392 475
(a)
pH
pH A
B/I
Fluoreszenzintensit ät [w . E.]
λ em [nm]
507
(b)
B/I
pH
Abbildung 2.6: (a) Anregungsspektren bei einer Emissionswellenlange von 507 nm von
wtGFPund(b)EmissionsspektrenbeieinerAnregungswellenlangevon488nmvonwtGFP
und EGFP in Abhangigkeit vom pH-Wert aus [151]. Die Pfeile zeigen die Veranderun-
gen bei zunehmendem pH an, und die Maxima sind mit den beteiligten Kongurationen
gekennzeichnet.
36 , 44 , 43] und FCS-Messungen von EGFP in Losung [54 ] unter Anregung mit 488nm
zeigen daruber hinaus ein Blinken oder Flackern einzelner Molekule mit An- und Aus-
Zeitenzwischenwenigenmsundeinigen s.
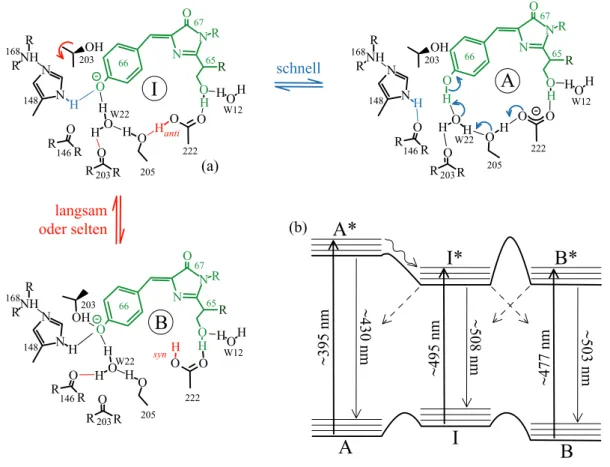
AusdiesenErgebnissen,weiterenspektroskopischenStudienundausderProteinstruk-
turistfolgendesModellentwickeltworden[24 ,16 ,99 ,30 ,157 ]:ZwischendenKonformatio-
nenA undBdeswtGFP,diesichinderProtonierungdesChromophorsundihrerraumli-
chenKongurationunterscheiden, stelltsich einGleichgewicht ein(Abb. 2.7). ZustandA
wirdmitca. 395nm angeregtundkann bei Emissionum 430nmstrahlendzerfallen. Sehr
vielschnelleristjedochdieUmlagerungeinesProtons(10ps),sodassderangeregteInter-
mediarzustandI*entsteht.Dieserkann strahlendmitca.508nminseinenGrundzustandI
oderstrahlungslosdurchRelaxationderKonguration inBbzw.durchReprotonierungin
A
ubergehen. Bwird mitca. 477nm angeregtundzerfallt dannentweder unter Emission
vonLichtoberhalbvon500nmodergehtstrahlungslosinIuber. DessenAnregungerfolgt
mit495nm.
Die dunkelgrun markierteRestgruppe inAbb.2.7a, imwtGFP nur einH-Atom,wird
durch dieS65T-Mutation desEGFPdurcheineMethylgruppeersetzt.Diesfuhrt zueiner
sterischenBevorzugungderdeprotoniertenKongurationB, diesichvon Ispektralundin
derKonformationwenigerdeutlichunterscheidetalsA.DaherfallendieAnregungsmaxima
bei488nmnahezu zusammen.
Bendet sich das Molekul in Losung, so kann die Protonierung alternativ durch H +
-
IonenderFlussigkeiterfolgen.DiesfuhrtzurbeobachtetenpH-AbhangigkeitderSpektren.
Konformationsuktuationen zwischenA undB im Grundzustand konnen das Blinken er-
klaren, da bei Anregungum 488nm nurI undB angeregtwerden konnen. Geht dasMo-
lekulinA
uberoder wirddurch einH +
-Ionprotoniert, bleibtessolange
"
unsichtbar\,bis
schnell
langsam oder selten
~395 nm ~495 nm ~477 nm
~430 nm ~508 nm ~503 nm
A A*
I*
I B
B*
(a)
(b)
R R
R R
R
O O
O
O O
OH NH
N N
O H H
H H O
W22 W12
R 146 148
203
203 205
222 168
O
O
O N
N R R H -
H H
H syn
B
66
67
65 R
R
R R
R
O O
O
O O
NH OH N
N
O H H
H H O
W22 W12
R 146 148
203
203 205
222 168
O
O
O N
N R
H H -
H
H anti
I
66 R
67
65
R R
R R
R
O O
O
O O
NH OH N
N
O H H
H H O
W22
W12
R 146 148
203
205 203
222 168
O
O
O N
N R
H H
H - H
A
66 R
67
65
Abbildung 2.7: (a) Mogliche Struktur des wtGFP-Chromophor in den verschiedenen
Zustandennach [16 ].KovalenteBindungensinddick,Wasserstobruckendunngezeichnet.
A ist der im wtGFP dominierende Zustand, B die im EGFP am haugsten anzutreen-
de Konguration, I der Intermediarzustand. DerChromophor ist in grun, Veranderungen
beim
Ubergangvon A nach I sindin blau und vonI nach Binrot markiert. (b)Mogliches
Zustandsschema nach [30 ]: Dickgezeichnete
Ubergange entsprechen der Anregung, dunne
durchgezogene dem strahlenden Zerfall und gestricheltedem strahlungslosem
Ubergangso-
wie die Schlangenlinie dem photoinduzierten
Ubergang A*!I*. Die Wellenlangen geben
die ungefahrenWerte beiRaumtemperatur an.
2.2.3 GFP-Varianten und AFPs mit abweichenden spektralen Eigen-
schaften
Neben der am haugsten verwendeten Variante mit der Mutation S65T (z.B. EGFP)
existierenweiterespektralveranderteVarianten,derenAnregungs-undEmissionsspektren
Abb. 2.8zeigt. Einennutzlichen
Uberblickuber dieFluoreszenzeigenschaften gibt [105].
Yellow uorescent protein YFP: Die Mutationen S65G undS72A undeine der Al-
ternativen T203F, T203H oder T203Y ergeben zwei gestapelte aromatische Ringe, deren
mesomeres-ElektronensystemzueinemAnregungspeakbei512nmundeinermaximalen
Emission um 525nm fuhrt.Auch hierkann ein Ionisierungs- bzw.Protonierungsgleichge-
wichtdes ChromophorsineinerpH-AbhangigkeitderSpektrenundinBlinkenresultieren
0 100
Relative Fluoreszenzausbeute
EGFP EYFP
0 100
400 450 500 550 600 650 700 750
350
400 450 500 550 600 650 700 750
350
l [nm]
0
100 EBFP ECFP
0 100
400 450 500 550 600 650 700 750
350
400 450 500 550 600 650 700 750
350
0 100
400 450 500 550 600 650 700 750
350
DsRed
Relative Fluoreszenzausbeute
l [nm]
l [nm]
Relative Fluoreszenzausbeute Relative Fluoreszenzausbeute
l [nm]
Relative Fluoreszenzausbeute
l [nm]
Abbildung2.8:DienormiertenAnregungs-undEmissionsspektrenvonverschiedenenGFP-
Mutanten und von DsRed nach [105 ]. Anregungsspektren wurden mit Detektion im Maxi-
mum der Emissionsspektren aufgenommen und umgekehrt.
CyanuorescentproteinCFP: DieentscheidendeMutationdieserVarianteistY66W,
der Tyr-Ring wird durch den Doppelring des Trp ersetzt, z.B. bei ECFP (F64L, S65T,
Y66W, N146I, M153T, V163A) [28]. Eine zum wtGFPanaloge Chromophorprotonierung
legt die Struktur nicht nahe. Die maximale Anregungliegt bei ca. 435nm, die maximale
Emissionum480{490nm.
Blue uorescent protein BFP: Um ein Anregungsmaximum bei 382nm und einen
Emissionspeak bei 440nm zu erhalten,ist Tyr66 durch His ersetzt worden (Y66H). Auch
hierscheinteinezumwtGFPanalogeChromophorprotonierungunwahrscheinlich.EinBei-
spielist EBFP (F64L, Y66H, Y145F) [28 ].
Reduorescent proteinDsRed: DasinDiscosomastriataentdeckterotuoreszieren-
de ProteinDsRed [84 , 28 ] (225Aminosauren,25,9kDa) besitzt einen denGFP-Mutanten
sehr
ahnlichen Chromophor Gln-Tyr-Gly(66{68), d.h.der fur dieFluoreszenz notwendi-
ge Tyr-Ringund dasfur die Zyklisierung erforderliche Gly sind erhalten. Die Umgebung
scheint sich jedoch deutlich von wtGFP zu unterscheiden [159, 168 ], so dass ein Absorp-
tionsmaximum bei 558nm und eine maximale Emission um 583nm moglich wird. Auch
in DsRed ist einGleichgewicht von ZustandenunterschiedlicherFluoreszenzeigenschaften
beobachtet worden, das deutlich von der Beleuchtungsintensitat, aber nur schwach vom
pH abhangt [56 ]. Esist nicht geklart, wie derChromophor nach derTranslation gebildet
wird[49]. EinerzellbiologischenVerwendungsteht (noch) entgegen,dass dieReifung sehr
langsam stattndetunddasProteintetramerisiert[8].
Theoretische Grundlagen
3.1 Konfokale Fluoreszenzanregung und -detektion
DiegemeinsameGrundlagederindieserArbeitkombiniertenFluoreszenzkorrelationsspek-
troskopie (FCS) undkonfokalen Laserscanningmikroskopie(CLSM)istdieAnregunguo-
reszenzmarkierterTeilchenmitLaserlichtunddiekonfokaleDetektionderemittiertenFluo-
reszenz.
Liegendie optischenElementeoderStrahlengangeder Beleuchtungundder Detektion
so zueinander, dass die Brennpunkte zusammmenfallen,heit diese Anordnung konfokal.
IhrVorteil ist dieKontrastverbesserung durchStreulichtunterdruckung:Fluoreszenzwird
auch auerhalb des Beleuchtungsfokus z.B. durch gestreutes Anregungslicht erzeugt. Ein
konfokalerDetektionsstrahlengangkanndenStreuuntergrundzwarnichtvollstandigunter-
drucken, jedoch verringern, wie Abb. 3.1 zeigt. Wenn die optischen Elemente abbildende
Eigenschaften haben (z.B. lichtmikroskopische Objektive), kann durch Konfokalitat eine
gutelateraleOrtsauosungundTiefendiskriminierungerreicht werden.
Die Anwendung des konfokalen Prinzips in der Lichtmikroskopie wurde bereits von
M. Minsky 1957 konzipiert, jedoch fuhrte erst die (Weiter-)Entwicklung von hochemp-
ndlichenDetektoren, mechanischenScannern, Lasern, konventionellen Mikroskopen und
Computern zu einer raschen Verbreitung seitMitte der1980er Jahre. Fur FCS sindkon-
fokaleoptische Aufbautenprinzipiellerforderlich:Nachdem inden1970er Jahrenmit Pa-
rabolspiegelnundkonventionellenLinsenexperimentiertwurde,sinddieEntwicklungenin
derkonfokalen Mikroskopie inzwischenerfolgreichauf FCS
ubertragenworden.
FurdieseArbeitwurdeeinbestehenderFCS-AufbauzueinemCLSMerweitertundfur
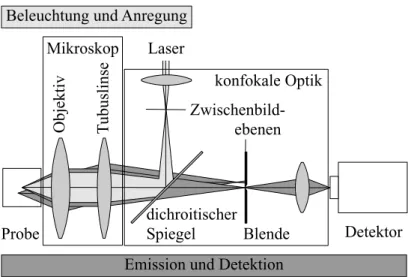
intrazellulareMessungen verwendet. Wiein Abb.3.1 skizziert, tritt der Laserstrahlkolli-
miert auseiner Faser, wird miteiner Linsefokussiertunddahinter
uberdenKameraaus-
gang einesLichtmikroskops indasObjektiveingekoppelt.Das Fluoreszenzlicht wird
uber
das gleiche Objektiv undden gleichen Lichtweg aus dem Mikroskop und mittels Filtern,
SpiegelnundLinsenzudenDetektoren gefuhrt.InderZwischenbildebenedesMikroskops
vor dem Kameraausgang besitzt der anregende Laser eine Strahltaille und der Detekti-
onsstrahlengang eine Lochblende (Pinhole). Sie benden sich an zueinanderkonjugierten
Positionen, getrennt durch einen dichroitischen Spiegel. Dies gewahrleistet die Konfoka-
litat. Entweder wird an einer denierten Position in der Probe der zeitliche Verlauf des
Fluoreszenzsignalsaufgenommenundanalysiert{FCS{oderdasAnregungslichtuberdie
ProbemittelsdrehbarerSpiegelgescanntundpunktweisedieFluoreszenzintensitatmitder
Ortsinformationverknupft{ CLSM.
Probe
Objektiv T u buslinse
dichroitischer Spiegel Laser
Blende Detektor Beleuchtung und Anregung
Emission und Detektion Mikroskop
konfokale Optik Zwischenbild-
ebenen
Abbildung3.1:Das konfokale Prinzipam BeispielderFluoreszenzanregung und -detektion
in einem Mikroskop: Fluoreszenzlicht, das nicht aus dem gemeinsamen Fokus emittiert
wird, wird durchdie Detektionsblende abgeschirmt.
3.1.1 Beleuchtung { Fluoreszenz { Detektion
Das amDetektornachgewiesene Signalentsteht durcheine Kettevon Prozessen: DerAn-
regung des Fluorophors durch den Laser folgt die Umwandlung in Fluoreszenzphotonen,
dieimDetektorelektrischeImpulseerzeugenwerden.AlleSchrittekonnenentwederdurch
gerate- und probenspezische Parameter und Funktionen oder durch spektrale und geo-
metrischeAbhangigkeitenbeschrieben werden [152].
Beleuchtung: DasPrinzipderMehrfarben-FCSund-CLSMsiehtvor,dassuoreszenz-
markierte Teilchendurch Laser unterschiedlicherWellenlangen
ill;i
angeregt werden, die
aufeinmoglichstkleinesgemeinsamesVolumenfokussiertsind.DieraumlichenIntensitats-
verteilungen ergeben sich aus derjeweiligenLaserleistung P
i
undeiner geratespezischen
Funktion
i
(r), die das Strahlproldes Lasers unddie Abbildungseigenschaften des Ob-
jektivsberucksichtigt:
I
ill;i
(r)=P
i
i
(r): (3.1)
Vor allem Beugungseekte und chromatische Fehler der Optik bewirken die spektrale
Abhangigkeit, die aber mit einem Index i erfasst werden kann, da mit diskreten Laser-
liniengearbeitetwird.
Fluoreszenz: Fur biologische Fragestellungen werden haug Makromolekule wie DNA
oderProteine verwendet,an dieFluorophoregebundensind.Die spektralenEigenschaften
werden durch denTyp, die Anzahlunddie Bindung derFluorophore bestimmt.Der Ab-
sorptionsprozess
uberfuhrtmiteinerwellenlangenabhangigenWahrscheinlichkeit(),dem
Absorptionsspektrum,denFluorophorineinen angeregten Zustand.Anschlieend kommt
es mit der Wahrscheinlichkeit q(), dem Emissionsspektrum, zum strahlenden
Ubergang
Detektion: Fluoreszenzphotonen werden isotrop abgestrahlt. Die Wahrscheinlichkeit,
dass sie vom Objektiv aufgefangen werden undauf den Detektor j treen, wird von der
Position r des Teilchens in der Probe bestimmt und als geometrische Transferfunktion
GTF
j
(r)bezeichnet.DiespektraleTransferfunktionSTF
j (
det
)hingegenberucksichtigtdie
EigenschaftenderEmissionslterunddiespektraleNachweiseÆzienzderDetektoren.Ver-
wendet manzur Detektion Photomultiplier(PMTs)oderAvalanchephotodioden(APDs),
sozeigt sichdieQuantennaturdesUmwandlungsprozessesvon Licht inelektrischeSignale
ineinerzusatzlichenPoisson-VerbreiterungderAnzahldernachgewiesenenPhotonen,dem
sogenanntenShotNoise [120 ].
Zusammenergebendie eingefuhrtenGroenundFunktionendenamDetektorj nach-
gewiesenen PhotonenusseinesFluorophors, dersichamOrtrinderProbe bendet und
mitderLaserlinieiangeregt wird:
f
j
(r)= P
i
i (r)(
ill;i )
| {z }
Beleuchtung, Anregung GTF
j (r)
Z
d
det q(
det )STF
j (
det )
| {z }
Emission,Detektion
: (3.2)
SielassensichzusammenfassenzueinerdurchdieanregendeWellenlangeiunddenDetek-
tionskanal j bestimmtenKonstanten
ij
, dem Farbmatrixelement [152], undeiner raum-
lichenDetektionswahrscheinlichkeit
ij
(r),dermolecular detection eÆciencyMDE[6 ],so
dassmit
ij
=(
ill;i )
Z
d
det q(
det )STF
j (
det
) und (3.3)
ij
(r)=
i
(r)GTF
j
(r) (3.4)
bei Verwendung mehrerer Anregungslinien am Detektor folgendes Signal nachgewiesen
wird:
f
j (r)=
X
i P
i
ij ij
(r): (3.5)
Die Farbmatrixwird durch dieEigenschaften der Fluorophore undder optischenEle-
mentedesSystems(wieLaserlinienundEmissionslter)deniert.UnteridealenBedingun-
gen verschwinden inMehrfarbenexperimentendieNichtdiagonalelemente der Farbmatrix,
d.h. es kommt nicht zu sogenanntem
Ubersprechen oder Crosstalk. Dieser Eekt wird
in Abschnitt 3.2.6 diskutiert, ansonsten werden eben diese idealen Voraussetzungen an-
genommen. Je eine Laserlinie und ein Detektionskanal werden zusammengefasst und im
Folgendenmitk;l2f1;2g indiziert.
3.1.2 Verschiedene Strahlgeometrien
Sowohl fur FCS als auch fur CLSM ist ein moglichst kleiner Fokus wunschenswert. Die
kleinstedenkbare Lichtquelle zurAnregungist einLeuchtpunktinderZwischenbildebene
desMikroskops, deraberinFolge von Beugung nicht als Punkt indie Objektebeneabge-
bildetwird,sondernals verschmierteIntensitatsverteilung,diePoint Spread Functionder
BeleuchtungPSF
ill
(r)[52 ,106].VonallenPunkteninnerhalbdieserPSFkannFluoreszenz
emittiertwerden,deren Emissionsprolwiederum durch dieDetektions-PSF PSF
det (r) in
Man verwendet daher in der Zwischenbildebenezur Anregung eine Strahltaille, deren
Radius,beidemdieIntensitat auf1/e 2
abgefallen ist,gleichdemoderkleineralsder1/e 2
-
Radius der PSF
ill
(r) multipliziertmit dem Abbildungsmastab des Objektivs ist. Dies
beeinusst das Beleuchtungsprol an der Eingangsapertur des Objektivs und damit das
ProlderPSF
ill
(r),wieAbb.3.2gzeigt:JekleinerdieStrahltaillegewahltist,umsobreiter
ist dasBeleuchtungsprolundumgekehrt.
Der Radius der Detektionsblende sollte etwa gleich dem 1/e 2
-Radius der PSF
det (r)
multipliziertmitgewahltwerden.Dannistgewahrleistet,dasseinerseitsnurFluoreszenz
aus dem Beleuchtungsfokus durch die Lochblende tritt undandererseits moglichst wenig
Signalausdem Fokus abgeschnittenwird.
UnterdiesenVoraussetzungenentsprechendieraumlichenFunktionen
i
(r) {Gl.(3.1)
{undGTF
j
(r)derBeleuchtungs-undderDetektions-PSF,unddieDetektionswahrschein-
lichkeit ist [145]
k
(r)=PSF
ill;k
(r)PSF
det ;k
(r); (3.6)
Man spricht von wellenoptischer Konfokalitat [169 ]. Insbesondere fur groere Blenden-
durchmesseristeine zusatzliche FaltungderDetektions-PSFmitdem Transmissionsprol
inderZwischenbildebenevorzunehmen[103,125,127].
Gau'sches Strahlprol: Beleuchtet man die Eingangsaperturdes Objektivs mitLa-
serlicht inTEM
00
-Mode, dessen 1/e 2
-Radius gleich dem Aperturradius ist, ist die Inten-
sitatsverteilunginderProbenaherungsweiseein Gau'schesStrahlprol
PSF
ill;k (r)=
w
0
w(z)
2
exp
2 x
2
+y 2
w 2
(z)
mit (3.7)
w(z)=w
0 s
1+ z
2
2
w 2
0
; w
0
=
ill;k
n
; NA =nsin; (3.8)
dabeiist w
0
die lateraleStrahltaille,NA dienumerische Apertur, der maximaleWinkel
deskonvergentenLichtszuroptischenAchseundnderBrechungsindex.DieoptischeAchse
entspricht der z-Achse. Gl. (3.7) und(3.8) geltennurin paraxialerNaherung (NA<0; 7),
fur groe NA kann die Strahltaille unter das Abbe'sche Beugungslimit w
0
= 0; 61=NA
sinken. Dann ist w
0
durch 0; 61=NA zu ersetzen. Die reine Detektion wird beschrieben
durchdiePSF beigleichformigbeleuchteter Apertur:
PSF
det ;k (r)=
sinu
u
2
2J
1 (v)
v
2
mit (3.9)
u=n 2
det;k zsin
2
(=2); v=n 2
det;k p
x 2
+y 2
sin: (3.10)
AnschaulichistdieslateraldasBeugungsbildeinerKreisblende{ daherdieBesselfunktion
J
1
{ und axial das einesSpaltes { daher die Sinusfunktion[142,52]. Das laterale Haupt-
maximum wird als Airy disk mitdem Radius0;61=NA bezeichnet. Gl. (3.9) und(3.10)
sindfurgroere NA nurapproximiertgultig.
0 2 0 0 4 0 0
M D E F i t
P S F d e t P S F i l l
( a )
0 1 0 0 0 2 0 0 0
G a u ß ' s c h e B e l e u c h t u n g
( b )
( c )
Ü b e r b e l e u c h t u n g ( d )
0 2 0 0 4 0 0
( e )
r a d i a l e r A b s t a n d [ n m ]
0 1 0 0 0 2 0 0 0
k o r r i g i e r t e
Ü b e r b e l e u c h t u n g ( f )
a x i a l e r A b s t a n d [ n m ]
Zwischenbild- ebene Fokus- ebene
α w k
Objektiv
Tubuslinse (g)
z k
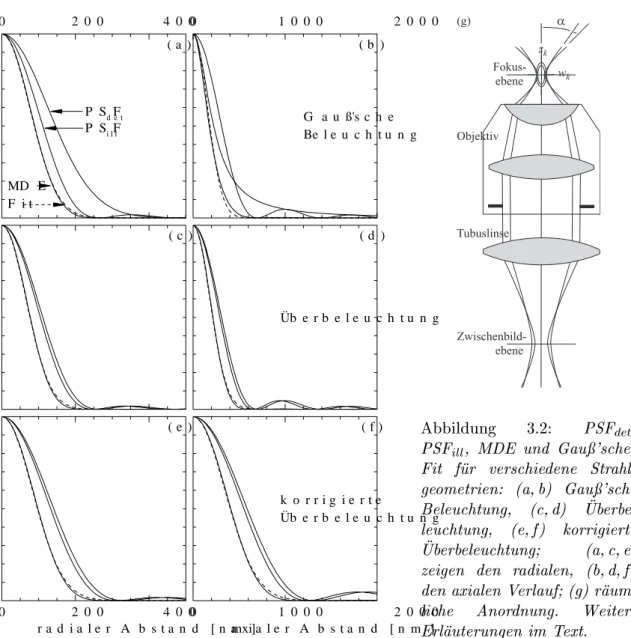
Abbildung 3.2: PSF
det ,
PSF
il l
, MDE und Gau'scher
Fit fur verschiedene Strahl-
geometrien: (a,b) Gau'sche
Beleuchtung, (c,d)
Uberbe-
leuchtung, (e,f) korrigierte
Uberbeleuchtung; (a,c,e)
zeigen den radialen, (b,d,f)
denaxialen Verlauf;(g) raum-
liche Anordnung. Weitere
Erlauterungen im Text.
Uberbeleuchtete Eingangsapertur: In diesem Fall ist die Beleuchtungsstrahltaille
kleiner als der 1/e 2
-Radius der PSF in der Zwischenbildebene und die Intensitat an der
Eingangsaperturnaherungsweisekonstant. Dann sindBeleuchtungs- und Detektions-PSF
nachGl. (3.9) mitzugehorigenWellenlangenzu beschreiben.
Die Detektionswahrscheinlichkeiten fur typische experimentelle Parameter sind in
Abb.3.2 dargestellt:Die AnpassungeinerdreidimensionalenGaufunktion Gl.(3.27), die
furdieBerechnunganalytischerKorrelationsfunktionennotwendigist,zeigteinegute
Uber-
einstimmung mitdenMDE
k
(r).Gewahltwerden
ill;k
=488nm(die imRahmen dieser
Arbeit uberwiegend verwendete Laserlinie),
det ;k
= 519nm, NA= 1;2 und n= 1; 34 (fur
dasim Rahmendieser Arbeit verwendete Wasserimmersionsobjektiv)entsprechendeinem
halbenAperturwinkelvon63,6 Æ
.Damitergebensichderradialeundderaxiale1/e 2
-Radius
zu
w
k
=150nm ; z
k
=312nm furGau'sche Beleuchtung, Abb. 3.2a, b,
w =130nm ; z =361nm fur
Uberbeleuchtung, Abb.3.2c,d. (3.11)
DaeinerseitsdieBeschreibungalsGau'scherStrahlbeigroerNAamwenigstengeeignet,
anderserseits die Ausleuchtung der Objektiv-Eingangsapertur im hier verwendeten expe-
rimentellenAufbau jedoch gauformig ist, ergibtsich als weiterer Ansatzdie Berechnung
der PSFnach Gl. (3.9) mitreduzierter NA:Fur wirdder zum Intensitatsabfallauf 1/e
(nicht1/e 2
) gehorende Winkel=63; 6 Æ
= p
2=45; 0 Æ
(NA=0;95) gewahlt:
w
k
=164nm ; z
k
=685nm furkorrigierte
Uberbeleuchtung,Abb. 3.2e, f. (3.12)
3.1.3 Fokusgroe und raumliche Auosung
Die Groe desFokus bestimmt dieraumliche Auosung einesMikroskops, die als der mi-
nimale Abstanddeniert ist, denzwei gleichhelle Lichtpunkte in der Objektebene haben
durfen,umnochalsgetrenntePunkteaufgelostzu werden.DiesentsprichtdenHalbwerts-
breiten derDetektionsfunktion
k (r):
w
FWHM
=w
k p
2ln2 lateralund z
FWHM
=z
k p
2ln2 axial: (3.13)
BeispielsweiseerfordernDekonvolutionsverfahrenfurmikroskopischeBildereinemoglichst
genaueKenntnisvon
k
(r).Die Fokusgroe bestimmtauch diemittlereAufenthaltsdauer
diundierender Molekule im Fokus, so dass bei genauer Kenntnis von
k
(r) mit FCS-
Experimenten DiusionskoeÆzienten bestimmt werden konnen und umgekehrt mit der
DiusionvonMolekulenmitbekanntemDiusionskoeÆzientenderFokus
"
vermessen\ wer-
denkann[143 ,58 ].Nimmtmanw
k
;z
k
nachGl.(3.12)alsRadieneinesRotationsellipsoids,
sohatderFokus einVolumenvon
V
focus
= 4
3 w
2
k z
k
=77al : (3.14)
3.2 Grundlagen der Fluoreszenzkorrelationsspektroskopie
Eine FCS-Messung ergibt die Korrelationsfunktionder Fluktuationen von Fluoreszenzsi-
gnalen, die Molekule in einem mikroskopischen Fokusvolumen emittieren, wenn sie mit
kontinuierlichemLaserlicht beleuchtetwerden.DieseSignaluktuationenkonnenverschie-
dene Ursachen haben, die entweder Diusionsprozessen oder
Ubergangen zwischen elek-
tronischensowieKonformationszustandenzugeordnetwerden konnen. UmdieseVorgange
zu charakterisieren, muss jeweils eine geeignete theoretische Korrelationsfunktion an die
gemesseneangepasst werden.
In den grundlegenden Arbeiten zur FCS aus den 1970er Jahren [81 , 39 , 82 ] wurden
statistische Teilchenzahlschwankungen im Fokusvolumen durch Diusion als Ursache der
Fluktuationenangenommen. Theoretischundexperimentellwurdegezeigt,dass sich Kon-
zentrationen und DiusionskoeÆzienten chemisch wechselwirkender Komponenten sowie
dieGeschwindigkeitskonstantenihrerReaktionbestimmenlassen.ErsteAnwendungenun-
tersuchtenauerdem zweidimensionale DiusioninMembranen [40,41 ].
Spater wurden andere Prozesse wie die Rotationsdiusion [37, 6 ], die Besetzung von
Triplett-undanderennichtstrahlenden Zustanden[165 ,54 ]undKonformationsuktuatio-
neneinzelnerMolekule[15 ] als Ursache von Fluoreszenzuktuationenberucksichtigt.
AuchderEinussderStrahlgeometrienaufdieKorrelationsfunktionenistfurverschie-
dene experimentelle Aufbauten behandelt worden [39 , 6 , 125 , 127 , 58 ], insbesondere in
Folge der Weiterentwicklung hochauosender konfokaler Mikroskopie. FCS ist auch zur
Bestimmung derGroe des Fokus verwendet worden[143,58 ].
Die Zweifarben-FCS mit der Kreuzkorrelation spektral unterschiedlicher Fluoreszen-
zen (FCCS) [129, 137 , 152 , 72] ist besonders zur Untersuchung biochemischer Interaktio-
nengeeignet. DieEntwicklungultrakurzgepulsterLaserim nahenInfrarotbereicherlaubt
MultiphotonenanregungfurFC(C)Sebensowieinder konfokalenMikroskopie[11 , 139 ].
Neben der FCS sindweitere Methodender Fluoreszenzuktuationsspektroskopie ent-
wickelt worden:Durch die Kinetik von Photobleaching kann Diusion untersucht werden
[7 , 111 ]. Die Identizierung spektraler Spezies und die Charakterisierung von Aggregati-
on geschieht durch die Analyse der Photonenverteilungen [123, 27 , 63 ] oder durch Kor-
relationsfunktionen hoherer Ordnung [100 , 102, 101 ]. Und auch raumliche Korrelationen
uoreszierenderMolekulekonnenstudiertwerden[112,114,10 ,167 ].
Die Charakterisierung von Diusions- undTransportprozessen inlebenden Zellenmit
FCS gewinnt zunehmend an Bedeutung, da dieseMethode nichtinvasiv, mit beugungsbe-
grenzter Ortsauosung und ohne wesentliche Storungen lokaler Gleichgewichte arbeitet.
Dabeigeht dietheoretische BerucksichtigunginsbesonderedesEinusseszellularerStruk-
turenauf dieBeweglichkeiteinzelner Molekule [138 ,158 , 46 ]einhermitexpermimentellen
Weiterentwicklungen,dieFCS mitFluoreszenzmikroskopieverknupft[17 ].
Die theoretischenGrundlagenderFCSin diesemAbschnittwerden angelehnt an[153 ,
152 ]dargestelltundgegebenenfallserweitert.DiefolgendenAbschnittebeleuchtenAspekte,
diebei komplexerenbiologischenSystemenwie Makromolekulen undZellen besonders zu
berucksichtigen sind.
3.2.1 Die Korrelationsfunktion einer Spezies
Betrachtet wird zunachst ein System aus N nicht wechselwirkenden Teilchen in einem
Probenvolumen V, die entweder einfarbig uoreszenzmarkiert sind mit Farbstoen der
Sorte k 2 f1;2g oder zweifarbig mit je einem Fluorophor jeder Sorte. Die Fluorophore
konnen zwei Detektionskanalen k 2 f1;2g zugeordnet werden. Es sei
k
(r) die Detekti-
onswahrscheinlichkeiteinesamOrtrlokalisiertenFluorophorsimKanalk undf
k;n (t)das
nachgewiesene Signaldes Teilchens n amOrtr(t) (Gl. (3.4) und(3.5). Das Gesamtsignal
ineinemDetektor entsteht aus derSummederBeitrage der einzelnenTeilchen
F
k (t)=
N
X
n=1 f
k;n
(t): (3.15)
Bendet sich das Teilchenzur Zeit tam Ort r
1
undzur Zeit t+ am Ort r
2
,so gilt
mitk;l2f1;2g
f
k;n (t)f
l ;n
(t+)/
k (r
1 )
l (r
2
): (3.16)
Wenndie TeilchenbewegungeinMarkow'scher Prozessist, ergibtsich dieWahrscheinlich-
keit,dasssichdasTeilchenzurZeitt+ amOrtr
2
bendetunterderVoraussetzung, dass
essichzur Zeitt beir
1
befand, zu [59 ]
P
D (r
2
;t+jr
1
;t)d 3
r
2
=P
D ( r
2
;jr
1
;0)d 3
r
2
; (3.17)
istalsounabhangigvonallenPositionenzuZeitenkleinert,vomPfadr
1
!r
2
undvonzeit-
lichenVerschiebungen. Die Aufenthaltswahrscheinlichkeit des Teilchens an einer Position
r
1
betragt
W (r )d 3
r : (3.18)
DiezeitlichgemittelteFluoreszenzintensitatergibtsichausdemEnsemblemittelwert,dem
Produkt von Detektions- und Aufenthaltswahrscheinlichkeit, integriert
uber das gesamte
Volumen:
hf
k;n (t)i/
Z
V d
3
r
1 W
D (r
1 )
k (r
1
); (3.19)
unddamit:
hf
k;n (t)f
l ;n
(t+)i/ Z
V d
3
r
1 Z
V d
3
r
2 W
D (r
1 )
k (r
1 )P
D (r
2
;jr
1
;0)
l (r
2
) (3.20)
In einem FCS-Experiment wird die normierte Korrelationsfunktion (CF) G
kl
() der
Fluktuationen der gemessenen Detektorsignale ÆF
k
(t) = F
k
(t) hF
k
(t)i aufgenommen,
k;l 2 f1;2g indizieren dabei die Kanale. Wenn k = l ist, handelt es sich um die Auto-,
sonstumdie Kreuzkorrelationsfunktion(ACFbzw.CCF):
G
kl
() = hÆF
k (t)ÆF
l
(t+)i
hF
k (t)ihF
l (t)i
= hF
k (t)F
l
(t+)i
hF
k (t)ihF
l (t)i
1
= h
P
N
n;m=1 f
k;n (t)f
l ;m
(t+)i
h P
N
n=1 f
k;n (t)ih
P
N
n=1 f
l ;n (t)i
1 (3.21)
Im Falle nicht wechselwirkender Teilchen sind die Groen f
k;n
(t) undf
l ;m
(t+) furalle
n6=m unabhangig,damit wird derErwartungswertihres Produktesgleich dem Produkt
ihrerErwartungswerte. Auerdem genugtes, dasSignal einesreprasentativen Teilchensn
zu betrachten. Damitergibt sich
G
kl
() = Nhf
k;n (t)f
l ;n
(t+)i+N(N 1)hf
k;n (t)ihf
l ;n (t)i
N 2
hf
k;n (t)ihf
l ;n (t)i
1
= 1
N hf
k;n (t)f
l ;n
(t+)i
hf
k;n (t)ihf
l ;n (t)i
1
N
= 1
N R
V d
3
r
1 R
V d
3
r
2 W
D (r
1 )
k (r
1 )P
D ( r
2
;jr
1
;0)
l (r
2 )
R
V d
3
r
1 W
D (r
1 )
k (r
1 )
R
V d
3
r
1 W
D (r
1 )
l (r
1 )
1
N
: (3.22)
Geometrische undspektraleEigenschaftendes optischenSystems bestimmen denVer-
lauf der Detektionswahrscheinlichkeiten, wahrend die Eigenschaften der Probe bezuglich
Diusionsverhalten, intramolekularer Fluktuationen und Photobleaching eine geeignete
Wahl der
Ubergangswahrscheinlichkeitenerfordern.
3.2.2 Freie Diusion
ImFallefreier Diusion ohnezusatzlichenFluss oder
auere Krafte verknupfen daserste
Fick'sche Gesetz unddieKontinuitatsgleichungdenTeilchenussmitderKonzentration:
j(r;t)=
^
D(r;t)rc(r;t) und
@c(r;t)
@t
= rj(r;t); (3.23)
^
D(r;t) ist im allgemeinsten Fall ein 33-Tensor, in einer isotropen Losung jedoch eine
Konstante D
0
,derDiusionskoeÆzient.Dieserist umgekehrt proportionalzumReibungs-
koeÆzientenf bzw.zurViskositat undzumStoke'schenoderhydrodynamischenRadius