Inhaltsverzeichnis
Inhaltsverzeichnis
1 Abkürzungen und Akronyme... 5
1.1 Materialien und Einheiten ... 5
1.2 Symbole für die DNA-Basen ... 13
1.3 Symbole für die Aminosäuren ... 14
2 Einleitung ... 15
2.1 Calciumfreisetzung in Lymphocyten ... 15
2.2 Nicht-spannungsgesteuerte Calciumkanäle ... 17
2.3 Aktivierungsmodelle ... 18
2.4 Die TRP-Protein-Familie ... 20
2.4.1 Entdeckung von TRP in der Lichtleitung in Drosophila melanogaster Photorezeptoren... 21
2.4.2 Merkmale der TRP-Protein-Familie ... 21
2.4.3 Eigenschaften der TRP-Proteine in Drosophila melanogaster... 26
2.4.4 Eigenschaften der TRPC-Familie ... 28
2.4.5 Eigenschaften der TRPV-Familie ... 33
2.4.6 Eigenschaften der TRPM-Familie... 36
2.4.7 Tetramerisierung von TRP-Proteinen ... 39
2.5 Signalkomplexbildung und Aktivierung von TRP-Proteinen ... 40
2.5.1 Aktivierung durch lösliche Faktoren... 41
2.5.2 Aktivierung durch direkte Protein-Protein-Interaktion... 42
2.5.3 Einfluss des Cytoskeletts auf die Aktivierung von TRPC-Kanälen... 44
3 Problemstellung... 47
4 Zusammenfassung... 48
5 Material ... 50
5.1 Geräte ... 50
5.2 Verbrauchsmaterialien ... 51
5.3 Chemikalien ... 52
5.4 Fertige Reaktionspakete ... 53
5.5 Enzyme... 53
5.6 Puffer, Medien und Lösungen... 53
5.7 Antikörper ... 58
5.8 Zelllinien ... 59
Inhaltsverzeichnis
5.9 E. coli-Stämme... 60
5.10 Hefe-Stamm ... 60
5.11 Genbank ... 60
5.12 Plasmide ... 61
5.13 cDNA-Konstrukte ... 63
5.14 Oligonukleotide... 63
5.15 Software und Internetdienste... 65
6 Methoden... 66
6.1 Molekularbiologische Methoden ... 66
6.1.1 RNA-Isolierung... 66
6.1.2 Konzentrationsbestimmung von Nukleinsäuren ... 66
6.1.3 Reverse Transkription ... 66
6.1.4 Polymerase Kettenreaktion ... 67
6.1.5 Restriktionsanalyse ... 68
6.1.6 Klenow-Behandlung ... 68
6.1.7 Dephosphorylierung von Vektor-DNA... 69
6.1.8 Agarose-Gelelektrophorese... 69
6.1.9 Aufreinigung von DNA-Fragmente ... 69
6.1.10 Ligation von DNA-Fragmenten ... 69
6.1.11 Herstellung kompetenter E. coli-Zellen und Transformation ... 70
6.1.12 Bakterienkultur und Lagerung ... 72
6.1.13 CTAB-Plasmidpräparation... 72
6.1.14 Plasmidpräparation über Ionenaustauschersäulen... 73
6.1.15 Fällen von DNA ... 73
6.2 LexA Hefe-2-Hybrid-System... 73
6.2.1 Kultivierung und Lagerung von Hefen ... 74
6.2.2 Herstellung chemisch kompetenter Hefen und Transformation ... 75
6.2.3 Notwendige Vortests... 75
6.2.4 Nachweis der Expression des vollständigen Proteins ... 78
6.2.5 Retitern der Genbank in E. coli... 79
6.2.6 Amplifikation der Genbank und Isolierung der Plasmid-DNA ... 79
6.2.7 Ermittlung der Transformationseffizienz... 80
6.2.8 Transformation der Hefen und Amplifikation der Genbank... 81
6.2.9 Titern und Durchmusterung der A20 cDNA-Expressionsgenbank ... 82
Inhaltsverzeichnis
6.2.10 Test der Induzierbarkeit der Expression des Reportergens... 82
6.2.11 Isolierung von Plasmid-DNA aus Hefen... 83
6.2.12 Selektion der Genbankplasmide... 83
6.2.13 Untersuchung der isolierten Genbank-Plasmide... 84
6.3 Zellbiologische Methoden... 86
6.3.1 Bestimmung der Zellkonzentration... 86
6.3.2 Lagerung und Auftauen von Zellen ... 86
6.3.3 Transiente Transfektion von COS-M6-Zellen ... 87
6.3.4 Immunfluoreszenzmikroskopie an COS-M6-Zellen... 87
6.4 Proteinbiochemische Methoden ... 89
6.4.1 Immunpräzipitationen aus transient transfizierten COS-M6-Zellen... 89
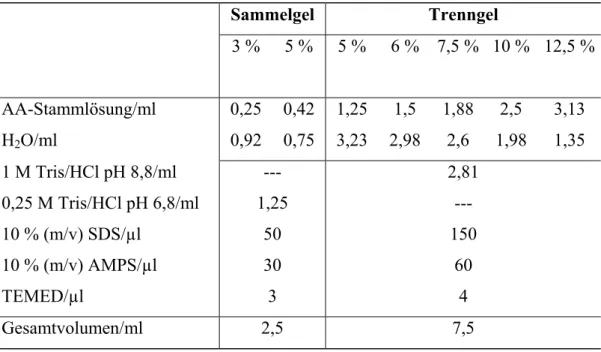
6.4.2 SDS-Polyacrylamid-Gelelektrophorese ... 90
6.4.3 Silberfärbung von Proteingelen... 91
6.4.4 Elektrophoretischer Proteintransfer ... 91
6.4.5 Immunologischer Nachweis... 92
6.4.6 Entfernung membrangebundener Antikörper ... 93
7 Ergebnisse ... 94
7.1 Klonierung von TRPC-Fusionsproteinen und Deletionsmutanten ... 94
7.2 Interaktion verschiedener TRPC-Isoformen miteinander ... 97
7.2.1 Voruntersuchungen zur Ermittlung des Systems ... 98
7.2.2 Interaktion von mTRPC1β mit mTRPC2β... 100
7.2.3 Einfluss der N-terminalen cytoplasmatischen Domäne von TRPC1β.. 101
7.2.4 Interaktion der TRPC-Proteine über den N-Terminus ... 107
7.2.5 Homotetramerisierung von TRPC-Proteinen im Vergleich zu Heterotetramerisierung und die Rolle der N-terminalen Domänen ... 111
7.2.6 Rolle der Porenregion bei der Assemblierung von TRPC-Proteinen.... 122
7.3 Interaktion mit dem LAT-Protein ... 123
7.4 Interaktion von TRPC1β-NT mit bisher unbekannten Partnern ... 127
7.4.1 Verlauf der Genbankdurchmusterung ... 127
7.4.2 Erste Untersuchung einiger Interaktoren von mTRPC1β-NT... 130
8 Diskussion ... 141
8.1 TRPC1, 2 und 3 bilden sowohl Homo- als auch Heterotetramere ... 143 8.2 Die Assoziation über den N-Terminus bevorzugt Heterotetramere mittels
Inhaltsverzeichnis
8.3 Die Interaktion von TRPC1 und 3 mit LAT benötigt weder die Ankyrin-
ähnlichen Wiederholungen noch die „coiled-coil”-Domäne ... 160
8.4 Die TRPC1-Interaktion mit dem Actincytoskelett über den N-Terminus könnte über Tropomodulin 3 vermittelt werden ... 162
8.5 mTRPC1β interagiert über seinen N-Terminus mit zellspezifischen Adapterproteinen... 168
8.6 Zusammengefasstes Modell und Hypothese der Aktivierung von TRPC1- Kanälen in B-Zellen ... 176
9 Literaturverzeichnis... 179
10 Anhang ... 227
10.1 Aminosäuresequenzen der TRPC-Isoformen... 227
10.1.1 Aminosäuresequenz von TRPC1-Varianten ... 227
10.1.2 Aminosäuresequenzen von mTRPC2-Isoformen... 230
10.1.3 Aminosäuresequenz von TRPC3 ... 233
10.1.4 Aminosäuresequenzvergleich der murinen TRPC-Proteine ... 234
10.1.5 Aminosäuresequenz von LAT... 237
10.2 Klonierungsschemata ... 238
10.2.1 Klonierungsschema von pcDNA3/mTRPC1β-NT-FLAG/myc... 238
10.2.2 Klonierungsschema von pBluescript KS/mTRPC1-CT-HA... 239
10.2.3 Klonierungsschema von pcDNA3/mTRPC1β-NT-HA ... 240
10.2.4 Klonierungsschema von pcDNA3/mTRPC1β-NT∆ank/cc-FLAG/HA 241 10.2.5 Klonierungsschema von pLexA/mTRPC1β-NT∆ank/cc... 242
10.2.6 Klonierungsschema von pcDNA3/hTRPC3-FLAG... 243
10.3 Genbank-Durchmusterung ... 244
10.3.1 Mit mTRPC1β-NT interagierende Klone ... 244
10.3.2 Aminosäuresequenzen mit mTRPC1β-NT interagierender Proteine.... 246
10.3.3 Sequenzvergleiche der Interaktoren von mTRPC1β-NT... 250
11 Abbildungs- und Tabellenverzeichnis... 254
11.1 Abbildung... 254
11.2 Tabellen... 255
1 Abkürzungen und Akronyme 1.1 Materialien und Einheiten
1.1 Materialien und Einheiten
1 Abkürzungen und Akronyme
βME β-Mercaptoethanol
[Ca2+] Calciumionenkonzentration
[Ca2+]i intrazelluläre Calciumionenkonzentration
°C Grad Celsius
∆ Deletion
µM Micromolar
12CA5 mAk der Maus gegen das HA-Epitop
14-3-3 ε 14-3-3 Protein epsilon Isoform (siehe Ywhae) 14-3-3 θ 14-3-3 Protein theta Isoform (siehe Ywhaq)
293T Variante der (HEK) 293-Zelllinie, die das große T-Antigen des SV40-Virus exprimiert
3F10 mAk der Ratte gegen das HA-Epitop 4.1G Generell exprimiertes Protein 4.1 9E10 mAk der Maus gegen das myc-Epitop 10A5 mAk der Maus gegen Actin
AA Acrylamid-Bisacrylamid Abb. Abbildung
Ac Acetyl
AD Aktivierungsdomäne (Y2HS)
ALS Amyotrophische Lateralsklerose Ak Antikörper
Amp Ampicillin, ampicillinhaltig AMPS Ammoniumperoxodisulfat ank Ankyrin-ähnliche Wiederholungen AS Aminosäure
ATCC „American Type Culture Collection”
ATP Adenosin-5’-triphosphat
1 Abkürzungen und Akronyme 1.1 Materialien und Einheiten BCR B-Zellrezeptor („B cell receptor“)
BD DNA-Bindungsdomäne (Y2HS)
Blk B-Lymphocyten Kinase („B-lymphoid kinase“) bp Basenpaar
BSA Rinderserumalbumin bzw. beziehungsweise ca. circa
CaM Calmodulin
cAMP cyclische Adenosin-3’,5’-phosphorsäure cc „coiled-coil”
CCE kapazitativer Calciumioneneinstrom („capacitative calcium entry”) CCP Clathrin beschichtete Grube („Clathrin-coated pit”)
CCV Clathrin beschichtetes Vesikel („Clathrin-coated vesicle”) CD „cluster of differentiation”
cDNA komplementäre DNA („complementary DNA“) C. elegans Caenorhabditis elegans
cfu Einheit des Genbanktiters („colony forming Units“) cGMP cyclische Guanosin-3’,5’-phosphorsäure
CHO Zellen aus Eierstöcken des Chinesischen Hamsters („chinese hamster ovary“) CIF Calciumeinstromfaktor („Calcium influx factor”)
CKII Casein Kinase II
CLa Clathrin leichte Kette Isoform a CMV Cytomegalievirus CoIP Co-Immunpräzipitation
Crlf3 Cytokinrezeptor-ähnlicher Faktor 3 („cytokine receptor-like factor 3“) CT C-terminale Domäne, cytosolisch bei TRPC-Proteinen
CTAB Hexadecyltrimethylammoniumbromid (Cetyltrimethylammoniumbromid) Cy2 Carbocyanin
Cy3 Indocarbocyanin
CytD Cytochalasin D
Cytor4 Cytokinrezeptor verwandtes Protein 4 („cytokine receptor-related protein 4“) d Schichtdicke bei OD-Messungen oder Drosophila melanogaster
DAG Diacylglycerin DEAE Diethylaminoethyl
1 Abkürzungen und Akronyme 1.1 Materialien und Einheiten DH Dbl Homologiedomäne
DI Aminosäurezusatz („Drop-In”)
DMEM „Dulbecco’s Minimal Essential Medium”
DMSO Dimethylsulfoxid
DN dominant-negative Mutante
DNA Desoxyribonukleinsäure („desoxyribonucleid acid”) DNase Desoxyribonuklease
dNTP Desoxyribonukleosidtriphosphat
DO Aminosäuremischung, der einzelne Aminosäuren fehlen („Drop-Out”) DTT 1,4-Dithiothreitol
dys Dystrophin-ähnlich E. coli Escherichia coli
ECL Verstärkte Chemilumineszenz („Enhanced Chemiluminescence”) EDTA Dinatriumsalz der Ethylendiamin-N,N,N’,N’-tetraessigsäure
EGFP verstärkstes Grünfluoreszierendes Protein („enhanced green fluorescent protein”)
ER Endoplasmatisches Retikulum
Erk Ras-extrazelluläres Signal-regulierte Kinase
F(ab’) Antigenbindendes Fragment („Fragment antigen binding“)
Fc kristallisierbares Fragment von Antikörpern („Fragment crystalline“) FcR Fc-Rezeptor
FCS fötales Kälberserum („fetal calf serum“) FcγR IgG-Rezeptor (Fc-spezifisch)
FGD „Faciogenital Dysplasia“ Protein
FLAG® Octapeptid, DYDDDDDK, eingetragenes Warenzeichen der Firma Sigma- Aldrich, wird als spezifisches Epitop für Ak verwendet
FRET Fluoreszenz-Resonanz-Energie-Transfer
g Erdbeschleunigung oder Gramm
Gads Grb-2 ähnliches Adapterprotein („Grb2-related adaptor protein“) Gal Galactose
GDP Guanosin-5’-diphosphat
GEF Guanin-Nukleotid-Austauschfaktor („guanine nucleotide exchange factor“) Glu Glucose
Gms Gentamycinsulfat
1 Abkürzungen und Akronyme 1.1 Materialien und Einheiten GPVI Glykoprotein VI (Kollagenrezeptor)
Grb Wachstumsfaktorrezeptor bindendes Protein („growth factor receptor binding protein”)
GTP Guanosin-5’-triphosphat Gαβγ trimeres G-Protein
h Human oder Stunde
HA Nonapeptid aus dem Hämagglutininprotein, YPYDVPDYA, wird als spezifisches Epitop für Ak verwendet
HEK menschliche embryonale Nierenzelllinie („human embryonal kidney“) HEK293 HEK-Zellinie
HEPES 2-[4-(2-Hydroxyethyl)-1-piperazino]-ethansulfonsäure His- Medium, in dem Histidin fehlt, oder Histidinauxotrophie
HMK hochmolekularer Komplex
Hsc cytosolisches Hitzeschock Protein („cytosolic heat shock“) hTRPC3 humanes TRPC-Protein, Isoform 3
HUVEC menschliche Nabelschnurvenenzellen („human umbilical vein cells“) ICRAC durch Ca2+-Freisetzung aktivierter Ca2+-Strom
(„Ca2+-release-activated Ca2+-current”) Ig Immunglobulin
IgG Immunglobulin G
IgM Immunglobulin M
IP Immunpräzipitation IP3 Inositol-1,4,5-trisphosphat
IP3-R IP3-Rezeptor IRES „internal ribosomal entry side”
ITAM tyrosinbasierendes Aktivierungsmotiv von Immunrezeptoren („immunoreceptor tyrosine-based activation motif”)
Itk durch Interleukin 2-induzierbare T-Zell-Kinase
JNK c-Jun N-terminale Kinase („c-Jun N-Terminal kinase”) k Kaninchen oder kilo
kB Kilobasenpaare kDa Kilodalton
LAT Verbindungsmolekül für die Aktivierung von T-Zellen („linker for activation of T-cells“)
1 Abkürzungen und Akronyme 1.1 Materialien und Einheiten
LB Luria Broth
Lck Kinase lymphoider Zellen („lymphoid cell kinase”) Leu- Medium, in dem Leucin fehlt, oder Leucinauxotrophie
LexA DNA-Bindungsdomäne (Y2HS), eigentlich bakterieller Repressor LMP-Agarose niedrig schmelzende Agarose („Low Melting Point“)
LMW Proteinmarker für SDS-PAA-Gele bis 94 kDa („Low Molecular Weight“) LOC Liganden-gesteuerter Kanal („ligand-operated channel“)
LRD Lipidfloß-Domäne („Lipid Raft Domain“) Lyn lck/yes-verwandte neue Tyrosinkinase m Maus (Mus musculus) oder Meter oder milli M molar (mol pro liter)
M1 muskarinischer Acetylcholinrezeptor Typ 1 M2 mAK der Maus gegen das FLAG®-Epitop M5 muskarinischer Acetylcholinrezeptor Typ 5 MβCD Methyl-β-cyclodextrin
mA Milliampère
mAk monoklonaler Antikörper
MAP-Kinase Mitogen-aktivierte Protein Kinase
mcs multiple Klonierungsstelle („multiple cloning site“)
MG rel. Molekulargewicht
Min Minute min. mindestens mk monoklonal mM millimolar
MMLV „Moloney Murine Leukemia Virus“
mRNA Boten-RNA („messenger RNA”)
mTRPC1β TRPC-Protein der Maus, Isoform 1, Variante β mTRPC2β TRPC-Protein der Maus, Isoform 2, Variante β m/v Verhältnis Masse zu Volumen
MβCD Methyl-β-cyclodextrin
myc Decapeptid, vom humanen c-myc Onkogenprodukt abgeleitet, EQKLISEEDL (AS 410 bis 419), wird als spezifisches Epitop für Ak verwendet
Na-Mops Natriumsalz der 3-(N-Morpholino)propansulfonsäure
1 Abkürzungen und Akronyme 1.1 Materialien und Einheiten NFAT Kernfaktor aktivierter T-Zellen („nuclear factor of activated T-cells“)
NFκB Kernfaktor für das κ-Gen in B-Zellen („nuclear factor for κ-gene in B-cells”) NK-Zellen Natürliche Killerzellen
NLS Kernlokalisierungssignal („nuclear localization signal“) nM nanomolar
nm Nanometer NP40-Ersatz Nonidet P40-Ersatz
NT aminoterminale Domäne, cytosolisch bei TRPC-Proteinen NTA Nitrilotriacetat
OAc Acetat
OAG 1-Oleayl-2-acetyl-sn-glycerin, membrangängiges DAG-Derivat
OD Optische Dichte
OdT oligo-Desoxythymidin
ori Replikationsursprung für Viren, Bakterien oder Hefen („origin“) OLR offenes Leseraster („Open Reading Frame“)
PAA Polyacrylamid
PAGE Polyacrylamidgelelektrophorese
pAk polyklonaler Ak
PBPCC „Petra Budde Primer for Calcium Channel“
PBS phosphatgepufferte physiologische Salzlösung („phosphate buffered saline“) PBS-T PBS mit Tween 20
PCR Polymerasekettenreaktion („polymerase chain reaction“) PFA Polyformaldehyd
PH Pleckstrin-Homologie
pH Negativer Logarithmus der H+-Ionen-Konzentration (in wässrigen Lösungen) PI3-K Phosphatidylinosit-3-OH-Kinase
PIP2 Phosphatidylinositol-4,5-bisphosphat PIP3 Phosphatidylinositol-1,4,5-trisphosphat
pk polyklonal
PKA cAMP-abhängige Proteinkinase
PKC Proteinkinase C
PKCBP1/2 Protein Kinase C bindendes Protein 1 (Isoform 2)
PLC Phospholipase C
PM Plasmamembran
1 Abkürzungen und Akronyme 1.1 Materialien und Einheiten PMA Phorbol-12-myristat-13-acetat
pp „putative pore” (mutmaßliche Porenregion) pS Picosimens
PTK Protein-Tyrosinkinase r Ratte
RACC rezeptoraktivierte Ca2+-Kanäle („receptor-activated Ca2+-channels“) RACK Rezeptor für aktivierte C Kinase
Raf Raffinose (auch Raf-Kinase)
RBL basophile Tumorzelle aus Ratten („rat basophilic leukemia“) RFP Ret Finger Protein
Rho Ras-Homologie
RIPA Radio-Immuno-Präzipitationsassay RNA Ribonukleinsäure
RNase Ribonuklease
ROC Rezeptor gesteuerter Kanal („receptor operated channel“) RPMI Roswell Park Memorial Institute
RT Raumtemperatur oder Reverse Transkription
RT-PCR Reverse Transkription mit nachfolgender Polymerase Kettenreaktion RyR Ryanodin-Rezeptoren
SD synthetisches Minimalmedium („synthetic drop out“) SDS Natriumdodecylsulfat
sek Sekunde
SERCA Ca2+-ATPase der sarcoendoplasmatischen Retikulums („sarco-endoplasmatic reticulum-Ca2+-ATPase”) SH src-Homologie
SH3BP2 Abl SH3 bindendes Protein 2
SLP SH2-Domänen-enthaltendes Leukocyten-Protein
SOC Speichergesteuerter Kanal („store operated Ca2+-channel“) Src „rous sarcoma oncogene”
Strep Streptomycin SV Affenvirus („Simian Virus”)
Syk Milz Tyrosinkinase („spleen tyrosine kinase”) Tab. Tabelle
TAE Tris-Acetat-EDTA
1 Abkürzungen und Akronyme 1.1 Materialien und Einheiten TBS Tris-gepufferte Salzlösung („Tris Buffered Saline”)
TBS-T Tris gepufferte Salzlösung mit Tween 20
TCA Trichloressigsäure TCR T-Zellrezeptor („T cell receptor“)
TEMED N,N,N’,N’,-Tetramethylethylendiamin Tet Tetracyclin
Tfb m/x/k „Transformation buffer“ (m für MC1061, x für XL1-Blue, k für KC8) TM Transmembransegment oder Warenzeichen („Trade Mark”)
TMOD Tropomodulin TMY Tropomyosin TRIM „tripartite motif” Protein
Tris Tris-(hydroxymethyl)-aminomethan TRITC Tetramethylrhodamin-isothiocyanat
Triton X100 4-(2’,2’,4’,4’,-Tetramethylbutyl)-phenyldecaethylglycol TRP „Transient Receptor Potential” Protein
Trp- Medium, in dem Tryptophan fehlt, oder Tryptophanauxotrophie TRPC Mitglied der Familie der kurzen TRP Proteinkanäle („canonical”) TRPM Mitglied der Familie der langen TRP Proteinkanäle („melastatin”)
TRPV Mitglied der Familie der TRP Proteinkanäle ähnlich zum vanilloiden Rezeptor Tween 20® Polyoxyethylen-(20)-sorbitanmonolaureat
U Einheit der Enzymaktivität oder Spannung
Ura- Medium, in dem Uracil fehlt, oder Uracilauxotrophie
üN über Nacht
V Volt
v/v Verhältnis Volumen zu Volumen
VOCC spannungsregulierter Ca2+-Kanal („voltage-gated Ca2+-channel) W Watt
WB Western-Blot (Detektion)
wt Wildtyp
x Xenopus laevis
X-Gal 5-Brom-4-chlor-3-indolyl-β-D-galactopyranosid Y2HS Hefe-2-Hybrid-System („Yeast Two Hybrid System”)
YPD Hefe-Vollmedium („yeast extract peptone dextrose medium“)
1 Abkürzungen und Akronyme 1.1 Materialien und Einheiten Ywhae Tyrosin-3-monooxygenase/Tryptophan-5-monooxygenase
Aktivierungsprotein, epsilon Polypeptid
Ywhaq Tyrosin-3-monooxygenase/Tryptophan-5-monooxygenase Aktivierungsprotein, theta Polypeptid
z Ziege
ZAP70 70 kDa großes ζ-Ketten assoziiertes Protein („zeta-chain associated protein of 70 kDa”)
1.2 Symbole für die DNA-Basen
Tab. 1.2 Einbuchstabencode für die DNA-Basen
Base Buchstabensymbol Desoxyadenosin a
Desoxycytidin c Desoxyguanosin g Desoxythymidin t
1 Abkürzungen und Akronyme 1.3 Symbole für die Aminosäuren
1.3 Symbole für die Aminosäuren
Tab. 2.1 Drei- und Einbuchstabencode der natürlichen α-L-Aminosäuren
Aminosäure Abkürzung Buchstabensymbol Alanin Ala A
Arginin Arg R
Asparagin Asn N
Asparaginsäure Asp D
Cystein Cys C
Glutamin Gln Q
Glutaminsäure Glu E
Glycin Gly G
Histidin His H
Isoleucin Ile I
Leucin Leu L Lysin Lys K
Methionin Met M
Phenylalanin Phe F
Prolin Pro P Serin Ser S
Threonin Thr T
Tryptophan Trp W
Tyrosin Tyr Y Valin Val V
2 Einleitung 2.1 Calciumfreisetzung in Lymphocyten
2.1 Calciumfreisetzung in Lymphocyten
2 Einleitung
Die Aktivierung von B-Zellen ist ein zentraler Prozess innerhalb des Immunsystems, der zur Produktion spezifischer Antikörper (Immunglobuline) gegen das eingedrungene Antigen führt.
Nach Quervernetzung des IgM-Moleküls im B-Zell-Rezeptor („B-Cell Receptor“, BCR) durch multivalente Antigene führt die Konzentration der rezeptorassoziierten Kinasen Blk, Fyn und Lyn aus der Src-Familie („rous sarcoma oncogene“, Src) zu einem lokalen Phosphorylierungsüberschuss. Infolgedessen werden die ITAM-Sequenzen („Immunoreceptor Tyrosine-based Activation Motive“) in den Igα- und Igβ-Untereinheiten des BCR phosphoryliert, woraufhin die Tyrosinkinase Syk („Spleen Tyrosine Kinase“) an die phosphorylierten Tandem-ITAM-Einheiten von Igβ bindet. Dadurch liegen je zwei Syk- Moleküle dicht beieinander und können sich wiederum durch gegenseitige Phosphorylierung aktivieren. Syk phosphoryliert daraufhin zahlreiche Zielproteine, unter anderem das Adapterprotein SLP-65 (SH2-Domänen-enthaltendes Leukocyten-Protein von 65 kDa), auch BLNK („B Cell Linker Protein“) genannt, das so andere Signalmoleküle zusammenbringen kann. Zahlreiche weitere Adapterproteine sind in die Lymphocytenaktivierung involviert, denen gemeinsam ist, dass sie keine enzymatische oder transkriptionellle Aktivität besitzen, aber konstitutive oder induzierbare Protein-Protein- oder Protein-Lipid-Interaktionen vermitteln. SLP-65 rekrutiert wiederum Tec-Kinasen, die die Phospholipase C-γ (PLC-γ) phosphorylieren und so aktivieren (Leo et al., 2002). Die PLC-γ ist an das Membranphospholipid Phosphatidylinositol-1,4,5-trisphosphat (PIP3) gebunden und spaltet Phosphatidylinositol-4,5-bisphosphat (PIP2) in das lösliche Inositol-1,4,5-trisphospat (IP3) und Diacylglycerin (DAG) (Rebecchi & Pentyala, 2000). Auch die Ca2+-ATPase des Sarcoendoplasmatischen Retikulums (SERCA) liegt an PIP2 gebunden vor und wird durch IP3 aktiviert, weshalb sie auch als IP3-Rezeptor (IP3R) bezeichnet wird (Lupu et al., 1998).
Der IP3R initiiert infolgedessen die Ausschüttung von Ca2+-Ionen aus diesem intrazellulären Speicher, was wiederum die Phosphatase Calcineurin und zahlreiche andere Ca2+-abhängige Proteine aktiviert (Sugawara et al., 1997; Takemura et al., 1989). Calcineurin aktiviert den Transkriptionsfaktor NFAT („Nuclear Factor of Activated T-cells“). DAG aktiviert Ca2+- abhängig die Proteinkinase C, die nun den Transkriptionsfaktor NF-κB („Nuclear Factor für
2 Einleitung 2.1 Calciumfreisetzung in Lymphocyten κ-gene in B-cells“). Durch die rezeptorassoziierten und rekrutierten Kinasen werden außerdem Guanin-Nukleotid-Austauschfaktoren („Guanine-nucleotide Exchange Factor“, GEF) aktiviert, die kleine GTP-bindende Proteine wie Ras aktivieren. Diese wiederum lösen Kaskaden von Proteinkinasen aus, die zur Aktivierung von MAP-Kinasen führen. Diese wandern in den Kern ein und phosphorylieren Proteine, die die Transkription regulieren, darunter Fos, einen Bestandteil des Transkriptionsfaktors AP-1. Der Corezeptor der B-Zelle aus CD19, CD21, das auch als Komplement-Rezeptor 2 bekannt ist, und CD81, welches alternativ TAPA-1 genannt wird, kann unter bestimmten Umständen, z.B. durch Komplement-gebundenes Antigen, aktiviert werden, indem der Komplex mit dem BCR quervernetzt wird. Das induziert die intrazelluläre Phosphorylierung von CD19 durch die BCR-assoziierten Tyrosinkinasen, woraufhin wieder Kinasen der Src-Familie gebunden werden sowie die Lipidkinase Phosphatidylinosit-3-OH-Kinase (PI3-K). Die PI3-K startet einen Signalübertragungsweg, der über das GEF-Protein Vav verläuft. Durch Bindung des BCR an den Corezeptor wird das von außen auf die Zelle wirkende Signal um ein Vielfaches verstärkt. Die so aktivierten Transkriptionsfaktoren NFAT, NF-κB und AP-1 induzieren eine spezifische Gentranskription, die zur Proliferation und zur Differenzierung des B-Zelle führt (Janeway et al., 2002).
In T-Zellen existiert eine ganz ähnliche Signalkaskade, die zur Aktivierung der Zellen führt.
Nach Aggregation des T-Zell-Rezeptors („T-Cell Receptor“, TCR) und des Corezeptors CD4 oder CD8 durch MHC-Peptid-Komplexe wird die TCR-assoziierte Tyrosinkinase Fyn aktiviert, die die ITAM-Sequenzen der CD3γ-, δ- und ε-Untereinheit sowie der ζ-Kette des Rezeptors phosphorylieren. Die Tyrosinkinase ZAP-70 („ζ-Ketten assoziiertes Protein“) bindet an die tandem-phosphorylierten ITAM-Sequenzen und wird durch Phosphorylierung durch die an den Corezeptor assoziierte Tyrosinkinase Lck aktiviert. ZAP-70 wiederum phosphoryliert die Adapterproteine LAT („Linker for Activation of T-Cells“) und SLP-76 (SH2-Domänen-enthaltendes Leukocyten-Protein von 76 kDa). LAT integriert über palmitylierte Cysteinreste mit Cholesterin- und Glykolipid-angereicherten Bereichen in der Plasmamembran, den sogenannten „Lipid Raft“ Domänen (gelegentlich als Lipidfloß übersetzt, LRD), und ist so an die Innenseite der Plasmamembran lokalisiert. Das phosphorylierte LAT rekrutiert zahlreiche SH2-Domänen-enthaltende Signalmoleküle („src- homology“, SH), die das Signal ins Zellinnere weiterleiten (Janeway et al., 2002; Leo et al., 2002; Liu et al., 1998; Trüb et al., 1997; Zweifach & Lewis, 1993).
Auch in myeloiden Zellen, die aktivierende Fc-Rezeptoren tragen, und zahlreichen nicht- leukocytischen Zellen mit heptahelikalen, G-Protein-gekoppelten Rezeptoren existieren ganz
2 Einleitung 2.1 Calciumfreisetzung in Lymphocyten ähnliche Signalkaskaden, die die Aktivierung der Phospholipase C, γ oder β, die Entleerung intrazellulärer Ca2+-Speicher und den Einstrom von Ca2+-Ionen über die Plasmamembran einschließen.
Das physiologische Kennzeichen dieser Ca2+-Eintrittsprozesse ist ein starker, rezeptorvermittelter transienter Anstieg der intrazellulären Ca2+-Konzentration, der von einer langanhaltenden hohen Plateauphase der intrazellulären Ca2+-Konzentration gefolgt wird, welche von der Menge an extrazellulärem Calcium abhängt. Die molekulare Identität dieser Plasmamembrankanäle war zunächst unbekannt. Erst bei der Erforschung der Lichtleitung in den Augen von Drosophila melanogaster stieß man auf einen vielversprechenden Kandidaten (siehe Kapitel 2.4) (Clapham et al., 2001; Janeway et al., 2002).
2.2 Nicht-spannungsgesteuerte Calciumkanäle
Ionenkanäle sind Proteine, die Poren in zellulären Membranen bilden und Ionen in die Zellen oder aus der Zelle heraus leiten. Einst dachte man, dass sie nur darin involviert wären, elektrische Signale zu transportieren. Heute weiß man, dass Ionenkanäle viele Funktionen in allen Arten von Zellen haben (Calahan, 2001). Die spannungsgesteuerten Ionenkanäle z.B. in Nervenzellen sind funktionell wie auch molekular gut charakterisiert (siehe Lodish et al., 1996), aber die Funktion und Regulation von nicht-spannungsgesteuerten Kationenkanälen ist weitgehend ungeklärt. Diese Kanäle können direkt durch einen Liganden aktiviert werden („ligand-operated channel“, LOC) wie z.B. der Ca2+-Kanal des Endoplamatischen Retikulums, der durch seinen namensgebenden Liganden IP3 aktiviert wird (IP3-Rezeptor, IP3R). Weitere Aktivierungsmöglichkeiten sind die Steuerung durch einen Oberflächenrezeptor („receptor-operated channel“, ROC) oder durch den Füllungszustand intrazellulärer Ca2+-Speicher („store-operated channel“, SOC) (Barritt, 1999; Berridge, 1993;
Parekh & Penner, 1997). 1977 stellte J. W. Putney ein Modell auf, nach dem leere Ca2+- Speicher den Eintritt von externem Ca2+ steuern, um diese Reserven wieder aufzufüllen (Putney, 1977), was er als kapazitativen Ca2+-Eintritt („capacitative calcium entry“, CCE) bezeichnete. Dieser Begriff prägte lange Zeit die Diskussion über nicht-spannungsaktivierte Ca2+-Ströme (Berridge, 1995; Putney, 1990; Putney & Bird, 1993). In Mastzellen wurde ein hochgradig calciumselektiver Strom charakterisiert, der durch eine Vielzahl von Speicherentleerungs- protokollen aktiviert und als „Ca2+-release activated Ca2+-current“
2 Einleitung 2.2 Nicht-spannungsgesteuerte Calciumkanäle (ICRAC) bezeichnet wird (Hoth & Penner, 1992; Huang & Putney, 1998; Lewis & Callahan, 1989; Mathes et al., 1998; Parekh, 1998; Penner et al., 1993).
2.3 Aktivierungsmodelle
Die verschiedenen nicht-spannungsgesteuerten Ca2+-Ströme besitzen neben unterschiedlichen biophysikalischen Eigenschaften unterschiedliche regulierende Mechanismen, denen gemeinsam ist, dass sie nicht durch den Ionenunterschied außerhalb und innerhalb der Zelle aktiviert werden, sondern durch die Stimulation eines Oberflächenrezeptors und die nachfolgende Entleerung intrazellulärer Ca2+-Speicher. Bislang existieren drei Modelle, wie diese Signale zum Kationenkanal weitergeleitet werden und zu dessen Öffnung führen (Zitt et al., 2002).
Zunächst wurde die Existenz eines löslichen Botenstoffes angenommen, der vom Endoplasmatischen Retikulum (ER) zu Kanal in der Plasmamembran (PM) diffundiert, , nachdem ein Extrakt aus Jurkat-Zellen stimulierend auf den Kationeneinstrom wirkte (Parekh et al., 1993; Randriamampita & Tsien, 1993; Thomas & Hanley, 1995). Der wirksame Bestandteil wurde als Calcium-Influx-Faktor (CIF) bezeichnet und war durch Dephosphorylierung inhibierbar (Parekh et al., 1993; Randramampita & Tsien, 1993;
Randriamampita & Tsien, 1995). Der CIF-haltige Extrakt war auch bei extrazellulärer Zugabe wirksam, so dass eine Membranpermeabilität angenommen wurde (Randriamampita & Tsien, 1993; Randriamampita & Tsien, 1995). CIF setzt sich aus zwei Bestandteilen mit einer molekularen Masse von 400 und 600 kDa zusammen, wovon der kleinere Bestandteil nur intrazellulär wirksam ist, und enthält eine Phosphatgruppe (Kim et al., 1995; Randriamampita
& Tsien, 1995). Jedoch ist auch zehn Jahre nach seiner Entdeckung keine molekulare Struktur von CIF ermittelt, obwohl CIF verhältnismäßig stabil zu sein scheint und teilweise aufgereinigt werden konnte (Kim et al., 1995). Auch ein Extrakt aus Hefen, denen die ATPasen, die für die Aufnahme von Ca2+ in die Zellorganellen zuständig sind, fehlen, konnte den Ca2+-spezifischen Strom (ICRAC) in Jurkat-Zellen stimulieren (Csutora et al., 1999).
Obwohl die Entdecker von CIF cGMP als mögliche Identität ausschlossen, scheint cGMP in den Acinarzellen des Pankreas den Ca2+-Einstrom nach Speicherentleerung zu regulieren (Gilon et al., 1995; Xu et al., 1994). Allerdings blockiert cGMP den phosphoinositvermittelten Ca2+-Anstieg in vielen Zellen auch (Carvajal et al., 2000;
Vaandragar & de Jonge, 1996).
2 Einleitung 2.3 Aktivierungsmodelle In Konkurrenz zum Modell eines diffundierenden, kleinen Moleküls wurde in Analogie zur Situation in gestreiften Muskelzellen die direkte Protein-Protein-Interaktion zwischen dem ER und dem Kanal in der PM vorgeschlagen. Dabei wird angenommen, dass eine Veränderung des Füllungszustandes in den Ca2+-Speichern eine Konformationsänderung in Proteinen der Speichermembran auslöst, die dann eine direkte Interaktion mit dem Kanal in der PM ermöglicht und zu dessen Öffnung führt (Franzini-Armstrong & Jorgensen, 1994;
Irvine 1990; Irvine, 1992). Der IP3-Rezeptor (IP3R) des ER ist der wahrscheinlichste Kandidat für diese konformationelle Kopplungsthese (Berridge, 1995). Im Rahmen der Untersuchung der Aktivierung von TRPC- Kanälen wurden inzwischen einige Hinweise, die dieses Modell unterstützen gefunden (siehe Kapitel 2.5.2).
Die dritte Hypothese wendet sich gegen die bisherige Ansicht, die Kanäle seien konstant in der Zellmembran und es müsse nur der zuständige Regulator gefunden werden. Stattdessen wird die Möglichkeit erörtert, dass die Zahl der Kanäle in der PM der entscheidende Parameter sein könnte und dass diese Anzahl einer schnellen und effektiven Regulation unterliegt (Patterson et al., 1999; Yao et al., 1999). Die Untersuchung des Einflusses des kleinen G-Proteins Rho auf den Ca2+-Einstrom in Xenopus Oocyten zeigte Ähnlichkeiten zu Sekretionsprozessen und Exocytose (Yao et al., 1999). Zuvor war ein aktivierender Effekt von GTP auf ICRAC in Mastzellen und auf den Ca2+-Eintritt in den Acinarzellen der Tränendrüsen von Mäusen („mouse lacrimal acinar cells“) festgestellt worden (Bird &
Putney, 1993; Fasolato et al., 1993). Da kleine G-Proteine oft in den Transport von Vesikeln und vesikulären Proteinen involviert sind (Van Aelst & D’Souza-Schorey, 1997), kleine G- Proteine eine Rolle in der Regulation des durch Speicherentleerung vermittelten Ca2+- Einstroms in Blutplättchen spielen (Rosado & Sage, 2000-a, Rosado et al., 2000-a) und der Ca2+-Eintritt nach Speicherentleerung SNAP-25, ein für das Koppeln von Vesikeln an die Plasmamembran essentielles Protein, benötigen (Calakos & Scheller, 1996; Yao et al., 1999) ähnelt die Steuerung des Ca2+-Einstroms nach rezeptorvermittelter Speicherentleerung exocytotischen Abläufen, indem beide Prozesse die Fusion von Vesikeln mit der Plasmamembran einschließen. Ebenso ähnelt die Stimulation des Ca2+-Eintritts dem Glucosetransport, wobei die Rho-vermittelte Insertion des Glucosetransporters GLUT4 in die PM das wichtigste regulatorische Element darstellt (Elmendorf & Pessin, 1999). Ergänzend wurde nach Untersuchung des Einflusses des Actincytoskeletts auf den rezeptor- und speichergesteuerten Ca2+-Einfluss ein sekretionsähnliches Kopplungsmodell aufgestellt.
Durch Stabilisierung des Actincytoskeletts oder Bildung einer festen Actinschicht unter der PM konnte der durch Rezeptorstimulation oder Speicherentleerung induzierte Ca2+-Einstrom
2 Einleitung 2.3 Aktivierungsmodelle deutlich reduziert werden (Patterson et al., 1999). Die Depolymerisation des Cytoskeletts hatte in glatten Muskelzellen keinen negativen Effekt auf den Ca2+-Einstrom (Patterson et al., 1999), in Blutplättchen hingegen sehr wohl (Rosado & Sage, 2000-a). Daher wurde geschlossen, dass ein festes Actincytoskelett unter der PM zwar nicht die Entleerung der intrazellulären Speicher durch IP3 unterbindet, aber das Signal von den Speichern zum Kanal in der PM verhindert. Eine räumliche Nähe der mutmaßlichen Vesikel zur PM ist also essentiell für den Ca2+-Eintritt, so dass die Situation ähnlich zur Sekretion ist (Patterson et al., 1999). Die postulierten Vesikel und auch ihr Inhalt wurden bisher noch nicht näher identifiziert und charakterisiert, ebenso nicht, wie die extrazelluläre Rezeptorstimulation und die Entleerung der intrazellulären Speicher den vesikulären Transport induzieren. Zudem widersprechen die Ergebnisse bezüglich der Actindepolymerisation in Blutplättchen (Rosado
& Sage, 2000-a) und die Untersuchungen des durch Speicherentleerung induzierten Ca2+- Einstroms in Xenopus laevis Oocyten einer Aktivierung durch Membranfusion (Gregory &
Barritt, 1996). Daher wurde ein Modell des reversiblen Transports und der Kopplung des Endoplasmatischen Retikulums an die Plasmamembran aufgestellt (Rosado et al., 2000-a;
Rosado et al., 2000-b).
Der rezeptorvermittelte Ca2+-Einstrom, der eine Entleerung intrazellulärer Speicher einschließt, ist ein genereller Prozess in vielen verschiedenen Zelltypen, der möglicherweise nicht durch einen einzigen Mechanismus ausgelöst wird. Wahrscheinlicher sind eine Vielzahl von Mechanismen, die sich gegenseitig überschneiden und ergänzen, die die Stimulation des Rezeptors und die Entleerung der Speicher mit der Öffnung der Ca2+-permeablen Kanäle verbinden.
2.4 Die TRP-Protein-Familie
Bei der Erforschung der Lichtsignalleitung in Drosophila Photorezeptoren wurde ein Gen entdeckt, das für den typischen biphasischen Calciumeinstrom nach Rezeptoraktivierung essentiell ist. Das identifizierte Protein war der Begründer der TRP-Familie, das Homologe in in allen eukaryotischen Organismen von Calliphora (Schmeißfliege) über Caneorhabditis elegans (Nematode) und Xenopus laevis (Frosch) bis hin zu zahlreichen Säugern wie Mäusen und Menschen besitzt. Daher wird intensiv untersucht, ob TRP-homologe Proteine in Säugern den rezeptorvermittelten und durch Speicherentleerung induzierten Kationeneinstrom ermöglichen (Birnbaumer et al., 1996; Clapham et al., 2001; Friel, 1996; Hardie & Minke,
2 Einleitung 2.4 Die TRP-Protein-Familie 1992; Minke & Selinger, 1996; Petersen et al., 1995). Inzwischen wurden zahlreiche bezüglich Selektivität und Leitfähigkeit unterschiedliche Calciumströme mit der Expression von TRP-Proteinen in Verbindung gebracht (Clementi et al., 1992; Friel, 1996; Kass et al., 1993; Montero et al., 1994; Zhu et al., 1996), so dass es wahrscheinlich ist, dass die TRP- Familie mit ihren zahlreichen Mitgliedern der beste Kandidat für die molekulare Identität dieser Kationenkanäle ist (Birnbaumer et al., 1996; Hardie & Minke, 1993; Vaca et al., 1994;
Zitt et al., 2002).
2.4.1 Entdeckung von TRP in der Lichtleitung in Drosophila melanogaster Photorezeptoren
Der Sehprozess im Auge von Drosophila erfolgt in von Säugern fundamental unterschiedlicher Weise. In Wirbellosen ist der Rhodopsinrezeptor an an das gleiche Signaltransduktionssystem gekoppelt, welches PLC-β („no receptor potential“, norpA NORPA) aktiviert, was zur Bildung von IP3, zur Entleerung intrazellzulärer Ca2+-Speicher und zum Einstrom von Ca2+ über die Plasmamembran führt, was einen langanhaltenden Anstieg der cytosolischen Ca2+-Konzentration bewirkt. Eine Mutante, die nicht in der Lage war, dieses langanhaltende Ca2+-Plateau aufzubauen, wurde durch intensives Licht geblendet, da die Ca2+-abhängige Anpassung unterbrochen war. Das defekte Gen wurde daher als
„transient receptor potential“ (TRP) bezeichnet und codiert für das erste Mitglied eine weitläufigen Familie von Kationenkanalproteinen (Montell & Rubin, 1989; Suss et al., 1989).
2.4.2 Merkmale der TRP-Protein-Familie
Die TRP-Ionenkanäle sind eine große Klasse von Kanaluntereinheiten, die durch eine gemeinsame Primärstruktur sowie durch ihre Permeabilität für einige mono- und divalente Kationen wie Na+, Ca2+ und Ba2+ vereint werden. Einige Mitglieder der Familie sind mit dem Phosphatidylinositol-Signaltransduktionsweg verbunden und bringen bei hyperpolarisierten Membranpotentialen Ca2+ in die Zellen. TRP-Kanalproteine zeigen vom dritten bis zum sechsten Transmembransegment (TM) eine evolutionäre Verwandtschaft zu spannungs- gesteuerten Kanälen, wie den K+-Kanälen (Kv), den durch cyclische Nukleotid-gesteuerten Kanälen (HCN und CNG) und den PKD-Proteinen („polycystic kidney disease“) (Liman et
2 Einleitung 2.4 Die TRP-Protein-Familie bilden TRP-Proteine wahrscheinlich Tetramere, bei denen die Aminosäuren zwischen der fünften und sechsten Transmembrandomäne die Pore erzeugen (Vannier et al., 1998). Die meisten TRP-Proteine sind relativ unselektiv bezüglich der Ionen, die sie in die Zelle hineinlassen. TRP-Kanäle werden in Folge der Stimulation einiger Membranrezeptoren, die zur Aktivierung von PLC-Isoenzymen, zur Bildung von Inositol-1,4,5-trisphosphat und Diacylglycerin und zur Entleerung von intrazellulären Ca2+-Speichern wie dem Endoplasmatischen Retikulum (ER) führt, oder auch direkt durch Stimuli wie Wärme bzw.
Kälte oder Geschmacksstoffe geöffnet. Diese Öffnung ist jedoch nicht notwendigerweise mit der Freisetzung von Ca2+ aus dem ER direkt verbunden. TRP-Kanäle besitzen nicht die deutliche Selektivität für Ca2+-Ionen der genau charakterisierten spannungsgesteuerten Ca2+- Kanäle, höchstwahrscheinlich auf Grund des Fehlens der vier negativ geladenen Glutamat- oder Aspartatreste innerhalb der Pore, die die Ca2+-Selektivität in spannungsgesteuerten Ca2+- Kanälen bestimmen (Hess & Tsien, 1994). Einige von ihnen lassen sogar mehr Ca2+-Ionen durch die Plasmamembran, wenn die Zelle stärker hyperpolarisiert ist. TRP-Kanäle werden in geringer Zahl pro Zelle exprimiert und erzeugen einen schwachen Netto einwärts gerichteten Kationenstrom (Clapham et al., 2001). Viele zeigen ähnlich zu den nikotinischen oder den Glutamat-Rezeptor-Kanälen keine Kationenselektivität, aber alle erhöhen die intrazelluläre Ca2+-Konzentration.
Hydrophobizitätsanalysen der Primärstruktur von TRPC1, TRPC2 und TRPC3 zeigen acht hydrophobe Regionen, von denen allerdings die dritte und siebte nicht bei allen TRP- Proteinen lang genug sind, um die Membran zu durchspannen, so dass von nur sechs Transmembransegmenten (TM) ausgegangen werden kann (siehe Abbildung 2.1 und Anhang 10.1). Allerdings fehlen die positiv geladenen Reste in TM4, die die Spannungssensitivität der spannungsgesteuerten Kanäle ermöglichen. Der Bereich zwischen dem fünften und sechsten Transmembransegment zeigt Ähnlichkeit zur Porenregion spannungsgesteuerter Kanäle („potential pore region“, pp) (Vannier et al., 1999; Wes et al., 1995; Yildirim et al., 2003;
Zhu et al., 1996). Es wird angenommen, dass sowohl N- als auch C-Terminus der TRP- Proteine intrazellulär lokalisiert sind (Clapham et al., 2001). Die postulierte Struktur wurde nachfolgend auf alle anderen TRPC-Proteine und auch auf TRPV- und TRPM-Isoformen übertragen, ohne sie jeweils im Detail zu analysieren.
2 Einleitung 2.4 Die TRP-Protein-Familie
80 % 50 % 66 %
(b) Strukturelle Eigenschaften von hTRPC1 (a) Strukturelle Eigenschaften von dTRP
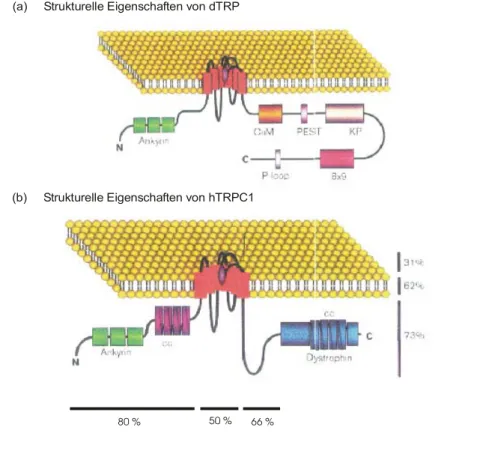
Abbildung 2.1: Postulierte Domänenstruktur von TRP (Drosophila melanogaster) und TRPC1 (Homo sapiens) (Minke & Selinger, 1996)
Beide Proteine enthalten sechs Transmembransegmente mit einer mutmaßlichen Porenregion zwischen dem fünften und sechsten Membrandurchgang und drei Ankyrin- ähnliche Wiederholungen im N-Terminus. Eine Calmodulinbindestelle (CaM) wurde inzwischen in allen TRPC-Proteinen gefunden, in dTRPL sind zwei CaM-Bindestellen vorhanden. Die CaM-Bindestelle in TRP scheint nicht funktionell zu sein (siehe Kapitel 2.5.2). a) Postulierte Domänenstruktur von dTRP. Der C-Terminus enthält eine PEST- Sequenz, eine prolinreiche Region (KP), eine hydrophile Sequenz aus neun Wiederholungen der Sequenz DKDKKPG/AD und eine P-Schleife („P-loop“).
b) Postulierte Domänenstruktur von hTRPC1. Der N-Terminus besitzt eine „coiled-coil“- Domäne, der C-Terminus eine Dystrophin-ähnliche Region mit interner „coiled-coil“- Domäne. Die Prozentangaben zeigen die Übereinstimmung zwischen den jeweiligen Bereichen beider Proteine an (senkrecht: extrazellulär, transmembran, intrazellulär;
waagerecht: N-Terminus, zentrale Region, C-Terminus).
Die Membranständigkeit wurde inzwischen mit Hilfe von fluoreszenzmarkierten Antikörpern oder fluoreszierenden Fusionsproteinen vielfach bewiesen (z.B. Lockwich et al., 2000;
Lockwich et al., 2001; Engelke et al., 2002; Hofmann et al., 2002; Wang et al., 1999), ebenso die cytosolische Lokalisierung von N- und C-Terminus (Vannier et al., 1998; Engelke et al.,
2 Einleitung 2.4 Die TRP-Protein-Familie 2002; Friedrich, 2001). Die Lage der Transmembransegmente wurde mit Hilfe der Analyse von Glykosylierungsstellen und Mutagenesestudien experimentell belegt (Vannier et al., 1998). Auch Die Relevanz der Region zwischen dem fünften und sechsten Transmembransegment, die wahrscheinlich die Kanalpore bildet, wurde durch verschiedene Mutationsexperimente gezeigt, die das jeweilige TRP-Protein funktionell ausschalteten (Xu et al., 1997; Hofmann et al., 2002; Engelke et al., 2002; Strübing et al., 2003).
Die TRP-Proteine in Wirbeltieren können unter Berücksichtigung der Sequenzhomologie in drei Unterfamilien eingeteilt werden, die zunächst als kurz („short“, STRP), lang („long“, LTRP) und osm-9-ähnlich (eine TRP-Mutante aus C. elegans, OTRP) bezeichnet wurden (Harteneck et al., 2000). Im Rahmen dieser Arbeit wird eine neuere Nomenklatur verwendet, die von zahlreichen namhaften TRP-Forschern entwickelt wurde. Die Proteine werden kanonisch („canonical“, TRPC) anstatt von kurz, vanilloid (TRPV) anstatt lang und Melastatin-ähnlich („melastatin“, TRPM) als Ersatz für osm-9-ähnlich genannt, die Gruppeneinteilung jedoch bleibt die gleiche (Montell et al., 2002-a). TRP-Proteine zeigen eine breite Gewebeverteilung und sind in die verschiedensten physiologischen Prozesse involviert (Clapham et al., 2001; Inoue et al., 2003).
Die größten Unterschiede zwischen den TRP-Proteinen liegen in ihren intrazellulär gelegenen C-Termini, weshalb dieser Bereich für die unterschiedlichen Aktivierungsmechanismen verantwortlich sein könnte. Die am stärksten konservierten Regionen liegen im sechsten Transmembransegment. Die TRP-Proteine aus Invertebraten und die TRPV-Familie besitzen vier N-terminale Ankyrin-ähnliche Wiederholungen, die TRPC-Proteine nur drei. Ankyrin ist ein 140 kDa Cytoskelettprotein, das verschiedene membranständige Proteine mit dem der Membran unterliegenden Actin-Cytoskelett verbindet, die Proteine so an einen bestimmten Ort fixiert, die laterale Wanderung durch die Plasmamembran verhindert und so für eine asymmetrische Lokalisation der Transmembranproteine z.B. in Neuronen, exokrinen Zellen und polarisierten Epithelzellen sorgt (Lodish et al., 1996). Dazu gehören der Anionenantiporter Bande 3 in Erythrocyten und Nierenzellen (Drenckhahn et al., 1985) der Amyloid-sensitive Na+-Kanal in der Mikrovilli-Domäne der apikalen Membranen von Nierenepithelzellen (Smith et al., 1991) und die Na+/K+-ATPase (Nelson & Veshnock, 1987;
Morrow et al., 1989). Darüber hinaus bindet Ankyrin in T-Zellen mit hoher Affinität an den kurzen, nicht-neuronalen Inositol-1,4,5-trisphosphatrezeptor (IP3R), was die Bindung von IP3 und so die IP3-induzierte Calciumfreisetzung inhibiert. Folglich spielt das Cytoskelett eine entscheidende Rolle bei der Regulation IP3R-vermittelter interner Calciumfreisetzung während der Lymphocytenaktivierung (Bourguignon et al., 1993). Ankyrin-ähnliche
2 Einleitung 2.4 Die TRP-Protein-Familie Wiederholungen (ank) sind ein 33-Aminosäuremotiv, das in zahlreichen Proteinen diverser Funktionen vorliegt, einschließlich Transkriptionsfaktoren, Zelldifferenzierungsmolekülen und Strukturproteinen (Michaely & Bennett, 1993). Dieses Motiv vermittelt nicht nur bei Ankyrin selbst Protein-Protein-Interaktionen, sondern wurde auch bei vielen das Motiv tragenden Proteinen für die Bindung an Interaktionspartner verantwortlich gemacht, so dass Ankyrin-ähnliche Wiederholungen als generelles Proteinbindungsmotiv vorgeschlagen wurden (Michaely & Bennett, 1992). Übertragen auf TRP-Proteine wird daher vermutet, dass die Ank-Domänen der Bindung an das Cytoskelett dienen und so die TRP-Kanäle an bestimmte Bereiche innerhalb der Zelle fixieren (Groschner et al., 1998; Lockwich et al., 2000; Lockwich et al., 2001; Wes et al., 1995), oder an Interaktionspartner, die die Kanalaktivität regulieren (Chu et al. 2002; Lockwich et al., 2000; Yildirim et al., 2003; Wes et al., 1995).
Darüber hinaus unterscheiden sich die Mitglieder der Unterfamilien deutlich. Eine 25- Aminosäuren lange sogenannte TRP-Domäne von unbekannter Funktion, die eine sogenannte TRP-Box enthält (EWKFAR), ist im C-Terminus von allen TRPC-Kanalproteinen enthalten, aber nicht von allen TRP-Kanalproteinen. Die N-terminalen cytoplasmatischen Bereiche von TRPC- und TRPV-Kanälen enthalten Ankyrin-ähnliche Wiederholungen. TRPC- und TRPM- Proteine enthalten prolinreiche Regionen in ihrem C-Terminus sowie „coiled-coil“-Strukturen in N- und C-Terminus (Clapham, 2002; Xu et al., 2001). Eine „coiled-coil“-Domäne (cc) ist eine Tertiärstruktur, die durch Superspiralisierung mehrerer α-Helices entsteht und die in verschiedenen Proteinen eine Dimerisierung bewerkstelligt, z.B. im Fall des Kernproteins PML (Perez et al., 1993), des onkogenen Fusionsproteins PML/RARα (Grignani et al., 1999), des Transkriptionsaktivators aus Gal4 Hefen (Lupas, 1996), der Assoziation von zwei Dimeren des Lac-Repressors (Lupas, 1996), der Interaktion von Dystrophin mit Troponin T (Pearlman et al., 1994) und der Bindung von Troponin-Heterotrimeren an Tropomyosin (Lupas, 1996). „Coiled-coil“-Motive kommen auch bei vielen Proteinen mit einem „Leucin- Zipper“ (Leucin-Reißverschluß) vor, darunter viele Transkriptionsfaktoren (Lodish et al., 1996). Es gibt Hinweise, dass die cc-Domäne der Tetramerisierung von TRP-Proteinen oder der Interaktion mit anderen Proteinen dient (Engelke et al., 2002; Friedrich, 2001; Xu et al., 1997; Xu et al., 2000).
2 Einleitung 2.4 Die TRP-Protein-Familie
2.4.3 Eigenschaften der TRP-Proteine in Drosophila melanogaster
In Drosophila melanogaster werden drei TRP-ähnliche Proteine exprimiert. Neben dem zuerst entdeckten TRP-Protein („transient receptor potential“) existieren TRPL („TRP-like“) und TRPγ (Niemeyer et al., 1996; Xu et al., 2002). TRPL wurde zunächst als Calmodulin- bindendes Protein isoliert (Phillips et al., 1992). TRP bildet bei Überexpression einen Ca2+- permeablen Kanal, der durch Speicherentleerung aktiviert werden kann, blockierbar durch niedrige mikromolare Gd3+-Mengen und relativ Ca2+-selektiv im Vergleich zu Na+ und Ba2+
ist (Hardie & Minke, 1992; Hardie & Minke, 1995-b; Petersen et al., 1995; Vaca et al., 1994), wohingegen TRPL zwar auch Ca2+-permeabel ist und eine deutlich höhere Einzelkanalleitfähigkeit besitzt, aber konstitutiv aktiv, nicht durch Speicherentleerung aktivierbar, nur durch hohe mikromolare Gd3+-Konzentrationen blockierbar und nicht-selektiv in Bezug auf Ca2+ ist (Estacion et al., 2001; Hu et al., 1994; Hu & Schilling, 1995; Reuss et al., 1997; Vaca et al., 1994). Dabei ist der Transmembranbereich für die Ca2+-Selektivität und der C-Terminus für die Speichersensitivität zuständig (Sinkins et al., 1996). PLC-β ist für die Aktivierung von TRP-Isoformen in Drosophila essentiell, da Mutanten, denen die photorezeptorspezifische PLC-β fehlt („no receptor potential“, NORPA) nicht auf Licht reagieren (Bloomquist et al., 1988; Dong et al., 1995). Die Relevanz des IP3-Rezeptors ist umstritten, da Mutationen der IP3R-Gene in Drosophila keinen Einfluss auf die Phototransduktion haben (Acharya et al., 1997, Raghu et al., 2000). Allerdings könnten andere ER-Kanäle wie z.B. Ryanodinrezeptoren die Funktion des IP3R übernehmen. Die Aktivierung von Kanälen aus TRP-Isoformen in der Phototransduktion durch Speicherentleerung ist Thema zahlreicher Diskussionen (Cook & Minke, 1999; Hardie &
Minke, 1995-a; Scott & Zuker, 1998). Durch Überexpression gebildete TRPL-Kanäle waren durch ein konstitutiv aktives Gα11-Protein, ein Mitglied der Gq-Familie, direkt in einer membranbegrenzten Weise aktivierbar (Obukhov et al., 1996). Auch ungesättigte Fettsäuren hatten einen positiv regulatorischen Effekt auf TRPL und möglicherweise TRP (Chyb et al., 1999). TRPL wird außerdem durch Ca2+ reguliert, das den Kanal sowohl stimulieren als auch inhibieren kann (Harteneck et al., 2000).
Als mögliches TRP-verankerndes Protein wurde bei der Durchmusterung von Drosophila Mutanten das PDZ-Domänen enthaltende INAD („inactivation no after potential“) identifiziert, das an den C-Terminus von TRP bindet (Clapham, 1996). Mutationen in InaD- Allelen erzeugen eine Fehllokalisation von Signalmolekülen der Phototransduktion, die auch
2 Einleitung 2.4 Die TRP-Protein-Familie die essentielle Phospholipase C NORPA einschließt. INAD interagiert über PDZ3 mit TRP und über PDZ1 und 5 mit der PLC und bringt somit den Effektor und den Kanal in räumliche Nähe, so dass das Signal vom Rezeptor zum Kanal geleitet werden kann (Van Huizen et al., 1998).
Die lichtinduzierten Ströme in Drosophila melanogaster werden hauptsächlich durch drei Arten von regulierten Kanälen ermöglicht, und zwar TRP/TRP-Homotetramere, TRP/TRPL- und TRPL/TRPγ-Heterotetramere. Eine nur untergeordnete Rolle spielen TRP/TRPγ- Heterotetramere. Während sowohl TRPL- als auch TRPγ-Homotetramere bei heterologer Expression konstitutiv aktiv waren, bildeten sie in den Kombinationen TRPL/TRP, TRPL/TRPγ oder TRP/TRPγ PLC-abhängig aktivierbare Kanäle mit unterschiedlichen Eigenschaften, die die endogenen Ströme in Photorezeptoren gut repräsentierten. Die Interaktionen wurden nicht nur funktionell, sondern auch molekular nachgewiesen (Gillo et al., 1996; Niemeyer et al., 1996; Xu et al., 1997; Xu et al., 2003). TRP-Homotetramere bilden regulierte Kanäle, die durch Stimulation PLC-gekoppelter Signalwege aktiviert werden. Sie sind in Drosophila Photorezeptoren die wahrscheinlichsten Kanäle, da TRP wesentlich stärker exprimiert wird als die verwandten Proteine. Die zweite Art von Kanälen sind TRP/TRPL-Heterotetramere. Die Interaktion von TRPL mit TRP ist im Vergleich mit der an TRPL etwa fünffach bevorzugt. Die Eigenschaften der TRPL/TRP-Kanäle unterscheiden sich stark von denen der TRPL/TRPL- und TRP/TRP-Kanäle, da die Heterotetramere reguliert statt konstitutiv aktiv wie die Homotetramere sind. Sie sind relativ unempfindlich für eine Inhibition durch Mg2+, zeigen eine deutlich größeren auswärts gerichteten Strom, sind weniger selektiv für Ca2+ und deutlich weniger empfindlich für eine Inhibition durch La3+ als TRP/TRP-Kanäle. Als drittes werden TRPL/TRPγ-Kanäle gebildet, die durch Agonisten des PLC-gekoppelten Rezeptors aktiviert werden. Eine Speicherentleerung durch Thapsigargin aktiviert diese Kanäle ebenfalls, auch wenn das nicht der stärkste Aktivator zu sein scheint.
Der Strom hat eine kleinere Amplitude und eine längere Verzögerung als TRP/TRP- oder TRP/TRPL-Kanäle. Der geringe in Drosophila melanogaster trp-Mutanen verbleibende Ca2+- Reststrom wird vermutlich von TRPL/TRPγ-Kanälen getragen. Eher unbedeutend sind TRPγ/TRP-Heterotetramere. TRPγ- und TRPL-Homotetramere sind eher unwahrscheinlich, da die heterophilen Interaktionen bevorzugt sind und beide Proteine im Vergleich zu TRP wesentlich schwächer exprimiert werden. TRPγ funktioniert anscheinend nicht unabhängig, da trp:trpl-Doppelmutanten insensitiv gegenüber Licht sind (Niemeyer et al., 1996; Xu et al., 1997; Xu et al., 2000).
2 Einleitung 2.4 Die TRP-Protein-Familie
2.4.4 Eigenschaften der TRPC-Familie
Die Mitglieder der TRPC-Familie, die am engsten mit den ursprünglichen TRP-Proteinen aus Drosophila melanogaster verwandt sind, werden nach Stimulation von G-Protein- oder Tyrosinkinase-gekoppelten Rezeptoren aktiviert. Sie sind daher vielversprechende molekulare Kandidaten für endogen gebildete sogenannte rezeptor- oder speichergesteuerte Ca2+-Kanäle (Clapham et al., 2001; Harteneck et al., 2000; Inoue et al., 2003). TRPC-Proteine können auf Grund ihrer Sequenzhomologie in drei Untergruppen eingeteilt werden (siehe Anhang 11.1.4), und zwar in TRPC1/4/5, TRPC2 und TRPC3/6/7 (Clapham et al., 2001; Inoue et al., 2003).
Tabelle 2.1: Expression von Säuger-TRP-Proteinen in verschiedenen ausgewählten Zellinien und Geweben
Analyse mittels RT-PCR oder Northern Blot. + positiv, - negativ, (+) nicht eindeutig, nd not determined (nicht untersucht). (Engelke 2003; Friedrich, 2001; Garcia & Schilling, 1997;
Groschner et al., 1998; Hofmann et al., 2000-a; Hofmann et al., 2000-b; McKay et al., 2000;
Mori et al., 1998; Mizuno et al., 1999; Okada et al., 1999; Vannier et al., 1999; Wes et al., 1995; Zhu et al., 1995)
Zellinie/Gewebe TRPC1 TRPC2 TRPC3 TRPC4 TRPC5 TRPC6 TRPC7
HEK293 + - + + (+) + nd
Jurkat + - (+) - - - nd
RBL + - - - + + nd
HUVEC + - + + nd nd nd
IIA1.6 + + + - - - nd
Raji + - - - - + nd
Daudi (+) - - - - + nd
Ramos + - - - - (+) nd
Niere + - + (+) - + -
Hoden + + + + + + +
Gehirn + + + + + + +
Herz + (+) + + - + +
Lunge + (+) + - - + +
Milz + (+) nd nd nd nd +
2 Einleitung 2.4 Die TRP-Protein-Familie Alle TRPC-Isoformen besitzen mögliche Bindestellen für Calmodulin (CaM) und den IP3- Rezeptor (IP3R) des Endoplasmatischen Retikulums (ER) in ihrem C-Terminus (siehe Kapitel 2.5.2) (Boulay et al., 1999; Inoue et al., 2003). Die Gewebelokalisation und das Expressionsniveau der TRPC-Proteine sind sehr unterschiedlich (Harteneck et al., 2000;
Walker et al., 2001), wie aus Tabelle 2.1 zu entnehmen ist.
Die Versuche zur funktionellen Charakterisierung ergaben verwirrende und stark widersprüchliche Ergebnisse. Dabei scheint es von nicht unerheblicher Wichtigkeit zu sein, welches Zellsystem mit welcher Spleißvariante aus welcher Spezies mit welchem Expressionsvektor transfiziert wurde. Von allen TRPC-Isoformen außer TRPC5 und TRPC3 sind mehrere Spleißvarianten bekannt, die sich meistens durch Deletionen in den cytosolischen N- und C-Termini unterscheiden. Im Fall von TRPC2 und TRPC4 aus der Maus sowie TRPC6 aus der Ratte konnten den Spleißvarianten unterschiedliche Bindungsfähigkeiten zugeordnet werden (Mery et al., 2001; Yildirim et al., 2003; Zhang &
Saffen, 2001) (siehe Kapitel 2.5.1 und 2.5.2). Üblicherweise wird die längste Form als α und die nächste kürzere als β bezeichnet. Darüber hinaus unterscheiden sich auch die homologen Isoformen unterschiedlicher Spezies durch den Austausch einiger weniger Aminosäuren, aber auch durch zusätzliche Reste am N-Terminus. Die im Rahmen dieser Arbeit untersuchte Spleißvariante mTRPC1β unterscheidet von der α-Variante durch eine Deletion von 34 Aminosäuren zwischen den Ankyrin-ähnlichen Wiederholungen (siehe Anhang 11.1.1).
Bislang konnte diesem Bereich keine entscheidende Funktion zugewiesen werden. Die murine Variante ist am N-Terminus um 16 Aminosäuren länger als die in den meisten Studien untersuchten humanen Formen, wobei allerdings eine menschliche Variante publizierte wurde, die ebenfalls die β-typische Deletion aufweist, aber N-terminal um 51 Aminosäuren länger als die anderen humanen Varianten ist (Wang et al., 1999; Wes et al., 1995; Zhu et al., 1995; Zitt et al., 1996). TRPC2 stellt einen Sonderfall dar, da es in Primaten (Mensch, Gorilla, Orang-Utan) nur als Pseudogen vorliegt (Wes et al., 1995). In Nagern jedoch hat das resultierende Protein eine wichtige Funktion in Spermien bei der Eizellbefruchtung (Jungnickel et al., 2001). Außerdem wird im vomeronasalen Organ ausschließlich TRPC2 exprimiert, was ungewöhnlich ist, da die meisten Zellen und Gewebe mehrere TRP-Proteine parallel exprimieren (siehe Tabelle 2.1). Es spielt dort eine wichtige Rolle bei der Reaktion auf geschlechtsspezifische Hormone und steuert so maßgeblich das Verhalten männlicher Mäuse (Leypold et al., 2002; Liman et al., 1999). Bisher wurden vier verschiedene Spleißvarianten von mTRPC2 publiziert, von denen zwei einen deutlich längeren N-Terminus
2 Einleitung 2.4 Die TRP-Protein-Familie Die kürzeren Spleißvarianten sind nicht in der Lage, messbare Ionenströme oder einen Anstieg des Thapsigargin-induzierten Ca2+-Einflusses zu erzeugen (Hofmann et al., 2000-a).
Die längeren Varianten bewirken jedoch eine Erhöhung des speicher- und rezeptorinduzierten Ca2+-Einflusses (Chu et al., 2002; Jungnickel et al., 2001; Vannier et al., 1999). Zudem konnten kürzeren Spleißvarianten von mTRPC2 im Gegensatz zu den längeren nicht über den N-Terminus mit Calmodulin interagieren (Yildirim et al., 2003) (siehe Kapitel 2.5.2), so dass eine dieser Varianten im Rahmen dieser Arbeit untersucht wurde. In Rindern, Lemuren und verschiedenen Affenarten liegen ebenfalls TRPC2-Transkripte vor, die allerdings bisher nicht näher charakterisiert wurden.
Auch das Zellsystem, das zur Untersuchung heterolog exprimierter TRPC-Proteine verwendet wird, kann einen nicht unerheblichen Einfluss auf die resultierenden Kanaleigenschaften haben. Zum einen können die unterschiedlichen endogen exprimierten TRP-Proteine Auswirkungen auf die durch das heterolog exprimierte TRPC-Protein gebildeten Kanäle haben, da inzwischen angenommen wird, dass TRP-Proteine nicht nur Homotetramere bilden, sondern auch zur heterotypischen Wechselwirkung mit anderen Isoformen in der Lage sind.
Zum anderen können spezies- und zellspezifische Adapterproteine auf die Regulation des TRPC-Proteins einwirken. Des weiteren hat auch das Expressionsniveau nachweislich einen Einfluss auf die Eigenschaften eines TRPC-Kanals (Vazquez et al., 2003). Daher sind Vergleiche der verschiedenen Studien nur mit größter Vorsicht anzustellen und sollten auf gleiche Spleißvarianten im gleichen Zellsystem beschränkt werden. Zu den häufig genutzten Zellsystemen gehört menschliche embryonale Nierenepithelzelllinie 293 („human embryonal kidney“, HEK) und das Derivat 293T, welches mit dem großen T-Antigen des SV40-Virus transfiziert wurde und so ein höheres Expressionsniveau für Protein unter Kontrolle des SV40-Promotors aufweist. 293-Zellen exprimieren endogen den G-Protein-gekoppelten muskarinischen Acetylcholinrezeptor, der durch Carbachol stimulierbar ist, so dass sie sich gut zur Untersuchung von Ca2+-Strömen eignen. Daneben werden auch COS- und CHO- Zellen verwendet, die endogen den ATP-stimulierbaren purigenischen Rezeptor exprimieren.
Zum Studium des Einflusses von TRPC-Proteinen auf den Ca2+-Einstrom in B-Zellen wurden bisher v.a. Hühner-DT40-Zellen genutzt, da sich diese Zelllinie v.a. sehr gut zum Ausschalten („knock out“) bestimmter Gene eignet. Zu Beginn der Forschung an TRP-Proteinen wurden auch Sf9-Insekten mit Hilfe von Baculoviren transfiziert, die sich aber zum Studium von Vertebraten TRP-Protein durch das mögliche Fehlen essentieller Adapterproteine nicht gut eignen.
2 Einleitung 2.4 Die TRP-Protein-Familie
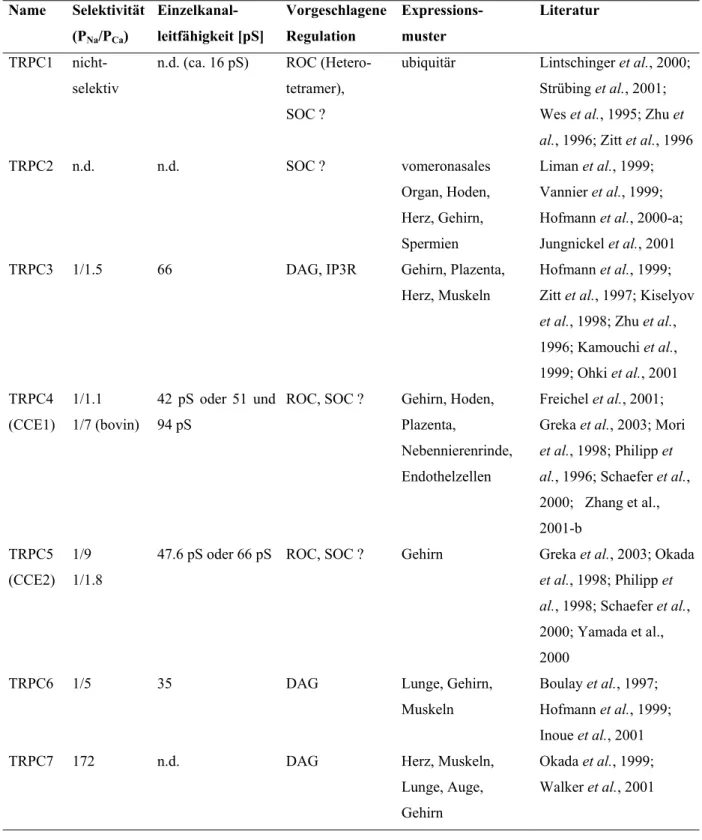
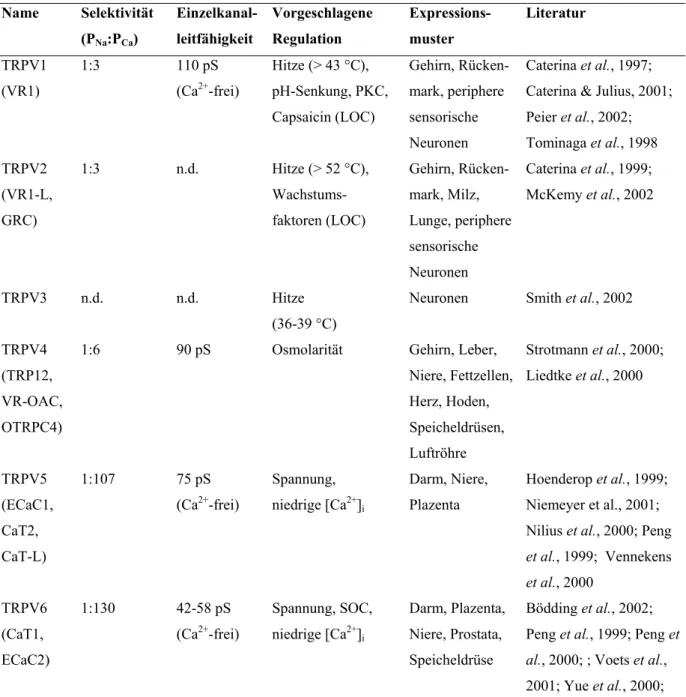
Tabelle 2.2: Eigenschaften von TRPC-Kanälen
ROC: rezeptorgesteuert („receptor-operated channel“); SOC: durch Speicherentleerung gesteuert („store-operated channel“); n.d.: nicht untersucht („not determined“) (modifiziert nach Clapham et al., 2001)
Name Selektivität (PNa/PCa)
Einzelkanal- leitfähigkeit [pS]
Vorgeschlagene Regulation
Expressions- muster
Literatur TRPC1 nicht-
selektiv
n.d. (ca. 16 pS) ROC (Hetero- tetramer), SOC ?
ubiquitär Lintschinger et al., 2000;
Strübing et al., 2001;
Wes et al., 1995; Zhu et al., 1996; Zitt et al., 1996
TRPC2 n.d. n.d. SOC ? vomeronasales
Organ, Hoden, Herz, Gehirn, Spermien
Liman et al., 1999;
Vannier et al., 1999;
Hofmann et al., 2000-a;
Jungnickel et al., 2001 TRPC3 1/1.5 66 DAG, IP3R Gehirn, Plazenta,
Herz, Muskeln
Hofmann et al., 1999;
Zitt et al., 1997; Kiselyov et al., 1998; Zhu et al., 1996; Kamouchi et al., 1999; Ohki et al., 2001 TRPC4
(CCE1) 1/1.1 1/7 (bovin)
42 pS oder 51 und 94 pS
ROC, SOC ? Gehirn, Hoden, Plazenta,
Nebennierenrinde, Endothelzellen
Freichel et al., 2001;
Greka et al., 2003; Mori et al., 1998; Philipp et al., 1996; Schaefer et al., 2000; Zhang et al., 2001-b
TRPC5 (CCE2)
1/9 1/1.8
47.6 pS oder 66 pS ROC, SOC ? Gehirn Greka et al., 2003; Okada et al., 1998; Philipp et al., 1998; Schaefer et al., 2000; Yamada et al., 2000
TRPC6 1/5 35 DAG Lunge, Gehirn,
Muskeln
Boulay et al., 1997;
Hofmann et al., 1999;
Inoue et al., 2001
TRPC7 172 n.d. DAG Herz, Muskeln,
Lunge, Auge, Gehirn
Okada et al., 1999;
Walker et al., 2001
2 Einleitung 2.4 Die TRP-Protein-Familie Unter Beachtung der aufgeführten Einschränkungen können die bisher ermittelten funktionellen Eigenschaften der verschiedenen TRPC-Proteine folgendermaßen zusammengefasst werden. TRPC1 bildet einen nicht-selektiven Kationenkanal (Zhu et al., 1996; Zitt et al., 1996; Sinkins et al., 1998). Eine Aktivierung durch Speicherentleerung, Rezeptorstimulation oder das PLC-Produkt DAG konnte nicht eindeutig festgestellt werden (Engelke, 2003; Lintschinger et al., 2000; Mori et al., 2002; Singh et al., 2001-a; Sinkins et al., 1998; Strübing et al., 2001; Zhu et al., 1996; Zitt et al., 1996). Mit Hilfe von Deletionsmutanten konnte eine negativ-regulatorische Region im C-Terminus ermittelt werden (Singh et al., 2001; Engelke, 2003). Darüber hinaus gibt es zahlreiche Hinweise auf eine positive Regulation durch die Interaktion mit IP3-Rezeptoren des ER (Lockwich et al., 2000; Rosado & Sage, 2000-b; Rosado & Sage, 2001; Rosado et al., 2002; Singh et al., 2001- a; Singh et al., 2001-b) (siehe Kapitel 2.5.2). Die längeren Spleißvarianten von TRPC2 konnten sowohl durch Rezeptorstimulation als auch durch Speicherentleerung aktiviert werden (Chu et al., 2002; Vannier et al., 1999). Die eng verwandten Isoformen TRPC3, TRPC6 und TRPC7 zeigen auch funktionell eine große Übereinstimmung. Sie bilden nicht- selektive Kationenkanäle, die durch La3+, Ni2+ und Gd3+ blockiert werden. Es gibt zahlreiche Hinweise für eine Aktivierung von TRPC3/6/7-Kanälen durch Interaktion mit dem IP3R (Boulay et al., 1999; Kiselyov et al., 1998; Sugawara et al., 1997; Vazquez et al., 2001).
Daneben wird das humane TRPC3 auch durch Calmodulin in Gegenwart von Calcium (Ca2+/CaM) negativ reguliert (Zhang et al., 2001-a) (siehe Kapitel 2.5.2). Darüber hinaus ließen sich TRPC3/6/7-enthaltenden Kanäle direkt durch Stimulation der PLC oder durch Diacylglycerin (DAG) und Derivate aktivieren (Gamberucci et al., 2002; Hassock et al., 2002; Hofmann et al., 1999; McKay et al., 2000; Okada et al., 1999; Venkatachalam et al., 2001; Zhang & Saffen, 2001; Zhu et al., 1998). Die Unterschiede in der Aktivierung von TRPC3 durch Speicherentleerung oder Rezeptorstimulation (Groschner et al., 1998; Hurst et al., 1998; McKay et al., 2000; Ohki et al., 2001; Vazquez et al., 2001; Venkatachalam et al., 2001; Zhu et al., 1996; Zhu et al., 1998; Zitt et al., 1996) werden inzwischen auf unterschiedliche Expressionsniveaus zurückgeführt (Vazquez et al., 2003), da vermutlich im Fall einer großen Menge an TRPC3 nicht alle TRPC3-Proteine eine Bindung mit dem IP3R eingehen können, so dass die Abhängigkeit von den intrazellulären Speichern nur im Fall ausgeglichener Mengen von TRPC3 und IP3R gegeben ist. Die IP3R-unabhängigen Kanäle sind dann für eine Modulation durch Lipidbotenstoffe zugänglich (Harteneck et al., 2001;
Kiselyov & Muallem, 1999; Vazquez et al., 2001; Zhu et al., 1998). TRPC6-enthaltende Kanäle gelten als rezeptoraktivierbar und unabhängig von intrazellulären Speichern (Hassock