Thermodynamik Serie 1 - Musterl¨ osung
HS 2020 Prof. P. Jetzer
M. Haney, S. Tiwari, M. Ebersold
https://www.physik.uzh.ch/de/lehre/PHY341/
Ausgeteilt am: 22.09.20 Abzugeben bis: 29.09.20
1. Reversible elektrische Zelle a)
F¨ ur die elektrische Zelle gilt p → E , V → e, i.e. der erste Hauptsatz ergibt sich zu
dU = δQ + δA = T dS − E de . (1)
Wir gehen ¨ uber zu den Variablen T und e, also schreiben dS = ∂S
∂T
edT + ∂S
∂e
Tde . (2) Wir erhalten:
dU = T ∂S
∂T
edT +
T ∂S
∂e
T− E
de
= ∂U
∂T
edT + ∂U
∂e
Tde , (3) wobei sich die zweite Zeile per Definition ergibt. Da es sich bei dU um ein totales Differential handelt, muss nach dem Satz von Schwarz gelten:
∂
∂e
T ∂S
∂T
e= ∂
∂T
T ∂S
∂e
T− E
. (4)
Daraus erhalten wir
∂S
∂e
T= ∂E
∂T
e, (5) eine der sogenannten Maxwell-Relationen. Einsetzen ergibt
dU = T ∂S
∂T
edT +
T ∂E
∂T
e− E
de . (6)
Im Vergleich mit Formel 3 sehen wir nun, dass
∂U
∂e
T= T ∂E
∂T
e− E . (7)
Diese Formel setzt die kalorische Zustandsgleichung U = U (T, e) mit der thermischen E = E(T, e) in Beziehung.
1
b)
Wir haben T = const. Es gilt f¨ ur die zugef¨ uhrte W¨ arme δQ = dU − δA. Also δQ = ∂U
∂e
Tde + ∂U
∂T
edT
| {z }
=0, da isotherm
+Ede (8)
=
∂U
∂e
T| {z }
=T ∂E∂T e
−E
+E
de = T ∂E
∂T
ede . (9)
Daraus folgt
∆Q = T Z
e1e0
∂E
∂T
ede . (10)
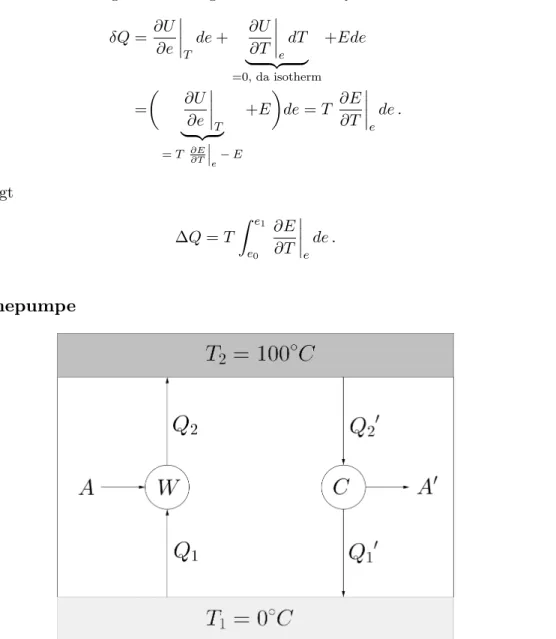
2. W¨ armepumpe
Abbildung 1: Schematische Darstellung einer Carnot-Maschine.
Betrachte eine Carnot-Maschine zwischen zwei W¨ armereservoirs der Temperatur T
1= 0
◦C und T
2= 100
◦C um eine untere Grenze f¨ ur A zu finden. Wir haben Q
1= 1cal und Q
2= Q
1+ A. Gem¨ ass dem 2. HS gilt A A
0. F¨ ur einen Carnot-Prozess gilt η
C=
QA02
≤
QA2