Thermodynamik Serie 4 - Musterl¨ osung
HS 2020 Prof. P. Jetzer
M. Haney, S. Tiwari, M. Ebersold
https://www.physik.uzh.ch/de/lehre/PHY341/
Ausgeteilt am: 13.10.20 Abzugeben bis: 20.10.20
1. Van-der-Waals Gas
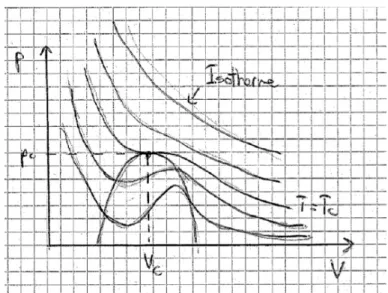
Abbildung 1: pV-Diagramm f¨ ur das Van-der-Waals Gas.
a) Am kritischen Punkt p c , V c , T c hat die Isotherme p(V ) einen Wendepunkt. Es gilt also:
∂p
∂V V
c,T
c= ∂ 2 p
∂V 2 V
c,T
c= 0 . (1)
Wir haben somit die folgenden 3 Gleichungen:
i) p c = nRT c
V c − nb − an 2
V c 2 (van-der-Waals-Gleichung) (2) ii) − nRT c
(V c − nb) 2 + 2an 2
V c 3 = 0 (1. Ableitung) (3)
iii) 2nRT c
(V c − nb) 3 − 6an 2
V c 4 = 0 (2. Ableitung) (4)
Setze ii) in iii) ein:
1
2 (V c − nb) = V c
3 ⇒ V c = 3nb . (5)
Ersetze V c in Gleichung ii):
2an 2
27n 3 b 3 = nRT c
4n 2 b 2 ⇒ T c = 8a
27Rb . (6)
Dann lautet die Van-der-Waals-Gleichung:
p c = n 2nb
8a
27b − an 2
9n 2 b 2 ⇒ p c = a
27b 2 . (7)
b) Die Umkehrung ist trivial, wir finden sofort b = V c
3n , (8)
a = 27
8 bRT c = 9 8
V c RT c
n . (9)
c) Schreibe p = πp c , V = vV c , T = tT c und dr¨ ucke in der Van-der-Waals-Gleichung p c , V c und T c durch a und b aus:
π a
27b 2 + 1 v 2
an 2 9n 2 b 2
(3nbv − nb) = 8ant
27b , (10)
an b
π 27 + 1
9v 2
(3v − 1) = 8ant
27b , (11)
und wir erhalten
π + 3
v 2
(3v − 1) = 8t . (12)
Das ist das sogenannte “Gesetz der korrespondierenden Zust¨ ande”, das heute auch uni- verselles Gasgesetz genannt wird. Dabei ist es bemerkenswert, dass die Kenntnis des kritischen Punktes allein gen¨ ugt, das Verhalten des Gases vollst¨ andig zu beschreiben.
Zwei Gase, die dieselben Werte von π, v, t haben (obwohl i. Allg. verschiedene p, V , T ), werden “im korrespondierenden Zustand”genannt.
d) Gegeben sind die Definitionen von κ T und α:
κ T = − 1 V
∂V
∂p T
, α = 1 V
∂V
∂T p
. (13)
Man k¨ onnte nun die Van-der-Waals Gleichung als Funktion des Volumens umschreiben.
Es ist jedoch einfacher, die Definitionen umzuformen zu κ T = − 1
V ∂p
∂V T
−1
, α = 1 V
∂T
∂V p
! −1
. (14)
und entsprechend
∂p
∂V T ,n
= − nRT
(V − nb) 2 + 2an 2
V 3 = 2an 2 (V − nb) 2 − nRT V 3
V 3 (V − nb) 2 . (16) Durch Substitution von ∂V ∂p
T ,n im Ausdruck f¨ ur κ T bekommt man κ T =
nRT V
(V − nb) 2 − 2an 2 V 2
−1
. (17)
Die van-der-Waals Gleichung als Funktion der Temperatur ist gegeben durch T(p, V ) =
p + an 2 V 2
V − nb
nR , (18)
und dementsprechend
∂T
∂V p,n
= − 2an 2 V 3
V − nb nR
+ V 2 p + an 2
nRV 2 = · · · = T V 3 − (2an/R)(V − nb) 2
V 3 (V − nb) . (19) Durch Substitution von ∂V ∂T
p,n im Ausdruck f¨ ur α erh¨ alt man α = V 2 (V − nb)
T V 3 − (2an/R)(V − nb) 2 . (20)
e) F¨ ur ein ideales Gas gilt a = b = 0, dadurch reduziert sich der Ausdruck f¨ ur κ T zu:
κ T , ideal gas = V
nRT = 1/p . (21)
Der Ausdruck f¨ ur α reduziert sich zu:
α ideal gas = 1/T . (22)
f) κ T kann f¨ ur ein van-der-Waals Gas auch negativ sein, siehe als Beispiel in Abb. 1 die unterste Kurve. Bei ansteigendem Volumen gibt es also einen Bereich in welchem auch der Druck zunimmt, wir erwarten aber einen Druckabfall, es handelt sich also um einen unphysikalischen Bereich. Zudem gibt es zu einem gegebenen Druck unterhalb p c eine dreifache Entartung, also verschiedene L¨ osungen f¨ ur das Volumen, die Forderung nach einem stabilen System ist also verletzt. Wir werden sehen das in diesem unphysikalischen Bereich ein Phasen¨ ubergang stattfindet.
α kann tats¨ achlich negativ sein, zum Beispiel f¨ ur Wasser zwischen 0 ◦ C und 4 ◦ C (An-
omalie des Wassers).
2. Die thermodynamischen Potentiale des idealen Gases
Den Ausdruck f¨ ur die innere Energie erhalten wir durch Aufl¨ osen der Gleichung f¨ ur die Entro- pie (auf dem Aufgabenblatt) nach u
u = u 0
v v 0
−
Rcv
e
s−s0
cv
. (23)
Die Legendre Transformation von u(s, v) in der Variablen s l¨ asst uns zur Helmholtzschen freien Energie f (T, v) ¨ ubergehen, d.h.
f (T, v) = u(T, v) − T s(T, v) , (24)
mit
T (s, v) = ∂u
∂s v
= u 0 c v
v v 0
−
cvRe
s−s0
cv
, (25)
wobei Gleichung (23) benutzt wurde. Der Wert T 0 ist definiert via T 0 = T (s 0 , V 0 ) = u 0
c v . (26)
In den neuen Variabeln v und T haben die Zustandsfunktionen s und u die Form s = c v log T
T 0
+ R log v v 0
+ s 0 , (27)
u = u 0
v v 0
−
Rcv