Thermodynamik Serie 5 - Musterl¨ osung
HS 2020 Prof. P. Jetzer
M. Haney, S. Tiwari, M. Ebersold
https://www.physik.uzh.ch/de/lehre/PHY341/
Ausgeteilt am: 20.10.20 Abzugeben bis: 27.10.20
1. Joule-Thomson Effekt
Ableitung der Zustandsgleichung nach T bei festem p liefert
− 2a V
3∂V
∂T
p(V − b) +
p + a V
2∂V
∂T
p= R , (1)
∂V
∂T
p− 2a
V
3(V − b) + RT V − b
= R . (2)
Auf der Inversionskurve ist
∂V∂T p=
VTf¨ ur T = T
i(V ), also 2a
V
2(V − b) = RT
iV V − b − 1
= RT
ib
V − b , (3)
T
i= 2a Rb
V − b V
2= 2a Rb
1 − b
V
2. (4)
Umgekehrt:
b V
i= 1 − r RbT
2a , (5)
denn das andere Vorzeichen der Wurzel ist wegen V > b auszuschliessen. Einsetzen in die Zustandsgleichung
p = 1 V
RT 1 −
Vb− a
V
!
(6) liefert
p
i= 1 b 1 −
r RbT 2a
! r 2RaT b − a
b 1 −
r RbT 2a
!!
(7)
= a
b
21 − 3 r RbT
2a
! r RbT 2a − 1
!
. (8)
Um den Bereich, wo Abk¨ uhlung stattfindet, zu bestimmen, berechnen wir aus 2 T
∂V
∂T
p
− V = 2a
VV−b2− RT b
−
2aV VV−b2+ RT . (9)
1
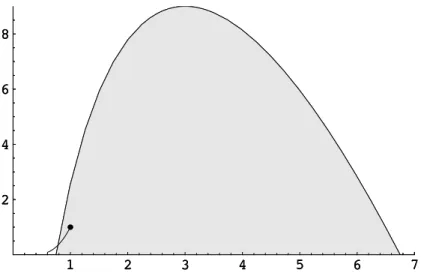
1 2 3 4 5 6 7 2
4 6 8
1 2 3 4 5 6 7
2 4 6 8
Abbildung 1: Inversionskurve f¨ ur ein van der Waals Gas. Im schattierten Bereich findet Abk¨ uhlung statt. Die Einheiten sind T
0=
278 bRa, bzw. p
0=
271 ba2. Auch eingezeichnet sind die Dampfdruckkurve und der kritische Punkt (T
0, p
0).
F¨ ur festes T und p → ∞ gilt V → b nach der Zustandsgleichung, also:
T ∂V
∂T
p− V → −b < 0 (f¨ ur p → ∞). (10) Damit findet bei Joule-Thomson Expansion im schattierten Bereich Abk¨ uhlung statt.
Man kann die Vorzeichenwechsel in ∂T /∂p|
Hmikroskopisch mit der Dominanz der kurzreich- weitigen abstossenden beziehungsweise der langreichweitigen anziehenden Wechselwirkung zwischen den Gasteilchen begr¨ unden.
Ist die abstossende Wechselwirkung dominant, so wird bei einer Verringerung des Drucks die potentielle Energie kleiner, also w¨ achst die kinetische Energie und mit ihr die Temperatur (negatives Vorzeichen).
Ist hingegen die anziehende Wechselwirkung dominant, so wird bei einer Verringerung des Drucks die potentielle Energie gr¨ osser, also werden die Teilchen langsamer und die Temperatur sinkt (positives Vorzeichen).
Wird f¨ ur eine vorgegebene Temperatur der Druck immer weiter erh¨ oht (d.h., man ist irgend- wann weit oberhalb der Inversionskurve), so werden die Teilchen auf immer engerem Raum zusammengepfercht, irgendwann wird die abstossende Wechselwirkung ¨ uber die anziehende dominant sein. Dasselbe passiert, wenn bei konstantem Druck die Temperatur immer weiter abgesenkt wird, das Volumen pro Teilchen sinkt, ab einem gewissen Punkt wird die abstos- sende Wechselwirkung dominant.
Befindet sich das Gas bei nicht zu hohem Druck und nicht zu hoher Temperatur in einem Zustand, bei dem die anziehende Wechselwirkung dominant ist (d.h., man ist unterhalb der In- versionskurve), so wird bei gleichbleibendem Druck und steigender Temperatur die kinetische
2
Energie pro Teilchen wachsen, weswegen es vermehrt zu Kollisionen zwischen den Teilchen kommt, der Einfluss der abstossenden Wechselwirkung wird also wieder wachsen.
2. Thermodynamik der Supraleiter
a) Die Zustandsgleichung lautet M (T, H) = −HΘ(H
c(T ) − H), wobei Θ(x) die Heaviside- Funktion darstellt. In anderen Worten gilt M(T, H) = −H im supraleitenden Zustand, w¨ ahrend der Normalleiter, wegen |χ
N L| |χ
SL| = 1, als nicht-magnetisch (M (T, H) = 0) betrachtet werden kann.
b) F¨ ur ein Fluidum, dU = T dS − pdV , mit Koexistenzkurve p = p(T ) zwischen zwei Phasen lautet die Clausius-Clapeyron Gleichung dp/dT = ∆S/∆V ; f¨ ur ein magnetisches System, du = T ds + HdM , gilt dementsprechend
− dH
c(T )
dT = ∆s/∆M. (11)
Zusammen mit ∆M (T ) = M (T, H
c(T ))|
SLN L
= −H
c(T ) folgt aus der magnetischen Clausius-Clapeyron Gleichung (11), die Beziehung
∆s(T) = s(T, H
c(T ))|
SLN L
= H
c(T ) dH
c(T) dT = 1
2
d[H
c(T )
2]
dT . (12)
Mit dem Symbol |
SLN L
wird angedeutet, dass die Funktion in einer kleinen Umgebung des Koexistenzpunktes (T, H
c(T)) im SL- und im NL-Zustand ausgewertet und die Differenz der Werte gebildet wird. Mit einer Maxwell Relation und M (T, H) = M(H) in den reinen Phasen, folgt sofort s(T, H) = s(T ). Aus diesem Sachverhalt und der Definition der spezifische W¨ arme c
H:= T ∂s/∂T |
Hfinden wir, dass
∆c
H(T ) = c
H(T, H
c(T ))|
SLN L