Thermodynamik Serie 3 - Musterl¨ osung
HS 2020 Prof. P. Jetzer
M. Haney, S. Tiwari, M. Ebersold
https://www.physik.uzh.ch/de/lehre/PHY341/
Ausgeteilt am: 06.10.20 Abzugeben bis: 13.10.20
1. Carnot-Kreisprozess a)
p
v v4
1
2
4
v2
Adiabate
3
v1 v3
Isotherme
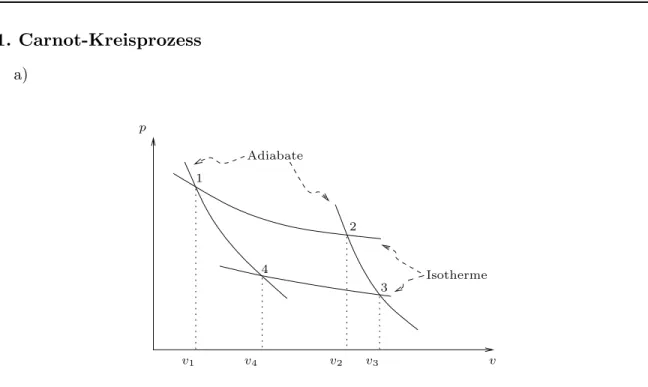
Abbildung 1: Folgende Schritte werden im Carnot-Prozess durchlaufen. Die Verwendung von Molvolumina, vi = Vi/n, ist hier angebracht. Dadurch l¨asst sich die ideale Gasgleichung schreiben alspv=RT.
1→2 W¨ahrend der isothermen Expansion von (T1 =ϑ1, v1) nach (T2 =ϑ1, v2) wird die Arbeit
∆a12=− Z v2
v1
pdv=−Rϑ1
Z v2
v1
dv
v =−Rϑ1logv2
v1
nach Innen geleistet (negativ, darum positiv nach Aussen). Aus der Volumenun- abh¨angigkeit der inneren Energie des idealen Gases,
0≡ Z 2
1
du= Z 2
1
δq− Z v2
v1
pdv= ∆q12+ ∆a12.
folgt sofort, dass der Carnot-Maschine w¨ahrend der isothermen Expansion die W¨armemenge ∆q12=−∆a12 zugef¨uhrt wird.
Bemerkung: du = δq +δa, d.h. das System leistet Arbeit falls δa < 0 (es wird Arbeit am System geleistet falls δa >0).
2→3 Da auf der Adiabaten von (T2 =ϑ1, v2) nach (T3 =ϑ2, v3) kein W¨armeaustausch stattfindet, ∆q23 = 0, wird die Arbeit δa = −pdv = du = cvdT nach Innen geleistet. Deshalb finden wir sofort
∆a23= Z 3
2
cvdT =cv(T3−T2) =−cv(ϑ1−ϑ2).
Da ϑ1 > ϑ2, ist ∆a23 negativ und so ist die Arbeit nach Aussen abgegeben.
3→4 W¨ahrend der isothermen Kompression von (T3 =ϑ2, v3) nach (T4 =ϑ2, v4), leistet das System die Arbeit
∆a34=Rϑ2logv3 v4
,
wodurch effektiv Arbeit dem System zugef¨uhrt werden muss. Gleichzeitig wird die W¨armemenge ∆q34 = −∆a34 < 0 aufgenommen, was also einer W¨armeabgabe
|∆q34|entspricht.
4→1 Die w¨ahrend der adiabatischen Kompression von (T4 =ϑ2, V4) nach (T1 =ϑ1, v1) geleistete Arbeit (nach Innen) ist
∆a41=cv(ϑ1−ϑ2), wobei kein W¨armeaustausch stattfindet, ∆q41= 0.
Damit ist der Anfangszustand wieder erreicht. Die bei einem Umlauf am System gelei- stete Arbeita ist
a= ∆a12+ ∆a23+ ∆a34+ ∆a41=−Rϑ1logv2
v1 −Rϑ2logv4 v3. Mit Hilfe der Adiabatengleichungen
ϑ1vγ−12 =ϑ2v3γ−1, (1) ϑ1vγ−11 =ϑ2v4γ−1, (2) erhalten wir v2/v1 =v3/v4 und finden somit f¨ur die totale Arbeit den Ausdruck
a=−R(ϑ1−ϑ2) logv2
v1.
Letztere ist mitϑ1 > ϑ2undv2> v1negativ, sodass die Arbeit von der Carnot-Maschine an der Umgebung geleistet wird. Mit der eingespeisten W¨arme ∆qin= ∆q12 finden wir schliesslich f¨ur den Wirkungsgrad
η= −a
∆qin = R(ϑ1−ϑ2) logvv2
1
Rϑ1logvv2
1
= 1− ϑ2
ϑ1.
Die W¨arme ∆q34 ist reine Abw¨arme und somit ein “Abfallprodukt” des Prozesses.
b) Sobald der Kolben das minimale Volumen erreicht hat, wird der Zylindermotor an das W¨armereservoir bei der Temperaturϑ1 angeschlossen (siehe Abbildung 2). Die Tempe- ratur des Gases ist zu diesem Zeitpunkt ebenfalls ϑ1. Daraufhin expandiert der Kolben isotherm. An einem gewissen Punkt (siehe Teilaufgabe c)) wird das Reservoir abgeh¨angt und der Kolben expandiert adiabatisch weiter. Erreicht der Kolben die maximale Aus- dehnung (TGas=ϑ2), so wird das W¨armebadϑ2angeschlossen und der Kolben zieht sich isotherm zusammen. Schliesslich wird das Bad wieder abgeh¨angt, so dass der Kolben die urspr¨ungliche Position adiabatisch erreicht.
Abbildung 2: Schematischer Ablauf des rechtslaufenden Carnot-Prozesses. Die Pfeile stellen die Bewegungsrichtung des Kolbens dar. Die adiabatischen Abschnitte sind f¨ur diesen rever- siblen Prozess isentrop.Quelle: http://de.wikipedia.org/
c) Einem Zylindermotor, welcher den Carnot-Kreisprozess zwischen ϑ1 und ϑ2 realisiert, sind nat¨urliche Grenzen gesetzt. Zum einen ist das maximal zul¨assige Volumen durch die Kolbengr¨osse gegeben. Diese Bedingung liefert einen maximalen Wert f¨urv3 =vmax. Zusammen mit ϑ2 ist damit die Position von Punkt 3 in Abbildung 1 festgelegt.
Im Punkt 1 von Abbildung 1 ist der maximal zul¨assige Druck der limitierende Faktor (p1 = pmax). Dieser h¨angt in erster Linie vom Dichtungsring am Zylinderkolben ab.
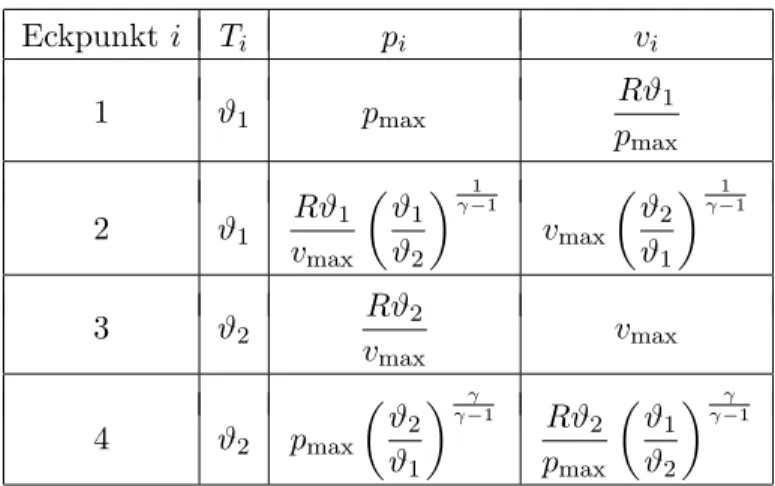
Durch die Gr¨ossen (ϑ1, ϑ2, pmax, vmax) sind die Eckpunkte des Carnot-Kreisprozesses auf eindeutige Weise bestimmt. Nutzt man n¨amlich die Adiabatengleichungen (1) und (2) sowie die Gleichungen f¨ur die Isothermen
p1v1=p2v2 =Rϑ1, (3) p3v3=p4v4 =Rϑ2, (4) so findet man nach einigen Umformungen die genaue Position der Eckpunkte (siehe Tabelle 1).
Eckpunkti Ti pi vi
1 ϑ1 pmax Rϑ1
pmax
2 ϑ1
Rϑ1
vmax
ϑ1
ϑ2
γ−11
vmax
ϑ2
ϑ1
γ−11
3 ϑ2 Rϑ2
vmax vmax
4 ϑ2 pmax
ϑ2
ϑ1
γ−1γ
Rϑ2
pmax
ϑ1
ϑ2
γ−1γ
Tabelle 1: Eckpunkte des Carnot-Prozesses als Funktion von (ϑ1,ϑ2,pmax,vmax).
2. Escher-Wyss-Kreisprozess
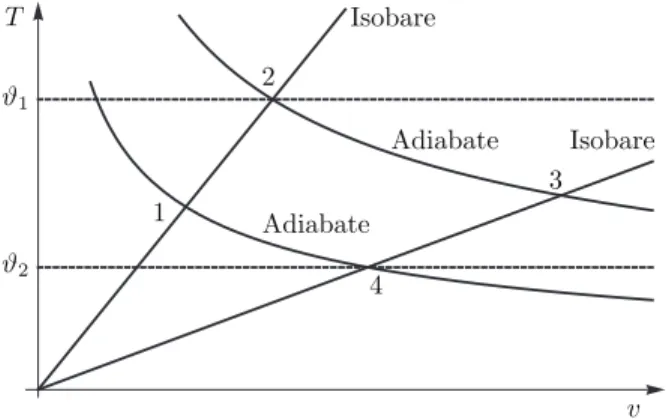
a) Wir berechnen nun f¨ur einen Escher-Wyss-Kreisprozess die auf den einzelnen Zyklus- abschnitten geleisteten Arbeitsmengen und die jeweils zu-/abgef¨uhrte W¨armemenge.
Adiabate Isobare 1
2
3
4
v T
ϑ1
ϑ2
Adiabate Isobare
Abbildung 3: Schematische Darstellung des Escher-Wyss-Kreisprozesses. Diese Maschine wird zwischen zwei Isobaren (p= const.⇒T ∝V) und zwei adiabatischen Abschnitten betrieben.
1→2 Auf diesem Abschnitt ist der Druck konstant (p=pA) und die Arbeit, welche am System geleistet wird, berechnet sich als
∆a12=− Z v2
v1
pAdv=−pA(v2−v1) =−R(T2−T1).
Das ist negativ, so wird Arbeit nach Aussen gemacht. Die innere Energie des idealen Gases h¨angt nur von der Temperatur ab und dessen ¨Anderung auf dem Abschnitt ist somit
∆u12=cv(T2−T1).
Mithilfe des ersten Hauptsatzes k¨onnen wir die dem System zugef¨uhrte W¨arme berechnen und finden
∆q12= ∆u12−∆a12= (cv+R)(T2−T1) =cp(T2−T1).
2→3 Dieser Abschnitt verl¨auft adiabatisch und somit ist ∆q23= 0. Dadurch vereinfacht sich die Berechnung der zugef¨uhrten Arbeit zu
∆a23= ∆u23=cv(T3−T2).
3→4 Wie in Abschnitt 1→2 ist der Druck konstant (p=pB) und wir finden
∆a34=− Z v4
v3
pBdv=−pB(v4−v3) =−R(T4−T3), und mit dem ersten Hauptsatz
∆q34= ∆u34−∆a34= (cv+R)(T4−T3) =cp(T4−T3).
4→1 Der letzte Abschnitt verl¨auft adiabatisch und somit finden wir neben ∆q41= 0,
∆a41=cv(T1−T4).
F¨ur die auf einem Kreiszyklus zugef¨uhrte Arbeit finden wir
a= ∆a12+ ∆a23+ ∆a34+ ∆a41=−cp(T2+T4−T1−T3).
Da die W¨armemenge ∆q12 die zugef¨uhrte W¨arme ins System ist, finden wir den Wir- kungsgrad als
η = −a
∆q12 = cp(T2+T4−T1−T3)
cp(T2−T1) = 1−T3−T4
T2−T1 Da entlang von Adiabaten p1−γTγ = const.gilt, finden wir die Relationen
p
1−γ γ
A T1 =p
1−γ γ
B T4, p
1−γ γ
A T2 =p
1−γ γ
B T3.
(5) Mithilfe dieser Relationen sehen wir, dass wir den Wirkungsgrad schreiben k¨onnen als
η= 1−T4
T1 = 1− T3 T2.
b) Mit den Relationen (5) l¨asst sich der Wirkungsgrad auch als Funktion der Dr¨ucke der beiden Isobaren schreiben, n¨amlich
η= 1− pB
pA γ−1γ
. (6)
Auch die Arbeit l¨asst sich als Funktion der von Aussen vorgegebenen Gr¨ossen pA,pB, ϑ1 undϑ2 schreiben als
a=−cph ϑ1
1−pB pA
γ−1γ +ϑ2
1−pA pB
γ−1γ i
. (7)
c) Der Kreisprozess arbeitet als Kraftmaschine f¨ur a ≤ 0. Mit a = 0 findet man den minimalen und maximalen Druck. Der maximale Druck pB,max ist gegeben durch pA, also pB,max=pA. F¨ur den minimalen Druck findet man
pB,min=pA
ϑ2
ϑ1
γ−1γ .
d) Den maximalen Wirkungsgrad erhalten wir offensichtlicherweise wenn der Druck pB
minimal ist, also pB =pB,min. Wenn wir dies in den Wirkungsgrad einsetzen, erhalten wir
η= 1−ϑ2
ϑ1,
was dem Carnot-Wirkungsgrad enspricht. F¨ur diese Wahl von pB findet man nun aber, dass
a=−cph ϑ1
1−ϑ2 ϑ1
+ϑ2 1−ϑ1
ϑ2
i= 0.
Somit arbeitet die Maschine zwar mit einem optimalen Wirkungsgrad, erzeugt aber keine Arbeit.
e) Indem wir a(ϑ1, ϑ2, pA, pB) nach pB maximieren, finden wir das optimale pB gegeben durch die Beziehung
pB pA
=ϑ2 ϑ1
2(γ−1)γ
. (8)
Indem wir dieses Ergebnis in die Ausdr¨ucke f¨ur den Wirkungsgrad (6) und die Arbeit (7) einsetzen, erhalten wir
η= 1− rϑ2
ϑ1, a=−cpp
ϑ1−p ϑ22
.
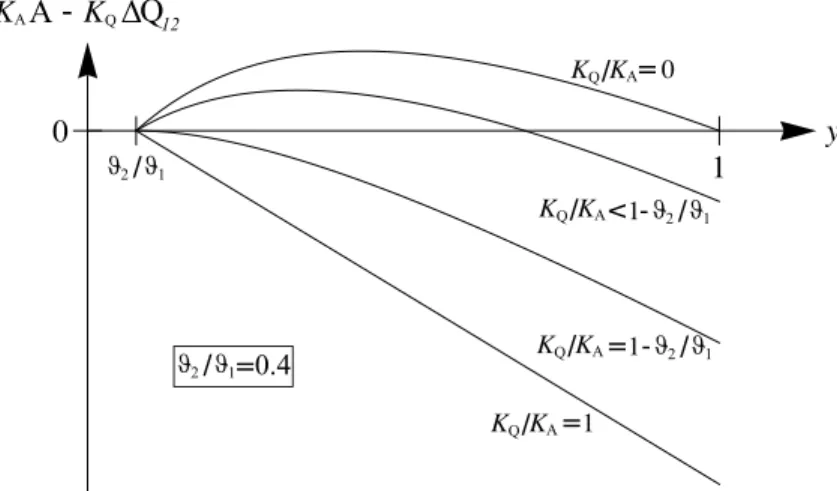
f) Um den aus ¨okonomischer Sicht optimalen DruckpB zu bestimmen m¨ussen wir Kaa−Kq∆q12=Kaa−Kq
a η
maximieren. Indem wir durch die von pB unabh¨angige Gr¨osse cpϑ1Ka teilen, erhalten wir
(1−y)
1−ϑ2/ϑ1
y
− Kq
Ka
1−ϑ2/ϑ1
y
,
wobei wir y= (pB/pA)(γ−1)/γ eingef¨uhrt haben. Dieser Ausdruck wird maximal f¨ur y=
rϑ2
ϑ1
r
1− Kq
Ka
. (9)
Aus der Beschr¨ankung der erlaubten pB-Werte erhalten wir f¨ury die Einschr¨ankung ϑ2
ϑ1
≤y≤1.
Die rechte Ungleichung ist immer erf¨ullt f¨ur ϑ2 < ϑ1 und Kq < Ka. Wegen der linken Ungleichung ist die L¨osung (9) ausserhalb des erlaubten Bereiches falls
Kq
Ka >1− ϑ2
ϑ1. Wir finden nun insgesamt
y=pB
pA
γ−1γ
=
qϑ2
ϑ1
q 1−KKq
a, KKq
a ≤1−ϑϑ2
1,
ϑ2
ϑ1, KKq
a >1−ϑϑ2
1, (10)
Wir erkennen, dass f¨ur Kq/Ka → 0 der ¨okonomisch optimale Arbeitsmodus f¨ur die maximale Arbeit pro Zyklus realisiert wird (Vgl. Gl. (10) f¨urKq/Ka= 0 mit (8)).
1 0 y
KAA-KQΔQ12
=
=0
<1-
=1-
=1 0.4
ϑ2/ϑ1
ϑ2/ϑ1
K KQ/ A
K KQ/ A ϑ2/ϑ1
K KQ/ A ϑ2/ϑ1
K KQ/ A
Abbildung 4: Die Gr¨osse Kaa−Kq∆q12 gilt es ¨okonomisch zu maximieren. So findet man den optimalen DruckpB, bei dem die Escher-Wyss-Maschine betrieben werden soll. Hier wird diese Gr¨osse als Funktion von y = (pB/pA)(γ−1)/γ f¨ur verschiedene Verh¨altnisse Kq/Ka und f¨ur ϑϑ2
1 = 0.4 dargestellt. Nur f¨ur KKq
a ≤1−ϑϑ2
1 existiert ein Maximum>0.