Herbstsemester 2013
Analytische Chemie
(für Biol. / Pharm. Wiss.)
Teil: Trenntechniken (Chromatographie, Elektrophorese)
Dr. Martin Pabst
ETH Zurich | Dr. Thomas Schmid, Dr. Martin Pabst | martin.pabst@org.chem.ethz.ch
HCI D323
Martin.pabst@org.chem.ethz.ch http://www.analytik.ethz.ch/
Zusammenfassung der letzten Stunde:
1) Einteilung von Chromatographie-Techniken
Mobiler Phase (LC u. GC) – Stationärer Phase – Verwendung
2) Grundlegende Formeln Chromatographie3) Peakform (Elutionsprofil der Analyten von der Säule)
Gauss Peak
(Mittelwert und Standardab., FWHM)
• Verteilungskonstante Kc
:
KC = cS cM• Trennfaktor a: α = tR2−tM tR1−tM = ′ t R 2
′ t R1 = k2
k1 = KC 2 KC1
• Retentionsfaktor k: k=tR−tM
tM = t ′ R
tM =KC VS VM =KC
β
Relative Ret. zweier benachbarter Peaks Retention eines Peaks Verteilung zwischen zwei Phasen
Herbstsemester 2013 ETH Zurich | Dr. Thomas Schmid, Dr. Martin Pabst | martin.pabst@org.chem.ethz.ch 3
1) Symmetrische Peakverbreiterung – Einfluss auf Peakbreite Verbreiterung des Elutionsprofiles eines Analyten
2) Effizienz der Chromatographie Theoretische Böden
van Deemter Kurve
Skript ab S 25ff
mehrere hundert Peaks !!
Abweichungen von der idealen Peakform (Gauss Peak)
Zeit t asymmetrisch
symmetrisch
„übersättigen mobile Phase“ „überladen stat. Phase“
Herbstsemester 2013 ETH Zurich | Dr. Thomas Schmid, Dr. Martin Pabst | martin.pabst@org.chem.ethz.ch 5
Symmetrische Peakverbreiterung
tailing factor a/b = 1
Einflüsse auf die Peakbreite
Im Fall der idealen Peakform entspricht die Retentionszeit der mittleren Aufenthaltszeit der Moleküle eines Analyten in der Säule.
Warum eluieren nicht alle Analyten
zur exakt gleichen Zeit?
Herbstsemester 2013 ETH Zurich | Dr. Thomas Schmid, Dr. Martin Pabst | martin.pabst@org.chem.ethz.ch
Wie entsteht der Gauss Peak?
7
Damit sich das Gleichgewicht einstellen kann, muss ein Molekül mehrmals z.B. ...
• innerhalb der mobilen Phase diffundieren,
• die Phasengrenze erreichen,
• die Phasengrenze überqueren,
• in der stationären Phase diffundieren (GC),
• die Phasengrenze erreichen,
• die Phasengrenze durchqueren, usw.
Die Geschwindigkeiten der einzelnen Prozesse sind für jedes Molekül zufällig
verschieden!
Wie entsteht der Gauss Peak?
Manche Moleküle sind also “zufällig schneller”, manche “zufällig langsamer” als die Moleküle, welche exakt bei der für den Analyten typischen Retentionszeit die Säule verlassen.
Positive und negative Abweichungen von der Retentionszeit mitteln sich im Idealfall heraus.
Die Aufenthaltszeiten der einzelnen Moleküle sind symmetrisch um die Retentionszeit
verteilt.
……folglich ergibt sich ein Gauss Peak!
Herbstsemester 2013 ETH Zurich | Dr. Thomas Schmid, Dr. Martin Pabst | martin.pabst@org.chem.ethz.ch
Aufgliederung der Einflüsse auf die Peakbreite:
9
Peakverbreiternde Prozesse sind:
1) Eddy-Diffusion
2) Longitudinaldiffusion 3) Massentransport-Effekte
(Stofftransport-Effekte)
Eddy-Diffusion
Peakverbreiterung aufgrund von Weglängenunterschieden einzelner Moleküle in gepackten Säulen
http://www.chemgapedia.de/vsengine/media/vsc/de/ch/3/anc/croma/basics/saulen_chr/deemter/anschaul/eddydiff000di0300_neu.swf
aus: chemgapedia -- Grundlagen der Chromatographie
Herbstsemester 2013 ETH Zurich | Dr. Thomas Schmid, Dr. Martin Pabst | martin.pabst@org.chem.ethz.ch
Longitudinaldiffusion
11
Peakverbreiterung durch Diffusion der Analytenmokeküle in der mobilen Phase Nur der longitudinale Anteil (entlang oder entgegen der Strömungsrichtung) ist von
Bedeutung
http://www.chemgapedia.de/vsengine/media/vsc/de/ch/3/anc/croma/basics/saulen_chr/deemter/anschaul/diffusion000di0300_neu.swf
aus: chemgapedia -- Grundlagen der Chromatographie
Massentransport-Effekte
Peakverbreiterung aufgrund von Geschwindigkeitsunterschieden im Stofftransport von individuellen Molekülen
(z.B. Diffusion der Analyten in der mobilen Phase, Übergang zwischen mobiler und stationärer Phase)
http://www.chemgapedia.de/vsengine/media/vsc/de/ch/3/anc/croma/basics/saulen_chr/deemter/anschaul/stoffaus000di0300_neu.swf
aus: chemgapedia -- Grundlagen der Chromatographie
Herbstsemester 2013 ETH Zurich | Dr. Thomas Schmid, Dr. Martin Pabst | martin.pabst@org.chem.ethz.ch 13
Modell der theoretischen Böden
= Effizienz einer Trennung
Modell der theoretischen Böden
Je mehr theoretische Böden, desto mehr Gleichgewichtseinstellungen!
Ein theoretischer Boden ist jene
„theoretische räumliche Einheit“
einer Trennsäule in der sich
zumindest einmal das Nernst-
Gleichgewicht einstellen kann!
Herbstsemester 2013 ETH Zurich | Dr. Thomas Schmid, Dr. Martin Pabst | martin.pabst@org.chem.ethz.ch
Theoretische Böden
15
Je mehr theoretische Böden (N) oder je kleiner die Bodenhöhe (H), desto höher die Effizienz der Trennung!
• Anzahl der theoretischen Böden N:
Die Bodenzahl N hängt von der Retentionszeit eines Peaks und dessen Breite ab. Je breiter ein Peak, desto ineffizienter die Trennung.
• Bodenhöhe H:
H ist besser geeignet als N um Säulen verschiedener Länge L miteinander zu vergleichen
N= tR σ
2
=16⋅ tR wb
2
= 5.54⋅ tR w1/ 2
2
H = L N
Die van-Deemter-Gleichung
H = A + B
u + C u
Beiträge von
A: Eddy-Diffusion
B: Longitudinaldiffusion C: Massentransport-Effekte
Die van-Deemter-Gleichung beschreibt die Effizienz einer Trennung bzw. die Bodenhöhe H als Funktion der Lineargeschwindigkeit u.
Je grösser A, B und C, desto ineffizienter die Trennung.
Die Trenneffizienz hat bei der Lineargeschwindigkeit u ein Optimum, bei der H minimal wird.
Herbstsemester 2013 ETH Zurich | Dr. Thomas Schmid, Dr. Martin Pabst | martin.pabst@org.chem.ethz.ch
Die van-Deemter-Gleichung
17
H = A + B
u + C u
Beiträge von
A: Eddy-Diffusion
B: Longitudinaldiffusion C: Massentransport-Effekte
A-Term: Eddy-Diffusion
Verringerung der Effizienz aufgrund unterschiedlicher Weglängen der Analyten in einer gepackten Säule.
Unabhängig von der Lineargeschwindigkeit u. Als Funktion von u ergibt der A-Term eine zur x-Achse parallele Gerade.
LC: arbeitet mit gepackten Säulen, der A-Term ist hier also von Bedeutung.
GC: ist nur bei gepackten Säulen von Bedeutung, kann bei den meistens eingesetzten
Kapillarsäulen vernachlässigt werden.
A-Term
Konstanter Einfluss, abhängig von Material und Beschaffenheit der stat. Phase
Herbstsemester 2013 ETH Zurich | Dr. Thomas Schmid, Dr. Martin Pabst | martin.pabst@org.chem.ethz.ch
Je grösser der Diffusionskoeffizient des Analyten in der mobilen Phase (DM), desto grösser B:
LC: Kleine Diffusionskoeffizienten (DM < 10-5cm2s-1) in Flüssig- keiten, deshalb geringer Einfluss von B.
GC: Grosse Diffusionskoeffizienten (DM≈10-1 cm2 s-1) in Gasen, deshalb starker Beitrag von B an der Peakverbreiterung.
B-Term: Longitudinaldiffusion
19
Verringerung der Effizienz aufgrund der Diffusion der Analyten in der mobilen Phase (nur der longitudinale Anteil hat einen Einfluss).
B ∝ D
MB-Term = B x u Hyperbel
Indirekte Proportionalität, da bei langer Aufenthaltszeit der Moleküle in der Säule die Peakverbreiterung durch Diffusion grösser wird.
C-Term: Massentransport-Effekte
Verringerung der Effizienz aufgrund von Unterschieden in der Stofftransport- geschwindigkeit
C-Term = Cu Gerade
Direkte Proportionalität, da bei geringerer Geschwindigkeit u mehr Zeit für den Ablauf der Stofftransportprozesse bzw. zur Gleichgewichtseinstellung zur Verfügung steht.
C u = C
Su + C
Mu
CS, CM: Beiträge von stationärer und mobiler Phase LC: CSspielt bei gepackten Säulen keine Rolle
GC: bei Kapillarsäulen sind CS und CM von Bedeutung
C u ≈ C
Mu
CM ∝ 1 DMCS ∝ dS
DS = Schichtdicke stat. Phase
Diffusionskoeffizient in stat. Phase CM ∝ 1 DM
Herbstsemester 2013 ETH Zurich | Dr. Thomas Schmid, Dr. Martin Pabst | martin.pabst@org.chem.ethz.ch
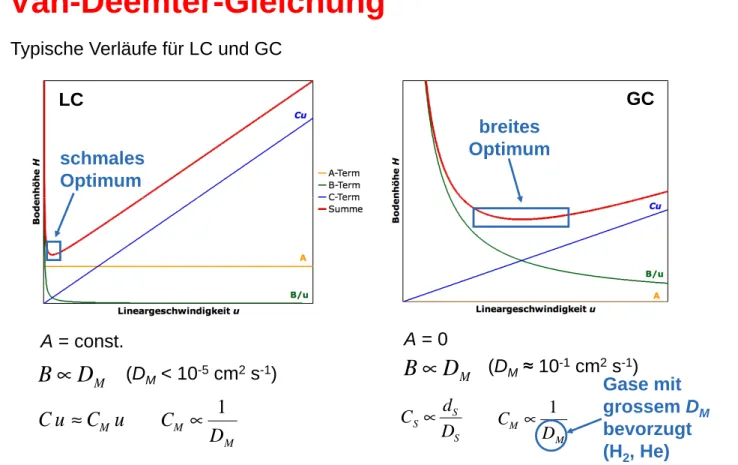
Van-Deemter-Gleichung
21
Typische Verläufe für LC und GC
LC GC
A = const. A = 0
B ∝ D
M (DM < 10-5 cm2s-1)B ∝ D
M (DM≈ 10-1cm2s-1)C u ≈ C
Mu
CM ∝ 1 DMCS∝ dS
DS CM ∝ 1 DM schmales
Optimum
breites Optimum
Gase mit grossem DM bevorzugt (H2, He)
Anzahl theoret. Böden N, Bodenhöhe H
Tab. 1: Typische Bodenzahlen N und Bodenhöhen H gängiger Säulen in der Gas- chromatographie (GC) und Hochleistungs-Flüssigchromatographie (HPLC) sowie typische Säulenparameter.
Säulen t y p N (pro Säu l e ) H (mm )
GC
Kapillarsäulen (25 m)
0.1 mm Innendurchmesser 0.5 mm Innendurchmesser gepackte Säulen (1-3 m)
30’000-100’000 20’000-50’000 500-2’000
0.2-0.6 0.5-1.3 1 - 6
HPLC
gepackte Säulen (25 cm) 10 µm-Partikel 3 µm-Part ik el
2’500-5’000 8’000-18’0 0 0
0.05-0.1 0.02-0. 0 5
Herbstsemester 2013 ETH Zurich | Dr. Thomas Schmid, Dr. Martin Pabst | martin.pabst@org.chem.ethz.ch
Anzahl theoret. Böden N, Bodenhöhe H
23
Tab. 2: Optimale und in der Praxis eingesetzte Lineargeschwindigkeiten und Fluss- raten in der Gaschromatographie (GC) und Hochleistungs-Flüssig- chromatographie (HPLC)
Technik / Säule Lineargeschwindigkeit [cm s-1]
Flussrate (Volumenstrom) [mL min-1]
Optimum In der Praxis Optimum In der Praxis GC
Kapillarsäule
(0.25 mm Innendurchmesser)
gepackte Säule
(4 mm Innendurchmesser)
30-40
2-4
60-80
4-8
1-2
40-50
1-4
40-80
HPLC
gepackte Säule
(4.6 mm Innendurchmesser) 0.05-0.1 0.1-0.2 0.2-0.5 1-2