Seite | 1 Philipps-Universität Marburg
Fachbereich 15: Chemie
Übungen im Experimentalvortrag Prof. Dr. B. Neumüller & Dr. Ph. Reiß Sommersemester 2013
Schriftliche Ausarbeitung des Experimentalvortrags zum Thema
Fette in der Schule
Langweilig oder spannender als ihr Ruf?
vorgetragen am 3. Juli 2013
Marcell Pausch
Quelle: www.chids.de
Seite | 2
Inhaltsverzeichnis
Didaktischer Hintergrund S. 3
Erläuterung zum Vorgehen und Einordnung in den schulischen Kontext
Einführung S. 4
Was sind Fette? Eine Definition.
V1 Fettlöslichkeit von β-Carotin (Definition von Lipiden)
Eigenschaften von Fetten S. 8
Eine experimentelle Annäherung an Fetteigenschaften V2 Lava Lampe (Dichte)
V3 Bromierung von Speiseöl – Nachweis der Doppelbindungen (Schmelzpunkt) V4 Fettbrand (Rauchpunkt)
Typische Reaktionen - Alkalische Hydrolyse S. 17 V5 Herstellung von Kernseife (Verseifung)
Raffination S. 21
Gewinnung und Raffinationsprozess von Fetten, Fetthärtung und Margarineherstellung V6 Fettextraktion nach Soxhlet
V7 Bleichung mit Aktivkohle V8 Herstellung von Margarine
Untersuchung von Speisefetten S. 31
Biodiesel S. 32
V9 Herstellung von Biodiesel
Seite | 3 Didaktischer Hintergrund
In dieser Ausarbeitung des Experimentalvortrags „Fette in der Schule – langweilig oder spannender als ihr Ruf?“ geht es zum einen um den fachlichen Aspekt der Fettchemie, zum anderen jedoch auch um eine mögliche Umsetzung des Themas im Schulunterricht.
Auf den ersten Blick wirken Fette als Thema für den Chemieunterricht etwas unscheinbar, manche sagen gar „langweilig“ im Vergleich zu Polymeren, Kohlenhydraten, Farb- oder Sprengstoffen. Auch im Studium kommen Lipide oft zu kurz, so dass das Thema schnell in Vergessenheit gerät. Und dennoch findet sich das Thema im Lehrplan des Landes Hessen in der Qualifikationsphase 2 direkt zu Beginn des Halbjahresthemas Naturstoffe.
Das Thema Fette stellt somit eine Einführung in die Naturstoffe dar. In dieser Arbeit soll die Fettchemie experimentell für den Schulunterricht aufgearbeitet werden, sodass die Leser sich ein eigenes Urteil zur obigen, provokant gestellten Frage fällen können.
Dabei wird aufgezeigt, dass Fette allgegenwärtig sind (z.B. Margarine, Kernseife, Biodiesel), die Fettchemie eine für die Schüler nicht allzu komplexe Chemie darstellt und viele Grundkenntnisse aus der Qualifikationsphase 1 angewandt und vertieft werden können (Triglyceride: Alkohole, Carbonsäuren, Ester; Fettbrand: Chemischer Flammenwerfer; Nachweis der Doppelbindungen in Öl: Bromierung an Alkene; Lava Lampe: Dichte von Ölen; …). So kann auch das tiefere chemische Verständnis in Bezug auf Alltägliches gefördert werden.
Die inhaltliche Reihenfolge dieser Arbeit ergibt sich aus dem Lehrplan: Der Schwerpunkt liegt auf dem ersten Teil: Bau, Eigenschaften, Reaktionen (Verseifung), Gewinnung, Verarbeitung und Fetthärtung. Zudem wird aufgrund der Aktualität und Brisanz des Themas auf Biodiesel eingegangen.
Q2 Fette Bau, Eigenschaften, Reaktionen;
Gewinnung und Verarbeitung Fetthärtung (Margarineherstellung) Untersuchung von Speisefett
z.B. Iodzahl, Verseifungszahl, Gehalt an gesättigten und ungesättigten Fettsäuren
Bedeutung für die Ernährung; Kosmetika
Q4 großtechnische vom Raps zum Biodiesel
Verfahren Auszug aus: Lehrplan Chemie (Hessen).
Seite | 4 Einführung
Das Wort Lipide stammt von dem griechischen Wort lipos = Fett. Dabei wird Fett manchmal den Lipiden gleichgesetzt, wobei die sogenannten Neutralfette eine Untergruppe der Lipide bezeichnen.
Unter Lipiden wird eine Vielzahl an Stoffen zusammengefasst, die sich nicht wie andere Stoffgruppen über ihre Struktur definieren, sondern über ihre chemischen Eigenschaften.
Lipide sind lipophil und damit gut in unpolaren Lösungsmitteln löslich.
Somit ist allen Lipiden ihr apolarer Charakter gemein. Sie können in vier Gruppen eingeteilt werden: Die nicht-verseifbaren Lipide, Wachse, Neutralfette und komplexe Lipide.
Die nicht-verseifbaren Lipide enthalten keine Ester-Gruppe und bestehen komplett oder zumindest überwiegend aus Kohlenwasserstoffen. Dazu zählt zum Beispiel eine Klasse natürlicher Farbstoffe, die Carotinoide. Sie sind mitverantwortlich für die charakteristisch orange-rote Farbe von Tomaten, Paprika und Karotten. Als Vorstufe des Vitamin A wird β-Carotin auch als Provitamin A bezeichnet. Und in der Tat bestehen auch einige andere Vitamine, aber auch Hormone aus Kohlenwasserstoffen und werden zu den nicht-verseifbaren Lipiden gezählt.
Abb. 1: Carotinoid-haltiges Gemüse (li), Strukturformel von β-Carotin (re).
Wachse sind Mono-Ester einer langkettigen Carbonsäure (Fettsäure) und eines langkettigen Alkanols (Fettalkohol). Bienenwachs besteht aus einer C26-Fettsäure und einem C30-Fettalkohol. Wachse sind in der Regel bei Raumtemperatur fest und kommen in der belebten Natur aufgrund ihrer wasserabweisenden Wirkung in Form von dünnen Wachsschichten vor (z.B. auf Blättern, Außenskelett von Insekten, Federn von Vögeln).
Abb. 2: Bienenwaben (li), Beispiel-Strukturformel eines Wachses (re).
O O
Seite | 5 Die Triacylglycerine, Triglyceride, Neutralfette oder einfach Fette und fetten Öle bilden die dritte Gruppe der Lipide, zu denen eben genau die in der Küche zum Einsatz kommenden Fette und Öle gezählt werden. Chemisch gesehen handelt es sich um einen Tri-Ester des Alkohols Glycerin (Propan-1,2,3-triol) und von drei, meist unterschiedlichen Fettsäuren. Fette sind bei Raumtemperatur fest oder halbfest, da sie überwiegend gesättigte Fettsäuren enthalten, also Fettsäuren deren C-Atome keine Doppelbindungen aufweisen. Diese Fette sind meist tierischen Ursprungs. Im Gegensatz dazu sind Öle bei Raumtemperatur per Definition flüssig, da sie überwiegend ungesättigte Fettsäuren mit mindestens einer Doppelbindung aufweisen. Diese sind häufig pflanzlichen Ursprungs.
Abb. 3: Butter und Speiseöl (li), Strukturformel eines Triglycerids (re).
Zu den komplexen Lipiden zählen Phospholipide, die wie die Neutralfette aus dem Tri-Alkanol Glycerin bestehen, wobei nur zwei der drei OH-Gruppen mit Fettsäuren verestert sind. Die dritte OH-Gruppe ist mit einem Phosphocholin-Rest verestert. Diese bilden einen Hauptbestandteil unserer Zellmembranen, in dem sie sich zu Lipid-Doppelschichten (Bilayer) zusammenlagen und so für Stabilität und Fluidität sorgen.
Abb. 4: Eigelb (li), Strukturformel eines Phospholipids (re).
Die Definition von Lipiden kann entweder anhand des ersten Versuchs untersucht oder mit diesem Vorwissen überprüft werden ( V1). Lipide sind lipophil und gut miteinander mischbar.
C H2
C H
C H2
O O
O O
O
O
N+
O P
O O O-
C
H2 CH CH2
O O
O O
Seite | 6
V1 Fettlöslichkeit von β-Carotin
1Mischbarkeit unpolarer Stoffe
Chemikalien
Tab. 1: Verwendete Chemikalien.
Eingesetzte
Stoffe Summen-
formel Menge H-Sätze P-Sätze Gefahren-
symbole Schul- einsatz
dest. Wasser H2O ca. 100 mL - - - -
Karotten - 1 - - - -
Speiseöl - 2 x 2 mL - - - -
Geräte Reibe, Spatel
2 Bechergläser (250 mL)
Reagenzglasständer, 2 Reagenzgläser, 1 Stopfen Pipetten mit Hütchen
Aufbau
Abb. 5: Experimenteller Versuchsaufbau.
Durchführung
Eine Karotte wird geraspelt, die Streifen in ein Becherglas (250 mL) überführt und das Becherglas mit Wasser aufgefüllt. Das Karottenwasser kann direkt in zwei Reagenzgläser überführt werden. Beide Reagenzgläser werden anschließend mit Speiseöl überschichtet.
Ein Reagenzglas wird kräftig geschüttelt und ein paar Minuten stehen gelassen. Nach erneuter Phasentrennung werden beide Reagenzgläser miteinander verglichen.
Tipp: Das Karottenwasser sollte nicht zu hoch konzentriert sein und kann noch verdünnt werden. Der Anteil Karottenwasser zu Speiseöl im Reagenzglas sollte etwa bei 2:1 liegen.
1 Vgl. Adam, K.: Fettlöslichkeit von β-Carotin.
URL: http://www.chids.de/dachs/wiss_hausarbeiten/FetteundOele_Adam.pdf.
Speiseöl
Karotten- wasser
Seite | 7 Beobachtung
Zunächst kommt es zur Bildung von zwei Phasen: Bei der unteren, trüb-orangefarbenen Phase handelt es sich um das Karottenwasser. Das Speiseöl ist klar, hellgelb und setzt sich als obere Phase ab. Nach dem Schütteln bildet sich kurzzeitig eine Emulsion, die sich langsam wieder trennt. Nach etwa 5 Minuten haben sich die zwei Phasen erneut ausgebildet, wobei die obere Phase an Volumen, Farbintensität und Trübung zunimmt.
Die untere Phase hingegen verliert an Volumen, Farbintensität und Trübung.
Abb. 6: Beobachtungen des Verlaufs.
Entsorgung
Alle anfallenden Abfälle können über den Abguss und den Hausmüll entsorgt werden.
Auswertung
Der farbgebende Stoff von Karotten und folglich des Karottenwassers ist β-Carotin, das aufgrund der konjugierten -Elektronen eine orangene Farbe aufweist. Es handelt sich um ein nicht-verseifbares Lipid. Auch Speiseöl ist ein Lipid und besteht aus Triacylglyceriden. Beide Stoffe sind nicht polar und nach der Definition gut untereinander mischbar.
Triacylglycerid β-Carotin
C H2
C H
C H2
O O
O O
O
O
Seite | 8 Das Speiseöl hat eine geringere Dichte als Wasser, sodass die ölige Phase zunächst über dem Karottenwasser zu liegen kommt. Durch das Schütteln werden beide Phasen vermischt, wobei sich ein Großteil des β-Carotins im Speiseöl löst, sodass dieses an Farbintensität und Volumen zunimmt. Dieser Versuch verdeutlicht damit die Definition der Lipide, die als apolare Stoffe gut untereinander mischbar sind.
Damit der menschliche Körper das wichtige β-Carotin besser aufnehmen kann, soll Karottensalat deshalb mit Öl-Dressing zu sich genommen werden.
Eigenschaften
In folgendem Abschnitt sollen die Eigenschaften von Fetten und Ölen anhand kleiner Versuche genauer untersucht werden.
Eine Eigenschaft wird in Versuch 1 indirekt -ohne es bewusst zu merken- mitbeobachtet, nämlich, dass Öl auf Wasser schwimmt und folglich eine geringere Dichte als dieses ( ) haben muss. Das ist den Schülern vom Spagetti-Wasser, Suppen oder Essig-Öl-Dressings auch bereits bekannt und fällt deshalb in der Regel nicht auf.
In Versuch 2 könnten die Schüler zuvor überlegen, was passiert, wenn ein mit Öl ge- füllter Kolben mit Wasser überschichtet wird (1. Annahme: Das Öl steigt direkt auf).
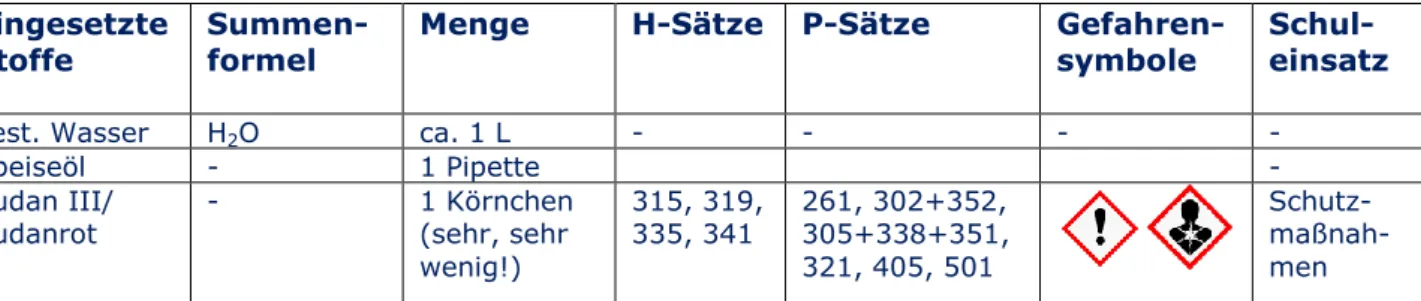
V2 Lava Lampe
2Dichte von Speiseöl
Chemikalien
Tab. 2: Verwendete Chemikalien.
Eingesetzte Stoffe
Summen- formel
Menge H-Sätze P-Sätze Gefahren- symbole
Schul- einsatz
dest. Wasser H2O ca. 1 L - - - -
Speiseöl - 1 Pipette -
Sudan III/
Sudanrot - 1 Körnchen
(sehr, sehr wenig!)
315, 319,
335, 341 261, 302+352, 305+338+351, 321, 405, 501
Schutz- maßnah- men
2 Vgl. Versuch des CHEMIKUM Marburg.
Seite | 9 Geräte
Becherglas (2 L), Enghals-Erlenmeyerkolben (25 mL), Becherglas (100 mL), Spatel, Tropfpipette mit Hut, Wasserbecher z.B. Becherglas (1 L)
Spülmittel, Kochsalz (Natriumchlorid)
Aufbau
Abb. 7: Experimenteller Versuchsaufbau.
Durchführung
Ein Erlenmeyer-Kolben mit sehr engem Hals wird zu ¾ mit Speiseöl gefüllt, mit einem Körnchen Sudanrot versetzt (sehr wenig) und das Öl mit einem Spatel gerührt, bis es gleichmäßig angefärbt ist. Der Kolben wird bis zum oberen Rand komplett mit Speiseöl aufgefüllt und in ein hohes Becherglas (vorzugsweise 2 L) gestellt.
Anschließend wird das Becherglas mit Wasser gefüllt. Es ist darauf zu achten, dass das Wasser nicht direkt auf die Öffnung des Kolbens gelangt, sondern am Rand eingefüllt wird. Es wird beobachtet.
Es wird Spülmittel mit Wasser verdünnt (1:1) und eine Pipette voll aufgesogen (ca.
1 mL). Die Pipettenöffnung wird unmittelbar oberhalb der Erlenmeyer-Öffnung platziert und das verdünnte Spülmittel dort zugesetzt. Es wird erneut beobachtet.
Zuletzt wird großzügig Kochsalz in das 2L-Becherglas gestreut. Es wird erneut beobachtet.
Seite | 10 Beobachtung
Es ist zu beobachten, dass Sudanrot das Speiseöl rot anfärbt. Bei der Zugabe von Wasser gelangt in dem Moment ein Tropfen Öl aus dem Erlenmeyer-Kolben heraus, indem das Wasser etwa die gleiche Füllhöhe wie die Kolben-Öffnung hat. Sobald der Kolben mit mehr Wasser überschichtet wird, verbleibt das angefärbte Speiseöl im Kolben.
Durch den Zusatz von Spülmittel fließt das angefärbte Öl komplett aus dem Kolben an die Oberfläche und es entstehen zwei Phasen. Nach dem Zusatz von Speisesalz sinken einige Öltropfen von der Oberfläche kurzzeitig ab und steigen rasch wieder auf.
Abb. 8: Beobachtungen des Verlaufs.
Entsorgung
Das Öl wird abgetrennt und im Behälter für Lösungsmittelabfälle entsorgt. Wasser wird kanalisiert.
Auswertung
Die Färbung des Öls beruht lediglich auf dem zugesetzten Farbstoff Sudanrot, der durch ein konjugiertes -System rot gefärbt ist. Er ist lipophil und löst sich deshalb gut im Speiseöl. Die zugegebenen Mengen sind so gering, dass sie keine nennenswerten Auswirkungen auf das Ergebnis des Experimentes haben und es lediglich wegen des Farbeffekts zugesetzt wird.
Obwohl bekanntlich Öl „auf Wasser schwimmt“, steigt das Öl nicht direkt an die Wasseroberfläche auf. Das liegt an den Wasserstoffbrückenbindungen. In dem Moment, indem sich die Öffnung des Kolbens auf der Höhe der Wasserfüllhöhe befindet, gelangt
N N
N
N
O H
Sudanrot
Seite | 11 tatsächlich ein kleiner Teil des Öls aus dem Kolben hinaus. Sobald sich jedoch eine genügend hohe Wassersäule auf dem Kolben gebildet hat, sind die Kräfte der H- Brückenbindungen so stark, dass das Öl nicht dagegen ankommen kann und es verbleibt im Kolben. Die H-Brückenbindungen und Oberflächenspannung des Wassers sind den Schülern aus der Mittelstufe und vom Wasserläufer oder „übervoll gefüllten“
Wassergläsern bereits bekannt.
Wenn Spülmittel zugesetzt wird, so werden die H-Brücken zerstört und das Öl fließt an die Wasseroberfläche und setzt sich oberhalb davon ab. Dies sieht aus wie eine Lava- Lampe. Durch die Zugabe von Salz werden einzelne Öltropfen mit dem Salz nach unten gesogen, wo sich das Salz löst und die Öltropfen steigen wieder nach oben.
Abb. 9: Wasserläufer (li), „übervoll gefülltes“ Glas (mi), H-Brückenbindungen (re).
Dieser sehr schön anzusehende Versuch zeigt auf, dass die Dichte von Ölen zwar unter der Dichte von Wasser liegt, aber die Dichte der Öle nicht deutlich geringer ist. Sie liegt, je nach Öl bei meist p = 0,90 – 0,95 g/cm3 und damit beispielsweise deutlich oberhalb von anderen organischen Verbindungen wie Ethanol (p = 0,79 g/cm3).
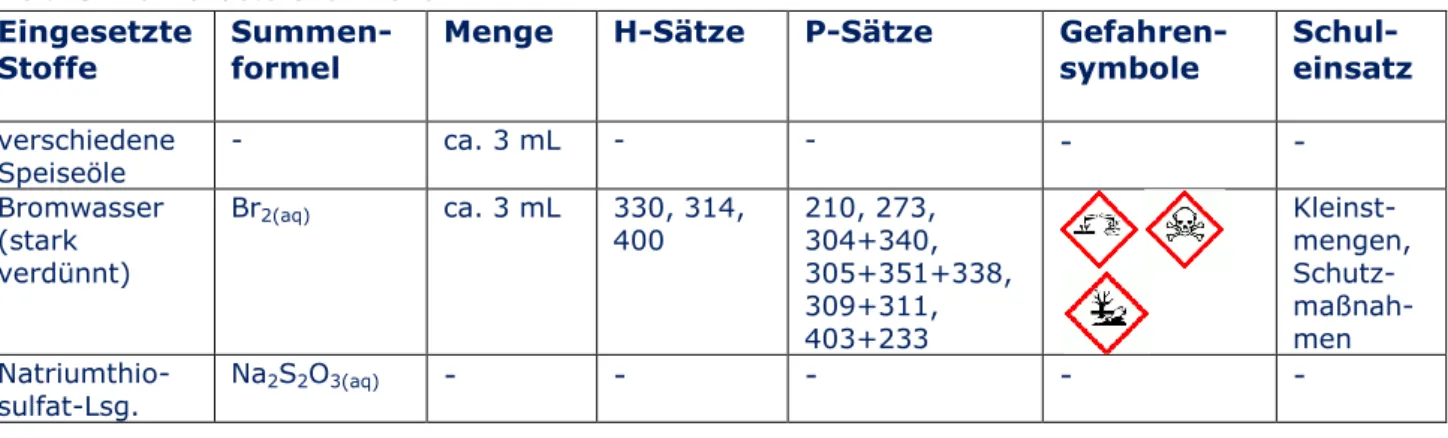
V2 Bromierung von Speiseöl
3Nachweis der Doppelbindungen
Chemikalien
Tab. 3: Verwendete Chemikalien.
Eingesetzte
Stoffe Summen-
formel Menge H-Sätze P-Sätze Gefahren-
symbole Schul- einsatz verschiedene
Speiseöle - ca. 3 mL - - - -
Bromwasser (stark verdünnt)
Br2(aq) ca. 3 mL 330, 314,
400
210, 273, 304+340, 305+351+338, 309+311, 403+233
Kleinst- mengen, Schutz- maßnah- men Natriumthio-
sulfat-Lsg.
Na2S2O3(aq) - - - - -
3 Vgl. Kreher, R., Schmidkunz, H.: Nachweis der Doppelbindung in Olivenöl. In: CHEMKON. 4/2010. S 172 V3.
O H
H
O H
H
Seite | 12 Geräte
Reagenzglasständer, Reagenzglas, Tropfpipette mit Hut, Bechergläser, Spatel, Waage
Aufbau
Abb. 10: Experimenteller Versuchsaufbau.
Durchführung
Im Abzug! Thiosulfat-Lösung bereit halten! In einem Reagenzglas wird ein Speiseöl vorgelegt und tropfenweise stark verdünntes Bromwasser hinzugegeben.
Beobachtung
Es ist zu beobachten, dass die Bromwasser-Tropfen langsam durch das Öl an den Boden des Reagenzglases sinken und sich das Bromwasser teilweise entfärbt. Es entstehen drei Phasen: Eine untere, wässrige Phase; eine obere, ölige Phase sowie in der Mitte eine feste, weiß-gelbe Phase.
Abb. 11: Beobachtung des Reaktionsverlaufs.
AgNO3
0,05 M
Brom- wasser Olivenöl
Bromwasser
Na2S2O3- Lösung
Seite | 13 Entsorgung
Das Bromwasser wird mit Natriumthiosulfat-Lösung umgesetzt und alle mit Bromwasser in Berührung gekommenen Geräte mit Natriumthiosulfat-Lösung gespült.
Auswertung
Die in Olivenöl am häufigsten vorkommende Fettsäure ist die sogenannte Ölsäure, eine C18-Carbonsäure, die vom Kettenende gezählt am neunten C-Atom eine Doppelbindung aufweist. Es handelt sich um eine ω-9-Fettsäure.
Der diesem Versuch zugrunde liegende Mechanismus ist eine elektrophile Addition, indem Brom an die Doppelbindung der Ölsäure addiert wird. Dieser Mechanismus ist Schülern von den Alkenen bereits aus der Q1 bekannt.
Das Brom-Molekül nähert sich der Doppelbindung an und wird polarisiert, sodass sich ein π-Komplex ausbildet. In einem konzertierten Schritt wird das Brom-Molekül heterolytisch gespalten und das partialpositiv polarisierte Brom-Atom an die Doppelbindung addiert. Es entsteht ein Bromonium-Ion. Das verbleibende Brom-Anion greift nucleophil von der Rückseite an einem der beiden C-Atome der ehemaligen Doppelbindung an.
Entsprechend geht das Brom-Atom des Bromonium-Ions zum anderen C-Atom der ehemaligen Doppelbindung. Es entsteht die jeweilige R,R- oder S,S-Dibromstearinsäure.
O H
O Ölsäure
C8H17 HOOC(H14C7)
H H
+
Br Br BrBr
C8H17 HOOC(H14C7)
Br+
H H
Br-
C8H17 HOOC(H14C7)
H H
C8H17 HOOC(H14C7)
Br
Br H
H
Ölsäure Brom - Komplex Bromonium-Ion
(9S,10S)- Dibromstearinsäure
C8H17 HOOC(H14C7)
H Br H
Br
Dibromstearinsäure oder
(9R,10R)-
Seite | 14 Somit wird Brom an die Doppelbindungen addiert und das Öl teilweise fest und quasi
„gehärtet“. Damit gelangen die Schüler zu der Erkenntnis, dass Öle und Fette aufgrund der Doppelbindungen der Fettsäuren flüssig oder fest sind. Fette sind Fette, wenn die beteiligten Fettsäuren überwiegend ungesättigt sind. Je größer der Anteil an ungesättigten Fettsäuren ist, desto niedriger ist der Schmelzpunkt der Fette und sie werden in flüssiger Form fette Öle genannt.
Dies lässt sich mit einem schönen Modell veranschaulichen: Wenn sich die Fettsäuren als Streichhölzer vorgestellt werden, ist es schnell ersichtlich, dass viele „gerade“
Streichholzer dicht gepackt in einem Raum (der Streichholzschachtel) nebeneinander vorliegen können. Durch Van-der-Waals-Wechselwirkungen entstehen relativ feste Fette.
Doppelbindungen sorgen jedoch für einen „Knick“ der Fettsäuren bzw. Streichhölzer.
Entsprechend weniger gut können ungesättigte Fettsäuren auf den gleichen Raum gepackt werden. Je ungesättigter die Triglyceride sind, desto flüssiger werden sie.
Abb. 12: Ungesättigte Fettsäuren (li), gesättigte Fettsäuren (re).
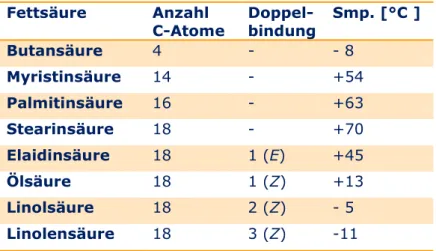
Dieses Ergebnis zeigt auch ein Vergleich der Schmelzpunkte unterschiedlicher Fettsäuren.
Je längerkettig eine Fettsäure ist, desto höher liegt ihr Schmelzpunkt. Dieser sinkt jedoch mit zunehmender Anzahl an Doppelbindungen rapide, besonders in Z-Konfiguration.
Tab. 4: Schmelzpunkte unterschiedlicher Fettsäuren im Vergleich.
Fettsäure Anzahl
C-Atome Doppel-
bindung Smp. [°C ]
Butansäure 4 - - 8
Myristinsäure 14 - +54 Palmitinsäure 16 - +63 Stearinsäure 18 - +70 Elaidinsäure 18 1 (E) +45 Ölsäure 18 1 (Z) +13 Linolsäure 18 2 (Z) - 5 Linolensäure 18 3 (Z) -11
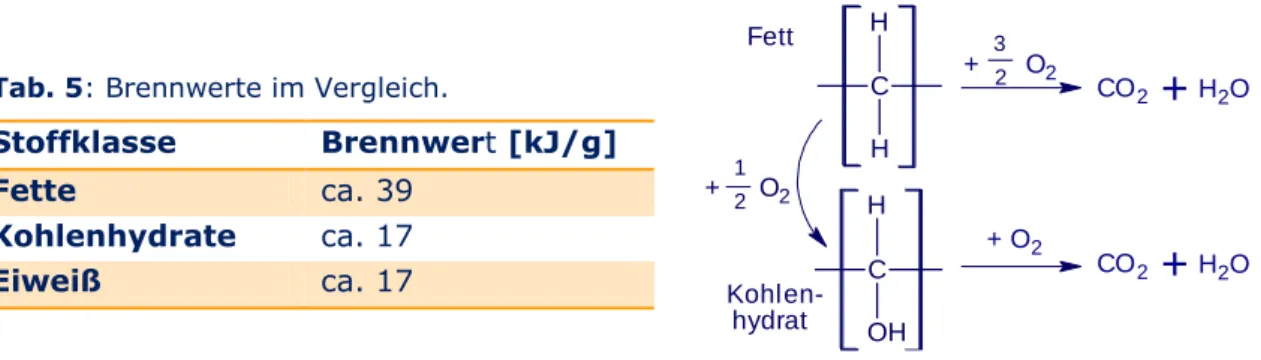
Seite | 15 Es stellt sich noch die Frage, zu welchem Zweck es Fette überhaupt gibt bzw. wo sie in der Natur vorkommen. Da es sich um schlechte Wärmeleiter handelt dienen sie bei Großsäugetieren zum einen der Wärmeisolation, zum anderen aber auch zum mechanischen Schutz der inneren Organe. Außerdem sind Fette langfristige Energiespeicher, wobei Kohlenhydrate bereits die teiloxidierte Form auf dem Weg zu CO2
und H2O darstellen. Kohlenhydrate sind im Gegensatz zu Fetten osmotisch wirksam.
Allerdings kann aus Fetten nicht so schnell Energie freigesetzt werden, sodass beide ihre Berechtigung haben.
Tab. 5: Brennwerte im Vergleich.
Stoffklasse Brennwert [kJ/g]
Fette ca. 39 Kohlenhydrate ca. 17 Eiweiß ca. 17
Der Begriff des Brennwertes ist im Übrigen historisch bedingt und kommt tatsächlich vom Brennvermögen der jeweiligen Stoffe. Deswegen wird im kommenden Versuch Öl angezündet (Vorsicht, Anweisungen genau befolgen!).
V4 Fettbrand
4Rauchpunkt
Chemikalien
Tab. 6: Verwendete Chemikalien Eingesetzte
Stoffe Summen-
formel Menge H-Sätze P-Sätze Gefahren-
symbole Schul- einsatz
Speiseöl - 4 Tropfen - - - -
dest. Wasser H2O Spritzer - - - -
Geräte
Dreifuß mit Drahtnetz, Teelicht-Form aus Aluminium, Becherglas (100 mL), Tropfpipette mit Hut, Bunsenbrenner mit Feuerzeug, Spritzflasche
4 Verändert nach: Prof. Blume: Friteusenbrand. http://www.chemieunterricht.de/dc2/gefahr/gefv_02.htm C
H
H
C H
OH + O2
+ O2
+ O2
CO2 H2O
3 2
1 2
+
CO2
+
H2O FettKohlen- hydrat
Seite | 16 Aufbau
Abb. 13: Öl erhitzen (li) und Brand löschen (re).
Durchführung
Zur Durchführung des Versuchs werden etwa 4 – 5 Tropfen Speiseöl in eine Alu- Teelichtform pipettiert, über dem Brenner erhitzt und der entstehende Brand aus sicherer Entfernung mit einem Spritzer Wasser aus der Spritzflasche gelöscht.
Beobachtung
Es ist zu beobachten, dass das Öl durch Erhitzen schnell anfängt zu rauchen und sich schließlich entzündet. Bei dem Versuch den Brand mit Wasser zu löschen kommt es zur Bildung eines kleinen Feuerballs.
Abb. 14: Löschversuch eines Fettbrandes mit Wasser (hier: größere Öl-Menge).
Entsorgung
Die Alu-Schale kann wiederverwendet oder im Behälter für Feststoffabfälle entsorgt werden.
Auswertung
Fette beginnen ab einer bestimmten Temperatur zu rauchen – je nach Zusammensetzung an Fettsäuren kann dieser Rauchpunkt z.B. bei 200 °C oder 300 °C liegen. Da das Fett eine höhere Temperatur als das Wasser aufweist, verdampfen die Wassertropfen beim Einsinken in das heiße Öl schlagartig.
Speiseöl
Speiseöl
Seite | 17 Beim Übergang in die Gasphasen nimmt Wasser um das 1700fache an Volumen zu, sodass es bei der Volumenexpansion aus der Schale verpufft und dabei das heiße Öl mitreißt. Dieses Öl liegt dann fein verteilt an der Luft vor. Da das Öl immernoch sehr heiß ist, entzündet es sich an der Luft selbst. Es entsteht ein Feuerball, der je nach Ölmenge unterschiedlich groß werden kann.
Dass das Öl anfängt zu rauchen kann auch in der heimischen Küche passieren, wenn das Öl überhitzt wird. Dieses sollte unter gar keinen Umständen versucht werden mit Wasser zu löschen, sondern stattdessen erstickt werden!
Typische Reaktionen
Die für Fette typische Reaktion ist die alkalische Hydrolyse (Verseifung). Dieser Reaktionstyp wird auch explizit in den Handreichungen für die Abiturprüfungen des Landes Hessen aufgeführt!
V5 Herstellung von Kernseife5
Verseifung Chemikalien
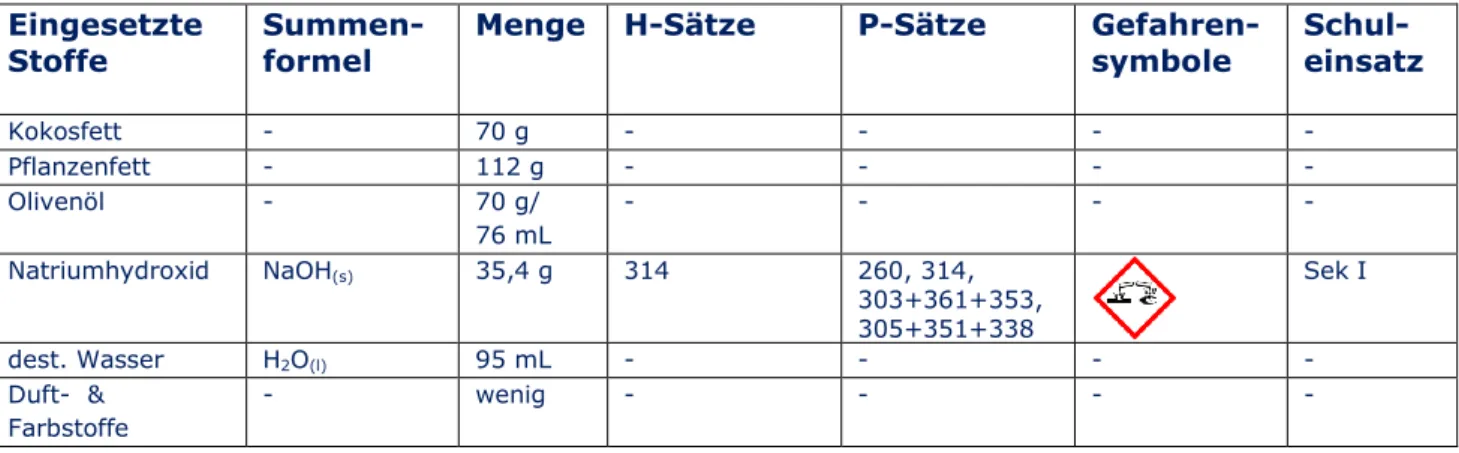
Tab. 7: Verwendete Chemikalien.
Eingesetzte
Stoffe Summen-
formel Menge H-Sätze P-Sätze Gefahren-
symbole Schul- einsatz
Kokosfett - 70 g - - - -
Pflanzenfett - 112 g - - - -
Olivenöl - 70 g/
76 mL
- - - -
Natriumhydroxid NaOH(s) 35,4 g 314 260, 314,
303+361+353, 305+351+338
Sek I
dest. Wasser H2O(l) 95 mL - - - -
Duft- &
Farbstoffe
- wenig - - - -
Geräte
2 Bechergläser (500 mL, 250 mL), 2 Magnetrührer mit Heizplatte, ggf. Thermometer, Messzylinder oder Messbecher, Waage, Messer, Pürierstab, Form (Margarineverpackung)
5 Vgl. Hennies, C., Pracht, C.: Seife – auch daheim leicht herzustellen. In PdN 2001 6/50. S. 8f.
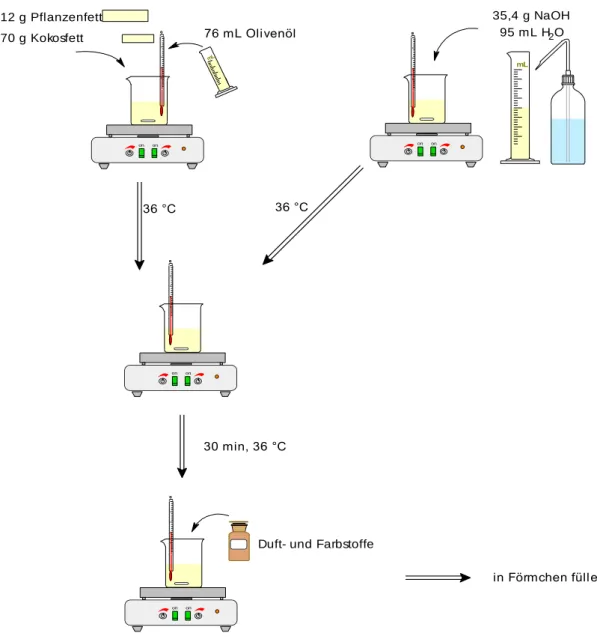
Seite | 18 Aufbau
on on mL
mL
112 g Pflanzenfett
70 g Kokosfett 76 mL Olivenöl
35,4 g NaOH 95 mL H2O
36 °C
on on on on
36 °C
30 min, 36 °C
on on
Duft- und Farbstoffe
in Förmchen füllen
Abb. 15: Experimenteller Versuchsaufbau.
Durchführung
In einer Küche mit Küchenutensilien! In einem Becherglas werden 112 g Pflanzenfett, 70 g Kokosfett und 76 mL Olivenöl bei 36 °C erwärmt. In einem zweiten Becherglas werden 35,4 g Natriumhydroxid in 95 mL dest. Wasser gelöst. Sobald die Fette ein homogenes Gemisch bilden und die Natronlauge (w 0,27) angesetzt ist, wird die Natronlauge langsam unter Rühren zu dem Fettgemisch gegeben. Es wird für weitere 30 min bei 36 °C gerührt, bis die Mischung dickflüssig wird. Der Ansatz kann auch kurz (20 sec) mit einem Pürierstab durchmischt werden. Anschließend können Duft- und Farbstoffe (wenige Gramm/ Milliliter) hinzugegeben werden und nach erneutem Verrühren in eine nicht Alu-beschichtete Form gegeben werden. Die Form wird mit Haushaltstüchern abgedeckt.
Seite | 19 Am nächsten Tag kann der entstandene Seifenblock in kleinere Stücke geschnitten werden. Nach bis zu 6 Wochen ist der Verseifungsprozess vollständig abgeschlossen.
Nach dem Prüfen des pH-Wertes (pH = 8 - 10) können die Seifen verwendet werden.
Liegt der pH-Wert darüber, sollte die Seife nicht verwendet werden.
Beobachtung
Die Fette bilden beim Erwärmen ein homogenes Gemisch. Bereits am nächsten Tag ist die Seife formstabil, aber noch sehr weich und stark alkalisch.
Abb. 16: Reaktionsverlauf.
Entsorgung
Die erhaltene Seife kann bei einem pH-Wert von 8 – 10 verbraucht werden.
Auswertung
In diesem Versuch wird Kernseife nach dem Verfahren der Neutralölverseifung von unterschiedlichen Fetten mit Natronlauge hergestellt. Der Verseifungsprozess ist dabei recht langsam und dauert etwa 6 Wochen bis er völlig abgeschlossen ist und die Seife verwendet werden kann.
Dazu wird ein Fettgemisch aus Kokosfett, Olivenöl und Backfett verwendet. Schon bei den einzelnen Fetten handelt es sich häufig um Stoffgemische, die aus dem dreiwertigen Alkohol Glycerin bestehen und über die drei Hydroxygruppen mit unterschiedlichen Fettsäuren verestert sind. Beim verwendeten Kokosfett handelt es sich ausschließlich um
Seite | 20 Palmitinsäure (C15H31COOH), bei Olivenöl überwiegend um Ölsäure (C17H31COOH) und bei dem Backfett um unterschiedliche Fettsäuren. Eine Verseifung bezeichnet die irreversibel verlaufende basische Hydrolyse eines Esters. Sie findet an allen drei Esterfunktionen statt. Durch Verwendung von Natronlauge als Base entsteht dabei Kernseife. Hier die Reaktion im Überblick: Die Esterbindungen der Fette (Triester) werden durch die Zugabe von Natronlauge gespalten. Es entstehen neben Glycerin noch die Natriumsalze (Carboxylate) der jeweiligen Fettsäuren.
Der Mechanismus wird nun im Detail betrachtet. Damit die Übersichtlichkeit bewahrt bleibt, wird der Mechanismus nur für eine Estergruppe aufgeführt. Da Fette drei Esterfunktionen aufweisen, findet die Reaktion dreimal am gleichen Molekül statt. Zu Beginn der Reaktion steht der nucleophile Angriff des Hydroxids am partial-positiven Carbonyl-C-Atom der Esterfunktion. Ein Elektronenpaar klappt von der C=O- Doppelbindung zum O-Atom aufgrund seiner höheren EN hoch, sodass eine tetraedrische Zwischenstufe entsteht. Durch das Zurückklappen des Elektronenpaares wird ein Alkoholat abgespalten, das negativ geladen ist und somit eine starke Lewis-Base darstellt. Da Carbonsäuren nur sehr schwache Säuren sind, entzieht das negativ geladene O-Atom der Carbonsäure ein Proton: Es entsteht irreversibel der Alkohol (Glycerin) sowie ein Carboxylat (Natriumsalz der Fettsäure).
R1 O
O R
O-H
R1 O-
O R
O H
Ester Hydroxid-Ion tetraedrische Zw ischenstufe
R1 O
O H O-
R
+
Alkoholat Carbonsäure
R1 O
O- O
R H
+
Alkohol Salz der Fettsäure (Glycerin)
C H
C H2
C H2
O O O
C
C
C O
O
O R1
R2
R3
+ 3 NaOH(aq)
C H
C H2
C H2
OH OH OH
+
Na+ O- C
R1 O
Na+ O- C
R2 O
Na+ O- C
R3 O
Triacylglycerin Natronlauge Glycerin Natriumsalze der Fettsäuren
Seite | 21 Die Wirkung von Seife:
Kernseife besteht folglich aus Tensiden, die einen hydrophilen Kopf und eine lipophile Kohlenwasserstoffkette haben.
Abb. 17: Darstellung eines Tensids.
Sie sind amphiphil und somit in der Lage sich an Öl und Wasser mit der jeweiligen Ausrichtung anzulagern: Öl in Wasser kann deshalb von Seife emulgiert werden. Dabei bilden sich von Tensiden umgebene Öltröpfchen im Wasser, sogenannte Micellen. Es entsteht eine Öl-in-Wasser Emulsion.
Abb. 18: Bildung einer Öl-in-Wasser-Emulsion.
Fettraffination
Den ersten Schritt der Raffination von Fetten stellt die Fettgewinnung dar: Tierische Fette können entweder ausgeschmolzen oder im Fall von Milch durch Zentrifugieren gewonnen werden. Für den schulischen Unterricht bietet sich hingegen das Gewinnen von pflanzlichen Ölen an: Diese können entweder kaltgepresst oder extrahiert (warm/kalt) werden.
Kaltpressung Kalte Extraktion Warme Extraktion
Öl Wasser
on on on on
oC 100.4
Seite | 22
V6 Fettextraktion nach Soxhlet
6Chemikalien
Tab. 8: Verwendete Chemikalien.
Eingesetzte
Stoffe Summen-
formel Menge H-Sätze P-Sätze Gefahren-
symbole Schul- einsatz n-Heptan C7H16(l) 1,25-
faches Hülsen- volumen
225, 304, 315, 336, 410
210, 273, 301+310, 331, 302+352, 403+235
Schutz- maßnah- men, Sek II gemahlene
Mandeln/
alternatives Extraktions- material
- ¾ Hülse,
z.B. 50 g - - - -
Geräte
Hebebühne, Heizrührer mit Fisch, Ölbad mit Fisch, Thermometer, Rundkolben (250 mL), Soxhlet-Aufsatz mit Extraktionshülse, Watte, Rückflusskühler, Stativmaterial, Wasserschläuche mit Klemmen und Wasserwächter
Aufbau
Abb. 19: Experimenteller Versuchsaufbau.
6 Vgl. Heimann, R., Greiwe, R.: Extraktion von Kokosnussfett. In: PdN-ChiS. Heft-Nr. 7/ 2007. S. 34f.
Seite | 23 Durchführung
Die Hülse des Soxhlet-Aufsatzes wird mit dem Extraktionsmaterial zu ¾ befüllt und mit einem Wattebausch verschlossen. Die Hülse wird in den Aufsatz gestellt. In einen Rundkolben wird ein Volumen an Lösungsmittel (z.B. n-Heptan) gefüllt, die die Hülse zu 5/4 füllen würde. Die Apparatur wird gemäß Abb. 19 aufgebaut, in aufsteigender Reihenfolge: Hebebühne, Magnetrührer, Ölbad, Rundkolben mit Fisch, Soxhlet-Aufsatz, Rückflusskühler, KEIN Stopfen! Aus dem erhaltenen Extrakt wird das Lösungsmittel am Rotationsverdampfer entfernt.
Es wird bei 120 °C (für Heptan) erhitzt und unter Rückfluss gekühlt.
Beobachtung
Sobald das Lösungsmittel zu sieden beginnt, steigen Dämpfe auf, die einmal um die Hülse herum geleitet werden, am Rückflusskühler kondensieren und in die Hülse tropfen.
Sind Hülse und Heberrohr völlig mit Flüssigkeit gefüllt, sodass die Flüssigkeit am Heberrohr den oberen Scheitelpunkt erreicht, fließt die gesamte Flüssigkeit zurück in den Rundkolben. Die Hülse füllt sich kurze Zeit später erneut und dieser Vorgang wiederholt sich aufs Neue.
Abb. 20: Aufbau (li), Extrakt (oben re), Mandelöl (unten re).
Entsorgung
Das Lösungsmittel wird im Behälter für organische Lösungsmittel entsorgt. Die Extraktionshülse samt Inhalt wird trocken im Behälter für Feststoffabfälle entsorgt.
Seite | 24 Auswertung
Sobald das Lösungsmittel zu sieden beginnt, steigen Dämpfe auf, die einmal um die Hülse herum geleitet werden, am Rückflusskühler kondensieren und in die Hülse laufen.
Das Lösungsmittel sammelt sich in der Extraktionshülse an, sodass das Öl aus den Mandeln extrahiert wird. Das Prinzip ist dabei analog der Extraktion von β-Carotin aus Versuch 1: Öle sind lipophil und deshalb gut in n-Heptan löslich.
Die Extraktion nach Soxhlet hat den Vorteil, dass Lösungsmittel mehrfach hintereinander wiederverwendet werden können. Am Scheitelpunkt des Rohres fließt das gesamte Extrakt (Lösungsmittel mit Öl) aufgrund von Adhäsion und Kohäsion zurück in den Kolben. Dort beginnt jedoch nur das Lösungsmittel erneut zu sieden und erneut steigen die Lösungsmitteldämpfe auf. Das Öl würde erst bei höheren Temperaturen zu sieden beginnen und verbleibt deshalb im Kolben. So kann auch die quantitative Menge an Fett eines Lebensmittels bestimmt werden, wenn Einwaage der Hülse und Auswaage des Öles bestimmt werden.
Der Raffinationsprozess
Nach der Gewinnung der Rohöle und einer analytischen Kontrolle werden sie entschleimt, entsäuert, geblichen, filtriert und desodoriert, bevor sie als raffinierte Öle in den Handel gelangen, „rein“ sind sowie neutral schmecken und riechen.
Es gibt jedoch auch Öle, die nicht alle Raffinationsstufen durchlaufen: Dies trifft z.B. auf native Öle (häufig Olivenöle) zu, die nicht entsäuert, geblichen und desodoriert werden dürfen.
Abb. 21: Schematische Darstellung des Raffinationsprozesses.
Seite | 25 Der erste Schritt des Raffinationsprozesses stellt die Entschleimung dar. Wenn die Rohöle gewonnen werden, werden bei der Extraktion neben den reinen Ölen auch weitere lipophile Fettbegleitstoffe wie Lecithin mit extrahiert. Diese werden als Schleimstoffe bezeichnet und können ausgefällt, abfiltriert oder nach dem Hydratationsverfahren entfernt werden. Dabei wird dem erwärmten Öl Wasser zugesetzt, wodurch die Schleimstoffe aufquellen, ihre Fettlöslichkeit verlieren und aufgrund ihrer höheren Dichte in Separatoren von den Ölen getrennt werden können. Der Schlamm enthält zu einem Großteil Lecithin, das nach Reinigung als solches im Handel erwerblich ist.
Im nächsten Schritt erfolgt die Entsäuerung. Diese ist nötig, da Öle immer einen gewissen Anteil an freien Fettsäuren (bis zu 6%) enthalten. Zur Neutralisation kann z.B.
die entsprechende Menge an Alkali-Lösung zugesetzt werden, wobei das Öl anschließend seifenfrei-gewaschen werden muss. Es können jedoch auch die unterschiedlichen Siedepunkte von Fettsäuren und Triglyceriden ausgenutzt werden, um die freien Fettsäuren abzudestillieren. Zu hohe Temperaturen schädigen allerdings die Öle.
Zudem können die Triglyceride umgeestert werden.
Den nächsten Schritt stellt die Bleichung dar, wobei das Bleichen durch Adsoroption an aktiven Oberflächen geschieht. In erster Linie sind diese Stoffe Bleicherde oder kolloidale Silicate. Aktivkohle wird nur gelegentlich eingesetzt, eignet sich jedoch sehr gut im Schulversuch. Dieser Vorgang dient neben der Aufhellung insbesondere der Entfernung unerwünschter Fettbegleitstoffe, wie Oxidationsprodukten (Hydroperoxide, Keto- Verbindungen), Metallspuren, Farbstoffe, Seifen und Resten an Phosphatiden.
Anschließend wird gegebenenfalls gehärtetes Fett beigemengt, um die gewünschte Konsistenz zu erreichen.
Die Desodorierung (Dämpfung) dient dazu störende Geruchs-und Geschmackstoffe zu entfernen. Zwar machen die charakteristischen Gerüche Fette und Öle aus, auf der anderen Seite können sie durch Oxidation zum Verderb der Fette führen. Die Abtrennung dieser Stoffe erfolgt durch das Einblasen von heißem Wasserdampf und das Anlegen eines Vakuums.
Es werden reine, neutral riechende und schmeckende Fette und fetten Öle erhalten.
Seite | 26
V7 Bleichung mit Aktivkohle
7Chemikalien
Tab. 9: Verwendete Chemikalien.
Eingesetzte
Stoffe Summen-
formel Menge H-Sätze P-Sätze Gefahren-
symbole Schul- einsatz Natives
Olivenöl
- 50 mL - - - -
Aktivkohle C(s) 1 Esslöffel - - - -
Geräte
Heizrührer mit Fisch, Erlenmeyer-Kolben (250 mL), Esslöffel, Stativmaterial, Glastrichter, Faltenfilter, Erlenmeyer-Kolben (100 mL)
Aufbau
Abb. 22: Experimenteller Versuchsaufbau.
Durchführung
In einen Erlenmeyer-Kolben (250 mL) wird etwa 50 mL natives (ungebleichtes) Olivenöl gegeben und mit einem Esslöffel Aktivkohle versetzt. Der Ansatz wird auf dem Heizrührer bei 100 °C für 20 min gerührt. Anschließend wird das Gemisch durch einen Faltenfilter filtriert und das erhaltene Öl mit dem eingesetzten Öl verglichen.
7 Vgl. Vgl. Haupt, P.: Vom Rohfett zum Reinfett – Fettraffinationen in Modellversuchen.
In: NiU-C. Heft-Nr. 49/ 1999. S. 31.
Seite | 27 Beobachtung
Das native Olivenöl weist einen deutlichen Eigengeruch und eine satte grüne Farbe auf.
Nach dem Bleichvorgang hat das Öl deutlich an Farbintensität und Geruch verloren.
Abb. 23: Beobachtung des Reaktionsverlaufs.
Entsorgung
Der Faltenfilter wird trocken im Abfallbehälter für Feststoffe entsorgt. Die Öle werden kanalisiert.
Auswertung
Dieser Versuch stellt die Bleichung als Teil des Raffinationsprozesses nach. Aktivkohle ist aktivierter Kohlenstoff, der aus kleinsten Graphit-Kriställchen bestehet und eine sehr große innere Oberfläche aufweist (~ 1500 m2/g). Die innere Oberfläche von 4 g Aktivkohle entspricht in etwa der Größe eines Fußballfeldes. Damit besitzt Aktivkohle ein großes Adsorptionsvermögen und ist dazu in der Lage das ungebleichte Öl von Farb-, Geruch- und unerwünschten Fettbegleitstoffen zu entfernen.
In der Industrie wird Aktivkohle in der Regel durch Bleicherde oder kolloidale Silicate ersetzt.
Seite | 28
V8 Herstellung von Margarine
8Auf einen weiteren, der Raffination anschließenden Produktionsprozess wird in diesem Versuch eingegangen: Die Herstellung von Margarine.
Chemikalien
Tab. 10: Verwendete Chemikalien.
Eingesetzte
Stoffe Summen-
formel Menge H-Sätze P-Sätze Gefahren-
symbole Schul- einsatz
Speiseöl - 1 Teil - - - -
Kokosfett - 2 Teile - - - -
Milch - 1 Teil - - - -
Eigelb - 1 Eigelb für
1 Teil = 20 g - - - -
Geräte
Magnetrührer mit Fisch, Becherglas (500 mL), Messbecher, Waage, Messer, Schneebesen, Eisbad
Aufbau
Abb. 24: Experimenteller Versuchsaufbau mit Teilschritten.
Durchführung
In einer Küche mit Küchenutensilien! In einem Becherglas werden 2 Teile Kokosfett unter leichtem Erwärmen geschmolzen. Ohne weitere Erwärmung werden 1 Teil Speiseöl und 1 Teil Milch untergerührt. Das Becherglas wird in ein Eisbad gestellt, ein Eigelb hinzugegeben und mit einem Schneebesen geschlagen, bis eine homogene, feste Masse entsteht. Nach Belieben kann eine Prise Salz für den Geschmack dazugegeben werden.
8Vgl. Dittmer, M.: Fette und Öle in unserem Leben. In: PdN-ChiS. Heft-Nr. 6/ 2004. S. 14.
Ethanol
Öl
96 %Fett
on onEthanol
Milch
96 %onon
1 Teil 2 Teile 1 Teil
Eigelb
Seite | 29 Beobachtung
Bereits beim Abmessen fällt auf, dass Öl und Milch zwei Phasen bilden und sich nur zu einem geringen Teil miteinander mischen lassen. Durch Zugabe des Eigelbs entsteht eine für Margarine typisch gelbe Farbe und es bildet sich eine feste, homogene Masse.
Abb. 25: Beobachtung des Reaktionsverlaufs.
Entsorgung
Die Margarine ist verzehrfertig und sollte wegen dem frischen Ei zügig aufgebraucht werden. Alle anfallenden Abfälle können über den Haushaltsmüll entsorgt werden.
Auswertung
Es ist bekannt, dass sich Wasser und Öl nicht miteinander mischen lassen und es zur Ausbildung von zwei Phasen kommt. Im Eigelb ist ein natürliches Tensid, Lecithin, enthalten. Dieses wirkt als Emulgator und es entsteht die Margarine als Wasser-in-Öl- Emulsion (umgekehrt zur Wirkung von Seife).
Abb. 26: Wasser-in Öl-Emulsion.
Seite | 30 Lecithin ist ein Phospholipid, das eine polare Kopfgruppe und einen lipophilen Kohlenwasserstoff-Rest aufweist und so analog zur Wirkung von Seife dazu in der Lage ist beide Phasen zu emulgieren. Phospholipide sind Hauptbestandteil von Biomembranen.
Sie lagern sich als Doppelschichten (Bilayer) zusammen und grenzen so Zellräume voneinander ab. In die Zellmembranen sind weitere Bestandteile wie Proteine integriert.
Abb. 27: Lecithin (li) und schematische Darstellung einer Zellmembran (re).
Um die Margarine als feste Masse zu erhalten, wird ihr in der Regel gehärtetes Pflanzenöl zugesetzt. Diese gehärteten Fette entstehen durch Hydrierung der in den Fetten enthaltenen Doppelbindungen über einem Paladium-Katalysator. Entweder wird das Fett bis zur gewünschten Konsistenz schrittweise gehärtet (früher) oder so lange gehärtet, bis sie nicht mehr weiter gehärtet werden können. Durch gezielte Mischung dieser total gehärteten Fette mit weicheren Fetten oder Ölen kann dann die gewünschte Konsistenz erhalten werden (heutzutage).
R1 R2
<Metall>
H2 R1
R2
Nachfolgende schematische Darstellung veranschaulicht die Herstellung von Margarinen in der Industrie:
Ethanol
Öle96 %
Fette Härtung
Mich Wasser, Salz
Lecithin
Farbstoffe, Vitamine mischen
Kühlung
Seite | 31
Untersuchung von Speisefett
Mit denen bis dato kennengelernten Prinzipien rund um die Chemie der Fette sind weitere Untersuchungen von Fetten möglich.
Tab. 11: Mögliche Untersuchungsmethoden.
Zunächst kann der Fettgehalt von Lebensmitteln bestimmt werden. Dazu wird analog zur Extraktion von Fetten verfahren, jedoch Ein- und Auswaage notiert. In vereinfachter Form kann dies bereits mit Mörser und Pistill und einem geeigneten Lösungsmittel vorgenommen werden. Es kann beispielsweise der Fettgehalt von Chips und Chips light verglichen werden, indem beide mit Aceton gemörsert werden.
Außerdem gibt es gewisse Kennzahlen, die Aufschluss über Qualität und Zusammensetzung der Fette geben und in der Analytik von Bedeutung sind. Das Mittel der Wahl stellt das Titrieren dar. Die Reaktionen an sich sind in der Regel schon bekannt.
Die Säurezahl beschreibt die Anzahl der frei vorliegenden Fettsäuren in Fetten. Dazu werden die Fette mit Kaliumhydroxid titriert. Dies ist ein Maß für die Frische der Fette, da die Anzahl an freien Fettsäuren mit Dauer der Lagerung zunimmt. Die Iodzahl beschreibt, wie viel Iod (Iod = klassisch) nötig ist, um alle Doppelbindungen in 100 g eines Fettes umzusetzen. Zur Bestimmung wird bromiert und der Brom-Überschuss mit Thiosulfat-Lösung rücktitriert. Dies lässt auf den Gehalt an ungesättigten Fettsäuren schließen. Die Verseifungszahl gibt darüber Auskunft, wie viel Kaliumhydroxid zur Neutralisation und Verseifung eines Fettes nötig ist und beschreibt entsprechend die Menge an Kaliumhydroxid, die zur Verseifung gebraucht wird. Die Esterzahl ergibt sich schlicht aus der Differenz von Verseifungszahl und Säurezahl. Je höher die Verseifungszahl ist, desto kürzer sind die Fettsäureketten im Durchschnitt. Alle chemischen Grundlagen (Bromierung, Verseifung) werden bereits in den zuvor durchgeführten Versuchen besprochen.
Seite | 32
Biodiesel
Biodiesel wird durch Umesterung von Rapsöl mit Methanol gewonnen. Zur Durchführung im Schülerversuch wird Ethanol anstelle von Methanol verwendet.
V9 Herstellung von Biodiesel
9Chemikalien
Tab. 12: Verwendete Chemikalien.
Eingesetzte
Stoffe Summen-
formel Menge H-Sätze P-Sätze Gefahren-
symbole Schul- einsatz Ethanolat-
Lösung Ethanol
Natrium
C2H5OH(aq)
Na(s)
8 mL
225
260, 314 EUH014
210
280, 370+378, 301+330+331, 305+351+338, 309+310, 422
Sek I
LV
Rapsöl - 4 mL - - - -
Salzsäure 0,5 M HCl(aq) 40 mL - - - Sek I
Geräte
Stativmaterial, Reagenzglas mit durchbohrtem Stopfen für Glasrohr, Magnetrührer mit Mini-Fisch, Wasserbad [Becherglas (500 mL)]
Aufbau
Abb. 28: Experimenteller Versuchsaufbau mit Teilschritten.
9 Vgl. Harsch, G., Niepel, S., Musli, S.: Experimentelle Vergleiche. In: PdN-ChiS. Heft-Nr. 2/ 2008. S. 23.
Seite | 33 Durchführung
Ethanolat-Lösung: Zur Herstellung der Ethanolat-Lösung werden 0,3 g Natrium (frisch
geschnitten) zu 100 mL Ethanol gegeben und darin aufgelöst. Alternativ können 1 g NaOH anstelle von 0,3 g Na verwendet werden.
Zur Herstellung von Biodiesel werden 8 mL Ethanolat-Lösung mit 4 mL Rapsöl in einem Demo-Reagenzglas mit Mini-Fisch gegeben und ein durchbohrter Gummistopfen mit Glasrohr darauf gesetzt (vereinfachter Rückflusskühler). Das Reagenzglas wird in ein Wasserbad (70 °C, Heizrüher auf ca. 150 °C) eingelassen und für 5 – 7 min erhitzt.
Sobald der Ansatz aufklart ist der Versuch beendet. Zusätzlich kann das abgekühlte Produkt mit 0,5 M Salzsäure gewaschen werden. In der oberen Phase kommt der Rapsölethylester („Biodiesel“) zu liegen; in der unteren Phase die Salzsäure mit Ethanol- und Glycerin-Rückständen.
Das Produkt wird auf Geruch und Konsistenz geprüft und kann mit Rapsöl, Diesel oder Biodiesel (RME) verglichen werden.
Beobachtung
Es ist zu beobachten, dass das Gemisch beim Erhitzen aufklart und es zu einem Farbumschlag von hellgelb nach orange kommt.
Der käuflich erworbene Fettsäuremethylester weist eine grüne Farbe auf. Dieser ist jedoch genauso dickflüssig und weist den gleichen, charakteristischen Geruch auf wie der in diesem Versuch hergestellte Rapsölethylester.
Abb. 29: Reaktionsverlauf (li); Vergleich von Rapsölethylester mit Rapsöl, Rapsölmethylester und Diesel (re)
Entsorgung
Das Produkt wird im Behälter für organische Lösungsmittel entsorgt.
Seite | 34 Auswertung
In diesem Versuch werden die Triglyceride des Rapsöls umgeestert und die langen Fettalkohole durch das kurzkettige Ethanol ersetzt. Es entsteht Rapsölethylester.
Eigentlicher Biodiesel ist Rapsölmethylester und wird mit Methanol erzeugt.
Damit die Umesterung funktioniert wird zunächst eine Ethanolat-Lösung angesetzt. Dabei reagiert das Natrium mit Ethanol zur Ethanolat-Lösung und elementarem Wasserstoff.
Der Mechanismus erfolgt analog der Verseifung. Hier die Reaktion im Überblick:
Es entsteht Glycerin und die gewünschten Ethylester der Rapsöl-Fettsäuren. Im Unterricht sollte auf die aktuelle Brisanz der Thematik mit Vor- und Nachteilen eingegangen werden.
Fette in der Schule – langweilig oder spannender als ihr Ruf?
… Entscheiden Sie selbst!
2 C
2H
5OH
(l)2 C
2H
5O Na
++ H2(g)
Ethanol Natrium
+ 2 Na(s)
+1 0 +1 0
Ethanolat Wasserstoff
C H
C H2
C H2
O O O
C
C
C O
O
O R1
R2
R3
C H
C H2
C H2
OH OH OH
+
O C
R1 O CH2 C H3
O C
R2 O CH2 C H3
O C
R3 O CH2 C H3 Rapsöl
Ethanolat
Glycerin 3
Fettsäureethylester C
H3 CH2
+
OHEthanol
Seite | 35
Literatur
[1] Vgl. Hessisches Kultusministerium: Lehrplan Chemie.
http://www.kultusministerium.hessen.de/irj/HKM_Internet?cid=ac9f301df54d1fbfab83dd3a6449af60 [2] Vgl. Bruice, P.Y.: Organische Chemie. 5. Auflage. Pearson. München. 2007. S. 1074ff.
[3] Vgl. Adam, K.: Fette und Öle in der Ernährung.
http://www.chids.de/dachs/wiss_hausarbeiten/FetteundOele_Adam.pdf
[4] Vgl. Dr. Reiß, P.: Lipide. Fachwissenschaftliches Seminar zum Praktikum zur Organischen Chemie für Studierende des Lehramts am 07.12 und 14.12.2012.
[5] Vgl. Pfeifer, P.: Fette und fette Öle. Aufarbeitung des Themas für den Chemieunterricht.
In: NiU-C. Heft-Nr. 113/ 2009. S. 2 – 45.
[6] Vgl. Haupt, P.: Vom Rohfett zum Reinfett – Fettraffinationen in Modellversuchen.
In: NiU-C. Heft-Nr. 49/ 1999. S.28 – 32.
[7] Vgl. Andre, C.: Chemie? – Aber sicher! Experimente kennen und können. 2. Auflage.
Hrsg.: Akademie für Lehrerfortbildung und Personalführung. Dillingen. 2012. V. 16-6.
[8] Vgl. Seilnacht, T.: Das Phänomen der Grenzflächenspannung.
http://www.seilnacht.com/waschm/tenside.html
[9] Vgl. Heimann, R.; Greiwe, R.: Extraktion von Kokosnussfett.
In: PdN-ChiS. Heft-Nr. 7/ 2007. S. 34 – 38.
[10] Vgl. Harsch, G., Niepel, S., Musli, S.: Experimentelle Vergleiche.
In: PdN-ChiS. Heft-Nr. 2/ 2008. S. 23.
[11] Vgl. Weber, N., Mukherjee, K. D., Warwel, S.: Fette in der Ernährung.
In: PdN-ChiS. Heft-Nr. 6/ 2001. S. 2 – 7.
[12] Vgl. Dorgerloh, R., Mai, A., Suhrweier, U.: Bestimmung des Acroleingehaltes in Fetten und Ölen. In: PdN-ChiS. Heft-Nr. 6/ 2001. S. 9 – 12.
[13] Vgl. Hinze, Th.: Fette und Öle – im Chemieunterricht der Sekundarstufe I.
In: PdN-ChiS. Heft-Nr. 6/ 2001. S. 13 – 16.
[14] Vgl. Hauschild, G.: Gedanken zu Arbeitsblättern zum Thema „Fette und Öle“.
In: PdN-ChiS. Heft-Nr. 6/ 2001. S. 20 - 24.
[15] Vgl. Dittmer, M.: Fette und Öle in unserem Leben.
In: PdN-ChiS. Heft-Nr. 6/ 2004. S. 12 – 15, S. 19.
Seite | 36
Abbildungen
Zugriff im Juni 2013Abb. 1:Gemüse. URL: http://beta-carotin.net/images/beta-carotin.jpg
Abb. 2: Bienenwachs. URL: http://www.bsab-naturkerzen.de/uploads/pics/Biene.jpg Abb. 3: Butter und Öl. URL: http://www.abiweb.de/chemie-makromolekuele-naturstoffe- kunststoffe/chemie-der-naturstoffe/fette.html
Abb. 4: Eigelb. URL: http://mhstatic.de/fm/1/thumbnails/sh_ei_eigelb_800.jpg.2440635.jpg Abb. 5: Selbst erstellt mit ChemSketch.
Abb. 6: Selbst gemachte Fotos.
Abb. 7: Selbst erstellt mit ChemSketch.
Abb. 8: Selbst gemachte Fotos.
Abb.9: Wasserläufer und Wasserglas. URL: http://www.seilnacht.com/waschm/tenside.html Wasserstoffbrücken-Bindungen: Selbst erstellt mit ChemSketch.
Abb. 10: Selbst erstellt mit ChemSketch.
Abb. 11: Selbst gemachte Fotos.
Abb. 12: Selbst erstellt mit ChemSketch.
Abb. 13: Selbst erstellt mit ChemSketch.
Abb. 14: Fettexplosion. URL: http://data.motor-talk.de/data/galleries/98519/744/fettexplosion.jpg Abb. 15: Selbst erstellt mit ChemSketch.
Abb. 16: Selbst gemachte Fotos.
Abb. 17: Selbst erstellt mit ChemSketch.
Abb. 18: Selbst erstellt mit ChemSketch.
Abb. 19: Selbst erstellt mit ChemSketch.
Abb. 20: Selbst gemachte Fotos.
Abb. 21: Selbst erstellt mit ChemSketch.
Abb. 22: Selbst erstellt mit ChemSketch.
Abb. 23: Selbst gemachte Fotos.
Abb. 24: Selbst erstellt mit ChemSketch.
Abb. 25: Selbst gemachte Fotos.
Abb. 26: Selbst erstellt mit ChemSketch.
Abb. 27: Tensid: Selbst erstellt mit ChemSketch.
Bilayer: URL: http://www.genesisnet.info/bild.php?Sprache=de&ID=179 Abb. 28: Selbst erstellt mit ChemSketch.
Abb. 29: Selbst gemachte Fotos.