Hinweis
Bei dieser Datei handelt es sich um ein Protokoll, das einen Vortrag im Rahmen des Chemielehramtsstudiums an der Uni Marburg referiert. Zur besseren
Durchsuchbarkeit wurde zudem eine Texterkennung durchgeführt und hinter das eingescannte Bild gelegt, so dass Copy & Paste möglich ist – aber Vorsicht, die Texterkennung wurde nicht korrigiert und ist gerade bei schlecht leserlichen Dateien mit Fehlern behaftet.
Alle mehr als 700 Protokolle (Anfang 2007) können auf der Seite
http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html eingesehen und heruntergeladen werden.
Zudem stehen auf der Seite www.chids.de weitere Versuche, Lernzirkel und Staatsexamensarbeiten bereit.
Dr. Ph. Reiß, im Juli 2007
Philipps-Universität Marburg Fachbereich Chemie
Übungen im Experimentalvortrag - Organik Wintersemester 1997/98
Leitung: Dr. J. Butenuth Dr. E. Gerstner Prof Dr. H. Perst
Thema
Holz
Silke Börner 9. Sem. LA
Chemie, Biologie Wehrdaer Weg 16 35037 Marburg
14.01.1998
!~
Inhaltsverzeichnis
1. Einleitung
2. Morphologie
2.1 Botanische Definition 2.2 Holzgewebe
2.3 Entstehung von Jahresringen 2.4 Funktion
3. Eigenschaften
Versuch 1: Heizwertbestimmung
4. Chemische Zusammensetzung 4.1 Holzanalyse
Versuch 2: Verbrennung von Holz 4.2 Hauptbestandteile
4.2.1 Polyosen 4.2.2 Cellulose
Versuch 3: Cellulosenachweis 4.2.3 Lignin
Versuch 4: Ligninnachweis 4.3 HolzinhaltsstofIe
3
3 3 4 4 5
6 7
9 9 10 12 12 13 15 18 19 20
5. Venwendung 21
5.1 Papierherstellung 22
Versuch 5a: Acetosolv-Verfahren 25
Versuch 5b: Bleiche von Zellstoff 29
5.2 Holzverkohlung 30
Versuch 6a: Holzverkohlung 30
Versuch 6b: Holzgasnachweis 33
Versuch 6c: Methanolnachweis als Borsäuretrimethylester 34
1. Einleitung
Die wertvollen Eigenschaften des Holzes als Werkstoff und Rohmaterial resultieren sowohl aus seinem morphologisch-strukturellen Aufbau als auch aus seiner stoffiichen Zusammensetzung. Es sind aber weder seine mechanischen Eigenschaften allein aus der Morphologie, noch sein chemisches Verhalten allein aus der Zusammensetzung zu erklären. Beide Faktoren sind vielmehr für alle Eigenschaften des Holzes gemeinsam wirksam und zum Verständnis seines chemisch-technologischen Verhaltens gleich wichtig. Holz ist ein morphologisch und chemisch uneinheitlicher Stoff.
2. Morphologie
2.1 Botanische Definition
Alles vom Kambium nach innen erzeugte Gewebe unabhängig vom Grad der Verholzung bezeichnet man als Holz.
Abb.l: Holzquerschnitt
Jahresring Bast
Borke - -
.---Holz
Kambium
2.2 Holzgewebe
Im Holz lassen sich schon mit bloßem Auge einige für seinen Aufbau typische Merkmale beobachten. Die äußerste Schicht, die Rinde besteht aus Bast und Borke. Darunter liegt eine sehr dünne Gewebeschicht aus teilungsfähigen Zellen, das Kambium, welches nach außen den Bast und nach innen das eigentliche Holz erzeugt, welches die Hauptmasse des Stammes bildet.
Vom Kambium geht das sekundäres Dickenwachstum aus, da die fortlaufende Erzeugung neuer Zellen nach innen eine Umfangserweiterung zur Folge hat, der das Kambium durch Dilatation, durch tangentiales Wachstum folgen muß.
2.3 Entstehung von Jahresringen
Im gemäßigten Klima entstehen zu Beginn der alljährlichen Wachstumsperiode, im Frühjahr, dünnwandige weitlumige Zellen (Frühholz), die vorallem der Leitung dienen. Im Spätsommer werden dickwandige Zellen (Spätholz) gebildet, die Träger der Festigkeit sind.
Schließlich stellt das Kambium seine Tätigkeit ganz ein, um im Frühjahr wieder mit der Bildung von weitlumigen Zellen zu beginnen.
Die regelmäßige Aufeinanderfolge von Früb- und Spätholz rührt zur Entstebung der Jahresringe.
Das zwischen zwei Jahresgrenzen liegende Gewebe entspricht also einem Jahreszuwachs, so daß sich durch die Anzahl der Jahresringe das Alter der Bäume abschätzen läßt. Auf diese Weise kann man schließen, daß die mehr als 100m hohen Mammutbäume Kalifomiens ca. 3000 Jahre alt sind. Der mit 4600 Jahren älteste noch lebende Baum, eine Borstenkiefer in Kalifomien, ist allerdings nur noch 1Om hoch.
2.4 Funktion von Holz
Die verschiedenen Funktionen die das Holz zu erfüllen hat (Festigung, Leitung und Speicherung) haben zur Ausbildung von Zelltypen geführt, die sich in Form und Struktur charakteristisch unterscheiden.
Abb. 2: Zelltypen
Trachee
0 0 0 0 0 0 0 0
Tracheide Holzparenchym Holzfaser
Während die weitlumigen Tracheen ausschließlich der Wasserleitung dienen, können die Tracheiden sowohl Leitungs- als auch Festigungsfunktion übernehmen. Im letzten Fall haben sie stark verdickte Wände und enge Lumina. Die Holzfasern haben gleichmäßig verdickte Wände und sind an den Enden stark zugespitzt. Sie stehen ausschließlich im Dienste der Festigung. Die Holzparenchymzellen schließlich sind plasmareich und ihre Zellwände sind im allgemeinen nur schwach verdickt. Sie dienen überwiegend der Speicherung von Reservestoffen zum Teil allerdings auch der Querleitung innerhalb des Gewebes.
3. Eigenschaften
Die verschiedenen Holzarten zeigen in ihrem mikroskopischen Aufbau, der Farbe, der Härte, Dichte und chemischer Zusammensetzung erhebliche Unterschiede.
Wassergehalt: 40-60%" frisch geschlagenes grünes Holz ' 15-18% . . lufttrockenes Holz
Dichte: Linde. 0,32 glem3 Eiche: 1,03 glem3
r: Ein aufgeklaftertes Raummeter (1m Länge, Breite und Stapelhöhe) Holz wiegt zwischen 300-500kg. Bis auf wenige Ausnahmen wird Holz nach Raumeinheiten und nicht nach Gewicht gehandelt.
Auch in der Spaltbarkeit und Härte zeigen sich erhebliche Unterschiede.
Spaltbarkeit:
r>
leicht schwer nicht
spaltbar spaltbar spaltbar
Fichte Linde Pockholz
Eiche Obstbäume Härte:
sehr hart hart weich sehr weich
Pockholz Buche Birke Weide
Steineiche Eiche Fichte Linde
Apfelbaum
Das in Westindien heimische sehr harte und schwere sowie nicht
Versuch 1: Heizwertbestimmung:
Infolge des hohen Sauerstoffgehaltes ist der Heizwert des Holzes nicht sehr groß. Er beträgt bei einem Kilogramm lufttrockenen Holz etwa 3700- 4500 kcal (1cal = 4, 1855 Joule). Das sind umgerechnet etwa 15,49kJ-
18,83kJ.
Die Verbrennungstemperatur erreicht bei einem gewöhnlichem Feuer kaum 1000°C. Dennoch ist Holz in afrikanischen und südamerikanischen Ländern wo z.B. 74% (Brasilien), 94% (Äthiopien) oder 98% (Tansania) des Holzes verheizt werden, immer noch der meistgenutzte Brennstoff.
Chemikalien:
t~' Sauerstoff, Holzstück (ca. O,5g), Wasser GeräteNersuchsaufbau:
Versuchsdurchführung:
Das exakt ausgewogene Holzstück wird so zwischen den beiden Drähten der Verschlußeinheit befestigt, daß es auf seiner ganzen Länge Kontakt mit dem zwischen den beiden Drähten befindlichen Zünddraht aus Konstantan hat. Die Apparatur wird verschlossen und mindestens fünf Minuten ein leichter SauerstofIstrom durch die Apparatur geleitet.
Als nächstes wird die Anfangstemperatur des Wassers bestimmt. Mit Hilfe eines elektrischen Funkens wird das Holz gezündet und alle 30 Sekunden die Temperaturerhöhung des Wassers abgelesen. Nach Beendigung des Versuchs wird die Masse des nicht verbrannten Holzstückes bestimmt.
Auswertung:
mHolz: 0,393g
mQuarzschälchen+Rest: 5,075g
mRest: 0, 009g
mverbranntes Holz: 0,381g
Kalorimeterdaten
Bestandteil Masse Cp Produkt
[g] [J/g *K] [J/K]
Cu-Spirale 199,21 0.385 76,69
Verschlußeinheit 41,02 mit Zünddraht
Schraubglas 145,78 0,847 412,11
Quarzschälchen 5,066 Becherglas und 294,69 Rührfisch
Wasser 558 4,185 2335,23
E(mGlas* CPGlas+mCu *C Cu+ mWasser * CPWasser)= 2824,03 J/K
t [min]
°
0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 5,5 15T[OC] 20,6 20,8 21,2 21,9 22,2 22,7 22,8 22,9 22,9 23 23 23 22,9 AT=2,4K
Berechnung des Heizwertes:
MIp = -LlT *E(mGlas *CPGlas+ men *Cpen+mH20 *CPWasser) 6777,67 J
AHp,m= AHpI m = 17, 79 kJ/g
Durch Einsetzen der während des Versuchs gemessenen Daten und den sich daraus ergebenden Werten (kursiv) wurde der Heizwert des Holzes bestimmt. Er liegt mit 17,79 kJ/kg Holz innerhalb der aus der Literatur entnommenen Werte.
4. Chemische Zusammensetzung
4.1 Holzanalyse
Holzanalyse
• 491%,
• 44%
• 6,30/0
• 0 1%,
• 05%,
C
o
H N
unverbrennbare Mineralien, die als Asche zurückbleiben
Die im Holz enthaltenen Mineralien dienen den Pflanzen als Nährstoffe.
Dabei unterscheidet man nach Makronährelementen wie Stickstoff:
Schwefel, Phosphor und Calcium, sowie nach Spurenelementen z.B.
Mangan, Bor, Zink, Molybdän, Kupfer und Chlorid.
Versuch 2: Verbrennung von Holz
Chemikalien:
Holzstück, Sauerstoff, wäßrige Bromthymolblau-Lösung Geräte:
Brennlötfel, Erlenmeyerkolben (IL), Becherglas (250 ml), 2 Reagenzgläser, Bunsenbrenner
Versuchsdurchführung:
In einem Brennlöffel erhitztes Holz läßt man In einem sauerstoffgefüllten Weithalserlenmeyerkolben verbrennen.
Anschließend schüttelt man das gasförmige Verbrennungsprodukt mit Wasser aus. Es entsteht eine farblose Lösung. Den Rest des Holzes und die zurückbleibende, anhaftende, weiße Asche werden in einem Becherglas mit Wasser versetzt. Die Asche löst sich in Wasser unter Bildung einer ebenfalls farblosen Lösung. Gibt man zu beiden Lösungen nun einen pH-Indikator hinzu, in diesem Fall Bromthymolblau-Lösung, färbt sich Lösung 1 gelb, während die Lösung der Asche blau wird.
Auswertung:
Holz ist wie oben beschrieben ein Gemenge, das unter anderem Kohlenstoff und Mineralsalze (Nährsalze der Pflanze), also Verbindungen aus Metallanteil 'und Säurerest enthält. Bei der Verbrennung wird Kohlenstoff zum C02 oxidiert. Das entstandene Kohlenstoffdioxid löst sich in Wasser und reagiert damit als Nichtmetalloxid zu kohlensaurer Lösung und erscheint daher nach Zugabe des Säure-Base-Indikators Bromthymolblau gelb. Aus den Mineralsalzen bilden sich beim Erhitzen Metalloxide, die sich in Wasser lösen und zu Laugen reagieren. Diese werden durch die blaue Lösung nach Zugabe von Indikator nachgewiesen. Hier wird die Reaktion exemplarisch für Calciumoxid dargestellt.
1. Verbrennung
a) C(s)+02(g) ) C02(g) t (Oxidation)
b) CaC03(s/aq) L\) CaO(s)+C02(g)t (Thermolyt.
Spaltung)
2. Aufnahme in Wasser
a) Säurebildung:
Gashydrat
C02(g) + n H20 ~C02 * nH20~"H2C03" + (n-I) H20
b) Laugenbildung:
CaO(s) + H20 ---7 Ca(OH)2(aq) " >0 Ca2+ + 20H-
3. Nachweis mit Bromtbymolblau
Hlnd
e-Ja ~~3
~.
R C R
~O20-
Ind2 -blau pR > 7
HO ~3 ~3 01
~
gelb pH 2-6
4.2 Hauptbestandteile des Holzes
.H!!:!J?tbestandteile von Holz Cellulose:
Polyasen:
Lignin:
(25-50%) (20-35%) (20-30%)
I r - '
Wie aus den unterschiedlichen Prozentangaben zu ersehen, schwankt die Zusammensetzung der verschiedenen Bestandteile beträchtlich.
Aufbau der Zellwand
Die Zellwand besteht aus Polyosen, Pektin, Glykoproteinen und Cellulose. Eine Verfestigung erfährt sie durch die chemische Quervemetzung und die Einpolymerisation von Lignin.
4.2.1 Polyosen
Unter Polyosen (Hemicellulosen, Cellulosane) versteht man Polysaccharide mittlerer Kettenlänge, die in der chemischen Struktur und im Polymerisationsgrad von der Cellulose abweichen. Sie bilden die Hauptmasse der im elektronenmikroskopischen Bild strukturlos erscheinenden Grundsubstanz (Matrix) der Zellwand. Man unterscheidet zwischen Hexosanen, deren Moleküle aus Hexosen, z.B. D-Glucose, D- Mannose und D-Galaktose, aufgebaut sind und Pentosanen, deren Makromoleküle aus Pentosen, z.B. D-Xylose und L-Arabinose bestehen.
Sie liegen meist als Heteroglycane vor, z.B. Xyloglucane, Arabinogalaktane, Glucomannane und Rhamnogalakturonane, deren Moleküle aus kleineren, sich periodisch wiederholenden Einheiten bestehen.
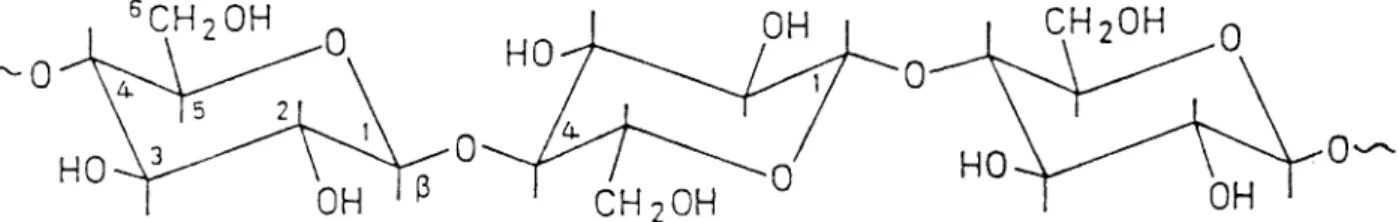
4.2.2 Cellulose
Cellulose ist ein ß-I,4 Glucan, d.h. die D-Glucoseeinheiten sind ß-I,4- glykosidisch verknüpft. Dadurch entstehen langgestreckte, unverzweigte Fadenmoleküle, die mehrere tausend Glucosemoleküle umfassen können.
Die höchsten bisher gefundenen Werte liegen bei 15000, was einer Molekülmasse von etwa 2.5 Millionen entspricht. Da ein Glucosemolekül in der Kette einen Raum von 0,5nm beansprucht, ergibt dies eine Moleküllänge von 7,5um, Cellulose ist eine farblose, in Wasser und den meisten organischen Lösungsmitteln unlösliche Substanz, doch löst sie.
sich unter Erhaltung der Fadenmoleküle in Schweizers-Reagenz unter Komplexbildung. Im Gegensatz zur Stärke reagiert Cellulose mit Jod nur in Gegenwart gewisser quellend wirkender Chemikalien, z.B. Zinkchlorid.
Unverholzte Cellulose färbt sich mit Zinkchlorid-Iod-Iodid-Lösung blau bis dunkelviolett, verholzte dagegen gelb.
Abb. 3: Cellulosemolekül
"-0
o
o
.o~
Bereits im Lichtmikroskop lassen sich bei stärkerer Auflösung fibrilläre Elemente, die Makrofibrillen erkennen, die einen Durchmesser von 0,5
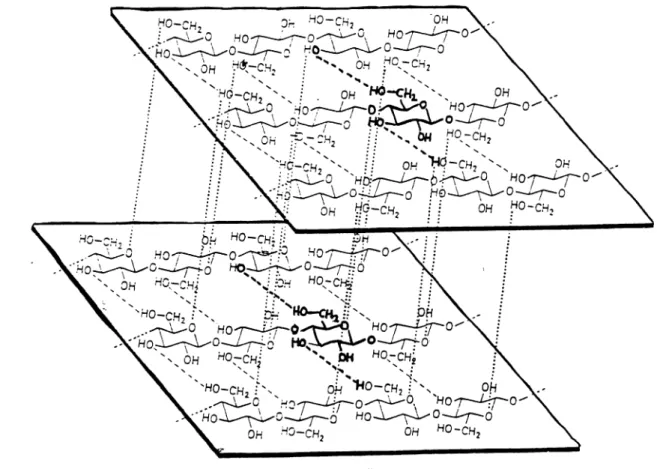
um haben. Bei elektronenmikroskopischer Betrachtung erscheinen sie aus feineren Fibrillen, den Mikrofibrillen mit einem Durchmesser von 10-30 nm zusammengesetzt. Bei höherer Auflösung erscheinen diese aus bis zu 20 noch feineren Elementen aufgebaut, die einen Durchmesser von 3,5- 5nm haben und als Elementarfibrillen (Micellarstränge) bezeichnet werden. Diese bestehen aus je 50-100 Cellulosemakromolekülen. Deren genaue Anordnung ist zwar noch nicht klar, doch es gibt begründete Modellvorstellungen. Danach sind alle ß-Glucanketten parallel angeordnet, und zwar so, daß sich ihre reduzierenden Enden alle am gleichen Ende der Fibrille befinden. Benachbarte Ketten sind jeweils um die Länge eines halben Glucoserings gegeneinander verschoben, so daß sich zwischen dem Ringsauerstoff des einen und einer Hydroxylgruppe
des benachbarten Glucosemoleküls Wasserstoflbrückenbindungen ausbilden können. Folglich ist jedes Glucosemolekül eines jeden Stranges durch je zwei Wasserstoflbrückenbindungen mit zwei Glucosemolekülen benachbarter Celluloseketten verbunden. Auf diese Weise entstehen kristallgitterähnliche Bereiche in denen die Glucanketten parallel zueinander und in regelmäßigen Abständen voneinander angeordnet sind. Zwischen den Elementarfibrillen bleiben Räume von etwa 1nm Durchmesser ausgespart, die als intermicelläre Räume bezeichnet werden. Die Mikrofibrillen sind durch interfibrilläre Räume getrennt, deren Weite in der Größenordnung von 10nm liegt. Im nativen Zustand ist die Zellwand gequollen, das heißt sowohl die micellären als auch die interfibrillären Räume sind mit Wasser gefüllt.
Hinsichtlich der Fixierung der Fibrillen in der Matrix besteht noch keine Klarheit. Nach einer neueren Modellvorstellung sind die Xyloglucanmoleküle mit den an der Oberfläche der Fibrillen liegenden Cellulosemolekülen durch Wasserstoflbrückenbindungen quer vemetzt, und zwar in der gleichen Art wie die Glucanketten der Cellulosefibrillen untereinander. So entsteht gewissermaßen ein Gerüstwerk mit dessen Hilfe die Cellulosefibrillen in der versteiften Matrix fixiert sind.
Abb. 4: Aufbau der Cellulosefibrillen
Versuch 3: Cellulosenachweis
Chemikalien:
Cuoxam-Lösung [Cu(NH3)4](OH)2 (frisch)
(6,5g CUS04 x 5H20 in 20ml H20 lösen, mit 20ml NH3 w(NH3)=25% versetzen und genau 4,3ml NaOH-Lösung w(NaOH)=32% hinzugeben)
Cellulose
(Zellstoff nach dem Acetosolv-Verfahren gewonnen, s. Versuch 5a) Schwefelsäure C(H2S04) = 2mol/1
Zinkchlorid-Iod-Iodid-Lösung:
(20g ZnCl2 in 100ml H20 lösen und mit einer Lösung aus 2,1g KI und 0, 1g 12 in H20 vermischen)
Geräte:
1 Petrischale (0 15cm), Kristallisierschale, Tropfpipette, Becherglas (100mI), Magnetrührer, Rührfisch, Meßpipette (20ml)
Durchführung:
Man legt im Becherglas 15ml dunkelblaues Schweizers Reagenz vor und gibt unter Rühren ca. 1g Cellulose hinzu. Diese hochviskose Lösung gibt man in die zur Hälfte mit Schwefelsäure gefüllte Kristallisierschale (Fällbad). Es fällt sogenannte Hydratcellulose aus.
Man wartet einige Minuten bis sich die Cellulose vollständig entfärbt hat und gibt dann etwas von der erhaltenen Verbindung in eine Petrischale. Nach Zutropfen der Zinkchlorid-Iod-Iodid-Lösung erhält man eine blauviolette Färbung der Cellulose.
Auswertung:
1. Lösen in Schweizers Reagenz (Cuoxam)
Die Cellulose löst sich unter Komplexbildung in Schweizers Reagenz.
Durch das stark alkalische Milieu werden die Oll''Gruppen der Cellulose deprotoniert und das Cu2+-Ion bildet 4 gleichwertige koordinative Bindungen zwischen den freien Elektronenpaaren des Stickstoffs und dem 02-Ion aus. Nicht aufgeführt sind die beiden koordinativen Bindungen zum H20-Molekül (Cu2+ ist sechsfach koordiniert).
Es entsteht ein planar-quadratischer Komplex.
r>.
1
H-C-OH
I
H-C-OH I
+
+ 2 NH3t +2H20 (blau)
2. Ausfällen im Fällbad
Durch Zugabe von Säure wird der entstandene tiefblaue Komplex zerstört und Cellulose fällt aus.
(blau)
I
H-C-OH 4H30+~ I
I H- C - OH I
. + Cu2+ + 2 N14+ + 4 H20 (farblos)
3. Nachweis mit Zinkchlorid-Iod-Iodid-Lösung
ZnC12 zerstört die Wasserstoflbrückenbindungen zwischen den Celluloseketten durch Solvolyse der Cellulose-Hydroxidgruppen.
Demzufolge tritt eine Vergrößerung der intramicellären Räume auf: was wiederum die Quellung der Cellulosefaser nach sich zieht. Dadurch kann es ähnlich wie bei der Stärke zur Einlagerung der linearen Polyiodidionenketten in die aufgequollene Cellulosefaser kommen.
mK+ + mI3- + (C6HIOÜ5)n ~ mK+ + "(l3-)m---(C6HlOÜ5)n"
(blau)
Die auftretende Blaufärbung kommt durch die Elektronendelokalisierung entlang der Polyiodidionenketten und durch die räumlichen Verhältnisse innerhalb der Einschlußverbindung zustande.
4.2.3 Lignin
Nachträgliche Veränderungen der Zellwand führen nicht so sehr zu gestaltliehen Veränderungen der Zellen, als vielmehr zu einer Änderung der chemischen und physikalischen Eigenschaften ihrer Wände.Dies trifft vor allem für die Verholzung zu, bei der bereits vorhandene und verdickte Zellwände durch Einlagerungen verfestigt werden.
Die Verholzung kommt durch die Einlagerung von Ligninen in die interfibrillären Räume der Zellwand zustande. Lignine sind Mischpolymere aus Phenylpropanen wie Coniferyl- Cumaryl- und Sinapylalkohol, die sich zu einem dreidimensionalen Gitter vernetzen und so die Zellwand durchdringen. Mit den polymeren Kohlenhydraten der Zellwand sind sie durch kovalente Bindungen - in erster Linie Etherbrücken - verknüpft.
Abb. 5: Lignine
1[~~_~CH=CH-{-H
OH HCumarylalkohol Coniferylalkohol
'}fi CO
:.'~~}-CH=CH - 5
"'H.,...' JGO". -,,.~
~~~~·,,·...;l
Sinapylalkohol
In der erdgeschichtlichen Entwicklung der Pflanze trat die Verholzung im Übergang vom Wasser- zum Landleben ein, da ihr Körper in der Luft höheren Biegebeanspruchungen ausgesetzt war. Durch die Einlagerung von Lignin in das Zellgewebe wird die Verschiebbarkeit der Cellulosefasern, welche die Elastizität bedingt, herabgesetzt, und dadurch eine erhöhte mechanische Festigkeit erreicht, insbesondere gegen Druckbelastung. Auch die Wasserwegsamkeit der Zellwände wird durch die Inkrustierung mit dem Lignin herabgesetzt. Zum mikrochemischen
I~\
Versuch 4: Ligninnachweis
Chemikalien:
Salzsäure w(HCI)=0,37
Phloroglucin-Lösung (lg 1,3,5 Trihydroxybenzol in 50 ml Ethanol) Geräte:
2 Pumpzerstäuber, Baumscheibe mit Schablone, Reisnägel Durchführung:
Man befestigt die Schablone mit der Aufschrift LIGNIN mit Hilfe der Reisnägel eng anliegend auf der Baumscheibe und besprüht anschließend mit der Phloroglucin-Lösung. Nach dem man die Schablone abgenommen hat besprüht man nun die gesamte Baumscheibe mit Salzsäure. Eserscheint in rot-violetter Farbe das Wort LIGNIN.
Auswertung:
Lignin bildet mit Phloroglucin einen intensiv dunkelroten Farbkomplex.
4.3 Holzinhaltsstoffe
Stets finden sich auch einige Prozent sogenannter Holzinhaltsstoffe wie Harze, Wachse, Terpene und Terpenoide, Phenole, Gerbstoffe, Chinone, Fette, Zucker, Mineralstoffe, Farbstoffe etc im Holz.
Bildung von Kernholz:
Die nicht mehr an der Leitung beteiligten Jahresringe dienen nur noch der Festigung und Speicherung. Die Lumina der Gefäße werden in manchen Fällen durch Thyllen, das sind in die Gefäße eingewachsene Holzparenchymzellen, oder durch Einlagerung von Gerbstoffen und anderen oben genannten Substanzen verstopft.
Durch derartige Einlagerungen werden sowohl die mechanischen Eigenschaften des Holzes als auch seine Dauerhaftigkeit verbessert, wodurch es technisch wertvoller wird. Bei manchen Bäumen z.B. Linde, Pappel und Weide unterbleibt die Verkernung. Sie werden deshalb häufig durch Fäulnis hohl.
Mit der Verkernung geht häufig eine dunklere Verfärbung einher, an der man das Kernholz gut von dem helleren Splintholz unterscheiden kann.
Farbstoffe:
Bei Eichen und Ulmen ist das Kernholz braun, bei Eiben, Lärchen und den Rothölzern der Tropen rot, beim Ebenholz schwarz.
Die Nutzung der Farbhölzer für die Textilfärberei war deshalb im Altertum selbstverständlich.
Gerbstoffe und Zedernholzöl schützen die Zellwände gegen mikrobielle Zersetzung. Sehr häufig tritt in diesem Zusammenhang die Weiß- und Braunfäule auf. Bei der Weißfäule zersetzen Mikroorganismen überwiegend Lignin und die helle faserige Struktur der Cellulose bleibt erhalten. Bei der Braunfäule wird die Cellulose durch Mikroorganismen abgebaut und die dunkle WÜrfelige Struktur des Lignins bleibt zurück.
Der charakteristische Geruch des geschnittenen Holzes stammt von Gerbstoffen (Eiche), Harzen und Terpentinöl (bei Nadelhölzern).
5. Verwendung
Mengenmäßig gesehen ist Holz das weitaus häufigste organische Naturprodukt. Auch heute noch sind mit ca. 40 Mio. km2, rund 1/3 des Festlandes mit Wäldern bedeckt, von denen etwa 30% erschlossen und ca.
14% in intensiver Nutzung sind. Man schätzt, daß es heute für Holz rund 5000 verschiedene Verwendungszwecke gibt, bei denen mengenmäßig die Papierherstellung und die Verwendung als Bau- und Industrieholz am stärksten zu Buche schlagen.
Abb.6: Verfahren
Verfahren
Mechanisch Chemisch Thermisch
5.1 Papierherstellung
Erst seit Mitte des 19. Jahrhunderts beherrscht der Mensch chemisch- technologische Verfahren, mit denen Papier in großem Maßstab hergestellt werden kann. Seither hat die Bedeutung von Papier in unserem Leben ständig zugenommen.
1988 lag der Verbrauch von Druck-, Schreib-, Kopier-, Hygiene-, Packpapier und Pappe bei weltweit 228 Mio.Tonnen.
Die wichtigsten- Rohstoffe für die Papierherstellung sind Altpapier (40%)
Frischzellstoff(30%)
Holzschliff (mechanische Zerfaserung des Holzes, Lignin bleibt erhalten) Faserstoffe (15%)
Papierhilfsmittel (15%)
Während Holzschliff nur für minderwertige Zeitungspapiere verwendet werden kann, ist für hochwertige Schreib-, Druck- und Kopierpapiere ein Frisch-Zellstoffgehalt von 80-90% erforderlich.
Zellstoff gehört zu den Chemieerzeugnissen, die in großer Menge hergestellt werden. Jährlich sind es weltweit 130 Mio Tonnen.
Die chemischen Holzaufschlußverfahren beruhen alle darauf: daß Zellstoff, der etwa 50% der Holztrockenmasse ausmacht, von seinen Nebenbestandteilen (Lignin und Hemicellulosen) abgetrennt wird.
~r'\ Schwierig ist das bei Lignin, so daß die wesentliche Aufgabe des Aufschlusses die überführung vom unlöslichem, makromolekularem Lignin in lösliche Derivate bzw. Bruchstücke ist.
Bei den bekannten Aufschlüssen wird systematisch zwischen wäßrigen (Sulfat- und Sulfit-) und organischen bzw. wasserarmen (ASAM-, Organocell- und Acetosolv-) Verfahren unterschieden.
Verfahren zur Zellstoftberstellung:
1. Sulfat-Verfahren (90%) 2. Sulfit-Verfahren (10%)
3. Acetosolv-Verfahren (wenige Pilotanlagen)
Prinzip: überführung des unlöslichen makromolekularen Lignins in lösliche Derivate und Bruchstücke
Verfahrensablauf: Holz
Entrinden
L
Hacken
~
Hackschnitzel Kochung
1
I
Wäsche
l
Sortierung
~
Ungebleichter Zellstoff
~
Bleichstufen
1
Gebleichter Zellstoff
Sulfat-Verfahren:
900/0 des Zellstoffs werden nach diesem Verfahren hergestellt. Als Aufschlußchemikalien dienen Natriumhydroxid und Natriumsulfid in wäßriger Lösung. Unter Einwirkung des Alkalis werden bei 170°C in Lignin Alkylaryletherbrücken gespalten und die entstehenden Ligninbruchstücke gehen als Phenolat in Lösung. Die Hydrogensulfid Ionen haben zwei Funktionen: Erstens Katalysatorwirkung und zweitens reagieren sie als nucleophile Teilchen mit den Methoxygruppen des Lignins. Das Lignin wird dabei demethyliert, so daß Phenolatgruppen zurückbleiben und Methylmercaptan und Dimethylsulfid entstehen. Beide Abbauprodukte führen zu einer starken Geruchsbelästigung im Umfeld von Sulfat-Zellstoffwerken.
Das in der Ablauge enthaltene Lignin hat einen hohen Brennwert und wird zur Energieerzeugung verwendet. Dazu wird die Ablauge eingedampft und dann verbrannt. Das Gesamtverfahren ist dadurch energieautark. Unter betriebswirtschaftliehen Gründen lohnt nur der Betrieb sehr großer Sulfatanlagen, die jedoch die Umweltauflagen in der Bundesrepublik nicht erfüllen können, so daß hier weitgehend neben einigen Pilotanlagen zum Acetosolv-Verfahren nur nach dem Sulfit- Verfahren produziert wird.
Sulfit-Verfahren:
Als Aufschlußlösung dient eine Lösung von Calciumhydrogensulfit oder Magnesiumhydrogensulfit. Unter Einwirkung des Hydrogensulfits im
r>. leicht sauren Medium bei hohen Temperaturen werden
Phenylpropaneinheiten in der Seitenkette sulfoniert, wobei Hydroxygruppen substituiert oder Alkyletherbrücken gespalten werden.
Die Ligninbruchstücke gehen als Sulfonate in Lösung. Auch beim Sulfit- Verfahren wird die ligninhaltige Lauge eingedampft und zur Energieerzeugung verbrannt.
Als wesentlicher Nachteil der Wäßrigen Aufschlußverfahren ist der hohe Frischwasserverbrauch zu nennen. Pro Tonne Zellstoff werden trotz teilweiser Rückführung von Wasser in den Prozeß mindestens 80-300 Tonnen Frischwasser verbraucht. Wegen der hohen Fracht an organischen Substanzen und anorganischen Salzen muß das Wasser unbedingt
Acetosolv-Verfahren:
Als Aufschlußlösung dient eine Mischung aus Eisessig und wenig, konzentrierter Salzsäure. Bei mittleren Temperaturen (110°C) werden Etherbrücken gespalten und Hydroxygruppen des Lignins acetyliert.
Dadurch wird das Lignin in der Essigsäure löslich. Der unlösliche Zellstoff wird abgetrennt. Die ligninhaltige Ablauge wird zur Rückführung von Essigsäure und Salzsäure in den Prozeß eingedampft.
Versuch 5: Zellstoffberstellung Versuch 5a: Acetosolv-Verfahren Chemikalien:
Holzspäne, Eisessig, Salzsäure (w HCI - 36%), Kaliumhydroxid (Trockenmittel), dest. Wasser
Geräte:
2 Rundkolben (250mI), Rückflußkühler, Ölbad, Magnetrührer, Meßzylinder (100mI), Meßpipette (10ml), Saugflasche (250mi), Büchnertrichter, Exsikkator,Destillationsvorrichtung,Abzug
Versuchsaufbau:
Kühler -
-Ölbad - Magnetrührer
Versuchsdurchführung:
5g Holzspäne, 65ml Eisessig und 5,5ml Salzsäure werden unter Rückfluß eine Stunde auf ca. 110°C erhitzt. Dabei wird stark gerührt.
Nachdem die Reaktionslösung abgekühlt ist, wird abgesaugt und filtriert. Der bräunlich gefärbte Zellstoff wird zweimal mit Essigsäure gewaschen und kann leicht mit alkalischer Wasserstoffperoxidlösung gebleicht werden (siehe Versuch 5b). Das Filtrat wird mit Hilfe einer Destillationsapparatur auf ein Restvolumen von 10 ml eingeengt. Nach Zugabe von 50-60ml Wasser zu dem Destillationsrückstand fällt Lignin aus. Es wird abfiltriert und je zweimal mit Wasser gewaschen. Der Rückstand wird über Nacht im Exsikkator über Kaliumhydroxid getrocknet.
Versuchsauswertung:
Ziel:
Spaltung der Etherbrücken zwischen Cellulose und Lignin
+
R1= Cellulose
R2=Lignin / Polyose
Vorteil:
Es entsteht kein mit festen anorganischen Aufschlußchemikalien belastetes Abwasser, da Essigsäure und HCI zurückgewonnen werden können. Das zurückbleibende Lignin und Pentosane können als
aber insgesamt nicht so hoch ist, daß alles Lignin im Verfahren als Brennstoff benötigt wird, kann der verbleibende Rest verkauft werden.
Für die Zellstoffabriken ist Lignin ein Abfallstoff: der zum größten Teil zur Gewinnung von Prozeßwärme verbrannt oder in das Abwasser geleitet wird. Bisher wird nur ein geringer Anteil des Lignins zu hochwertigeren Produkten verarbeitet. Die bestehenden Anwendungen beruhen auf der oberflächenaktiven Eigenschaft der Ligninsulfonate sowie auf der Chemie der Hydroxygruppen im Lignin.
Verwendung von Lignin: -7 Baustoffadditive -7 Polyurethane -7 Phenol-Harze -7 Klebstoffe
Es wäre unrealistisch lediglich die Prozeßbedingungen zur Grundlage einer vergleichenden Bewertung zu machen. Entscheidend ist auch die Produktqualität , die die einzelnen Verfahren liefern.
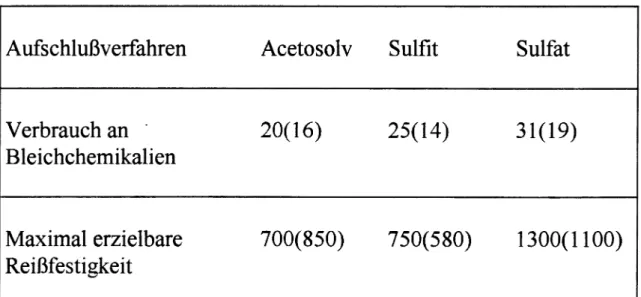
Tabelle 1 vergleicht die Zellstoffqualitäten im Hinblick auf Reißfestigkeit und den notwendigen Einsatz von Bleichchemikalien in Abhängigkeit von der eingesetzten Holzart (Nadel- oder Laubholz).
Tabelle: Vergleich der Produktqualitäten
Aufschlußverfahren Acetosolv Sulfit Sulfat
Verbrauch an - 20(16) 25(14) 31(19)
Bleichchemikalien
Maximal erzielbare 700(850) 750(580) 1300(1100) Reißfestigkeit
Angaben für Nadelholz (Laubholz)
Aus der Tabelle ist ersichtlich, daß Sulfat-Zellstoffe die höchste Reißfestigkeit besitzen, aber nur mit vergleichsweise hohem Aufwand zu bleichen sind, während Acetosolv-Zellstoffe leicht bleichbar sind, aber ebenso wie Sulfit-Zellstoffe nur eine mittlere Reißfestigkeit zeigen. Sulfat- Zellstoffe können also nicht einfach durch Acetosolv-Zellstoffe ersetzt werden. Allerdings wären Sulfit-Zellstoffe durch schadstoffarm produzierte Acetosolv-Zellstoffe weitgehend substituierbar.
Bleiche von Zellstoff
Zellstoff enthält nach dem Aufschluß noch Restlignin, das für die dunkle Färbung des Zellstoffs verantwortlich ist. Ungebleichter Zellstoff hat nur für Verpackungen, einige technische Spezialpapiere und neuerdings im Hygiene-Bereich Bedeutung. Die Bleiche ist verglichen mit dem Aufschluß ein verhältnismäßig komplizierter Vorgang, der sich aus bis zu fünf Behandlungsstufen zusammensetzt, die durch Waschstufen ergänzt werden. Wegen der Abwasserprobleme hat sich die Forschungs- und Entwicklungsarbeit in den letzten 20 Jahren vor allem auf die Bleiche konzentriert. Das bisher üblicherweise in der ersten Bleichstufe eingesetzte Chlor wird dabei wegen der dabei entstehenden chlorierten Lignin-Abbauprodukte zunehmend durch eine ein- oder mehrstufige Sauerstoflbehandlung verdrängt, die allerdings technisch schwieriger ist.
In weiteren Stufe werden Chlordioxid, Hypochlorit, Wasserstoffperoxid und neuerdings auch Ozon eingesetzt.
Ziel ist ein möglichst vollständiger oxidativer Abbau des Restlignins und die Entfernung der Abbauprodukte.
Zwar wird Marktzellstoff nach wie vor meist bis zur höchst möglichen Weiße gebleicht, es setzt sich jedoch langsam die Erkenntnis durch, daß die Bleiche den Anforderungen an das spätere Endprodukt angepaßt werden soll, für die ein solcher Aufwand häufig nicht erforderlich ist.
Versuch 5b: Bleiche von Zellstoff Chemikalien:
Ungebleichter Zellstoff aus Versuch 5a, Wasserstoffperoxidlösung (WH202= 30 %), Natronlauge (c= 2 mol/l), Eisbad
Geräte:
Becherglas (800ml), Kristallisierschale, Glasstab. Büchnertrichter mit Absaugflasche, 2Petrischalen
Versuchsdurchführung:
Zu der frisch im Becherglas hergestellten alkalischen Wasserstoffperoxidlösung (100ml H202, 20ml NaOH) wird der zerkleinerte ungebleichte Zellstoff gegeben. Ab und zu wird mit dem Glasstab umgerührt, um eine gleichmäßige Bleichung zu erreichen. Es setzt eine Sauerstoffentwicklung ein, und man kann die Entfärbung des Zellstoffs beobachten. Mit Hilfe des Eisbades bricht man die Reaktion ab und filtriert anschließend die Lösung. Den gebleichten Zellstoff gibt man in eine Petrischale und kann ihn mit dem aus Versuch 5a erhaltenen ungebleichten Zellstoff vergleichen.
Versuchsauswertung:
Ziel:
• Oxidativer Abbau des Restlignins zu organischen Säuren, Methanol, C02
• Entfernung der Abbauprodukte
Bleichmittel: H202
Hoi , 1/2 02f +OH-
Bleichwirkung
AR = - 98 kJ/mol
+
Versuch 6a: Holzverkohlung
Holzverkohlung nennt man die trockene Destillation es Holzes. Sie liefert neben der Holzkohle gasförmige und flüssige Zersetzungsprodukte, aus welchen besonders Essigsäure, Holzgeist und Holzteer isoliert werden.
Hauptprodukte:
Holzkohle: ca. 80% Kohlenstoff
Rohholzessig: CH3COOH, Holzgeist, Wasser
Holzgeist:
Holzteer:
Holzgas:
Methanol, Aceton, Methylacetat, Holzgeistöle
aromatische Verbindungen (Phenol, Phenolether)
52% COz 34% CO 10% CRt 20/0 C214
2% H2
Chemikalien:
Holzspäne, kleine Holzstücke, Eis Geräte:
Getrocknete Holzspäne und Holzstücke werden in einem Reagenzglas aus schwerschmelzbarem Glas vorgelegt, ein gebogenes Verbindungsstück führt in eine eisgekühlte Vorlage und von dort in ein Gasometer.
Versuchsaufbau:
\f(.v~ÜJ..ci~\k~~- S~'"lo:\ktt."'-
A
Durchführung:
Das Reagenzglas mit den Holzspänen wird langsam erhitzt. Das Holz entsendet Qualmwolken, die in der Vorlage teilweise zu flüssigen Produkten kondensieren. Das Holz selbst geht in schwarze Holzkohle über. Das nicht kondensierende Gas füllt das Gasometer. Um das teilweise Zurückströmen des entstandenen Gases beim Abkühlen der Holzkohle zu verhindern, wird Verbindungshahn 1 des Gasometers geschlossen nach dem man das Erhitzen abgebrochen hat.
Auswertung:
Die Produkte des Versuchs ist die Holzkohle in der Brennkammer, die flüssigen Kondensationsprodukte in der Vorlage, hauptsächlich Holzessig und Holzgeist sowie das Holzgas im Gasometer. Der thermische Abbau des Holzes ist ein sehr komplexer Prozeß. Im folgenden wird kurz der Verlauf der Verkohlung beschrieben.
Verlauf der Verkohlung
• 100-150°C: Beginn der Zersetzung:
Abspaltung von H20
allmähliche Zersetzung der Hemicellulosen geringe Veränderungen des Lignins
• 150-275°C: Gewichtsverminderung des Holzes
• 275-350°C: Hauptmenge der Zersetzungsprodukte
• 380-400°C: hauptsächlich Holzteer
Die entstandene Essigsäure wird überwiegend aus den Acetylgruppen der Polyosen gebildet. Methanol entsteht hauptsächlich aus den Methoxygruppen des Lignins und den Polyosen. Der darüber hinaus entstehende Holzteer, der aus einer Vielzahl meist aromatischer Verbindungen zusammengesetzt ist, bildet sich vorwiegend aus Lignin.
Versuch 6b: Nachweis des Holzgases Chemikalien:
Holzgas Geräte:
Bunsenbrenner, Gasometer Durchführung:
Ein Bunsenbrenner wird an Hahn 2 des Gasometers angeschlossen und das entströmende Gas an der Sparflamme entzündet. Sie brennt als WÜrde Erd- oder Stadtgas verbrennen.
Auswertung:
Verbrennung von Holzgas
1. Schritt: Heizgas
2. Schritt: Synthesegas
2 CO +4 H2 (-MI)
(-MI)
Versucb 6c: Nachweis von Methanol als Borsäuretrimetbylester
Borsäure verbindet sich mit Methanol zum recht flüchtigen Borsäuretrimethylester. In Anwesenheit protonenreicher und zugleich dehydratisierend wirkender Reagenzien wie Schwefelsäure wird das Gleichgewicht der Veresterung zugunsten der Esterbildung verschoben.
Chemikalien:
Borsäure, H2S04 (w = 0,98), Kondensat aus Versuch 6a (Holzgeist) Geräte:
Reagenzglas, Spatel, Bunsenbrenner, 2Pasteurpipetten Durchführung:
In einem Reagenzglas legt man eine Spatelspitze Borsäure vor und gibt anschließend 2ml Holzgeist und 1ml Schwefelsäure hinzu. Man schüttelt und erhitzt zum Sieden und entzündet die entweichenden Dämpfe.
Auswertung:
lOH
I
B +
_/ \-
HO . OH
H-O- CH3 H - 0 - eH3 H- 0 -CH3
10 -- CH3
a".2.<;0'1...
~
+ 3 H20" H3C
-0/ ~-CH3
trigonal planar sp2 - hybridisiert
I-f@ --- H,@
10-H H-O 10-H H-O 10-H
-. /
-\ /
I
H+8 " 8 "- Be ~...
"
H-Ö/ ""O-H
"
_/ _/ \G>
/0-CH3
H-O H-O ,Q-CH3
H H
H-O'
-,
8
-/ \G)
H-O O-CH3
-- 1.-
H
...':)
H3C-O'
- '"8 - 0 --
CH3
- / -
H3C-O
+
Der flüchtige Borsäuretrimethylester verursacht eine grüne Flammenfärbung aufgrund der sekundären Bildung von angeregten B203- Molekülen.
2B(OCH3)3 (g) + 902 (g)
2 8203 (g) A ) 2 B203 (g) * --~> 2 B203 (g) Grundzustand angeregter Zustand Grundzustand
grüne Flammenfärbung
6.Literaturverzeichnis 1. Beyer/Walter.:
2. Butenuth:
3. Försterling/Kuhn:
4. Gerstner:
5. Hollemann/Wiberg:
6. Römpp:
LEHRBUCH DER ORGANISCHEN CEMIE, Hirzel Verlag 1991.
SCRIPTUM ZUM ORGAN.-CREM.
PRAKTIKUM; Marburg 1996.
PRAXIS DER PHYSIKALISCHEN CHEMIE; VCH, Göttingen 1991.
SCRIPTUM ZUM ANORG:-CHEM.
PRAKTIKUM; Marburg 1993.
LEHRBUCH DER ANORGANISCHEN CHEMIE;
de Gruyter, Berlin 1985.
CHEMIE-LEXIKON, Thieme, stuttgart 1993.
7. Ullmanns Enzyklopädie der chem. Technologie, Urban und Schwarzenberg, 1964.
8. Winnacker/Küchler:
9. Kober., F.:
10. Baierl/Pfeiffer:
11. Feckl., J.:
12. Melle/Jansen:
13. Sommerfeld, H.:
14. Sommerfeld, H.:
CHEMISCHE TECHNOLOGIE, München 1959.
Holzgas, Treibstoff aus Holz, In: Praxis der Naturwissenschaften Chemie,3, 1991, S.36.
Von der Cellulose zum Papier.,In
Naturwissenschaftenim Unterricht-Chemie., 29 ,1995, S. 17-22.
Papierherstellung aus Holz und Altpapier,In:
Praxis der Naturwissenschaften-Chemie, 7, 1992, S. 13-19.
Einfaches Kalorimeter zur Bestimmung der Verbrennungsenthalpie von Kohlenstoff, In:
Praxis der Naturwissenschaften-Chemie, 2, 1993, S. 20-22.
Nachwachsende Rohstoffe-Lignin und Proteine, In:
Naturwissenschaften im Unterricht-Chemie, 17, 1993, S. 19-21.
Das Acetosolv-Verfahren, In: