PCI Thermodynamik G. Jeschke FS 2011
Musterl¨osung zu ¨ Ubung 2
(1. M¨arz 2011)
1. a) Die Ampulle mit dem fl¨ussigen Brom ist zugeschmolzen, der Stoffaustausch mit der Umgebung wird somit ausgeschlossen. Das System kann daher nur geschlossen oder abgeschlossen sein. Glas ist kein guter Isolator, daher kann Energie mit der Umgebung (z.B. Temperatur¨anderung) ausgetauscht werden. Das System ist somit
als geschlossen anzusehen. (1 Punkt)
b) Wenn die Thermosflasche als gut abgedichtet und ideal betrachtet wird, han- delt es sich um ein abgeschlossenes System. Auf einer langen Wanderung wird der Tee dennoch langsam abk¨uhlen. Demnach m¨usste die Thermosflasche dann als geschlossenes System angesehen werden. Sobald man eine Pause macht, um einen Schluck Tee zu nehmen, verwandelt sich das System in ein offenes System.
(1 Punkt)
c) Der mit Helium gef¨ullte Luftballon wird seine Temperatur der Umgebungstempera- tur auf dem Jahrmarkt anpassen. Das System kann somit nur offen oder geschlossen sein. Betrachtet man den Luftballon als ideal abgedichtet, kann man von einem geschlossen System sprechen. In der Realit¨at kann eine komplette Abdichtung des Ballons jedoch nicht gew¨ahrleistet werden, weshalb der Heliumballon nach einigen Tagen zu Hause nicht mehr prall gef¨ullt ist. Das System ist somit offen. (1 Punkt) 2. Uber die Gleichung¨
pV =nRT = m
MRT (0.5 Punkte) (1)
l¨asst sich die Masse des bei -25 ◦C im Tank vorhandenen Heliums mit einer Molmasse von M = 4.003 g mol−1 berechnen.
m1 = M pV
RT1 = 4.003 g mol−1·1.04·105Pa·10000 m3
8.314 J K−1mol−1248.15 K (2)
= 4.163·106
2063.12 kg = 2018 kg (3)
(1 Punkt) analog l¨asst sich m2 bestimmen und die gesuchte Differenz ∆m ermitteln. Rechenzeit l¨asst sich durch die Gleichung
1
m2T2 =m1T1 (4) sparen. Nachm2 aufgel¨ost und eingesetzt
m2 = m1T1
T2 (5)
= 2018 kg · 248.15 K
318.15 K = 1574 kg (6)
(1 Punkt) erh¨alt man ∆m mit
∆m=m1−m2 = 444kg. (7)
(0.5 Punkte) 3.
a) Wir behandeln Stickstoff als ideales Gas, daher ergibt sich die thermische Zustandsglei- chung zu:
p·V =n·R·T. (1 Punkt) (8)
Die Stoffmenge in unserem System ¨andert sich w¨ahrend des gesamten Prozesses nicht.
¨andert, fassen wir die Gaskonstante und die Stoffmenge zu einer neuen Gr¨osse (R=n·R) zusammen. Unsere thermische Zustandsgleichung vereinfacht sich somit zu:
p·V =n·R·T. (9)
Um Zustand I vollst¨anding zu beschreiben, k¨onnen wir aus den gegebenen Zustands- gr¨ossen V1 und T1 p1 nach
p1 = n·R·T1 V1
(10) berechnen.
Durch isotherme Prozessf¨uhrung (T=const.;T1 =T2 (0.5 Punkte)) und eine Kompres- sion des Volumen auf die H¨alfte (p2 = 0.5 p1) gelangen wir zum Zustand II, dessen Druck durch
p2 = n·R·T2 V2
= n·R·T1 0.5V1
(11)
p2 = 2·p1 (0.5 Punkte) (12)
gegeben ist.
Durch die Arretierung des Kolbens kann eine isochore Prozessf¨uhrung gew¨ahrleistet 2
werden (V3 =V2 = 0.5V1) (0.5 Punkte), wobei sich der Druck auf p3 = 3p1 erh¨oht. F¨ur Zustand III kann die Temperatur somit zu
T3 = p3·V3
n·R = 3p1·0.5 V1
n·R (13)
T3 = 1.5·T1 (0.5 Punkte) (14)
berechnet werden.
Zustand IV wird durch isotherme (T = const.;T4 = T3 = 1.5 T1) Expansion (0.5 Punkte) aufp4 =p1 erreicht und das Volumen im Kolben berechnet sich zu:
V4 = n·R·T4
p4 = n·R·1.5 T1
p1 (15)
V4 = 1.5·V1. (0.5 Punkte) (16)
Schlussendlich kann das System ¨uber einen isobaren Prozess in den Ausgangszustand I gebracht werden.
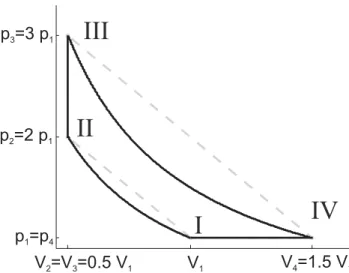
b) Die Ergebnisse von Aufgabe 3a sind in Tabelle 1 zusammengefasst.
Tabelle 1: Zusammenfassung der Ergebnisse aus 3a. Die fett gedruckten Zustandsvariablen wurden berechnet.
Zustand I Zustand II Zustand III Zustand IV T T1 T2 =T1 T3 = 1.5 T1 T4 = 1.5T1
V V1 V2 = 0.5V1 V3 = 0.5V1 V4 = 1.5 V1 p p1 = nRT1/V1 p2 = 2 p1 p3 = 3 p1 p4 =p1
Aus diesen Werten f¨ur die Zustandsvariablenp und V k¨onnen wir nun ein p- V - Dia- gramm erstellen(siehe Abb.1). Dabei kennen wir alle Werte f¨ur die Zust¨ande I-IV.
Dabei ist zu beachten, dass f¨ur isotherme Prozesse (T=const.) das Boyle-Mariottesche Gesetz (p ∝ V−1) gilt und somit ein nicht lineare Zusammenhang zwischen p und V besteht (1 Punkt). Daher ist es falsch eine gerade Verbindung zwischen den Zust¨anden I & II sowie III & IV einzuzeichnen (grau gestrichelte Linie). Die Isothermen folgen ei- ner indirkten Proportionalit¨at und sind in schwarz gekennzeichnet.
Da wir ebenfalls die Temperatur f¨ur alle Zust¨ande kennen, ist in Abb.2 ein dreidimen- sionales Diagramm der Zustands¨anderungen gezeigt.
3
V =V =0.5 V2 3 1 V1 V =1.5 V4 1
p =p1 4
p =2 p2 1
p =3 p3 1
I II
III
IV
Abbildung 1: p - V - Diagramm f¨ur die berechneten Zust¨ande I-IV mit den Zustands¨ande- rungen als schwarze Linien gekennzeichnet.(2 Punkte)
V =V =0.5 V2 3 1 V1 V =1.5 V4 1 T =T1 2
T =T =1.5 T3 4 1
p =p1 4
p =2 p2 1
p =3 p3 1
I II
III
IV
Abbildung 2: 3D Diagramm der Zustands¨anderung f¨ur das berechnete System.
4