Aufgabe 1
1.1
Bei einer gegebenen TemperaturT, laufen die folgenden drei chemischen Reaktionen ab:
R1 :A1(g) +B1(s)↔C1(g) +D1(g) R2 :A2(g) + 3B2(g)↔2C2(g) + 2D2(g) R3 :A3(g) + 2B3(g)↔C3(g) +D3(g)
Bei dieser Temperatur und beim Standardruck p0 sind die thermodynamischen Gleichgewichtskon- stanten aller drei Reaktionen gleich K†(1)=K†(2)= K†(3).
1.1.1
a) Welche von diesen Reaktionen sind druckabh¨angig? (3 Punkte)
b) In welche Richtung verschiebt sich das Gleichgewicht f¨ur jede dieser Reaktionen wenn der Druck erh¨oht wird? (3 Punkte)
1.1.2
a) Berechnen Sie das Verh¨altnis Kx(1)/Kx(3) bei einem beliebigen Druck p, der nicht gleich den Standarddruckp0 ist. (2 Punkte)
b) Bei welchem Verh¨altnis zwischen p undp0 gilt die Beziehung Kx(3) = 2Kx(1)? (1 Punkt) 1.2
Die Gleichgewichtskonstante einer Reaktion wurde bei zwei verschiedenen Temperaturen gemessen.
Die Werte sind in Tabelle 1 zusammengestellt.
Tabelle 1: Temperaturabh¨anigkeit einer chemischen Reaktion T[◦C] K†
27 0.281 200 1.008
a) Ist diese Reaktion exotherm oder endotherm? (1 Punkt)
b) Berechnen Sie die Standard-Reaktionsenthalpie ∆RH◦(2 Punkte) und Standard-Reaktionsentropie
∆RS◦ (2 Punkte).
Hinweis: Nehmen Sie an, dass ∆RH◦ und ∆RS◦ in diesem Temperaturbereich konstant sind.
1
Aufgabe 2
2.1
a) Entscheiden Sie, ob die folgenden Mehrphasensysteme im thermodynamischen Gleichgewicht existieren k¨onnen (1 Punkt):
– Eis, Natriumchloridl¨osung in Wasser, Wasserdampf
– Eis, Natriumchloridl¨osung in Wasser, Natriumchloridbodensatz, Wasserdampf
b) Wie viele Freiheitsgrade h¨atten diese zwei Systeme im thermodynamischen Gleichgewicht? (1 Punkt)
2.2
Eine Substanz wird in einem Kalorimeter mit einer konstanten W¨armezufuhr von 10 kJ/min erhitzt.
Nehmen Sie an, dass jeglicher W¨armeverlust durch die W¨ande des Kalorimeters vernachl¨assigt werden kann. Ferner sei die Substanz zu jedem Zeitpunkt im thermodynamischen Gleichgewicht. Nehmen Sie zus¨atzlich an, dass der Prozess bei konstanten Druck durchgef¨uhrt wird und die Substanz sowohl im festen als auch im fl¨ussigen Zustand jeweils nur eine einzige Modifikation aufweist. Die Temperatur-
¨anderung der Substanz ist in Abbildung 2 dargestellt und die genauen Werte f¨ur t1...t6 und T1...T4
sind in den Tabellen 2 und 3 zusammengestellt.
aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa aaaaaaaaaaaaaaaaaaaaaaa
aaaaaaaaaaaaaaaaaaaaaaa Isolation p= Const
Heizelement dQ/dt = Const
Abb. 1: Kalorimeter
t T
t6
t5
t4
t3
t2
t1
T1
T2
T3
T4
Abb. 2: Zeitabh¨angigkeit der Temperatur Tabelle 2: Zeit
t1 [min] t2 [min] t3 [min] t4 [min] t5 [min] t6 [min]
0 4.7 124.6 151.2 193.7 196.4
Tabelle 3: Temperatur T1 [K] T2 [K] T3 [K] T4 [K]
110 159 352 380
a) Geben Sie Schmelz- und Siedetemperatur dieser Substanz an? (1 Punkt)
b) Die molare W¨armekapazit¨at dieser Substanz bei konstantem Druck in der fl¨ussigen Phase betr¨agt Cp(l) = 125.3J/(K mol). Berechnen Sie die Stoffmenge n der Substanz im Kalorimeter? (2 Punkte)
c) Berechnen Sie die molare Schmelzenthalpie der Substanz. (1 Punkt) 2.3
Ein geschlossenes Volumen von 20L (Autoklav) befindet sich bei einer Temperatur von 110◦C.
2
2.3.1 Wie hoch ist der Dampfdruck des Wassers bei dieser Temperatur? (2 Punkte) (Die mola- re Verdampfungsenthalpie von Wasser betr¨agt 40.65 kJ/mol. Nehmen Sie an, dass dieser Wert im betrachteten Temperaturbereich temperaturunabh¨angig ist. Der Dampfdruck des Wassers bei 100◦C betr¨agt 1.013·105 Pa. Betrachten Sie den Wasserdampf als ideales Gas.)
2.3.2 Berechnen Sie den Druck im Autoklaven, wenn sich darin folgende Wassermengen befinden
• 10 g H2O (2 Punkte)
• 100 g H2O (2 Punkte)
3
Aufgabe 3
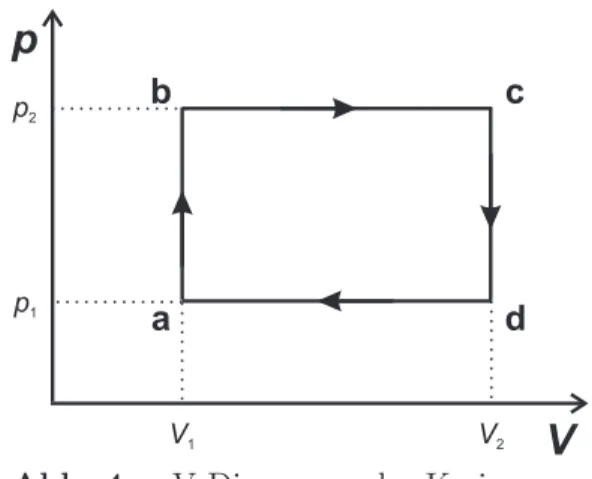
Betrachten Sie eine Maschine, deren Arbeitskreis nicht ein Carnot-Prozess, sondern der in Abbildung 3 gezeigte Kreisprozess ist. Nehmen Sie an, dass die den Kreisprozess durchlaufende Substanz als ideales Gas betrachtet werden kann.
q
inq
outw
Abb. 3: Schema der W¨arme- maschine
V p
V2
V1
p1
p2
a
b c
d
Abb. 4: p-V Diagramm des Kreisprozesses
3.1
Welche Punkte des Kreisprozesses entsprechen der h¨ochsten Temperatur Tmax und der niedrigsten TemperaturTmin? Geben Sie die Beziehung zwischen Tmax,Tmin (unbekannt) und den VoluminaV1, V2, den Dr¨ucken p1,p2, sowie der konstanten Stoffmengen (bekannt) an. (2 Punkte)
3.2
Betrachten Sie f¨ur die Schritte a→b, b→c, c→d und d→a die ¨Anderung der inneren Energie ∆u des Arbeitsstoffes, die ausgetauschte W¨arme q und die ausgetauschte Arbeit w bei jedem der vier Teilprozesse. Welche Werte sind positiv, welche negativ und welche gleich Null? Warum? (8 Punkte) Hinweis: Die molare innere Energie eines idealen Gases ist durchU = (3/2)RT gegeben.
3.3
Nehmen Sie an, dassp1=1 bar, p2=5 bar,V1=1 L undV2=2 L sind. Berechnen Sie den Wirkungsgrad dieses Prozesses. (4 Punkte)
Hinweis: Die Formel f¨ur den Wirkungsgrad des Carnot-Prozesses ist hier nicht anwendbar.
3.4
Berechnen Sie f¨ur die gleichen Werte von V1, V2, p1 und p2 wie in (3.3.) den Wirkungsgrad eines Carnot-Prozesses, bei dem sich die beiden W¨armereservoire bei TemperaturenTw =Tmax und Tk = Tmin (siehe 3.1.) befinden. Vergleichen Sie diese beiden Wirkungsgrade (3.3. und 3.4.). (1 Punkt)
4
![Tabelle 3: Temperatur T 1 [K] T 2 [K] T 3 [K] T 4 [K]](https://thumb-eu.123doks.com/thumbv2/1library_info/4556873.1598935/2.892.380.679.517.716/tabelle-temperatur-t-k-t-k-t-k.webp)