Pflanzenfarbstoffe: Thomas Niedenthal
Hinweis
Bei dieser Datei handelt es sich um eine Wissenschaftliche Hausarbeit (1. Staatsexamensarbeit), die am Fachbereich Chemie der Philipps-Universität Marburg angefertigt wurde.
Weitere Wissenschaftliche Hausarbeiten können auf der Seite http://www.chids.de/veranstaltungen/wiss_hausarbeit.html eingesehen und heruntergeladen werden.
Zudem stehen auf der Seite www.chids.de weitere Versuche, Lernzirkel und Experimentalvortäge bereit.
Dr. Ph. Reiß, im Juli 2007
Erste Staatsprüfung für das Lehramt an Gymnasien Wissenschaftliche Hausarbeit im Fach Chemie
„Pflanzenfarbstoffe“
vorgelegt von Thomas Niedenthal
Hersfelder Str. 18 36151 Burghaun
Gutachter: Dr. Philipp Reiß
Mai 2007
Inhaltsverzeichnis
1. Einleitung 1
2. Fachwissenschaftliche Aspekte 3
2.1. Farbigkeit - was ist das? 3
2.2. Die Lichtreaktion der Photosynthese 9
2.3. Chlorophyll 15
2.3.1. Varianten - Molekülstruktur 15
2.3.2. Extraktion von Blattgrün 19
Versuch 1: Kaltextraktion von Blattgrün 19 Versuch 2: Heißextraktion von Blattrün 21 Vergleich der Extraktionsmethoden 22 2.3.3. Versuche zum Nachweis charakteristischer
Strukturelemente
23 Versuch 3: Darstellung der Phaeophytine 23 Versuch 4: Nachweis des Magnesium-Ions 25 Versuch 5: Verseifung der Chlorophylle 27 2.3.4. Versuch zum Nachweis der Sauerstoffproduktion 30 Versuch 6: Sauerstoffnachweis mit Indigo 30
2.4. Carotinoide 34
2.4.1. Varianten - Molekülstruktur 34
2.4.2. Extraktion des bekanntesten Carotinoids: β-Carotin 38 Versuch 7: Extraktion von β-Carotin aus klein-
geschnittenen Möhren mit Aceton
39 Versuch 8: Extraktion von β-Carotin aus klein-
geschnittenen Möhren mit n-Heptan
40 Versuch 9: Extraktion von β-Carotin aus
geraspelten Möhren mit Aceton
41 Versuch 10: Extraktion von β-Carotin aus
getrockneten Möhren mit Soxhlet- Apparatur
42
Vergleich der verschiedenen Methoden 44
2.4.3. Nachweis des Strukturelementes Doppelbindung 45 Versuch 11: Elektrophile Addition von Brom an
β-Carotin
45 2.4.4. Schutzfunktion des
β-Carotins für das Chlorophyll49 Versuch 12:
β-Carotin als Radikalfänger49
Versuch 13: Desaktivierung von Singulett- Sauerstoff
54
2.5. Chromatographie von Blattfarbstoffen 60 2.5.1. Erläuterung der unterschiedlichen Methoden 60
2.5.2. Praktische Umsetzung 64
Versuch 14: Chromatographie nach Tswett 64 Versuch 15: Chromatographie mit Tafelkreide 66 Versuch 16: Herstellung von DC-Karten 68
Versuch 17: Dünnschichtchromatographie 69
Versuch 18: Präparative Dünnschichtchromato- graphie und photometrische Untersuchung
71
3. Methodisch-didaktische Umsetzung 87
3.1. Ziele des Chemieunterrichtes 87
3.2. Didaktische Vorüberlegungen zur Behandlung des Themas „Pflanzenfarbstoffe“ im Unterricht
88
3.3. Grobplanung der Unterrichtseinheit 90
4. Schlusswort 94
5. Literatur 95
6. Abbildungsverzeichnis 97
7. Anlagen 101
Anlage 1: R- und S-Sätze 102
Anlage 2: Versuchsvorschrift „Kaltextraktion von Blattfarbstoff“
105 Anlage 3: Versuchsvorschrift „Heißextraktion von
Blattfarbstoff“
106
Anlage 4: Versuchsvorschrift „Darstellung der Phaeophytine“ 107
Anlage 5: Versuchsvorschrift „Nachweis des Magnesium- Ions“
108 Anlage 6: Versuchsvorschrift „Verseifung der Chlorophylle“ 109 Anlage 7: Versuchsvorschrift „Nachweis der Sauerstoff-
produktion“
110 Anlage 8: Versuchsvorschrift „Extraktion von β-Carotin aus
kleingeschnittenen Möhren mit Aceton“
111 Anlage 9: Versuchsvorschrift „Extraktion von β-Carotin aus
kleingeschnittenen Möhren mit n-Heptan“
112 Anlage 10: Versuchsvorschrift „Extraktion von β-Carotin aus geraspelten Möhren mit Aceton“
113 Anlage 11: Versuchsvorschrift „Extraktion von β-Carotin aus getrockneten Möhren mit Soxhlet-Apparatur“
114 Anlage 12: Versuchsvorschrift „Elektrophile Addition von
Brom an β-Carotin“
115 Anlage 13: Versuchsvorschrift „β-Carotin als Radikalfänger“ 116 Anlage 14: Versuchsvorschrift „Desaktivierung von
Singulett-Sauerstoff“
117 Anlage 15: Versuchsvorschrift „Chromatographie nach
Tswett“
119 Anlage 16: Versuchsvorschrift „Chromatographie mit
Tafelkreide“
121 Anlage 17: Versuchsvorschrift „Herstellung von DC-Karten“ 122 Anlage 18: Versuchsvorschrift „Dünnschichtchromato-
graphie“
123 Anlage 19: Versuchsvorschrift „Präparative Dünnschicht-
chromatographie und photometrische Untersuchung“
124
1. Einleitung
Das subjektive Empfinden eines Menschen wird ganz entscheidend mitbestimmt durch die unterschiedlichsten Farbeindrücke. Eine besondere Rolle spielt hier die Farbenvielfalt in der Natur. Pflanzen synthetisieren viele unterschiedliche Farbstoffe.
Ich möchte einige Beispiele anführen: Tomate – Lycopin (rot), Curcuma- Wurzel – Curcumin (gelb), Kornblume – Cyanidin (blau), Karotte – Carotin (orange), alle grünen Pflanzenteile – Chlorophyll.
Im Rahmen einer wissenschaftlichen Hausarbeit ist es nicht möglich, Pflanzenfarbstoffe umfassend zu behandeln. Deshalb beschränke ich mich in meiner Arbeit auf Pflanzenfarbstoffe, die in grünen Blättern enthalten sind: die Chlorophylle und die Carotinoide.
Zunächst werde ich darstellen, warum ein Stoff farbig ist und in welcher Beziehung Stoff, Licht und resultierende Farbe stehen. Dies werde ich in Kapitel 2.1. erläutern.
In den Kapiteln 2.3., 2.4. und 2.5. gehe ich auf Chlorophylle, Carotinoide und Chromatographie ein. Zu Beginn eines jeden Kapitels stelle ich die wesentlichen wissenschaftlichen Erkenntnisse dar. Im Anschluss daran folgen die entsprechenden Versuche. Bei der Auswahl der Versuche habe ich darauf geachtet, dass diese von Schülern – überwiegend selbständig – durchgeführt werden können. Dies impliziert die schnelle und einfache Durchführbarkeit der Versuche sowie die Verwendung von möglichst gefahrstoffunbedenklichen Chemikalien.
Ich habe mich auf schulrelevante Versuche beschränkt, weil ich im folgenden Kapitel 3. die Behandlung des Themas „Pflanzenfarbstoffe“ in der Schule darstellen möchte.
Zunächst müssen didaktische Vorüberlegungen bzgl. Lehrplan, Lerngruppengröße und Lernvoraussetzungen der Schüler angestellt werden.
Es müssen eindeutige Lernziele formuliert werden. Sie müssen dem
Leistungsvermögen der Schüler angepasst sein. Dies hat die didaktische
Reduktion des komplexen Themengebietes zu Folge.
Im letzten Teil des Kapitels geht es um die methodisch-didaktische
Umsetzung. Ich werde Mittel und Wege aufzeigen, wie dieses doch recht
komplexe Stoffgebiet Schülern nahe gebracht werden kann.
2. Fachwissenschaftliche Aspekte
2.1. Farbigkeit – was ist das?
Der Farbeindruck eines Stoffes entsteht dadurch, dass dieser Licht aus dem sichtbaren Bereich des Spektrums (λ=380-780 nm) selektiv zu absorbiert, den der Rest reflektiert oder durchlässt.
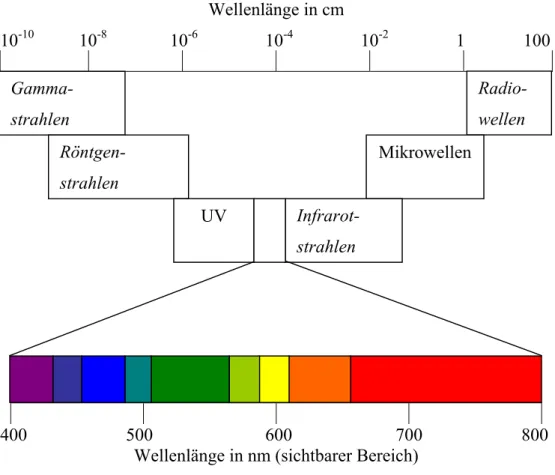
Der sichtbare Bereich zwischen 380 und 780 nm ist jedoch nur ein kleiner Teil der elektromagnetischen Strahlung, wie folgende Abbildung zeigt:
Wellenlänge in cm
10
-1010
-810
-610
-410
-21 100
Gamma-strahlen
Röntgen- strahlen
Infrarot- strahlen
UV
Mikrowellen
Radio- wellen
400 500 600 700 800 Wellenlänge in nm (sichtbarer Bereich)
Abb. 1: Spektrum elektromagnetischer Wellen
Trifft Licht aus dem Bereich des sichtbaren Spektrums auf einen Gegenstand, so kann das komplette Licht absorbiert, reflektiert bzw.
durchgelassen werden. Wird das komplette Licht absorbiert, so erscheint der Gegenstand schwarz. Wird das komplette Licht reflektiert bzw.
durchgelassen, so erscheint der Gegenstand farblos. Wird Licht nur zum
Teil absorbiert, so ergibt die Summe der Spektralfarben, abzüglich der
absorbierten Spektralfarben, den Farbeindruck. Man spricht auch von der Komplementärfarbe.[23]
Spektralfarben
violett indigo blau blau- grün
grün
gelb- grün
gelb orange rot gelb-
grün
gelb orange rot purpur violett indigo blau blau- grün nach Absorption einer Spektralfarbe wahrgenommene Komplementärfarbe
Abb. 2: Übersicht über Spektralfarben und ihre zugehörige Komplementärfarbe
Farbstofftheorie
Schon im 19. Jahrhundert vermuteten Wissenschaftler, dass die unterschiedlichen Farbeindrücke durch verschiedenartige Moleküle bewirkt werden. Es muss Moleküle geben, die kurzwelliges, energiereiches Licht aufnehmen können und wieder andere, die langwelliges, energiearmes Licht absorbieren können. Man sah einen Zusammenhang zwischen der Farbigkeit eines Stoffes und der Struktur seiner Moleküle.
Bereits im Jahre 1868 gelang den deutschen Chemikern Carl Gräbe und Carl Liebermann die Entfärbung bekannter Farbstoffe durch Reduktion. Sie formulierten die folgenden Annahme, konnten sie aber noch nicht beweisen.
„Diejenigen Farbstoffe, zu welchen sich Wasserstoff hinzuaddirt, müssen entweder Elemente mit unvollständig gesättigten Valenzen besitzen, oder es sind in ihnen irgend welche Atome in einer innigeren Lagerung, als zu ihrem Zusammenhange im Molecül nothwendig ist, enthalten.“[18]
Heute würde man diesen Sachverhalt mit dem Begriff
„Mehrfachbindungen“ beschreiben.
Bereits acht Jahre später, also 1876, veröffentlichte der deutsche Chemiker
Otto Nikolaus Witt die „Chromophortheorie“. Er ging davon aus, dass die
Farbstoffnatur bedingt ist durch die gleichzeitige Anwesenheit einer
farbstoffgebenden und einer salzbildenden Gruppe in einem Molekül. Die farbstoffgebende Gruppe bezeichnete er als „Chromophor“. Ein Molekül, das ein Chromophor besitzt, dem aber noch die salzbildende Gruppe fehlt, nannte er „Chromogen“. Als Beispiel führte er Stickstoffdioxid, das Chromophor des Nitroanilins und des Nitrophenols, an, während Nitrobenzol das Chromogen für diese Moleküle darstellt. Erst im Jahre 1888 – also 12 Jahre später – nannte er die salzbildenden Gruppen
„Auxochrome“. Diese Bezeichnung ist heute noch gebräuchlich.[23]
Weil sich die praktischen Möglichkeiten zur Strukturaufklärung von Farbstoffen ständig verbesserten, führte die Chromophortheorie in ihrer Anwendung zu Schwierigkeiten. So ließen sich z.B. die Farbigkeit der Triphenylmethanfarbstoffe oder auch die der Xanthenfarbstoffe nicht ausreichend mit der Chromophortheorie deuten. Rudolf Nietzki veröffentlichte deshalb um 1890 seine „Chinonhypothese“. Er hatte erkannt, dass sowohl die von Witt betrachteten Farbstoffe, als auch die Triphenylmethan- und Xanthenfarbstoffe mit mindestens einer chinoiden Teilstruktur formulierbar sind.
Zu Beginn des 20. Jahrhunderts war es schließlich möglich, die Masse eines Teilchens, das die Energie sichtbaren Lichtes in Form von Eigenschwingungen aufgenommen hatte, zu berechnen. Man schloss daraus, dass Elektronen am Farbeindruck eines Stoffes beteiligt sein müssen. Im Jahr 1908 teilte J. Stark die Valenzelektronen in gesättigte, ungesättigte und gelockerte Valenzelektronen ein. Die Anwendung des klassischen Valenzbegriffes bei den Farbstoffen gelang jedoch nicht. Mit der zuvor von Friedrich Karl Johannes Thiele entwickelten
„Partialvalenzhypothese“ versuchte H. Kaufmann das Problem zu lösen. Er formulierte hierzu einen Valenzausgleich außerhalb des Systems, bzw. um das System herum:
„Die benzoiden und chinoiden Formeln der auxochromhaltigen Nitrokörper stellen zwei Gegensätze dar, zwischen welchen alle möglichen Uebergänge bestehen. Die dazwischen liegenden Zustände lassen sich mit Hülfe von Partialvalenzen ausdrücken. Die Nitrophenolsalze z.B. erhalten demnach etwa die Formel:
NO2 NaO
Abb. 3: Partialvalenz eines Nitrophenolsalzes
wobei die punktirte Linie einen Ausgleich freier Valenz zwischen Auxochrom und Chromophor darstellt.“[18]
Was jedoch zur damaligen Zeit niemand erkannte oder wagte zu formulieren, war der Valenzausgleich innerhalb des Systems. Hinzu kam großer Widerstand gegen die Vermutung, auch organische Moleküle könnten ionisch sein. Diese Annahme verstärkte sich erst nach dem Ersten Weltkrieg.
Weiter geht H. Kaufmann auf den Begriff „Auxochrom“ zurück. Aufgrund einiger gegenläufiger Effekte der Chromophore nannte er diese
„Antiauxochrome“.
Auch K. Gebhard ging im Jahr 1911 davon aus, dass sich Farbstoffe durch weiträumig verbrückte Partialvalenzen auszeichnen. Er formulierte die Partialvalenzen innerhalb des Moleküls. An diese Theorie knüpfte auch das Polymethinkonzept von W. König an. Auch er war der Auffassung, dass nicht eine Partialvalenzbrücke um das System herum sondern ein Valenzausgleich innerhalb des Systems die Farbigkeit eines organischen Moleküls verursacht.
Etwa zur gleichen Zeit wie W. König arbeiteten R. Witzinger und
W. Dilthey an einer Theorie, welche direkt an die Chromophortherie von
O. Witt und R. Nietzky anknüpfte. Die beiden Wissenschaftler betrachteten
die koordinative Sättigung an jedem einzelnen Atom innerhalb des
Moleküls. Atome, in denen sie den eigentlichen Chromophor des Systems
sahen, markierten sie mit einem Punkt („Bonner Punkt“). Hieraus leitet sich
auch der Begriff „Bonner Farbstofftheorie“ ab. Beispielsweise sollte das
zentrale Carbeniumion der Triphenylmethanfarbstoffe deren eigentlicher
Chromophor sein. Bei dieser Theorie wurde aber immer noch verkannt, dass das komplette Elektronensystem eines Moleküls für die Farbe maßgeblich ist.
Etwa um 1930 wurde die „Mesomerielehre“ herangezogen, um die Abhängigkeit von Struktur und Farbe zu klären. Sie war zuvor von deutschen, englischen und amerikanischen Wissenschaftlern aufgestellt worden. Mit Hilfe der Mesomerielehre konnte bewiesen werden, dass nicht einzelne Atome oder Atomgruppen der Chromophor eines Farbstoffes sind sondern das komplette π-Elektronensystem. Der Farbeindruck ist abhängig von der Anzahl der Elektronen und deren Verschiebbarkeit. Hat ein System z.B. eine große Anzahl von π-Elektronen, die leicht beweglich sind – es sind also in der Theorie viele mesomere Grenzstrukturen formulierbar – so ist die zur Anregung benötigte Energie gering und die erscheinende Farbe ist dunkel. Umgekehrt ist die Farbe hell, wenn viel Energie benötigt wird, um wenige, schwer bewegliche π-Elektronen anzuregen. Die freien Elektronenpaare eventuell vorhandener Heteroatome spielen beim Farbeindruck nur eine untergeordnete Rolle.[18]
Grundsätzlich benötigt ein organischer Farbstoff ein Kohlenstoffgerüst mit konjugierten Doppelbindungen, an welchem sich geeignete Substituenten befinden. Diese Substituenten werden nach ihren mesomeren Eigenschaften unterschieden. In diesem Zusammenhang wurden auch die bereits geprägten Begriffe Auxochrom, Chromophor und Chromogen (O. Witt) sowie der Begriff Antiauxochrom (H. Kaufmann) neu definiert. Als Auxochrome werden seither Substituenten bezeichnet, welche Elektronendonatoren sind, also einen +M-Effekt ausüben. Analog sind Antiauxochrome als Elektronenakzeptoren definiert. Sie üben einen –M-Effekt aus. Der Chromophor ist der Teil des Moleküls, der die leicht anregbaren
π-Elektronen enthält. Die Gesamtheit aus Chromophor, Auxochrom undAntiauxochrom wird als Chromogen bezeichnet.
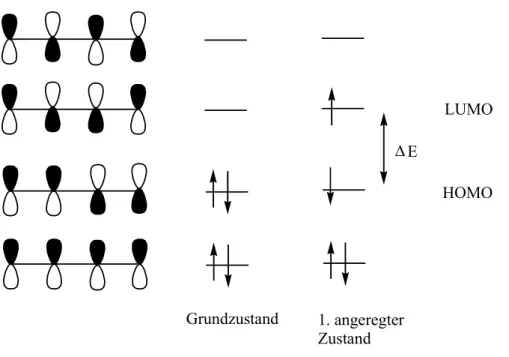
Heute zieht man die MO-Theorie zur Deutung der Farbigkeit heran.
Licht ist in der Lage, Elektronen anzuregen. Diese gehen dabei vom highest
occupied molecul orbital (HOMO) in das lowest unoccupied molecul orbital
(LUMO), den ersten angeregten Zustand, über. Beim Zurückfallen in den
Grundzustand wird die aufgenommene Energie meist als Wärme frei.[11]
HOMO LUMO
∆E
Grundzustand 1. angeregter Zustand
Abb. 4: Übergang von HOMO nach LUMO am Beispiel des Butadiens
Die Energiedifferenz zwischen HOMO und LUMO, ∆E, entspricht dabei genau der Wellenlänge λ des absorbierten Lichtes. Dabei gilt:
∆E = h • ν = λ
hc
Ù λ =
E hc∆
mit:
∆E: Energiedifferenz zwischen HOMO und LUMO in kJ/molh: Plancksche Konstante, h = 6,626 • 10
-34J • s
ν: Frequenz in s-1
c: Lichtgeschwindigkeit, c = 2,998 • 10
8m • s
-1λ: Wellenlänge in nm
Man erkennt, dass nach obiger Gleichung die Absorptionswellenlänge
umgekehrt proportional zum Abstand zwischen Grundzustand und
angeregtem Zustand ist. Somit wird die Absorption um so langwelliger, je
kleiner ∆E ist.[23]
2.2. Die Lichtreaktion der Photosynthese
Unter Photosynthese versteht man die Fähigkeit grüner Pflanzen und Bakterien, mit Hilfe von Lichtenergie und anorganischen Vorstufen organische Verbindungen zu synthetisieren. Man denkt dabei sofort an die Kohlenstoffassimilation, bei der aus dem in der Luft vorkommenden Kohlenstoffdioxid Kohlenhydrate gebildet werden. Die Lichtenergie wird genutzt, um Ammoniumstickstoff aus aufgenommenem Nitrat (Nitratassimilation) zu bilden sowie Sulfat zu Sulfid zu reduzieren (Sulfatassimilation). Auch der Kohlenstoff im Kohlenstoffdioxid und der Stickstoff im Nitrat werden bei der Photosynthese reduziert. Die zur Reduktion benötigten Elektronen entstammen bei grünen Pflanzen dem Wasser. Bei der Lichtreaktion (Teilreaktion der Photosynthese) werden aus dem Photosynthesepigment Chlorophyll nach der Absorption von Licht Elektronen freigesetzt und über Elektronentransportketten auf Ferredoxin übertragen. Das dadurch reduzierte Ferredoxin dient nun als Elektronendonator bei der Schwefel- und Stickstoffassimilation. Es ist auch in der Lage, oxidierte Purinnucleotide (NADP
+) unter Bildung der Reduktionsmittel NADPH + H
+zu reduzieren. Die Lichtreaktion läuft an den Thylakoidmembranen, welche sich im Stroma der Chloroplasten befinden, ab. Außerdem wird bei der Lichtreaktion auch ATP gebildet.
Dieses und das Reduktionsmittel NADPH werden zur Kohlenstoffassimilation genutzt. Die Synthese von Kohlenhydraten aus Kohlenstoffdioxid wird auch als „Dunkelreaktion“ bezeichnet. Der Name Dunkelreaktion rührt daher, dass diese Reaktion nicht direkt lichtabhängig ist. Sie würde auch bei entsprechender Verfügbarkeit von ATP und NADPH im Dunkeln ablaufen. Jährlich werden etwa 275 Milliarden Tonnen Kohlenstoffdioxid durch Pflanzen gebunden. Die dazu benötige Menge an Lichtenergie liegt bei 10
25J pro Jahr.[20][21]
Photosynthesepigmente – Chlorophylle und Carotinoide
Der Prozess der Photosynthese beginnt mit der Absorption von Photonen.
Diese Absorption erfolgt durch Photosynthesepigmente, die dabei in einen
angeregten Zustand übergehen. Hierbei sind die Chlorophylle von zentraler
Bedeutung. Das wichtigste Chlorophyll ist dabei das Chlorophyll a. Neben diesem kommt bei höheren Pflanzen zusätzlich noch das Chlorophyll b vor.
Das Verhältnis von Chlorophyll a : Chlorophyll b beträgt 3:1.[20]
N
N N
N
O H3C
HC CH2
R
CH2 CH3
CH3
C O
O
CH3 CH2
H2C C O
CH3
CH3 CH3
CH3
CH3 O
H3C
Mg R: CH3 Chlorophyll a
R: CHO Chlorophyll b
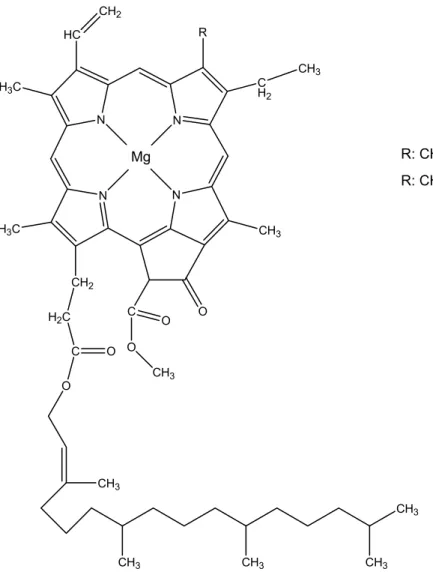
Abb. 5: Molekülstruktur Chlorophyll a bzw. Chlorophyll b
Wie wichtig die Chlorophylle sind, zeigt sich darin, dass diese an den Orten der photosynthetischen Primärprozesse, den Reaktionszentren, vorkommen.
Chlorophylle sind auch Bestandteile der Lichtsammelkomplexe (light harvesting complex, LHC), welche die Reaktionszentren als „Antennen“
umgeben. Sie sorgen für eine viel effektivere Lichtabsorption. Als weitere
Antennenpigmente sind die Carotinoide zu nennen. Die Antennenpigmente
(Chlorophylle und Carotinoide) bezeichnet man auch als akzessorische
Photosynthesepigmente.[21]
Chlorophylle absorbieren Licht im Bereich von 400 – 480 nm (blau) und 550 – 700 nm (gelb bis rot). Im Bereich zwischen 480 nm und 550 nm ist nur eine sehr geringe Lichtabsorption durch Chlorophyll feststellbar. Da dies der Bereich des grünen Lichtes ist, erscheinen chlorophyllhaltige Pflanzenteile grün. Man spricht man auch von der „Grünlücke“. Diese Lücke wird teilweise durch das Photosynthesepigment β-Carotin, ein Carotinoid geschlossen, das genau in diesem Bereich ein lokales Absorptionsmaximum besitzt.[5]
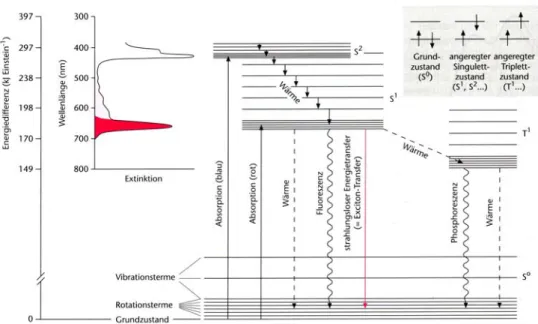
Wichtig für die Lichtabsorption der Photosynthesepigmente ist das Vorhandensein von delokalisierten π-Elektronen. Im Falle der Chlorophylle liegen diese Elektronen in einem Ringsystem (Porphyrinring) vor. Dieses ermöglicht es ihnen nicht nur zu oszillieren sondern zusätzlich noch im Ringsystem zu zirkulieren. Durch geringe Energien ist es möglich, die π- Elektronen aus dem Grundzustand (S
0) auf höhere Energieniveaus anzuheben. Hierbei geht das Molekül in einen angeregten Zustand über.
Von zentraler Bedeutung sind der erste Singulettzustand (S
1), welcher einer Rotabsorption entspricht, und der zweite Singulettzustand (S
2), der einer Blauabsorption entspricht. Beiden Zuständen ist gemeinsam, dass zwei ungepaarte Elektronen mit antiparallelem Spin vorliegen. Beim Prozess der Anregung hat also keine Spinumkehr stattgefunden. Ein weiterer wichtiger angeregter Zustand ist der erste Triplettzustand (T
1). Dieser kann nur aus dem ersten Singulettzustand heraus erreicht werden, da dessen Lebensdauer mit etwa 15 • 10
-6s lang genug für eine Spinumkehr ist. Im Triplettzustand liegen folglich zwei ungepaarte Elektronen mit parallelem Spin vor. Der zweite Singulettzustand ist mit 10
-12s zu kurzlebig für eine Spinumkehr.
Der Triplettzustand des Chlorophylls ist für die Photosynthese nicht bedeutsam. Beim Übergang in den Grundzustand kann die Energie nur in Form von Wärme und Phosphoreszenz abgegeben werden. Allerdings ist ein Chlorophyllmolekül im Triplettzustand in der Lage, Sauerstoff zu einem Singulett-Sauerstoff anzuregen. Dieser ist chemisch sehr reaktiv und wirkt gewebeschädigend. Das β-Carotin ist in der Lage, die Energie vom Singulett-Sauerstoff zu übernehmen, ohne dabei selbst zerstört zu werden.
Man spricht auch von „quenchen“. Dadurch wird eine Schädigung des
Gewebes vermieden. [20][21]
Abb. 6: Jablonski-Diagramm
Wie obige Abbildung zeigt, geschieht die Abgabe der Energie auf
verschiedene Arten. Nur ein Teil dieser Prozesse kann zur Leistung
chemischer Arbeit genutzt werden. Sie sind mit dem Übergang vom ersten
Singulettzustand in den Grundzustand verknüpft. Hierbei kann es zu einem
Excitonentransfer (strahlungsloser Energietransfer) zwischen benachbarten
Chlorophyllmolekülen kommen. Dies ist jedoch nur möglich, wenn der
Abstand zwischen den beiden Chlorophyllmolekülen kleiner als 10 nm ist
und wenn die Absorptionsfähigkeit des energieaufnehmenden
Chlorophyllmoleküls niederenergetischer als die Absorption des
energieabgebenden Chlorophyllmoleküls ist. Dieser Mechanismus ist die
Grundlage für den Energietransport vom Lichtsammelkomplex zum
Reaktionszentrum. Das im Reaktionszentrum befindliche Chlorophyll a hat
bedingt durch eine besondere Proteinumgebung die niedrigste
Energieabsorption. Daher erfolgt der Excitonentransfer immer von den
Chlorophyllmolekülen der „Antennen“ zum Chlorophyllmolekül im
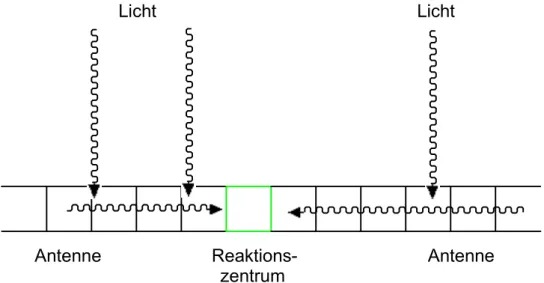
Reaktionszentrum. [20]
Antenne Reaktions- Antenne zentrum
Licht Licht
Abb. 7: Schematische Darstellung des Excitonentransfers von den Antennen zum Reaktionszentrum
Nur in seltenen Fällen wird das Chlorophyllmolekül im Reaktionszentrum direkt durch ein Photon angeregt. Da das Chlorophyllmolekül die aufgenommene Energie an kein Molekül mit niedrigerer Energieabsorption weiterleiten kann, gibt es unter Bildung eines positiv geladenen Radikals ein Elektron ab. Unter Aufnahme eines Elektrons aus der Wasserspaltung (s.u.) geht das Chlorophyllmolekül wieder in den Grundzustand zurück. Bei optimalen Bedingungen läuft dieser Prozess etwa 100 – 200 mal pro Sekunde ab.
Chl a
→∆EChl a
+•+ e
-Der Prozess der Ladungstrennung ist der entscheidende Schritt bei der Photosynthese. Die kurzlebige Anregungsenergie der Photonen ist in ein elektrisches Potential umgesetzt worden, welches wesentlich langlebiger ist.
Dieses Potential kann nun in chemische Arbeit umgewandelt werden. [20]
Beschreibung des Elektronentransportes
Bereits 1937 stellte R. Hill bei Untersuchungen von belichteten
Blattextrakten fest, dass diese in Gegenwart von künstlichen
Elektronenakzeptoren (A), wie z.B. Fe
3+, Disauerstoff entwickeln. Bei
dieser nach ihm benannten „Hill-Reaktion“ wird als Elektronendonator
ausschließlich Wasser benötigt. Kohlenstoffdioxid ist an dieser Reaktion nicht beteiligt.
2 H
2O + 4 A
→Licht4 A
-+ 4 H
++ O
2Daraus folgt, dass der bei der Photosynthese entwickelte Sauerstoff aus dem Wasser stammt und nicht aus dem Kohlenstoffdioxid. Die Reduktion von Kohlenstoffdioxid zu Kohlenhydraten ist also ein Prozess, den man von der Lichtreaktion trennen muss, die Dunkelreaktion (s.o.).
Untersuchungen haben gezeigt, dass der natürliche Elektronenakzeptor der
„Hill-Reaktion“ NADP
+ist. [20]
N H
C
H H
H NH2 O
2 H2O + 2
N
C
H H
H NH2 O
+ 2 H+ + O2
H H
2
NADP+ NADPH
Es werden zwei in Serie geschaltete Lichtreaktionen benötigt, um NADP
+mit den Elektronen des Wassers zu reduzieren. Diese Reaktionen laufen in den Photosystemen I und II ab, welche nach der Reihenfolge ihrer Entdeckung nummeriert wurden. Tatsächlich beginnt die Photosynthese mit der Anregung eines Chlorophyll-Moleküls im Photosystem II. Die aufgenommene Energie wird von dort über Elektronentransportketten auf den Cytochrom-b
6/f-Komplex übertragen. Über andere Elektronentransportketten gelangen die Elektronen schließlich zum Chlorophyllmolekül im Reaktionszentrum vom Photosystem I. [21]
Die Chlorophyllmoleküle der Reaktionszentren der jeweiligen
Photosysteme unterscheiden sich in ihrem Absorptionsverhalten. Das
Chlorophyllmolekül im Reaktionszentrum des Photosystems II absorbiert
maximal bei 680 nm. Man bezeichnet es deshalb auch als P680. Da das
Chlorophyllmolekül im Reaktionszentrum des Photosystems I bei 700 nm maximal absorbiert, wird es analog P700 genannt. [21]
2.3. Chlorophyll
2.3.1. Varianten - Molekülstruktur
Der Begriff „Chlorophyll“ leitet sich aus dem griechischen ab und bedeutet
„grünes Blatt“.
Erst zu Beginn des 20. Jahrhunderts begannen die Forschungen zur Strukturaufklärung des Chlorophylls. Der deutsche Chemiker Richard Willstätter stellte zu dieser Zeit erste Forschungen zu Photosynthese und Chlorophyll sowie dem strukturell ähnlichen Häm an. [8]
Im Jahr 1940 konnte der Chemiker Hans Fischer schließlich die Struktur des Chlorophylls aufklären. Hierzu zerlegte er ein Chlorophyllmolekül in kleinere definierte Bruchstücke. Deren Struktur bewies er durch ihre Synthese. [8]
Zwanzig Jahre später konnten die US-amerikanischen Chemiker Woodward, Strell und Treibs die von Fischer entwickelte Chlorophyllformel durch zwei Totalsynthesen beweisen. [8]
Einteilung
Grundbaustein der Chlorophylle ist das Pyrrol.
N H
Abb. 8: Molekülstruktur Pyrrol
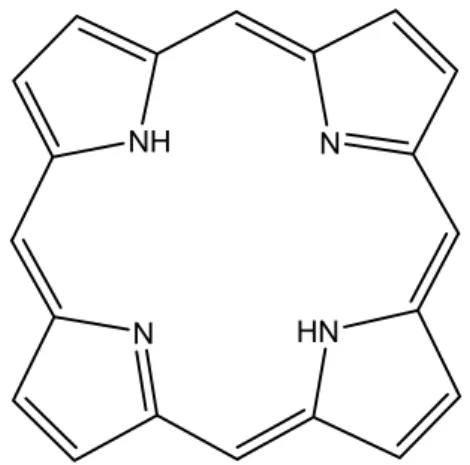
Sind diese Pyrrole über Methinbrücken zu einem Ring geschlossen, so
spricht man von einem Porphyrin. [21]
N
NH N
HN
Abb. 9: Molekülstruktur Porphyrin
Chlorophyll enthält zusätzlich noch ein Magnesium-Ion als Zentralatom.
Jedes Stickstoffatom der vier Pyrrolringe ist kovalent an das Magnesium
gebunden. Es handelt sich um vier gleichwertige, nicht unterscheidbare
Bindungen. Deshalb bezeichnet man den Porphyrinring als vierzähnigen
Chelatliganden. Außerdem besitzt Chlorophyll noch einen
charakteristischen isozyklischen Fünferring sowie verschiedene
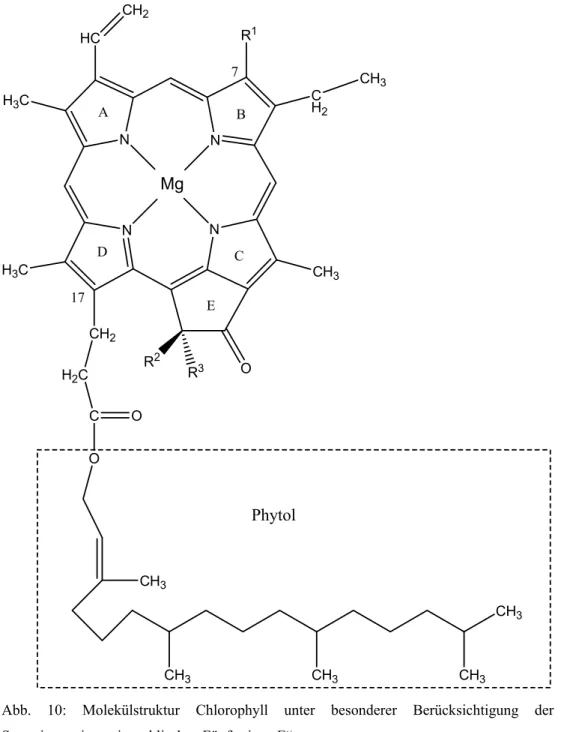
Substituenten an den Pyrrolringen. [7][22]
N
N N
N
O H3C
HC CH2
R1
CH2
CH3
CH3
CH2 H2C
C
CH3
CH3 CH3
CH3
CH3 O
H3C
Mg
7
A B
D C 17
O
Phytol
E
R2 R3
Abb. 10: Molekülstruktur Chlorophyll unter besonderer Berücksichtigung der Stereoisomerie am isozyklischen Fünferring „E“
Pigment R
1R
2R
3Chlorophyll a CH
3H COOCH
3Chlorophyll a’ CH
3COOCH
3H
Chlorophyll b CHO H COOCH
3Chlorophyll b’ CHO COOCH
3H
Der Unterschied zwischen Chlorophyll a und Chlorophyll b ist der
Substituent am C
7-Atom. Während Chlorophyll a an dieser Stelle eine
Methylgruppe besitzt, befindet sich dort beim Chlorophyll b eine
Aldehydgruppe. Bei den Chlorophyllen a’ bzw. b’ handelt es sich um
Stereoisomere der Chlorophylle a bzw. b. Die jeweiligen Isomere unterscheiden sich funktionell nicht, jedoch besitzen sie unterschiedliche polare Eigenschaften und kommen nur in geringer Konzentration in Pflanzenzellen vor. (vgl. Versuch: Präparative Dünnschicht- chromatographie). [7]
Allen Chlorophyllen gemeinsam ist der Propionylrest am C
17-Atom. Mit diesem ist im Fall der Chlorophylle a und b der langkettige Alkohol Phytol verestert. Dieser lipophile Alkohol dient der Verankerung der Chlorophyllmoleküle im lipophilen Innenbereich der Chlorophyll- bindeproteine. Diese sitzen in den Antennen oder in den Reaktionszentren.
Strukturell handelt es sich bei Phytol um einen C
20-Körper, ein Diterpen (vgl. Carotinoide). [20] [5]
Ein Chlorophyllmolekül ohne Phytolrest wird als Chlorophyllid bezeichnet (vgl. Versuch: Verseifung der Chlorophylle). [24]
Wird aus den Chlorophyllmolekülen das Zentralatom entfernt, so erhält man die Stoffgruppe der Phaeophytine (vgl. Versuch: Darstellung der Phaeophytine). Die Phaephytine sind auch Bestandteil der Elektronentransportkette im Photosystem II. Dort übernehmen sie Elektronen von angeregten P680 Molekülen und leiten diese über Plastochinon zum Cytochrom-b
6/f-Komplex. [21]
Vorkommen und Funktion der Chlorophylle
Wie schon im Kapitel „Lichtreaktion der Photosynthese“ beschrieben handelt es sich bei den Chlorophyllen um Photosynthesepigmente der grünen Pflanzen. Sie absorbieren Photonen und gehen dabei in einen angeregten Zustand über, den Beginn des Photosyntheseprozesses.[21]
Neben grünen Pflanzen betreiben aber auch andere Organismen Photosynthese. So verfügen z.B. Cyanobakterien über Chlorophyll a.
Rotalgen (Rhodophyta) enthalten zusätzlich noch Chlorophyll c, welches
sich strukturell nur durch einen anderen Rest am C
17-Atom vom
Chlorophyll a unterscheidet. Grünalgen (Chlorophyta) enthalten
Chlorophyll a und b. Auch einzellige Flagellaten (Geißeltierchen) der
Gattung Euglena besitzen Chlorophyll a und b. Kommen diese in Pfützen
und Gräben in großen Mengen vor, so verfärbt sich das Wasser grün.
[20][25]
2.3.2. Extraktion von Blattgrün
Um Blattgrün untersuchen zu können, muss dieses zuerst aus dem pflanzlichen Gewebe extrahiert werden.
Verschiedene Methoden der Extraktion werde ich in diesem Abschnitt beschreiben.
Versuch 1: Kaltextraktion von Blattgrün [5][24]
Chemikalien:
Substanz Gefahrensymbol R-Sätze S-Sätze
Aceton F, Xi 11-36-66-67 9-16-26
Methanol T, F 23/24/25-
39/23/24/25
7-16-36/37-45
Calciumcarbonat - - -
Seesand - - -
Geräte:
Mörser mit Pistill, Trichter, Faltenfilter, Becherglas, Messpipette 20 mL, Pipettierhilfe
Durchführung:
Im Abzug werden etwa 10 g frische grüne Blätter in einem Mörser mit einer Spatelspitze Calciumcarbonat, etwas feinem Seesand sowie 1 mL Aceton versetzt. Alternativ kann man auch tiefgekühlten Spinat („ohne Sahne“) verwenden. Dieser sollte jedoch vor seiner Verwendung mittels Faltenfilter oder Toilettenpapier ausgepresst werden.
Das Gemenge im Mörser wird nun mit einem Pistill zu einem feinen Brei zerrieben, mit 20 mL Aceton versetzt und 20 Minuten stehen gelassen.
Danach wird durch einen Faltenfilter abfiltriert und zweimal mit 5 mL
Aceton nachgespült. Das Filtrat wird zur weiteren Verwendung lichtgeschützt in einem verschließbaren Gefäß aufbewahrt.
Analog kann man auch mit Methanol extrahieren. Die Art der Folgeversuche entscheidet über das zu verwendende Extraktionsmittel (vgl.
2.5.2. Versuch: Präparative Dünnschichtchromatographie)
Beobachtung:
Bereits beim Abfiltrieren kann man nebenbei einen chromatographischen Effekt beobachten. Der Blattextrakt wandert aufgrund kapillarer Kräfte am Filterpapier nach oben. Mehrere gelbe und grünen Banden sind zu erkennen.
In der Vorlage sammelt sich eine intensiv grüne Lösung.
Abb. 11: Chromatographischer Effekt auf Filterpapier
Auswertung:
Beim Mörsern werden die Pflanzenzellen zerstört. Blatteigene Säuren können nun Chlorophyll verseifen (vgl. Versuch: Verseifung der Chlorophylle). Um dies zu verhindern, wird beim Mörsern eine Spatelspitze Calciumcarbonat zugesetzt, das die blatteigenen Säuren neutralisiert.
CaCO
3(s)+ H
2O
(l)Ca
2+(aq)+ HCO
3-(aq)
+ OH
-(aq)H
3O
+(aq)+ OH
-(aq)2 H
2O
(l)Die Blattfarbstoffe lösen sich im polaren Lösungsmittel Aceton bzw.
Methanol.
Entsorgung:
Der Faltenfilter wird getrocknet und in der Feststofftonne entsorgt.
Versuch 2: Heißextraktion von Blattgrün [5]
Chemikalien:
Substanz Gefahrensymbol R-Sätze S-Sätze
Aceton F, Xi 11-36-66-67 9-16-26
Methanol T, F 23/24/25-
39/23/24/25
7-16-36/37-45
Geräte:
Reagenzglas, Reagenzglasklammer, Wasserbad, Siedesteinchen, Becherglas
Durchführung:
In ein Reagenzglas werden 2-3 Siedesteinchen und 2 gerollte Blätter (z.B.
Ficus benjamina, Hedera helix, Tilia chordata) gegeben. Anschließend wird
im Abzug mit Aceton überschichtet und im Wasserbad mehrmals kurz aufgekocht. Wenn das Lösungsmittel eine intensiv grüne Farbe angenommen hat, überführt man dieses in ein Becherglas. Die Blätter im Reagenzglas werden ein weiteres Mal mit Aceton überschichtet und erneut mehrmals kurz aufgekocht. Die Lösung wird in das Becherglas dazugegossen. Zum Aufkonzentrieren wird bis zur Trockne eingedampft und in wenig Aceton wieder aufgenommen.
Entsprechend lässt sich statt Aceton auch Methanol verwenden.
Beobachtung:
Bereits nach kurzer Zeit färbt sich das Lösungsmittel grün. Bei den Blättern
kann nach Beendigung des Versuches eine Entfärbung festgestellt werden.
Auswertung:
Blattfarbstoffe lösen sich im polaren Lösungsmittel Aceton bzw. Methanol.
Bedingt durch die Tatsache, dass ganze Blätter verwendet wurden - Pflanzenzellen wurden nicht zerstört – kann keine Verseifung stattfinden.
Deshalb kann auf Calciumcarbonat verzichtet werden.
Entsorgung:
Die Blätter werden in der Feststofftonne entsorgt.
Vergleich: Extraktionsmethoden - Lösungsmittel
Sowohl Aceton als auch Methanol sind in der Lage, Blattfarbstoffe aus pflanzlichem Gewebe zu extrahieren. Untersucht man jedoch die verschiedenen Extrakte chromatographisch, dann zeigen sich Unterschiede.
Bei der Verwendung von Aceton macht es keinen Unterschied, ob kalt oder heiß extrahiert wurde. Im Chromatogramm können maximal zwei Xanthophylle, β-Carotin sowie Chlorophyll a und b aufgetrennt werden.
Setzt man bei der Chromatographie jedoch einen Heißextrakt mit Methanol ein, dann werden zusätzlich sichtbar Chlorophyll a’ und b’ sowie ein drittes Xanthophyll (vgl. Versuche zur Chromatographie).
Für die meisten Versuche mit Blattgrün ist ein Acetonextrakt völlig
ausreichend.
2.3.3. Versuche zum Nachweis von charakteristischen Strukturelementen Versuch 3: Darstellung der Phaeophytine [24]
Chemikalien:
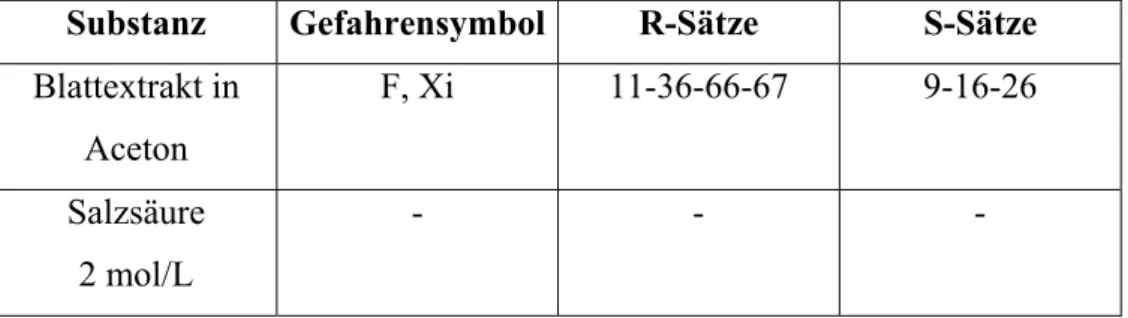
Substanz Gefahrensymbol R-Sätze S-Sätze Blattextrakt in
Aceton
F, Xi 11-36-66-67 9-16-26 Salzsäure
2 mol/L
- - -
Geräte:
Reagenzglas, Stopfen, Pasteurpipette
Durchführung:
Ein Reagenzglas wird etwa 2 cm hoch mit der Blattextraktlösung befüllt.
Anschließend werden einige Tropfen Salzsäure, 2 mol/L, zugesetzt, das Reagenzglas mit einem Stopfen verschlossen und geschüttelt.
Beobachtung:
Die Lösung im Reagenzglas verfärbt sich braun.
Abb. 12: linkes Reagenzglas: reiner Blattextrakt, rechtes Reagenzglas Blattextrakt mit Salzsäure (Phaeophytin)
Auswertung:
Wie bereits im Kapitel 2.3.1. beschrieben, befindet sich im Zentrum eines jeden Chlorophyllmoleküls ein Magnesium-Ion als Zentralatom. Der Porphyrinring ist der zugehörige Ligand des Komplexes. Jedes der vier Stickstoffatome im Porphyrinring trägt mit einem Elektronenpaar zur Komplexbildung bei. Durch milde Säurebehandlung wird der Komplex zerstört. Zwei Protonen ersetzen das zentrale Magnesium-Ion. Ein Chlorophyllmolekül ohne Magnesium-Ion als Zentralatom wird als Phaeophytin bezeichnet.
Chlorophyll
(solv)+ 2 H
3O
+(aq)Phaeophytin
(solv)+ 2 H
2O
(l)+ Mg
2+(aq)Durch das Herauslösen des Magnesium-Ions verliert das Chlorophyll seine typischen Absorptionseigenschaften. Die Lösung färbt sich braun.
Entsorgung:
Die Lösung kann neutral im Behälter für organische Lösungsmittel entsorgt
werden.
Versuch 4: Nachweis des Magnesium-Ions [22]
Chemikalien:
Substanz Gefahrensymbol R-Sätze S-Sätze Salzsäure
4 mol/L
Xi 36/37/38 26 Titangelb-Lösung
(gesättigt)
- - - Natronlauge
2 mol/L
C 35 26-36/37/39-45
Magnesiumchlorid - - -
Spinat - - -
Geräte:
Erlenmeyerkolben 100 mL, Spatel, Glasstab, Bunsenbrenner, Dreifuß mit Drahtnetz, Messpipette 10 mL, Pipettierhilfe, Faltenfilter, Trichter
Durchführung:
Etwa 10 g Spinat werden mit 10 mL Salzsäure, 4 mol/L, im Abzug aufgekocht. Anschließend wird die farblose Lösung abgefiltert. Das Filtrat wird mit Natronlauge, 2 mol/L, neutralisiert und mit entionisiertem Wasser auf 100 mL aufgefüllt.
In einem zweiten Erlenmeyerkolben wird eine Spatelspitze Magnesiumchlorid in etwa 100 mL entionisiertem Wasser gelöst. Diese Magnesiumchloridlösung dient als Vergleichslösung.
Beide Lösungen werden mit Natronlauge, 2 mol/L, alkalisch gemacht und mit drei Tropfen Titangelb-Lösung versetzt.
Beobachtung:
Durch Zusatz von Natronlauge kommt es in beiden Fällen zu einer leichten Trübung der Lösung.
In beiden Lösungen fällt nach Zusatz der Titangelb-Lösung ein roter
Feststoff aus.
Abb. 13 und 14: Magnesiumchlorid-Lösung und Extrakt aus Spinat vor und nach Zugabe von Titangelb-Lösung. Im jeweils linken Erlenmeyerkolben befindet sich die Magnesiumchlorid-Lösung, im jeweils rechten Erlenmeyerkolben der Extrakt aus Spinat.
Auswertung:
Die beobachtete Trübung wird durch entstehendes Magnesiumhydroxid hervorgerufen. Dieses ist weiß und schwerlöslich.
Mg
2+(aq)+ 2 OH
-(aq)Mg(OH)
2(s)Die Magnesium-Ionen werden bei Zusatz einer Titangelb-Lösung im alkalischen Milieu als roter Komplex gefällt. Es handelt sich um eine charakteristische Nachweisreaktion für Magnesium-Ionen. Allerdings ist die genaue Struktur des entstehenden Komplexes nicht bekannt.
Da man in beiden Fällen zur gleichen Beobachtung kommt, ist gezeigt, dass durch Säureeinwirkung Magnesium-Ionen aus dem Chlorophyll gelöst werden.
Entsorgung:
Die Lösungen können neutral im Behälter für organische Lösungsmittel
entsorgt werden.
Versuch 5: Verseifung der Chlorophylle [24]
Chemikalien:
Substanz Gefahrensymbol R-Sätze S-Sätze Blattextrakt in
Aceton
F, Xi 11-36-66-67 9-16-26 Kalilauge
w=0,6
C 22-35 26-36/37/39-45
Geräte:
Reagenzglas, Messpipette 10 mL, Pipettierhilfe, Stopfen
Durchführung:
Ein Reagenzglas wird etwa 3 cm hoch mit Blattextrakt-Lösung befüllt. Die Lösung versetzt man mit 2 mL Kaliumhydroxid-Lösung, w=0,6.
Anschließend wird das Reagenzglas mit einem Stopfen verschlossen und kräftig geschüttelt.
Beobachtung:
Nach dem Schütteln kann man eine Schaumentwicklung erkennen.
Abb. 15: Verseifter Blattextrakt
Auswertung:
Der Phytolrest des Chlorophylls ist über eine Esterbindung mit dem Propionylrest am C
17-Atom des Porphyrinringes verbunden. Durch Zusatz von Säuren oder Laugen, kann die Esterbindung gespalten werden. Im vorliegenden Versuch handelt es sich um eine basische Esterspaltung. Man spricht auch von einer Verseifung.
Mechanistisch lässt sich die Verseifung folgendermaßen darstellen: [11]
Zu besseren Übersicht ist der Phytolrest mit C
20H
39abgekürzt, das Ringgerüst mit R.
Im ersten Schritt greift ein Hydroxid-Ion nucleophil am positiv polarisierten Carbonylkohlenstoff der Esterbindung an. Dabei wird das bindende
π-Elektronenpaar der Carbonylgruppe zum Carbonylsauerstoff verschoben.R
C O
O
C20H39
HO
R
C O
O
C20H39 OH
Im zweiten Schritt greift ein Elektronenpaar des formal negativ geladenen Sauerstoffatoms nucleophil an einem Wasserstoffatom eines Wassermoleküls an. Dabei entsteht ein Diol und ein Hydroxid-Ion.
R
C O
O
C20H39
OH
O H
H
R
C OH
O
C20H39
OH
+ HO
Unter Abspaltung eines Protons kommt es schließlich zur Spaltung der
Estergruppe. Dabei entstehen als Produkte eine Carbonsäure und ein
Alkoholat-Ion.
R
C OH
O
C20H39
O H
- H+
R
C O OH
+ O C20H39
In einem letzen irreversiblen Schritt greift das Alkoholat nucleophil am Proton der Carbonsäuregruppe an. Es entstehen dabei Alkohol und Carboxylat-Ion (Verseifung). Das Carboxylat-Ion ist gut mesomeriestabilisiert und besitzt als Gegenion ein Kaliumion aus der Kaliumhydroxid-Lösung.
R
C O OH
+ O C20H39
R
C O O
+ HO C20H39 + K+
K+
Bezogen auf ein Chlophyllmolekül handelt es sich beim Carboxylat-Ion um das so genannte Chlorophyllid und beim Alkohol um Phytol.[24]
Durch Schaumbildung kann die Seifenentstehung gezeigt werden.
Entsorgung:
Die Lösung kann neutral im Behälter für organische Lösungsmittel entsorgt
werden.
2.3.4. Versuch zum Nachweis der Sauerstoffproduktion mit Indigo Vorbemerkung: Gewinnung des Farbstoffes Indigo [14]
Bei „Indigo“ handelt es sich um einen aus der in Indien beheimateten Pflanze
Indigofera tinctoria gewonnenen Farbstoff. In dieser Pflanze liegtdas farblose Glucosid Indican vor. Es wird gewonnen und zu Indigo verarbeitet. Durch enzymatische Hydrolyse wird das Glucosid zunächst in Glycose und Indoxyl gespalten. Durch Luftsauerstoff werden dann zwei Indoxyl-Moleküle zu einem Indigo-Molekül oxidiert. Dieses Indigo- Molekül ist blau und wasserunlöslich. Um es in eine wasserlösliche Form zu bringen, wird es mit Natriumdithionit in alkalischer Lösung reduziert.
Heute wird Indigo nach dem von Adolf von Baeyer entwickeltem Verfahren aus ortho-Nitrobenzaldehyd und Aceton hergestellt.
Verwendung findet der Farbstoff in der Textilindustrie (Küpenfärbung mit Indigo).
Versuch 6: Nachweis der Sauerstoffproduktion [3]
Chemikalien:
Substanz Gefahrensymbol R-Sätze S-Sätze
Indigopulver - - -
Natriumdithionit Xn 7-22-31 7/8-26-28-43
Natronlauge w=0,1
C 35 26-37/39-45
Ethanol F 11 7-16
Wasserpest - - -
Geräte:
Mörser mit Pistill, Bunsenbrenner, Dreifuß mit Drahtnetz, Thermometer
Schraubdeckelgläser 100 mL,
Durchführung:
In einem Mörser werden 0,9 g Indigo mit etwas Ethanol und 10 mL Natronlauge, w=0,1, verrieben. Anschließend überführt man die Suspension in 300 mL Wasser, das auf 70 °C vorgewärmt wurde. Danach rührt man so viel Natriumdithionit hinzu, bis die Lösung gerade gelb-grün wird.
In die Schraubdeckelgläser gibt man je einen Spross Wasserpest.
Anschließend befüllt man die beiden Gläser bis zum oberen Rand mit der Lösung. Eventuell auftretende Blaufärbung wird unter Einrühren von Natriumdithionit beseitigt. Danach werden die Gläser verschlossen
Das erste Schraubdeckelglas wird vor eine Lichtquelle gestellt, das andere lichtgeschützt aufbewahrt.
Beobachtung:
Nach etwa 90 Minuten hat die hell stehende Lösung eine blaue Farbe angenommen. Die Farbe der dunkel gelagerten Lösung ist unverändert.
Abb. 16 und 17: Dunkel gelagerte und belichtete Wasserpestpflanzen
Auswertung:
Indigo ist ein Redox-Indikator. In der oxidierten Form handelt es sich um
den Farbstoff selbst. Dieser ist blau und wasserunlöslich. Die reduzierte
Form wird Leukoindigo genannt. Sie ist wasserlöslich und gelb-grün.
Versetzt man Indigo in alkalischer Lösung mit dem Reduktionsmittel Natriumdithionit, so wird Indigo zur Leukoform reduziert.
NH O
HN
O
NH OH
HN
OH
+ S2O42-(aq) + 2 OH-(aq)
+ 2 SO32-(aq) Indigo
Leukoindigo
Im Verlauf der Reduktion verliert Indigo seine typische blaue Farbe. Durch Sauerstoff wird Leukoindigo wieder zu Indigo oxidiert (Blaufärbung).
NH OH
HN
OH
+ O2
Leukoindigo
NH O
HN
O
Indigo 2
2 + 2 H2O
Im belichteten Gefäß färbt sich Leukoindigo blau. Da das Gefäß geschlossen war, kann das Oxidationsmittel Sauerstoff nicht aus der Luft stammen. Es muss also von der Pflanze selbst produziert worden sein.
Im unbelichteten Gefäß bleibt die Blaufärbung aus. Folglich wurde kein Sauerstoff produziert.
Durch diesen Versuch kann gezeigt werden, dass im Verlauf der Photosynthese Sauerstoff gebildet wird und die Photosynthese lichtabhängig ist.
Entsorgung:
Die Lösungen werden neutral im Behälter für organische Lösungsmittel
entsorgt.
2.4. Carotinoide
2.4.1. Varianten - Molekülstruktur
Carotinoide sind Pflanzenfarbstoffe, die im gesamten Pflanzenreich vorkommen.
Bereits im Jahr 1837 bezeichnete Berzelius die gelben, alkohollöslichen Pigmente des Herbstlaubes als „Xanthophylle“.[2]
Fremy und Stokes konnten 1860 und 1884 als erste nachweisen, dass diese Farbstoffe auch in grünen Blättern vorkommen.[2]
Erst im Jahr 1911 gelang es dem russischen Botaniker und Biochemiker Mikail Tswett die gelben Pigmente chromatographisch aufzutrennen.
Aufgrund ihrer unterschiedlichen Löslichkeit in organischen Lösungsmitteln unterteilte er die Pigmente in die Gruppe der „Xanthophylle“ und in die Gruppe der „Carotine“. Als Überbegriff für beide Gruppen wählte er den Begriff „Carotinoide“.[2]
In den zwanziger Jahren des letzten Jahrhunderts gelang es schließlich verschiedenen Wissenschaftlern (u.a. Karrer, Kuhn, Heilbron und Zechmeister), die Strukturen verschiedener Carotinoide aufzuklären.
Bis zum heutigen Tag wird die Einteilung der Carotinoide in Carotine und Xanthophylle nach Tswett beibehalten. Heute versteht man unter Carotinen reine Kohlenwasserstoffe, unter Xanthophyllen mit Sauerstoff oxidierte Kohlenwasserstoffe. [5]
Einteilung
Die Carotinoide gehören zur Stoffklasse der Isoprenoiden. Dieser Oberbegriff leitet sich vom Grundbaustein aller Isoprenoide, dem Isopren, ab.
Abb. 18: Molekülstruktur Isopren
Während der Biosynthese der Carotinoide werden zwei Isopreneinheiten zu einem Monoterpen (C
10) zusammengelagert. Vier dieser Monoterpene ergeben schließlich das Grundgerüst der Carotinoide, ein Tetraterpen (8 Isoprene, C
40).[21]
Dabei handelt es sich um langgestreckte Moleküle mit 40 Kohlenstoffatomen in einer Reihe mit konjugierten Doppelbindungen.
Die Carotinoide sind gelb bis rot gefärbt. Die Farbe rührt von den chromophoren Eigenschaften der linear konjugierten Doppelbindungen her.
An diesen Doppelbindungen sind cis-trans-Isomere denkbar. Zumeist liegen die Carotinoide in der all-trans-Form vor.[5]
Man unterscheidet bei Carotinoiden zwischen Primär- und Sekundärcarotinoiden.
Primärcarotinoide sind die Carotinoide, die direkt an den Photosyntheseprozessen beteiligt sind. Sie zeichnen sich durch je einen Iononring an den Enden der Kohlenstoffkette aus und sie haben drei lokale Maxima im sichtbaren Spektrum. Alle diese Maxima liegen unter 480 nm.
Häufig vorkommende Primärcarotinoide sind β-Carotin, ein Vertreter der
Carotine, sowie Lutein, Violaxanthin und Neoxanthin als Vertreter der
Xanthophylle.[5]
Lutein HO
OH
Violaxanthin HO
OH
O
O
Neoxanthin HO
O
HO
OH β−Carotin
Abb. 19 – 22: Häufig vorkommende Primärcarotinoide
Sekundärcarotinoide sind nicht direkt an der Photosynthe beteiligt. Sie werden nur von Pflanzen gebildet, die unter Stress stehen, z.B. Dauerlicht oder Sickstoffmangel. [5]
Strukturell unterscheiden sich die Sekundär- von den Primärcarotinoiden durch das Fehlen eines oder auch beider Iononringe. Diese können durch einen substituierten Pentanring ersetzt sein. Im sichtbaren Bereich des Spektrums haben die Sekundärcarotinoide nur ein lokales Maximum. [5]
Vorkommen und Funktion der Carotinoide
Vorkommen und Funktion von Farbstoffen sind in der Natur eng miteinander verknüpft.
In Blättern dienen Carotinoide als akzessorische Photosynthesepigmente.
Außerdem sind sie am Aufbau des Photosystems II beteiligt und schützen vor Photooxidation. [5]
Als Lockstoff für Insekten kommen Carotinoide in Blüten vor,
z.B. Violaxanthin in Veilchen (Viola). Auch in Früchten können
Carotinoide als Lockstoff vorkommen, z.B. Lycopin in Tomaten (Solanum
lycopersicum). [5]Aber auch in anderen Organen von Pflanzen können Carotinoide vorkommen. So lagert beispielsweise die Möhre (Daucus carota) β-Carotin in der rübenförmigen Wurzel ein. [20]
Alle diese plasmochromen (membrangebundenen) Farbstoffe werden in Plastiden (Chromoplasten, Chloroplasten) angehäuft. [17]
Außerdem kommen Carotinoide in Schalen von Crustaceaen, im Fleisch von Fischen und in Federn oder im Eigelb von Vögeln vor. Da aber nur Pflanzen und einige Bakterien und Pilze in der Lage sind, Carotinoide zu synthetisieren, müssen diese Tiere die Carotinoide mit der Nahrung aufgenommen haben.
2.4.2. Extraktion des bekanntesten Carotinoides: β-Carotin
Die Gewinnung der Primärcarotinoide β-Carotin, Lutein, Neoxanthin und Violaxanthin aus Blattgrün erfolgt mittels einer präparativen Dünnschichtchromatographie von grünem Blattextrakt. Die Banden werden von der DC-Alufolie abgekratzt und in Aceton gelöst. Nachdem das Kieselgel abzentrifugiert ist, erhält man hochreine Lösungen o.g.
Primärcarotinoide in Aceton. Das Verfahren wird in Abschnitt 2.5.2.
beschrieben.
Behandelt man in der Schule Primärcarotinoide, so wird man sich
insbesondere bei Versuchen hauptsächlich auf β-Carotin beschränken, da es
entweder bereits in der Sammlung vorhanden ist, oder sich relativ einfach
und schnell in großen Mengen extrahieren lässt. Typische Eigenschaften
oben genannter Carotinoide, wie z.B. Farbe, Existenz von Doppelbindungen
und die Funktionen in der Pflanze lassen sich am Beispiel des β-Carotins als
Stellvertreter der Carotinoide gut veranschaulichen.
Versuch 7: Extraktion von β-Carotin mit Aceton aus kleingeschnittenen Möhren [9]
Chemikalien:
Substanz Gefahrensymbol R-Sätze S-Sätze
Aceton F, Xi 11-36-66-67 9-16-26
Möhre - - -
Geräte:
Messer, 2 Erlenmeyerkolben 250 mL
Durchführung:
Eine frische Möhre wird gewaschen und geschält. Etwa die Hälfte der Möhre wird in kleine Scheiben geschnitten und in den Erlenmeyerkolben gegeben. Anschließend werden die Möhrenscheiben im Abzug mit Aceton überschichtet. Der Erlenmeyerkolben wird nun etwa 2 Minuten geschwenkt.
Danach wird die Lösung in den zweiten Erlenmeyerkolben dekantiert.
Beobachtung:
Bereits nach etwa 20 Sekunden hat sich das Aceton gelb gefärbt. Nach dem Dekantieren kann man beobachten, dass die Möhrenscheiben ausgebleicht sind.
Auswertung:
Aceton ist in der Lage, β-Carotin aus dem Stroma der Chromoplasten herauszulösen. [17]
Entsorgung:
Die Möhrenscheiben können getrocknet als Feststoffabfall entsorgt werden.
Die Lösung von β-Carotin in Aceton kann für weitere Versuche aufbewahrt
werden. Falls diese nicht mehr benötigt wird, entsorgt man sie im Behälter
für organische Lösungsmittel.
Versuch 8: Extraktion von β-Carotin mit n-Heptan aus kleingeschnittenen Möhren [9]
Bei diesem Versuch soll geprüft werden, ob sich n-Heptan besser als Aceton eignet, β-Carotin zu extrahieren.
Chemikalien:
Substanz Gefahrensymbol R-Sätze S-Sätze n-Heptan F, Xn, N 11-38-50/53-65-
67
9-16-29-33-60- 61-62
Möhre - - -
Geräte, Durchführung, Beobachtung, Entsorgung vgl. Versuch: Extraktion von β-Carotin mit Aceton aus kleingeschnittenen Möhren.
Auswertung:
n-Heptan ist ähnlich wie Aceton gut geeignet, β-Carotin aus dem Stroma der
Chloroplasten herauszulösen. Für weitergehende Versuche mit β-Carotin-
Extrakten kommt es entscheidend auf das Lösungsmittel n-Heptan oder
Aceton an. Genau dies muss bei der Wahl des Extraktionsmittels
berücksichtigt werden. [17]
Versuch 9: Extraktion von β-Carotin mit Aceton aus geraspelten Möhren Es soll geprüft werden, ob die Verwendung geraspelter Möhren zu einer höheren β-Carotin-Ausbeute führt.
Chemikalien:
Substanz Gefahrensymbol R-Sätze S-Sätze
Aceton F, Xi 11-36-66-67 9-16-26
Möhre - - -
Geräte:
Messer, Küchenreibe, 2 Erlenmeyerkolben 250 mL
Vorbereitung:
Eine frische Möhre wird gewaschen und geschält. Etwa die Hälfte der Möhre wird auf einer Küchenreibe kleingeraspelt und in den Erlenmeyerkolben gegeben.
Durchführung, Beobachtung, Entsorgung vgl. Versuch: Extraktion von
β-Carotin mit Aceton aus kleingeschnittenen Möhren.Auswertung:
Es lässt sich feststellen, dass die Ausbeute an β-Carotin nicht erhöht ist. Die Gelbfärbung des Lösungsmittels ist vergleichbar (siehe Versuch: Extraktion von
β-Carotin mit Aceton aus kleingeschnittenen Möhren und Versuch:Extraktion von β-Carotin mit n-Heptan aus kleingeschnittenen Möhren).
Versuch 10: Heißextraktion von β-Carotin mit Petrolether in einer Soxhlet- Apparatur [24]
Chemikalien:
Substanz Gefahrensymbol R-Sätze S-Sätze Petrolether
(60/95)
F, Xn, N 11-38-48/20- 51/53-62-65-67
9-16-33-36/27- 60-62
Möhre - - -
Geräte:
Messer, Petrischale, Trockenschrank, Soxhlet-Apparatur, Rotations- verdampfer
Abb. 23: Soxhlet-Apparatur