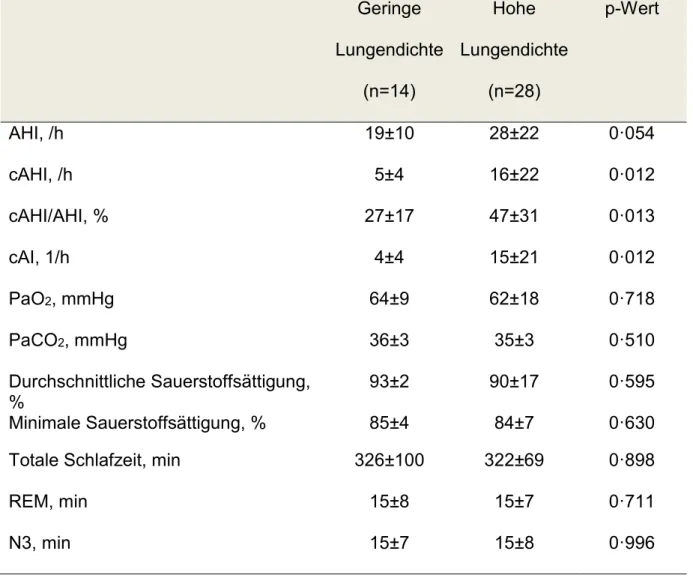
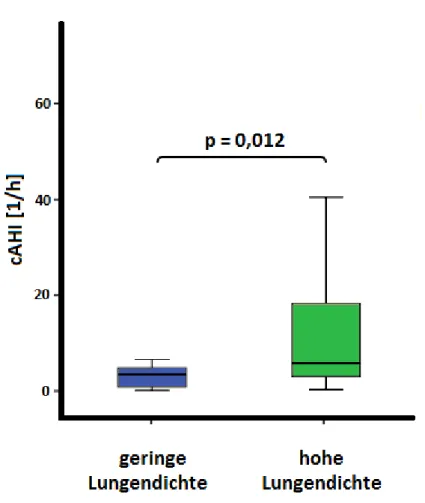
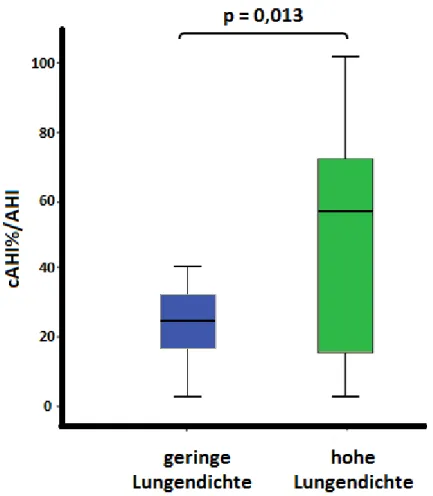
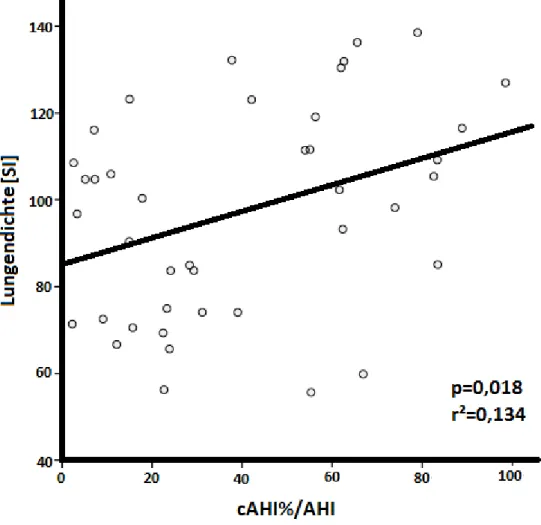
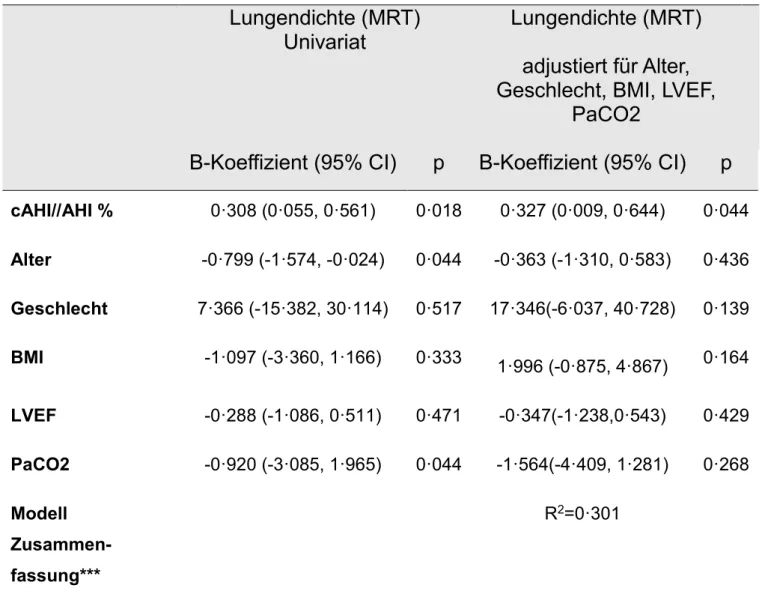
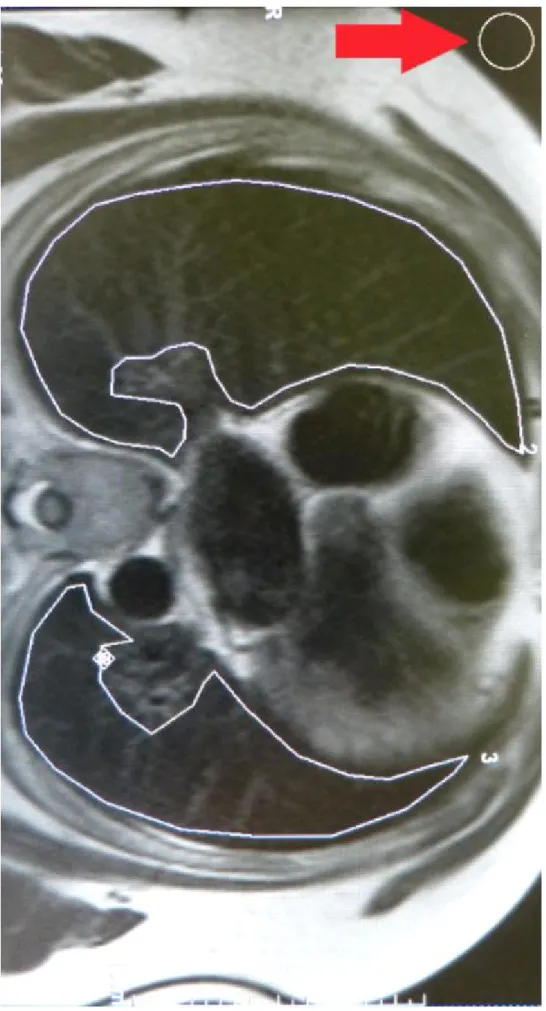
Zusammenhang zwischen der Lungendichte in der Magnetresonanztomographie und dem Schweregrad einer zentralen Schlafapnoe
Volltext
Abbildung
ÄHNLICHE DOKUMENTE
Während bisher 19.242 Personen aufgrund des Bleiberechtsbeschlusses im Besitz einer Duldung zur Arbeitsplatzsuche (Ziff. 9 des Beschlusses) sind, erhielten bereits 1.109
Unabhängig von den Einreisemöglichkeiten gilt in Deutschland weiter eine Quarantänepflicht auf Grundlage des Infektionsschutzgesetzes in allen Bundesländern für Ein- und
Nur in absoluten Ausnahmefäl- len, wenn die Kapazitäten der Ausländerbehörde es nicht anders zulassen, kann die Gewährung einer großzügigen Ausreisefrist auch per
Die Informationen zum Besuch von Ehegatten oder Lebenspartnern betreffen die Situation von Familien im innereuropäischen Grenzbereich (Binnengrenzregion Deutschlands). Auch hier
· Während der ersten 14 Tage (faktische Quarantäne): Übernahme der Einkäufe für die Saisonkräfte oder Gestellung der Verpflegung durch den Betrieb. ·
Nach § 60b Absatz 6 in Verbindung mit § 84 Absatz 2 Satz 3 AufenthG führt eine Aufhebung der Erteilung der Duldung mit dem Zusatz „für Personen mit ungeklärter Identität“
Die in Deutschland am häufigsten verwendete HES 200/0,5 sowie die niedermolekulare HES 70/0,5 würden hingegen selbst bei wiederholter Ver- abreichung weder zu einer
Ausschlusskriterien waren ein Tumor von mehr als 3 cm Größe, ein multizentrischer Tumor, tastbare Achsellymphknoten, eine vorausge- gangene Brustoperation und Schwangerschaft..