Musterl¨ osung ¨ Ubung 10
Aufgabe 1: Erzeugung von Wasserstoff aus Methan und Wasserdampf
a) Das Reaktionssystem (r1):
(r2):
(r3):
(r4):
−CH4(g)−H2O(g) + CO(g) + 3 H2(g) = 0 (1.1)
−CO(g)−H2O(g) + CO2(g) + H2(g) = 0 (1.2)
−CH4(g)−CO2(g) + 2 CO(g) + 2 H2(g) = 0 (1.3)
−CH4(g)−2 H2O(g) + CO2(g) + 4 H2(g) = 0 (1.4) besteht aus zwei linear unabh¨angigen Gleichungen, und die Reaktionen (r3) und (r4) lassen sich wie folgt als Linearkombinationen von (r1) und (r2) ausdr¨ucken:
(r3) = (r1)−(r2) (1.5)
(r4) = (r1) + (r2). (1.6)
b) Der Satz von Hess erlaubt es, die thermodynamischen Gr¨ossen einer Reaktion aus tabel- lierten Werten f¨ur einzelne Stoffe zusammenzusetzen. Es ist
∆rH =X
i
νi∆fHi und ∆rS =X
i
νiSi .
F¨ur die Reaktionen (r1) bis (r4) gilt demzufolge
T = 700 K T = 900 K
Reaktion ∆rH /kJ mol−1 ∆rS /J K−1mol−1 ∆rH /kJ mol−1 ∆rS /J K−1mol−1
(r1) 220.615 246.684 224.459 251.563
(r2) -37.882 -35.449 -35.802 -32.837
(r3) 258.497 282.133 260.261 284.400
(r4) 182.733 211.235 188.657 218.726
Wegen der linearen Abh¨angigkeit der Gleichungen gen¨ugt es bereits, die Werte f¨ur (r1) und (r2) zu berechnen. Man findet dann mit Beziehungen (1.5) und (1.6)
∆r3H = ∆r1H −∆r2H und ∆r4H = ∆r1H + ∆r2H .
Dasselbe gilt nat¨urlich auch f¨ur die Entropie ∆rS sowie die freie Enthalpie ∆rG in der n¨achsten Teilaufgabe.
c) Die Werte f¨ur ∆rG erhalten wir mit der Formel ∆rG = ∆rH −T∆rS . Reaktion ∆rG (T = 700 K)/kJ mol−1 ∆rG (T = 900 K)/kJ mol−1
(r1) 47.936 -1.948
(r2) -13.068 -6.249
(r3) 61.004 4.301
(r4) 34.869 -8.196
d) Die Gleichgewichtskonstante Kp f¨ur ideale Gase erh¨alt man mit der Formel Kp = exp −∆rG
RT
! .
Um Kx zu bestimmen, benutzen wir das Massenwirkungsgesetz und erhalten Kp = Y
i
pi p
νi
=Y
i
p·xi p
νi
= Y
i
p p
νi
·Y
i
xνii
= p
p P
i
νi
·Kx ⇒ Kx =Kp p
p −P
i
νi
, wobeiP
iνidie Anzahl an Teilchen ist, die bei einer Reaktion generiert werden. Da ein bar gerade dem Referenzdruck entspricht, gilt nat¨urlich f¨ur alle ReaktionenKx(p=p ) = Kp. Insgesamt findet man
T = 700 K T = 900 K
Reaktion P
iνi Kp =Kx(1 bar) Kx(0.1 bar) Kp Kx(0.1 bar)
(r1) 2 0.000265 0.0265 1.297 129.7
(r2) 0 9.443276 9.4433 2.305 2.305
(r3) 2 0.000028 0.0028 0.563 56.28
(r4) 2 0.002501 0.2501 2.990 299.0
Auch hier kann man Rechenzeit sparen, wenn man die lineare Abh¨angigkeit der Reaktionen ausnutzt. Es gilt n¨amlich f¨ur alle Gleichgewichtskonstanten
Kr3 = Kr1
Kr2 und Kr4 =Kr1·Kr2.
e) Das Prinzip von Le Chatelier besagt, dass ein System dem ¨ausseren Zwang auszuweichen versucht. Demzufolge werden bei hohen Dr¨ucken Reaktionen beg¨unstigt, bei denen mehr Teilchen vernichtet werden als entstehen und umgekehrt. Im betrachteten Reaktionssystem bleibt die Teilchenzahl entweder erhalten oder sie steigt an. Daher wird mehr Wasserstoff gebildet, wenn wir den Gesamtdruck verringern.
Zur Betrachtung der Temperatur wollen wir Kp als Funktion der wenig temperatur- abh¨angigen Gr¨ossen ∆rH und ∆rS darstellen:
Kp = exp −∆rG RT
!
= exp −∆rH
RT +∆rS R
!
= exp −∆rH RT
!
·exp ∆rS R
!
Wenn ∆rH eine positive Gr¨osse ist, wird der Exponent negativ und sollte daher m¨oglichst nahe bei Null sein, um trotzdem noch ein grossesKp zu erhalten. Dies erreichen wir, indem wir T so gross wie m¨oglich w¨ahlen. Wenn ∆rH dagegen negativ ist, sollte T klein sein, da dies zu einem gr¨osseren Exponenten und somit zu einem gr¨osseren K f¨uhrt.
0 0.2 0.4 0.6 0.8 1 ξ / n = x1
-1 -0.8 -0.6 -0.4 -0.2 0
(G − G 0) / nRT
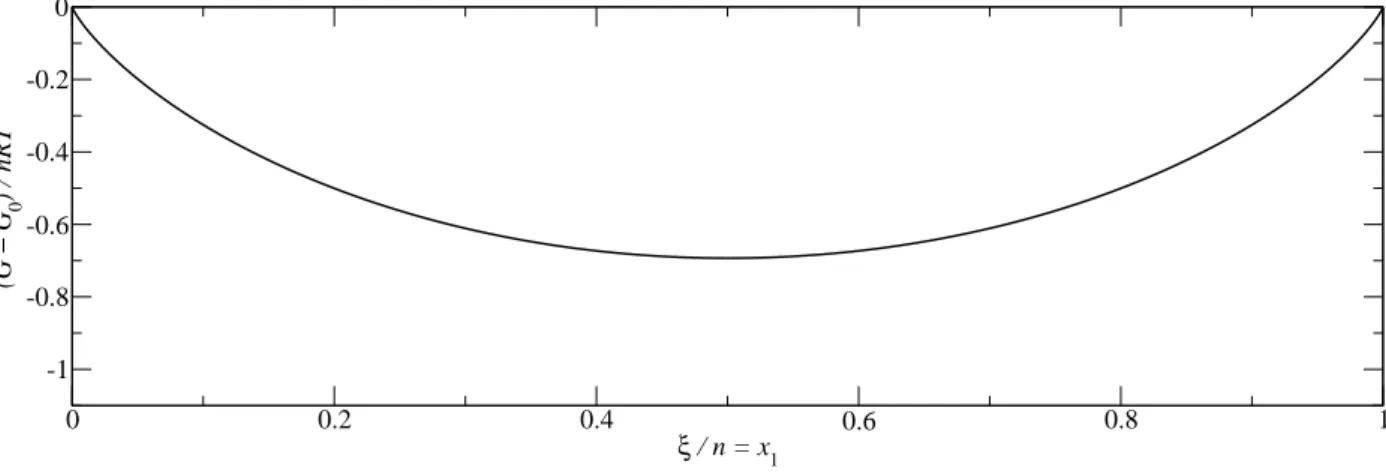
Abbildung 2-1: Gibbs-Energie bei bin¨aren Mischungen mit denselben thermodynamischen Eigenschaften.
Aufgabe 2: Mischungsbeitr¨ age zur Gibbs-Energie
a) Wenn die Stoffe A und B dieselben thermodynamischen Eigenschaften besitzen, so werden s¨amtliche relativen Gr¨ossen wie ∆rH , ∆rS und ∆rG zu Null.
b) Der Grund, weshalb die Funktion G ein Minimum besitzt, liegt einzig und allein in der Mischentropie begr¨undet:
∆rG= ∆rH−T∆rS = ∆rH −T(∆rS + ∆rSmix) = ∆rG −T∆rSmix =−T∆rSmix Die Mischentropie k¨onnen wir als Funktion der Reaktionslaufzahl ξ wie folgt schreiben:
Smix =−R[n1ln(x1) +n2ln(x2)] = −R
ξln ξ
n
+ (n−ξ) ln
n−ξ n
Damit ergibt sich eine Gibbs-Energie relativ zu einer unver¨anderlichen KonstanteG0:
G = G0−T Smix (2.1)
= G0+RT
ξln ξ
n
+ (n−ξ) ln
n−ξ n
(2.2)
= G0+nRT ξ
n ln ξ
n
+
1− ξ n
ln
1− ξ
n
(2.3) Wir erhalten eine geeignete Abbildung, wenn wir G−GnRT0 gegen den Molenbruch x1 = nξ auftragen (Abb. 2-1).
c) Um den Gleichgewichtszustand zu finden, m¨ussen wir Gleichung (2.3) nachξ ableiten. Da ξ immer in der Form ξ/n = x1 vorkommt, ist es praktischer nach x1 abzuleiten. Dazu
verwenden wir die Kettenregel
∆rG = ∂G
∂ξ = ∂G
∂x1
∂x1
∂ξ = ∂G
∂x1 1 n
= ∂
∂x1 G0
n +RT x1ln(x1) + (1−x1) ln(1−x1)
= 0 +RT ∂
∂x1 [x1ln(x1) + (1−x1) ln(1−x1)]
= RT
ln(x1) + x1
x1 −ln(1−x1)−1−x1 1−x1
= RT[ln(x1)−ln(1−x1)]
Im thermodynamischen Gleichgewicht gilt ja ∆rG = 0. Damit erhalten wir einen Molen- bruch von
0 = ∆rG
0 = RT[ln(x1)−ln(1−x1)]
RT ln(1−x1) = RTln(x1) 1−x1 = x1
x1 = 1 2.
In einer Reaktion, bei der sich zwei Molek¨ule ineinander umwandeln, ohne dass sich deren Entropie und Enthalpie dabei ¨andert, stellt sich also ein Gleichgewicht ein, wo jeweils beide Formen mit gleicher Wahrscheinlichkeit vorkommen. Dies ist verst¨andlich und macht auch intuitiv Sinn.
Aufgabe 3: Reaktionsthermodynamik
a) Um Kx zu berechnen, m¨ussen zuerst die Molenbr¨uche xI2 und xI bekannt sein, die sich ihrerseits aus den Stoffmengen ermitteln lassen. Es gilt:
nI2 = n0I2 −ξ (3.1)
nI = 2ξ (3.2)
ntot = nI2 +nI =n0I
2 +ξ (3.3)
wobei n0I
2 die anf¨anglich eingesetzte Stoffmenge an I2 und die Reaktionslaufzahl ξ den Fortschritt der Reaktion darstellt. Umformen von Gleichung (3.3) liefert
ξ =ntot−n0I2 = pV RT −n0I2
wobei die ideale Gasgleichung verwendet wurde, um ntot zu ermitteln. Kx kann nun als Funktion von ξ geschrieben werden
Kx = x2I
x = n2I
n n = (2ξ)2
(n0 −ξ)(n0 +ξ) = 4ξ2
0 2
Schliesslich kann durch die Kenntnis von Kp auch die freie Reaktionsenthalpie bestimmt werden
∆rG =−RTlnKp
F¨ur die beiden angegebenen Temperaturen ergeben sich die folgenden Werte:
T /K p/kPa ξ/mol Kx Kp ∆rG /kJ mol−1 1073 69.51 0.0627 0.0158 0.0110 40.245 1273 93.84 0.2093 0.1833 0.1720 18.632
b) Der Zusammenhang von ∆rG mit ∆rH und ∆rS ist durch folgende Gleichung gegeben
∆rG = ∆rH −T ·∆rS (3.4)
Nimmt man an, dass ∆rG im betrachteten Temperaturintervall linear von der Temperatur abh¨angt, d.h.
∆rG =a+b·T
so findet man f¨ur die Konstanten von Achsenabschnitt und Steigung gerade a = ∆rH und b =−∆rS . Ableiten von Gleichung (3.4) nach T unter der Annahme von tempera- turunabh¨angigem ∆rH ergibt also gerade die Steigung und damit die Reaktionsentropie
∆rS =−∂(∆rG )
∂T ≈ −∆(∆rG )
∆T = 108.1 J K−1mol−1 (3.5) Den Wert f¨ur ∆rH kann man mit der van’t Hoff-Gleichung bestimmen, (die man ¨ubrigens aus der Ableitung von Gl. (3.4) nach 1/T und einigem Umformen herleiten kann)
∆rH =−R· d lnKp
d(1/T) ≈ −R· ∆ lnKp
∆(1/T) = 156.2 kJ mol−1 (3.6) Es gen¨ugt bereits, eine der beiden Gleichungen (3.5) und (3.6) zu benutzen. Die fehlende Gr¨osse kann dann aus Gleichung (3.4) ermittelt werden, wenn man f¨ur ∆rG den Mittel- wert
∆rG (1173 K)≈ ∆rG (1273 K) + ∆rG (1073 K)
2 = 29.438 kJ mol−1
verwendet.