Chemie
Eigenschaftsvergleich: Alkane und Alkanole Datum:
Klasse 10
Arbeitsauftrag:
1. Vervollständige die Tabelle.
2. Trage die Siedetemperaturen für die Alkane und die Alkanole in unterschiedlichen Farben in das Diagramm ein.
3. Es sind folgende Regeln zu erkennen:
a) Vergleiche innerhalb einer Stoffklasse:
Je ___________die Molekülmasse, desto _____________________die Siedetemperatur.
b) Vergleiche zwischen den Stoffklassen:
Je ___________ das Molekül, desto ________________die zwischenmolekularen Bindungen.
c) Verallgemeinere:
Je ___________die zwischenmolekularen Bindungen, desto _________ die Siedetemperatur.
4. Erkläre auch mithilfe des Informationstextes „Wasserstoffbrückenbindungen“ (Rückseite) die in Aufgabe 3 dargestellten Regeln. Fertige zudem eine Skizze an, die die Wasserstoffbrückenbin- dung zwischen zwei Alkanolen verdeutlicht.
Quelle: Fokus Chemie Arbeitsheft 9/10, Cornelsen Verlag Berlin, S. 34
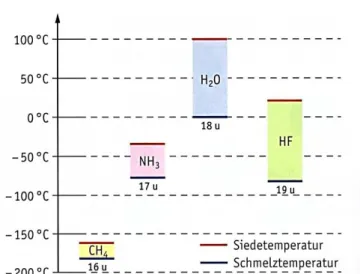
Abb. 1: Schmelz- und Siedetemperaturen einiger Wasserstoffver- bindungen
Chemie Zwischenmolekulare Wechselwirkungen:
Wasserstoffbrückenbindungen
Datum:
Klasse 10
Sauerstoff und Chlorwasserstoff liegen bei Raumtemperatur gasförmig vor. Obwohl die beiden Mo- leküle fast gleich schwer sind, unterscheiden sich die Siedetemperaturen der Stoffe beträchtlich:
Sauerstoff wird erst bei -183°C flüssig, während bei Chlorwasserstoff dazu eine Abkühlung auf -85°C ausreicht. Zwischen den Chlorwasserstoff-Molekülen müssen also zusätzliche Anziehungskräfte wir- ken, die stärker als Van-der-Waals-Bindungen sind. Chlorwasserstoff-Moleküle sind Dipol-Moleküle.
Die H-Cl-Bindung ist polar (EN = 1,0). Die vorliegenden Teilladungen bewirken Anziehungskräfte, die man als Dipol-Dipol-Wechselwirkungen bezeichnet. Sie wirken zwischen allen Dipol-Molekülen. Im Unterschied zu den Van-der-Waals-Wechselwirkungen beruhen Dipol-Dipol-Bindungen auf Anzie- hungen zwischen permanenten (dauerhaften) Dipolen und sind somit stärker als Van-der-Waals- Kräfte, jedoch sind sie schwächer als Primärbindungen.
Neben Van-der-Waals-Kräften und Dipol-Dipol-Wechselwirkungen kann in manchen Molekülen eine weitere Art Zwischenmolekularer Wechselwirkung vorliegen, die zu einer erheblichen Erhöhung der Siedetemperaturen führt: Man spricht hier von Wasserstoffbrückenbindungen (H-Brücken).
Voraussetzungen für die Bildung von Wasserstoffbrücken sind einerseits polar gebundene Wasser- stoff-Atome und andererseits kleine, stark elektronegative Atome mit einem freien Elektronenpaar.
In Fragekommen hier nur Stickstoff, Sauerstoff und Fluor.
Beim Wasser-Molekül sind die Voraussetzungen für die Ausbildung von Wasserstoffbrücken in nahezu idealer Weise erfüllt:
- Die O-H-Bindung ist stark polar, wobei die H-Atome eine positive Teilladung (δ+) und die O-Atome eine negative Teilladung tragen (δ-).
- Das Sauerstoff-Atom ist klein, stark elektronegativ und hat außerdem zwei freie Elektronen- paare.
So tritt in diesem Fall das stark positivierte H-Atom eines Wasser-Moleküls mit dem freien Elektro- nenpaar des O-Atoms eines benachbarten Moleküls in Wechselwirkung:
Wasserstoffbrücken können sich ebenfalls zwischen Ammoniak und Fluorwasserstoff- Molekülen bilden. Auch hier sind die Vo- raussetzungen erfüllt. Im Vergleich zu Was- ser-Molekülen können aber aufgrund des (räumlichen) Baus dieser Moleküle weniger H-Brücken ausgebildet werden.
Wasserstoffbrückenbindungen sind wie die andern Zwischenmolekularen Wechselwir- kungen elektrostatische Anziehungskräfte (also keine Bindungen im wortwörtlichen Sinne), die jedoch wesentlich stärker als die Van-der-Waals-Kräfte und die Dipol-Dipol- Wechselwirkungen sind.
Zusatzaufgabe: Erkläre die Schmelz- und Siedetemperaturen der verschiedenen Stoffe aus Abbildung 1.
Quelle (eigene Bearbeitung nach): Chemie heute SI Gesamtband, Schroedel Verlag Braunschweig, S.202