ORIGINAL! ARBEITEN
Mechanisch modifizierte Titanoberflä- chen für enossale Implantate - Korro- sionseigenschaften und Zellbiologie
Mechanically modified dental titanium implants - corrosion behaviour and cellular response
Nach wie vor ist die Optimierung der zellulären Response von enos- salen Titanimplantaten anhand kostengünstiger, technologisch ein- fach handhabbarer Verfahren von besonderem Interesse für die ze- mentfreie Endoprothetik und die dentale Implantologie. In dieser Studie wurde dementsprechend die Bedeutung des Einflusses ver- schiedener, technisch leicht praktikabler, abrasiver Oberflächen- modifizierungen (maschinengedreht, sandgestrahlt, geätzt) an Ti- tan hinsichtlich der Auswirkung auf deren Korrosionsbeständig- keit analysiert. Zusätzlich wurde der Einfluss dieser Oberflächen- modifikationen auf zellbiologische Parameter (Initialadhäsion, Proliferation, ALP-Aktivität, Kollagensynthese) unter Verwendung verschiedener Zelllinien zur Simulation des Hart- (MC3T3-E1 und SAOS-2) und Weichgewebekontaktes (L-929) untersucht. Im Er- gebnis dieser Arbeit ist festzustellen, dass die untersuchte Kom- bination aus Sandstrahlen und Ätzen im Vergleich zu den ur- sprünglich maschinengedrehten Titanoberflächen empfehlenswert ist, da diese Oberflächenmodifizierung trotz einer moderaten Wir- kung auf Adhäsion und Proliferation in einer gesteigerten Diffe- renzierung, d.h. möglicherweise optimalen Biomineralisierung des angrenzenden Knochengewebes resultiert. Neben positiv wirken- den topografischen Effekten im Mikro- und Nanometerbereich führt insbesondere die Erhöhung des Deckschichtwiderstandes und der daraus resultierende erniedrigte Ladungsträgertransfer durch die oxidische Deckschicht zu der beobachteten Qualitätsverbesserung.
Autor: Gerhard Hilde- brand, Steffi Groh- mann, Erwin Hüger, Bernd Rupprecht*, An- nett Rechtenbach**, Klaus Liefeith Schlagworte: abrasive Oberflächenmodifizie- rung, Sandstrahlen, Ät- zen, enossale Titanim- plantate, Korrosionsbe- ständigkeit, Zell- response
Keywords: abrasive surface modification, sand blasting, etching, biomaterial, corrosion resistance, cell response
Zitierweise dieses Bei- trages: BlOmaterialien 2009; 10 (1/2): S. 25-32
Einleitung
Dentalimplantate bestehen in aller Regel aus Titan, deren Ober- flächen partiell bzw. ganzheitlich mit speziellen Verfahren bzw. Beschichtungen [1-5] behandelt werden, um das ge- wünschte Eigenschaftsspektrum in Bezug auf eine schnelle und langzeitstabile Osteointegration im Hartgewebe zu opti- mieren [6-8], In diesem Zusammenhang ist unter Osteointe- gration die direkte, strukturelle und auch funktionelle Ver- bindung zwischen Hartgewebe und einem lasttragenden Im- ' plantat bzw. dessen Oberfläche zu verstehen.
"Impulse Biomedical Coorporation GbR, Rosenhof, 3 7 3 0 8 Heiligenstadt
" FH J e n a , Fachbereich SciTec, Carl Zeiss Promenade 2, 0 7 7 4 3 J e n a INNOVENT Technologieentwicklung e.V., Priissingstrasse 27b, 0 7 7 4 5 J e n a
Für den Langzeiterfolg enossaler Implantate müssen unter- schiedliche Kriterien beachtet werden, wie die Biokompatibi- lität, die klinische Festigkeit in Verbindung mit einer dichten Knochenanlagerung an der Implantatoberfläche sowie die funk- tionelle Krafteinleitung in den umgebenden Knochen. Bisher galt die stressfreie Einheilphase (subgingivale Einheilung oh- ne direkte Belastung) als eine der wichtigen Voraussetzungen für eine langzeitstabile Osteointegration. Mittlerweile führt die Forderung nach kürzeren Behandlungszeiten und einer wei- teren Kostenreduktion trotz des erreichten hohen Maßes an Verlässlichkeit sowie der permanent steigenden Erfolgsraten in der Implantattherapie zu einer kritischen Auseinanderset- zung mit dem konventionellen chirurgischen und protheti- schen Implantatprotokoll. In mehreren Studien konnten mitt-
2 ^ BlOmaterialien 10 (1/2), 2009
ORIGINAL "ARBEITEN
Gerhard Hildebrand: Mechanisch modifizierte Titanoberflächenlerweile hohe Erfolgsraten bei der Sofortbelastung von enos- salen Implantaten mit einer starr verbundenen Suprakon- struktion gezeigt werden [9-10], so dass zunehmend auch die einzeitige (zeit- und kostensparend, verminderte Belastung für den Patienten) Implantation von Dentalimplantaten immer mehr in den Fokus des Interesses rückt. Somit geht der Trend bei Zahnimplantaten eindeutig in Richtung kürzerer Behand- lungszeiten, ohne an ästhetisch anspruchsvollen Ergebnissen einzubüßen. Hauptsächlich sind es die Oberflächeneigen- schaften des enossalen Implantates, welche das Interfacege- schehen nach der Implantation bestimmen. Topografie, Chemie, Ladungsverteilung, die energetische Konstitution sowie die Korrosionsbeständigkeit der Implantatoberfläche sind wesent- liche Faktoren, die die Adsorption von Serumproteinen, die initiale Benetzbarkeit mit Blut, die primäre Zellanlagerung so- wie eine nachfolgende Wundheilung und periimplantäre Kno- chenapposition in vivo beeinflussen und dementsprechend die Osteointegrationsfähigkeit des Implantates bestimmen [11-
18].
In dieser Studie soll die Bedeutung des Einflusses verschiede- ner, technisch leicht praktikabler und vergleichsweise kosten- günstiger Oberflächenmodifizierungen (maschinenbearbeitet, Sandstrahlen, Ätzen) an Titan hinsichtlich der Auswirkung auf deren Korrosionsbeständigkeit dargestellt werden. Im Weiteren werden verschiedene zellbiologische Parameter wie die initia- le Adhäsion, Proliferation und Matrixbildung im direkten Kon- takt mit den modifizierten Titanoberflächen quantifiziert, wo- bei diese Testungen entsprechend dem Zielzellenkonzept so- wohl mit Osteoblasten (Hartgewebekontakt) als auch mit Fibroblasten (Weichgewebekontakt) durchgeführt werden.
Letztendlich soll das entstandene Know-how bezüglich des Einflusses der untersuchten Oberflächenmodifizierungen auf das Interfacegeschehen konsequent in das Oberflächendesign eines dentalen Implantates der Firma Impulse Biomedical Cor- poration GmbH einfließen.
Material und Methoden
Alle Titanproben wurden aus kommerziellem Titan Grade 4 (RTI International Metals GmbH, Deutschland) entsprechend ASTM F67 hergestellt. Die zylindrischen Titanproben wiesen einen Durchmesser von 15 mm und eine Höhe von 2 mm auf.
Vier verschiedene Titanmodifizierungen, die eine hohe prakti- sche Relevanz haben, wurden untersucht:
• Ti/G: maschinengedreht (Firma ANTHOGYR S.A., Frank- reich)(entspricht der standardmäßigen maschinellen Bear- beitung eines Implantates)
• Ti/G/Ä: maschinengedreht und zusätzlich geätzt (Firma NA- NOSURFACES SRL, Italien)(l mol/L NaOH / 2% H202 bei 80°C für 10 min, lh Säureätzung bei 38°C, Ultraschallreini- gung mit Aqua dest. nach den einzelnen Prozessschritten)
• Ti/G/S: maschinengedreht und zusätzlich sandgestrahlt (Fir- ma ANTHOGYR S.A., Frankreich), (Strahlmittel Silizium, Körnung 100-200 pm, 3 bar bei 90° Strahlwinke])
• Ti/G/S/A: maschinengedreht und zusätzlich sandgestrahlt und geätzt
Nach den einzelnen Prozessschritten sowie unmittelbar vor Beginn der oberflächenanalytischen und zellbiologischen Tes- tungen wurden die Proben einer mehrmaligen Standardreini- gung im Ultraschallbad (5 min Ethanol, 3 min Aqua dest.) unterzogen.
Oberflächenanalytik
Alle Materialoberflächen wurden mittels Rasterelektronenmi- kroskopie (Stereoscan 410, Leica GmbH) elektronenoptisch
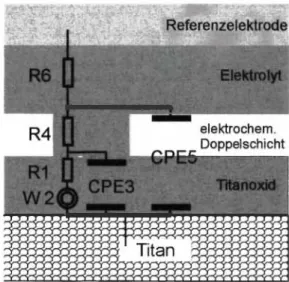
Abb. I: Verwendetes Ersatzschaltbild mit folgenden Parametern R6: Elektrolytwiderstand
R4: Widerstand der elektrochemischen Doppelschicht RI: Widerstand der Titanoxidschicht
W2: Warburgimpedanz
CPE3: Dielektrikum der Titanoxidschicht
CPE5: Dielektrikum einer Reihenschaltung der elektrochemischen Doppelschichtkapazität und der Kapazität der Titanoxidschicht.
analysiert. Die chemische Oberflächenanalyse erfolgte mittels energiedispersiver Röntgenspektrometrie (EDR 288, Röntec GmbH). Die Bestimmung verschiedener Rauhigkeitsparameter entsprechend DIN EN ISO 4287 [9] erfolgte mit einem Laser- profilometer (Microfocus, UBM GmbH). Weiterführende Mes- sungen zur Quantifizierung der Nanostruktur der verschieden modifizierten Titanproben erfolgten mittels eines Rasterkraft- mikroskops (Nanowizard, jpk Instrumente GmbH). Die Be- stimmung der Korrosionsstabilität der verschiedenen Titan- modifikationen erfolgte einerseits anhand der galvanostati- schen Bestimmung (10 μΑ über 167 min) des unteren Lochfraßpotentials (gegen Ag/AgCl-Bezugselektrode) in einer stickstoffgespülten 0.9% NaCl-Lösung unter Anwendung ei- nes Laborbioreaktormessplatzes [19]. Weiterführend wurden außerdem impedanzspektroskopische Messungen (UA.C 5 mV, Frequenzbereich 10 mHz - 100 kHz) im Ruhepotentialbereich durchgeführt und ausgewertet, da sich diese Technik insbe- sondere zur Quantifizierung von strukturellen Oxidschichtän- derungen und Deckschichtenphänomenen zur Quantifizierung des Korrosionsverhaltens bewährt hat. Für die in dieser Arbeit durchgeführten Untersuchungen bzw. die Ergebnisauswertung wurde das Ersatzschaltbild von Al-Mayouf et al. [20] ange- wandt. Dieses Modell (Abb. 1) basiert auf der klassischen Vor- stellung eines Elektrolytwiderstandes in Reihe mit der Impedanz der Titanoberfläche, wobei der Ladungsträgertransfer in diesem Interface im Wesentlichen durch zwei Barrieren bestimmt wird.
Eine davon ist die Grenzschicht Elektrolyt-Titanoberfläche (elektrochemische Doppelschicht), die zweite Barriere ist die Titanoxidschicht selbst, die aus verschiedenen „Layern" be- stehen kann. Die erste Barriere entsteht durch die Anlagerung von Ionen aus dem umgebenden Elektrolyten an die Ti-Ober- fläche und wird als Doppeltschichtkapazität bezeichnet. Im Er- satzschaltbild wird parallel dazu deren Durchtrittswiderstand implementiert. Der Titanoxid Barriere wird ein so genanntes Randles-Glied zugeordnet [20]. Dieses besteht aus einer Oxid- schicht-Kapazität (parallel zum Deckschichtwiderstand) und einem Diffusionselement in Form einer Warburgimpedanz.
2 A BlOmaterialien 10 (1/2), 2009
Gerhard Hildebrand: Mechanisch modifizierte Titanoberflächen
ORIGINAL" ARBEITEN
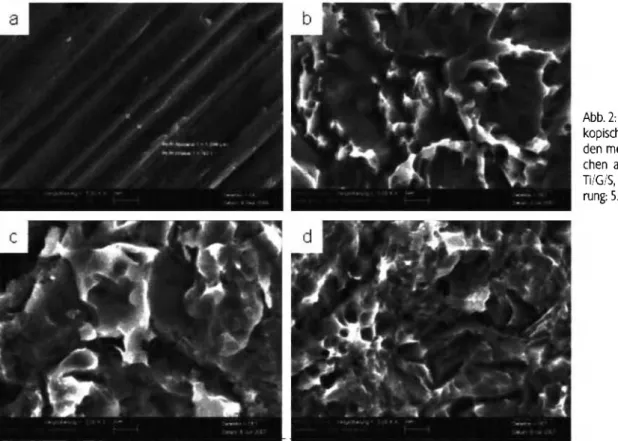
Abb. 2: Rasterelektronenmikros- kopische Befunde der verschie- den modifizierten Titanoberflä- chen a - Ti/G, b - Ti/G/Ä, c - Ti/G/S, d - Ti/G/S/Ä (Vergröße- rung: 5.000x, Messbalken: 2 μητι)
Letztere stellt ein geeignetes Charakteristikum zur Quantifi- zierung des Ladungsträgerdurchtritts dar. Um auch geometri- sche und chemische Heterogenitäten an den verschieden mo- difizierten Titanoberflächen berücksichtigen zu können, wur- den Verteilungsfunktionen in Form von C o n s t a n t - P h a s e - Elementen (CPE's) anstelle von idealen Schichtkapazitäten im Ersatzschaltbild verwendet.
Zellbiologische Testungen
Für die zellbiologischen Untersuchungen wurden die Probekör- per zusätzlich autoklaviert (Dampfsterilisierung, 121°C, 20 min) und mit verschiedenen Zelltypen besiedelt. Für die Simulation des Einflusses auf Hartgewebe kam die murine Zelllinie fötaler osteoblastenähnlicher MC3T3-E1 Zellen (DSMZ Nr. ACC 210) und die humane Osteosarkomazelllinie SAOS-2 (DSMZ Nr. ACC 243) zum Einsatz. Entsprechend DIN EN 10993 wurde auch der direkte Kontakt der modifizierten Materialoberflächen mit der murinen Fibroblastenzelllinie L-929 (DSMZ Nr. ACC 2) analysiert (Weichgewebekontakt). Als gewebeunspezifische Reaktionen wurden die Initialadhäsion nach 4 Stunden, sowie die Prolife- ration nach 7 Tagen untersucht. Zusätzlich erfolgte die Bestim- mung der Aktivität der Alkalischen Phosphatase (ALP) und die Synthese von Kollagen Typ I, anhand der Konzentration des se- kretierten C-terminalen Propeptids (CICP), als Marker für eine knochengewebespezifische Differenzierung.
Initialadhäsion: J e 5 0 . 0 0 0 Zellen wurden pro Probekörper in 2 ml Medium (MC3T3-E1 in Minimum Essential Medium Alpha Modification (αΜΕΜ), 10% Fötales Rinderserum (FBS), 3 % Pe- nicillin/Streptomycin (P/S) und L - 9 2 9 in RPMI Medium (ent- wickelt am Roswell Park Memorial Institute), 10°/o FBS und 3 % P/S) ausgesät. Anschließend wurden die besiedelten Ron- den für 4 Stunden im Brutschrank (37°C, 5 % C02, 8 0 % Luft- feuchte) inkubiert. Nach einem gründlichen Spülen des Zell- rasens (um nicht anhaftende Zellen zu entfernen) erfolgte die Trypsinierung (50 μΐ einer 0 , 2 5 % Lösung) der Zellen für 3 bis 5 min mit anschließender Inaktivierung des Enzyms durch die
Zudosierung von 150 ml serumhaltigem Medium. Um alle Zel- len von der Substratoberfläche zu lösen, wurden die Proben gründlich mit dem zugegebenen Medium gespült. Abschlie- ßend erfolgte die Anfärbung durch eine 1:1 Mischung der ab- genommenen Zellsuspension mit einer 0,4%igen Trypanblau- lösung und die Auszählung der abgelösten Zellen in einer Neu- bauer Zählkammer.
Proliferation: Pro Probekörper wurden 10.000 (L-929) bzw.
2 0 . 0 0 0 (MC3T3-E1) Zellen in 2 ml Medium ausgesät. Die In- kubation erfolgte wie bereits beschrieben über 7 Tage mit ei- nem vollständigen Wechsel des Nährmediums am 2. und 5.
Tag. Nach 7 Tagen wurde der Zellrasen mit temperiertem P B S gespült. Analog zur Vorgehensweise bei der Bestimmung der Initialadhäsion erfolgte danach die Trypsinierung, Anfärbung und Auszählung der Zellen.
Bestimmung der ALP Aktivität und Kollagen Typ I -Synthese:
Für die Quantifizierung der spezifischen ALP-Aktivität und Kollagen I Synthese wurden S A O S - 2 Zellen in McCoy's 5 A Medium ( 1 5 % FBS, 3 % P/S) verwendet. Dabei wurden 7 0 . 0 0 0 Zellen/Probe ausgesiedelt und die Gesamtinkubation betrug 7 Tage mit einem Mediumwechsel jeweils nach dem 2. und 5.
Tag. Am 5. Tag wurde dem Medium Ascorbinsäure (50 pg/ml) und ß-Glycerophosphat (10 mM) für eine ostenblastentypische Stimulation zugesetzt. Die Bestimmung der ALP-Aktivität er- folgte gemäß einem Kit der Firma Sigma. Die Zellen wurden ly- siert (50 mM Tris pH 8,0, 150 mM NaCl, 1% Triton X - 1 0 0 , 100 pg/ml PMSF) und 10 μΐ des Lysates wurden mit 50 pL alkali- schem Puffer und 50 pL p-Nitrophenyl-Substratlösung für
15 min bei 37°C im Wasserbad inkubiert. Nach dem Abstop- pen der enzymatischen Reaktion mit 1 ml NaOH (0,05 M) er- folgte das Auslesen der optischen Dichte bei 4 0 5 nm. Die Ka- librierung erfolgte hierbei durch einen p-Nitrophenolstandard definierter Konzentration. Die Quantifizierung der Kollagen Typ I-Synthese erfolgte über die Bestimmung der Konzentra- tion des C-terminalen Propeptides dieses Proteins mittels eines ELISA-Kits (Metra GmbH, Deutschland).
2 y BlOmatenalien 10 (1/2), 2009
ORIGINAL ARBEITEN
Gerhard Hildebrand: Mechanisch modifizierte TitanoberflächenTab. I: Vergleich des arithmetischen Mittenrauhwertes Ra der verschieden modifizierten Titanoberflächen: I, II - Ra aus Linienmessungen (2.000 μίτι bzw. 800 μίτι) mittels Laserprofilometer (DIN EN ISO 4287) und III - Sa aus Flächenmessung (100 μηι χ 100 μίτι) mittels AFM und anschließender Aus- wertung in SPIP™ (n-5).
Mess- methode
Rauhigkeit in μπι (+/-Standardabweichung)
Ti/G Ti/G/Ä Ti/G/S Ti/G/S/Ä 1 0,36±0,02 0,69 ±0,02 I,I3±0,04 0,90±0,03
II 0,33±0,02 0,61 ±0,03 0,89±0,02 0,79 ±0,03
„,
0,22±0,01 0,45±0,02 0,705±0,03 0,598+0,03Ergebnisse
In Abbildung 2 sind die rasterelektronenmikroskopischen Be- funde der modifizierten Titanoberflächen dargestellt. Bild 2a zeigt die typischen Bearbeitungsspuren nach der standardi- sierten Maschinenbearbeitung. Die Ätzung dieser Proben- oberfläche führt dann, wie in Abb. 2b dargestellt, zur Ausbil- dung von Komgrenzen aufgrund des Korrosionsangriffs und zu einer Erhöhung der Rauhigkeit Ra (Tab. 1).
In Abb. 2c ist eine sandgestrahlte Titanoberfläche zu sehen, die sehr scharf begrenzte, spitz ausgebildete Oberflächenstruktu- ren besitzt. Die nachträgliche Atzung' (Abb. 2d) dieser Ober- flächenstruktur führt zu einer Glättung dieser Strukturen und einer statistisch signifikanten Verminderung des Rauhigkeits-
Abb. 3: AFM-Aufnahmen der Nanostruktur der verschieden modifizierten Ti- tanoberflächen a - Ti/G, b - Ti/Ä, c - Ti/G/S, d - Ti/G/S/A (Scanfeld: 100 μηι χ
100 μπ, ζ=8 μπι).
wertes Ra in allen ausgewählten Messbereichen (Tab. 1). Ge- ringe Konzentrationen des Fremdelementes Silizium, welches auf der Probe Ti/G wahrscheinlich als Rückstand vom Schlei- fen bzw. auf der Probe Ti/G/S bedingt durch das Sandstrahlen detektierbar waren, werden durch den Ätzprozess restlos von der Probenoberfläche entfernt [21].
Abb. 3 zeigt vergleichend die Nanotopografie der verschie- den modifizierten Titanproben. Die durchgeführte Ätzproze- dur führt demnach zu einer gleichmäßigen Ausbildung von Nanopits, wie in Abb. 3b dargestellt ist. Das Sandstrahlen der Titanprobe führt, wie aus Abb. 3c zu erkennen ist, zu einer
deutlich stärker strukturierten Oberfläche. Ein zusätzliches Ät- zen (Abb. 3d) glättet die sandgestrahlte Oberflächentopogra- fie wieder etwas ein, wobei bei dieser Oberflächenmodifika- tion die typische nanoskalige Ätzstruktur in Verbindung mit der sandgestrahlten mikroskaligen Struktur zu einer sehr spe- zifischen Nanoporosität führt. Generell konnte nachgewiesen werden, dass die hier untersuchten Titanmodifikationen auch eine veränderte Nanostruktur aufweisen.
Die galvanostatisch bestimmten Lochfraßpotentiale liegen im Potentialbereich zwischen 4.200 mV für die maschinenge- drehte Titanoberfläche und 3.300 mV für die Titanoberfläche nach Probenmodifikation mittels Sandstrahlen und Ätzen. Die Bearbeitung' der maschinengedrehten Titanoberfläche mittels Tab. 2: Zusammenstellung der Einzelelemente des Ersatzschaltbildes zur Auswertung der Impedanzspektren fur unterschiedlich modifizierte Titan- oberflächen
Einzelelemente des Ersatzschaltbildes Ti/G Ti/G/
A
Ti/G/
S
Ti/G/
S/A Rl - Deckschichtwiderstand [ΜΩ] 0,29 0,88 10,50 10,70 W2 - Warburgimpedanz [kD/s] 79 120 501 474 C3 - Deckschichtkapazität [μΗ 1,8 2,2 1,8 2,4 n3 - Fraktale Dimension CPE3 0,92 0,99 0,95 0,95 R4 - Doppelschichtwiderstand [kQ] 0,65 0,63 0,55 0,46 C5 - Doppelschichtkapazität [μΗ 5,7 7,7 4,9 6,3 n5 - Fraktale Dimension CPE5 0,94 0,95 0,94 0,93 R6 - Elektrolytwiderstand [Ω] 107 109 104 104 Rl, W2, C3 und n3 sind der Deckschichtwiderstand, die Warburg-Impe- danz, der Kapazitätswert und der Exponent des CPE fur die Oxidschicht Die Einzelelemente des Ersatzschaltbildes fur die elektrochemische Dop- pelschicht sind R4, C5 und n5. R6 ist der Elektrolytwiderstand, der auch den Widerstand der Zuleitungen beinhaltet. Die Darstellung des Ersatz- schaltbildes zeigt Abb. I.
Sandstrahlen bzw. durch Ätzen führt zu vergleichsweise mitt- leren Lochfraßpotentialen im Bereich um 3.500 mV. Damit lie- gen die Lochfraßpotentiale für alle untersuchten Titanoberflä- chen deutlich höher als in der neueren Fachliteratur veröf- fentlichte Restpotentiale der Mundschleimhaut, die mit 350-550 m V angegeben werden [22].
Die impedanzspektroskopischen Messungen führten aufgrund des Fits der Parameter des Ersatzschaltbildes mit den vorhan- denen EIS-Messdaten auf einen Elektrolytwiderstand (R6 in Tab. 2), der probenunabhängig für alle Messungen nahezu konstant ist (104-107 Ω), was die Stabilität und die Reprodu- zierbarkeit der durchgeführten EIS-Messungen bestätigt.
Ätzt man eine maschinengedrehte Titanoberfläche (Ti/G/Ä) mit den vorgenannten Parametern (Material und Methoden), so ist ein moderater Anstieg der Warburg-Impedanz (W2) von 79 auf 120 kQ/s und des Deckschichtwiderstandes (Rl) von 0,29 auf 0,88 Μ Ω zu beobachten (Tab. 2). Das Sandstrahlen der maschinengedrehten Titanoberfläche (Ti/G/S) führt zu einer überaus deutlichen und signifikanten Erhöhung beider Para-
2 Q BlOmaterialien 10 (1/2), 2009
Gerhard Hildebrand: Mechanisch modifizierte Titanoberflächen
ORIGINAL! ARBEITEN
meter auf 10,50 Μ Ω bzw. 501 k Q / s . Der D e c k s c h i c h t w i d e r - stand f ü r die zusätzlich g e ä t z t e P r o b e n o b e r f l ä c h e (Ti/G/S/Ä) liegt mit 10,70 Μ Ω im selben Bereich wie f ü r Ti/G/S u n d weist auf eine erhöhte Korrosionsstabilität im Vergleich zu den Mo- difikationen Ti/G und Ti/G/Ä hin. Die P r o b e n m o d i f i k a t i o n e n Ti/G/S und Ti/G/S/Ä weisen mit ca. 500 k Q / s g e g e n ü b e r den Modifikationen Ti/G und Ti/G/Ä eine etwa 5-fach erhöhte War- b u r g i m p e d a n z a u f , w a s a u f e i n e n d e u t l i c h e r s c h w e r t e n La- d u n g s t r ä g e r d u r c h t r i t t f ü r die T i t a n m o d i f i k a t i o n e n Ti/G/S u n d Ti/G/S/Ä hinweist. Die zusätzliche Ä t z u n g e r h ö h t diesen Ef- fekt nicht, w a s ein Indiz d a f ü r ist, dass vermutlich durch das Sandstrahlen eine U m o r d n u n g in der Oxidschicht der Titan- o b e r f l ä c h e s t a t t g e f u n d e n h a t , die zu e i n e r e r h ö h t e n Korro- sionsstabilität u n t e r den g e g e b e n e n M e s s b e d i n g u n g e n f ü h r t . Alle weiteren P a r a m e t e r des Ersatzschaltbildes, wie in Tab. 2
Initialadhäsion α Osteoblasten
• Fibroblasten 6 0 . 0 0 0
Ti/G/Ä Ti/G/S Ti/G/S/Ä
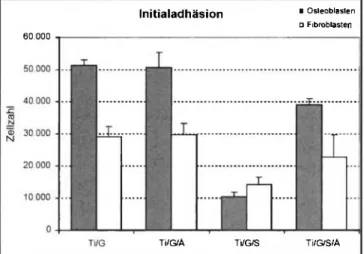
Abb. 4: Zahl der adhärierten Zellen, dargestellt als Mittelwert ± Standard- abweichung für n-6, (Osteoblasten: MC3T3-EI und Fibroblasten: L-929) nach 4 Stunden fur modifizierte Titanoberflächen: Ti/G-geschliffen, Ti/G/Ä- geschliffen und geätzt, Ti/G/S-geschliffen und sandgestrahlt, Ti/G/S/Ä- ge- schliffen, sandgestrahlt und geätzt.
dargestellt, zeigen f ü r die u n t e r s u c h t e n T i t a n o b e r f l ä c h e n kei- ne wesentlichen Ä n d e r u n g e n u n d sind d a h e r f ü r die weitere Interpretation der hier d u r c h g e f ü h r t e n U n t e r s u c h u n g e n nicht v o n Bedeutung.
Zellbiologie
Nach 4 - s t ü n d i g e r I n k u b a t i o n mit den m o d i f i z i e r t e n T i t a n - oberflächen zeichnet sich f ü r Zellen u n a b h ä n g i g v o n der Ge- webezugehörigkeit eine sehr h o h e A d h ä s i o n s r a t e f ü r die Mo- difizierungen Ti/G und Ti/G/Ä ab (Abb. 4). Eine m o d e r a t e In- itialadhäsion ist f ü r die Modifizierung Ti/G/S/Ä und eine sehr geringe Adhäsionsrate (lediglich 20 bzw. 50°/o bezogen auf die Kontrolle Ti/G) ist f ü r die Oberflächenmodifikation Ti/S zu ver- zeichnen. Generell zeigen die osteoblastenähnlichen MC3T3-E1 Zellen eine h ö h e r e A d h ä s i o n s r a t e als die Fibroblastenzelllinie L-929.
Die Ergebnisse der Proliferation n a c h 7 Tagen sind in Abb. 5 dargestellt. Im Kontakt mit den MC3T3-E1 Zellen weisen die O b e r f l ä c h e n m o d i f i k a t i o n e n Ti/G/Ä und Ti/G/S/Ä eine m o d e - rate Proliferationsaktivität auf, w ä h r e n d die auf Ti/G/S inku- bierten Zellen k a u m proliferieren. Die höchste Zellteilungsrate ist auf den lediglich m a s c h i n e n g e d r e h t e n T i t a n o b e r f l ä c h e n (Ti/G) zu verzeichnen. Die geringe A d h ä s i o n s - und Prolifera- tionfähigkeit der Zellen auf den sandgestrahlten Titanoberflä- chen kann vermutlich durch die Ausbildung von scharfkantigen Topographien begründet sein (Abb. 2). Zusätzlich sind in der
Proliferation α Osteoblasten ö Fibroblasten
: i h Q
Ti/G/Ä Ti/G/S Ti/G/S/Ä
Abb. 5: Zahl der proliferierten Zellen, dargestellt als Mittelwert ± Standard- abweichung fur n-6, (Osteoblasten: MC3T3-EI und Fibroblasten: L-929) nach 7 Tagen fur modifizierte Titanoberflächen: Ti/G-geschliffen, Ti/G/Ä-ge- schliffen und geätzt, Ti/G/S-geschliffen und sandgestrahlt, Ti/G/S/Ä- geschlif- fen, sandgestrahlt und geätzt
Literatur [5] häufig Rückstände von Korundpartikeln (auch nach intensiver Reinigung) auf den bestrahlten T i t a n i m p l a n t a t o b e r - flächen beschrieben, welche sich negativ auf die Zellbesiedelung auswirken. Ein Indiz hierfür wäre auch die gesteigerte Adhäsion u n d Proliferation n a c h einer z u s ä t z l i c h e n Ä t z u n g (Ti/G/S/Ä) der sandgestrahlten Oberflächen. Die Zellmorphologie im ras- terelektronischen Bild weist p r o b e n u n a b h ä n g i g auf eine g u t e Zelladhäsion und -migration hin (Abb. 6b). Im Weiteren ist da- v o n a u s z u g e h e n , dass die Adhäsion der Osteoblasten auf den verschieden modifizierten Titanoberflächen durch Lamellipo- dien u n d Filopodien vermittelt wird, die vorzugsweise an den S u b m i k r o m e t e r s t r u k t u r e n der Titanoberfläche verankert sind, wie in Abb. 6a f ü r die Probe Ti/G/S/Ä dargestellt ist. Weichge-
Abb. 6: Rasterelektronenmikroskopische Befunde von Osteoblasten MC3T3- EI nach 7 Tagen Kontaktzeit auf einer modifizierten (Ti/G/S/Ä) Titanober- fläche (a: Vergrößerung 5kx, Messbalken 2 μηΐ; b: Vergrößerung I kx, Mess- balken 20 μΐη)
webczellen proliferieren a u f g r u n d ihrer relativ kurzen Popula- tionsverdoppelungszeit (23 bis 24 Stunden) generell schneller, wie in Abbildung 5 an der gesteigerten Zellzahl zu erkennen ist.
Die h ö c h s t e P r o l i f e r a t i o n s r a t e ist f ü r L-929 Fibroblasten auf Ti/G/S/Ä zu verzeichnen.
Neben den a l l g e m e i n e n z e l l b i o l o g i s c h e n P a r a m e t e r n w u r d e zusätzlich die Synthese k n o c h e n s p e z i f i s c h e r Moleküle a n a l y - siert. Die Resultate der B e s t i m m u n g der Aktivität der alkali- schen P h o s p h a t a s e sind in Abb. 7 d o k u m e n t i e r t . Die Oberflä- c h e n m o d i f i z i e r u n g e n Ti/G/Ä u n d Ti/G/S resultieren in einer ca. 30°/o-igen M i n d e r u n g der ALP Aktivität im Vergleich zu Ti/G (ca. 10 U/mg im Vergleich zu ca. 15 U/mg). Die Kombi-
2 ζ ) B l O m a t e n a l i e n 10 ( 1 / 2 ) , 2009
ORIGINAL
ARBEITEN
Gerhard Hildebrand: Mechanisch modifizierte Titanoberflächenn a t i o n d e r b e i d e n O b e r f l ä c h e n m o d i f i z i e r u n g s v e r f a h r e n (Ti/G/S/Ä) hingegen steigert die ALP-Aktivität der kultivier- t e n SAOS-2 Zellen u m ca. 30%.
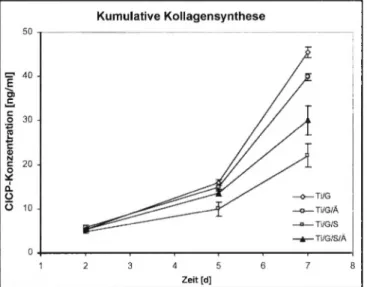
Gemessen an der Konzentration des sekretierten C-terminalen Propeptides des Kollagen Typ I (CICP), welches stöchiometrisch z u m neu-synthetisierten Kollagen im Kulturmedium vorliegt, k a n n zu j e d e m Zeitpunkt der Zellkultivierung Kollagensynthe- se nachgewiesen werden. In der kumulativen Darstellung zeigt sich zusätzlich, dass die Synthese in Abhängigkeit von der Kul- t i v a t i o n s d a u e r stetig steigt (Abb. 8). Die höchste Kollagensyn- theserate zeigen SAOS-2 Zellen, kultiviert auf den Oberflächen Ti/G u n d Ti/G/Ä. Auf Ti/G/S m o d i f i z i e r t e m Titan i n k u b i e r t e Zellen synthetisieren n u r ca. 50°/o Kollagen, im Vergleich zur
Ti/G Ti/G/A TiyGJS TijGß/A
Abb. 7: Spezifische Aktivität der Alkalischen Phosphatase (dargestellt als En- zymaktivität pro Gesamtproteinmenge im Zelllysat) exprimiert von Oste- oblasten kultiviert auf verschiedenen modifizierten Titanoberflächen: Tl/G- geschliffen, Ti/G/Ä-geschliffen und geätzt, Ti/G/S-geschliffen und sandge- strahlt, Ti/G/S/Ä-geschliffen, sandgestrahlt und geätzt (Mittelwert ± Standardabweichung für n=6).
Abb. 8: Kollagensynthese osteoblastenähnlichen Zellen (SaOs-2) kultiviert auf modifizierten Titanoberflächen: Ti/G-geschliffen, Ti/G/Ägeschliffen und geätzt, Ti/G/S-geschliffen und sandgestrahlt, Ti/G/S/Ä-geschliffen, sandgestrahlt und geätzt (kumulative Darstellung von Mittelwert ± Standardabweichung fur n=6
K o l l a g e n s y n t h e s e auf den Ti/G Oberflächen. Betrachtet m a n allerdings die Syntheserate bezogen auf die Zellzahl (siehe Abb.
7) resultiert eine zelluläre Syntheserate, die f ü r alle Oberflä- c h e n m o d i f i k a t i o n e n ähnlich stark ausgeprägt ist.
Diskussion
A u f g r u n d der vorliegenden Untersuchungsergebnisse ließ sich zeigen, dass s o w o h l das S a n d s t r a h l e n , das Ätzen s o w i e die Kombination a u s Sandstrahlen und Ätzen zu einer signifikant v e r ä n d e r t e n Oberflächenrauheit der Titanproben f ü h r t . Die zu e r w a r t e n d e n t o p o g r a f i s c h e n Unterschiede a u f g r u n d der e i n - gesetzten O b e r f l ä c h e n m o d i f i k a t i o n e n ( S a n d s t r a h l e n , Ätzen, K o m b i n a t i o n S a n d s t r a h l e n und Ätzen) zeigen sich d e m n a c h in der reproduzierbaren Ausbildung einer verfahrenstypischen Mikro- u n d a u c h N a n o t o p o g r a f i e der Titanoberfläche. Dem- z u f o l g e k a n n a u c h eine m e h r o d e r w e n i g e r o p t i m i e r t e bzw.
geänderte „zelluläre Response" f ü r die o.g. Titanmodifizierun- gen erwartet bzw. erklärt werden, wie dies u.a. f ü r chemisch produzierte, n a n o s k a l i g modifizierte T i t a n o b e r f l ä c h e n n a c h - gewiesen w u r d e [23],
Im Vergleich zur maschinengedrehten Titanmodifikation kann davon ausgegangen werden, dass die hier angewendeten Ober- f l ä c h e n m o d i f i z i e r u n g e n n u r zu einer unerheblichen V e r m i n - d e r u n g des u n t e r e n Lochfraßpotentials f ü h r e n , aber nach wie v o r sehr deutlich ü b e r dem in vivo zu e r w a r t e n d e n Restpo- tential der M u n d s c h l e i m h a u t liegen. Auf eine ü b e r a u s g u t e Korrosionsstabilität an den hier m o d i f i z i e r t e n T i t a n o b e r f l ä - c h e n k o n n t e a u c h a u f g r u n d der E r g e b n i s s e d e r i m p e d a n z - s p e k t r o s k o p i s c h e n M e s s u n g e n g e s c h l o s s e n w e r d e n . Dabei k o n n t e gezeigt w e r d e n , dass i n s b e s o n d e r e das S a n d s t r a h l e n der Titanoberfläche zu einer signifikanten Erhöhung des Deck- schichtwiderstandes führt, w a s offensichtlich auch mit einem reduzierten L a d u n g s t r ä g e r t r a n s f e r in der neu s t r u k t u r i e r t e n oxidischen Deckschicht einhergeht. Z u k ü n f t i g sind weitere im- pedanzspektroskopische U n t e r s u c h u n g e n an den unterschied- lich modifizierten T i t a n o b e r f l ä c h e n in einem sauren Elektro- lyten geplant, um so die aus korrosionschemischer Sicht m a r - k a n t e n U m g e b u n g s v e r h ä l t n i s s e bei der W u n d h e i l u n g n a c h Implantation v o n dentalen Implantaten besser simulieren zu k ö n n e n . In diesem Z u s a m m e n h a n g sollen auch fluoridhaltige (Freisetzung v o n Fluor aus Z a h n p a s t e n und Gelen) Elektroly- te verwendet werden, um die Korrosionsbeständigkeit der ver- schieden modifizierten Titanoberflächen auch unter diesen n a - t u r g e m ä ß aggressiven M i l i e u b e d i n g u n g e n [24, 19] q u a n t i f i - zieren zu k ö n n e n .
Konsequenterweise zeigen a u c h die Ergebnisse der zellbiolo- gischen U n t e r s u c h u n g e n deutlich den Einfluss der verschie- denen Oberflächenmodifizierung auf die Zellperformance von fibroblasten- u n d o s t e o b l a s t e n ä h n l i c h e n Zellen. Eine A u f r a u - h u n g der Oberfläche durch S a n d s t r a h l u n g f ü h r t f ü r alle a n a - lysierten Zelltypen zu einer deutlichen Reduktion der A d h ä - sion und folglich auch der Proliferation der inkubierten Zellen.
Durch eine zusätzliche Ä t z u n g der s a n d g e s t r a h l t e n Oberflä- chen wird dieser negative Effekt abgemildert: gemessen an der Initialadhäsion ca. 4 0 0 % Steigerung f ü r Osteoblasten und ca.
50% Steigerung f ü r Fibroblasten. Weniger stark ausgeprägt ist dieser Effekt auch bei den Resultaten der Proliferation zu be- obachten: über 100% Steigerung f ü r Osteoblasten und ca. 30%
Steigerung f ü r Fibroblasten. Eine zusätzliche Ä t z u n g der m a - s c h i n e n g e d r e h t e n T i t a n o b e r f l ä c h e n h i n g e g e n h a t einen ver- nachlässigbaren Effekt auf die Initialadhäsion u n d n u r einen geringen Einfluss auf die Proliferation der analysierten Zellli- nien. Gemessen an der spezifischen Aktivität der alkalischen P h o s p h a t a s e resultiert die Kombination aus Sandstrahlen und Ätzen (Ti/G/S/Ä) in einer gesteigerten Syntheserate, w ä h r e n d die einzelnen V e r f a h r e n zu einer Reduktion im Vergleich zu der maschinengedrehten Titanoberfläche (Ti/G) führen. Die Er- gebnisse der CICP-Analyse deuten auf einen eher geringen Ef- fekt der O b e r f l ä c h e n m o d i f i z i e r u n g auf die Kollagensynthese hin. Die detektierten Unterschiede in der CICP-Konzentration im Kulturmedium resultieren hauptsächlich aus der geringeren
2 Q BlOmaterialien 10 (1/2), 2009
Gerhard Hildebrand: Mechanisch modifizierte Titanoberflächen
Zellzahl der synthetisierenden Zellen, wie die Proliferations- untersuchungen gezeigt haben.
Zusammenfassend ist für implantologische Entwicklungen zur Verbesserung der Osteointegration (Hartgewebekontakt) eine Kombination aus Sandstrahlen u n d Ätzen der ursprünglich maschinengedrehten Titanoberflächen empfehlenswert, da die hier diskutierten Daten f ü r diese O b e r f l ä c h e n m o d i f i z i e r u n g trotz einer moderaten Wirkung auf Adhäsion und Prolifera- tion auf eine gesteigerte D i f f e r e n z i e r u n g u n d n a c h f o l g e n d möglicherweise auch eine optimierte postoperative Biomine- ralisation des angrenzenden Knochengewebes hinweisen.
In diesem Z u s a m m e n h a n g kann auch auf die Arbeitsgruppe von Kim [25] verwiesen werden, die f ü r Titanoberflächen mit steigender Rauhigkeit im Kontakt mit MG63 Osteoblasten ei- ne v e r m i n d e r t e P r o l i f e r a t i o n s r a t e nachweisen, w ä h r e n d die ALP-Aktivität, die Kollagen Typ I-Synthese u n d die R u n x 2 Genexpression s i g n i f i k a n t ansteigen. Eine m a x i m a l e Diffe- renzierung von MG63 Osteoblasten beschreiben die Autoren auf strukturierten Titanoberflächen mit einem Ra-Wert zwi- schen 0,9-1,4 p m .
Um ein tieferes Verständnis f ü r die Mechanismen der Zellad- häsion und der extrazellulären Matrixbildung im Kontakt mit den hier untersuchten Titanmodifikationen zu erhalten, werden z u k ü n f t i g geplante Untersuchungen auf die Ausbildung von Fokalkontakten und die Quantifizierung von Markerproteinen mittels Genexpressionsstudien fokussiert [26], bevor tierexpe- rimentelle Studien begonnen werden. Außerdem sind in vitro Adhäsionsstudien an einem klinisch validierten Plaquereak- tor [19, 27] geplant, um auch die initiale Biofilmbildung auf den supragingival zugänglichen Implantatregionen q u a n t i f i - zieren zu können [28].
ORIGINAL! ARBEITEN
Dr. Gerhard Hildebrand
Korrespondenzanschrift:
Institut für Bioprozess- und Analysenmesstechnik e.V., FB Biowerkstoffe
Rosenhof, 37308 Heilbad Hei- ligenstadt
E-Mail gerhard.hildebrand@
iba-heiligenstadt.de
Akademischer Lebenslauf:
1984 - 1989 Technische Universität Ilmenau: Studium Werkstoffwissenschaften
02/1989 Abschluss als Diplom-Ingenieur seit 1992 Wissenschaftlicher Mitarbeiter im Fach-
bereich Biowerkstoffe
(Leiter: Prof. Klaus Liefeith) im iba Heili- genstadt e.V. (www.iba-heiligenstadt.de) seit 1995 Geschäftsführer der Thüringer AG Bio-
material e.V. (www.tagb.de)
07/2005 Promotion zum Dr.-Ing. an der Univer- sität des Saarlandes, Lehrstuhl für Metal- lische Werkstoffe (Prof. Jürgen Breme)
Danksagung
Die Autoren danken dem Thüringer Kultusministerium (TKM) f ü r die f i n a n z i e l l e F ö r d e r u n g u n t e r dem F ö r d e r k e n n z e i - chen Β 478-04003.
Abstract
Up to date there is still a demand for cheap and easy to h a n d - le technologies for the improvement of the cellular response of osteoblasts to dental titanium implants. In this study we report on the influence of abrasive surface treatments, i.e., machine po- lishing, sand blasting and etching, on the corrosion resistance and the cellular p e r f o r m a n c e (initial adhesion, proliferation, ALP activity, collagen synthesis) of cells grown on modified titanium surfaces. Even though only minor influences on the in- itial adhesion and proliferation of the cells are observable, the combination of sand blasting and etching the titanium surfaces results in an increased differentiation of the analysed osteoblast- like cell lines. The observed positive effects can be attributed to the advantageous distribution of micro- and nanometer scale to- pographies. Furthermore, the increase in the surface layer re- sistance leads to a reduction in charge transfer through the oxi- dic surface layer eventually resulting in an improved quality of the implants made of titanium.
Literatur
[1] Schliephake H.: Functionalization of dental implant sur- faces using organic and inorganic coatings. BlOmaterialien, 8(1): 46-52, 2007.
[2] Scharnweber D.: Bio Surface-Engineering of titanium m a - terials. Biomaterialien, 8(1): p. 8-15, 2007
[3] Morra M.: Biochemical modification of titanium surfaces:
Peptides and ECM proteins. European Cells and Materialsl2: 1 - 15, 2006
[4] Senyah N., Hildebrand, G., Liefeith, K.: The comparison bet- ween RGD-peptide modified titanium and borosilicate s u r f a - ces Analytical and Bioanalytical Chemistry 383: 758-762, 2005 [5] Giordano C., Sandrini E., Busini V., Chiesa R., Fumagalli G„ Giavaresi G., Fini M., Giardino R„ Cigada A.:A new che- mical e t c h i n g process to improbe endosseous i m p l a n t oste- o i n t e g r a t i o n : in vitro e v a l u a t i o n on h u m a n o s t e o b l a s t - l i k e cells. Journal of Artificial Organs, 29, 8772-780, 2006 [6] Perlitz U.: Deutsche Medizintechnik: Exportdynamik u n - gebrochen. Deutsche Bank Research, Aktuelle Themen 369: 1-
11, 2006
[7] Jokstad Α., Braegger U„ Brunsk J.B., Carr Α., Naert I., a n d Wennerberg Α.: Quality of dental implants. International Den- tal Journal. 53: 409-443, 2003
[8] Bagno A. and Di Bello C.: Surface treatments and roughness properties ofTi-based biomaterials. Journal of Materials Scien- ce: Materials in M e d i c i n e l 5 : 935-949, 2004
[9] Joos U.: Gewebereaktion an der Grenzfläche sofortbelas- teter ILI parabolic implants mit definierter mikrostrukturierter Oberfläche, Implantologie Journal 8: 14-18, 2006
[10] Vizethum F. and Neugebauer J.: Einfluss der Implantat- oberfläche auf das Regenerationspotential am Interface. FRI- ATEC P r o d u k t i n f o r m a t i o n : 1-8, 2000
3 1
;BIOmaterialien 10 (1/2), 2009ORIGINAL " a r b e i t e n
Gerhard Hildebrand: Mechanisch modifizierte Titanoberflächen[11] Kasemo B. and Lausmaa J.: Biomaterial and implant s u r - faces: A surface science Approach. The international j o u r n a l of oral ft maxillofacial implants3(4): 2 4 7 - 2 5 9 , 1988
[12] Thull R.: Biokompatibilitätsbestimmende E i g e n s c h a f t e n der Grenzfläche. B i o m a t e r i a l i e n l ( l ) : 6 - 1 1 , 2 0 0 0
[13] Curtis, A. and W i l k i n s o n , C.: T o p o g r a p h i c a l c o n t r o l of cells. Biomaterialsl8(24): 1573-1583, 1997
[14] Nöth U„ Hendrich C., Merklein F., Altvater Τ., Rader C„
Schütze Ν., Eulert J., and Thull R.: Standardisiertes Testen von S k e l e t t - I m p l a n t a t o b e r f l ä c h e n mit einem O s t e o b l a s t e n - Zell- k u l t u r s y s t e m : II T i t a n o b e r f l ä c h e n unterschiedlicher R a u h i g - keit. Biomed. Technik 44(1-2): 6 - 1 1 , 1999
[15] Zhu X., Chen J„ Scheideier, L„ Reichl R„ Geis-Gerstorfer J.: Effects of t o p o g r a p h y and composition of t i t a n i u m surface oxides on osteoblast responses. Biomaterials 25: 4 0 8 7 - 4 1 0 3 , 2 0 0 4
[16] Rupp F., Scheideier L., Rehbein D., A x m a n n D„ Geis-Gers- torfer J.: Roughness induced dynamic changes of wettability of acid etched t i t a n i u m i m p l a n t m o d i f i c a t i o n s . Biomaterials25:
1429.1438, 2004
[17] Sader M.S., Balduino Α., Almeida-Soares G., Borojevic R.:
Effect of three distinct t r e a t m e n t s of t i t a n i u m surface on oste- oblast attachment, proliferation, and differentiation. Clin. Oral.
Impl. Res., 16: 6 6 7 - 6 7 5 , 2 0 0 5
[18] S a m m o n s R.L., L u m b i k a n o n d a N., Gross M„ Cantzler P.:
Comparison of osteoblast spreading on microstructured dental i m p l a n t s u r f a c e s and cell b e h a v i o u r in a n e x p l a n t model of osseointegration. Clin. Oral. Impl. Res. 16 : 6 5 7 - 6 6 6 , 2005 [19] Hildebrand G.: Korrosions- u n d Biokompatibilitätsunter- s u c h u n g e n an den A u f b r e n n k e r a m i k l e g i e r u n g e n des T y p s P d C u l 3 , 5 und TiTa30 z u r Beurteilung ihres Einsatzes in der z a h n ä r z t l i c h e n P r o t h e t i k . Dissertation a n der N a t u r w i s s e n - s c h a f t l i c h - T e c h n i s c h e n Fakultät III der Universität des Saar- landes, 2 0 0 5
[20] Mayouf A.M., Al-Swayih A.A., Al-Mobarak N.A., and Al- J a b a b A.S.: The effect of fluoride on the electrochemical b e - h a v i o r of Ti and some of its alloys for dental applications. M a - terials a n d Corrosion 55: 5 2 4 - 5 3 0 , 2004
[21] Textor M., Vörös J., W i e l a n d Μ., Ruiz-Taylor L., B r u n e t - te D.M.: Titanium in Medicine. Chapter 5: Characterization of t i t a n i u m surfaces: 8 7 - 1 4 0 , 2001
[22] Opydo W„ O p y d o - S z y m a c z e k J . : Metallic dental m a t e r i - als in p a t i e n t s oral cavity acting as electrodes of electroche- mical cells. Materials an Corrosion. 55(7): 520-523, 2004 [23] Oliveira P.T., Zalzal S.F.: Beloti M.M., Rosa A.L., Nanci Α.: E n h a n c e m e n t of in vitro osteogenesis o n t i t a n i u m by che- mically produced nanotopography. J. Biomed. Mater. Res. 80A:
554-564, 2007
[24] Reclaru L. and Meyer J.M.: Effects of fluorides on titanium and other dental alloys in dentistry. Biomaterials 19: 85-92, 1998 [25] Kim M.J., Kim C.W., Lim Y.J., Heo S.J.: Microrough tita- n i u m surfaces affects biological response in MG63 osteoblast-
like cells, J. Biomed. Mater. Res. 79A: 1023-1032, 2 0 0 6 [26] Lüthen F., Lange R., Becker P., Rychly J„ Beck U„ Nebe B.:
The influence of surface roughness of titanium on ß l - and ß3- integrin adhesion on the organisation of fibronectin in h u m a n osteoblastic cells. Biomaterials26: 2 4 2 3 - 2 4 4 0 , 2 0 0 5
[27] Schade R.: Entwicklung eines in-vitro Systems zur Prü- f u n g der initialen P l a q u e a d h ä r e n z an dentalen Biomaterialien.
Dissertation an der Biologisch-Pharmazeutischen Fakultät der FSU Jena, 2 0 0 5
[28] Göttfert, H.W.: Mikrobielle Penetration in den I n n e n r a u m dentaler Implantatsysteme, Dissertation an der Medizinischen Fakultät der Universität Bonn, 2 0 0 8
2 2 B l O m a t e r i a l i e n 10 (1/2), 2009