PCI Thermodynamik G. Jeschke FS 2012
Lösungsvorschlag Übung 6
23.03.2012
Ausgabe : Freitag, 23.03.2012 Rückgabe : Freitag, 30.03.2012
Besprechung : Fr/Mo/Di/, 30.03/02.04./03.04.2012 Verantwortlich : Carolin Seuring
1 Adiabatische und isotherme Expansion
(6 Punkte) Aus der Herleitung der adiabatischen Expansion im Skript, Kapitel 6.5.4 können wir zwei Aussagen über die isotherme und adiabatische Volumenarbeit machen. Während für die isotherme Volumenarbeit das Boyle-Mariotte'sche Gesetz gilt :
p·V =const., (1)
muss für die adiabatische Volumenarbeit die Poisson-Gleichung angewendet werden :
p·Vγ =const. (2)
Adiabatische Expansion
1a i) Der Zusammenhang zwischen p0, V0, pf inal, Vf inal lässt sich wie folgt berechnen :
p0·V0γ =pf inal·Vf inalγ. (3)
Stellen wir nun die Gleichung nach Vf inal um, erhalten wir : p0·V0γ
pf inal =Vf inalγ. (4)
Weil weiterhin gilt, dass Cv = 32 ·R, Cp = 52 ·R, ist γ = CCpv = 53 und damit folgt : p0·V053
pf inal =Vf inal
5
3 (5)
p0·V053
pf inal =Vf inal53 (6)
5 bar·(1l)53
1 bar =Vf inal53
2.63 l=Vf inal. (7)
ii) Die Temperatur des Gases am Ende der adiabatischen Expansion Tf inalerhält man mit V0 = 1l und Vf inal = 2.63 l aus :
T0·V0γ−1 =Tf inal·Vf inalγ−1 (8)
T0·V0γ−1
Vf inalγ−1 =Tf inal (9)
298.15K·(1·10−3 m3)53−1
(2.63 ·10−3 m3)53−1 =Tf inal (10)
156 K=−117◦C=Tf inal. (11)
iii) Die Arbeit wird allein durch die Abnahme der inneren Energie bestritten, denn im adiabatischen Prozess gilt q = 0 und damit :
∆u=q+w (12)
∆u=w. (13)
iv) Die ausgetauschte Arbeit berechnet sich aus :
∆u=w=n·Cv ·∆T (14) w=n·Cv
Z Tf inal
T0
dT (15)
w=n·Cv·(Tf inal−T0) (16)
w=n·3
2 ·R·(156 K−298.15 K) (17) Die Stomenge n ergibt sich aus :
n= p0·V0
R·T (18)
n= 5·105 Pa·0.001 m3
8.314mol·KJ ·298.15K (19)
n = 0.2 mol. (20)
Setzen wir den Wert n = 0.2 mol in Gl. (17) ein, lässt sich die Arbeit berechnen : w=n·3
2 ·R·(156 K−298.15 K) (21) w=−355.70J.
v) Aus der gleichen Beziehung, die wir nutzten um Vf inal zu berechnen, können wir pf inal berechnen, wenn das Endvolumen Vf inal = 8 l ist:
p0·V
5 3
0
V
5 3
f inal
=pf inal (22)
p0·V053 (8 l)53
=pf inal (23)
0.156 bar =pf inal. (24) Die Temperatur des Gases am Ende der adiabatischen Expansion Tf inalerhält man mit V0 = 1 l und Vf inal = 8 l aus :
298.15·1·(10−3 m3)53−1
(8 ·10−3 m3)53−1 =Tf inal (25)
74.5K =−198◦C=Tf inal. (26)
Die ausgetauschte Arbeit ergibt sich wiederum aus : w=n·Cv
Z Tf inal
T0
dT (27)
w=n· 3
2 ·R·(74.5 K−298.15K) (28) w=−557.82 J.
b Isotherme Expansion
i) Der Zusammenhang zwischen p0, V0, pf inal, Vf inal lässt sich wie folgt berechnen :
p0·V0 =pf inal·Vf inal. (29)
Stellen wir nun die Gleichung nach Vf inal um, erhalten wir : p0·V0
pf inal =Vf inal. (30)
5 l=V . (31)
ii) Die Temperatur des Gases am Ende der isothermen Expansion Tf inal ist gleich der Anfangstemperatur und damit 25◦C.
iii) Die innere Energie eines idealen Gases hängt nur von der Temperatur ab und ist im isothermen Prozess ∆u= 0.
iv) Die ausgetauschte Arbeit berechnet sich aus :
dw=−p·dV (32)
w=− Z
p·dV (33)
w=n·R·T lnVf inal
V0 =−p0V0·lnVf inal
V0 . (34)
Wir nutzen nun die folgende Beziehung und berechnen w : w=−p0V0·lnVf inal
V0 (35)
w=−5·1·ln5 l
1 l (36)
w=−8.05 bar·l=−8.05·105 Pa·10−3 m3 (37)
w=−805 J. (38)
v) Aus der gleichen Beziehung mit der wir Vf inal berechnet haben, können wir pf inal
berechnen, wenn das nale Volumen Vf inal = 8 l ist:
p0·V0
Vf inal =pf inal (39)
0.625 bar =pf inal. (40) Die Arbeit berechnen wir dann wiederum mit :
w=−p0V0 ·lnVf inal
V0 (41)
w=−5·1·ln8 l
1 l (42)
w=−10.40 bar·l=−10.40·105 Pa·10−3 m3 (43)
w=−1040 J. (44)
c Graphische Darstellung der Adiabaten und Isothermen
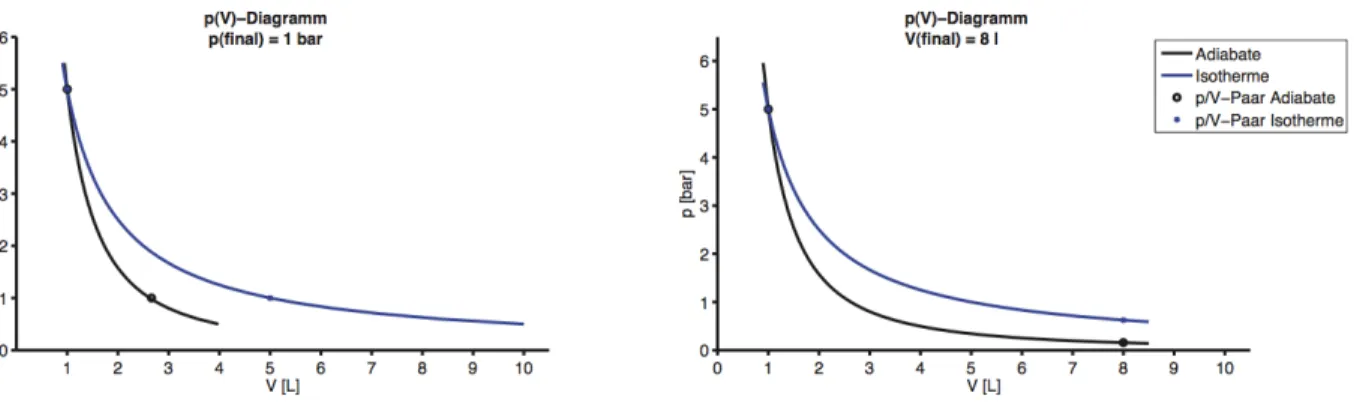
Abbildung 1: Dargestellt sind zwei p(V)-Diagramme die sich aus der Adiabatengleichung p·Vγ =const.bzw. Isothermengleichung p·V =const. ergeben. Die Adiabaten sind schwarz dargestellt, die Isothermen blau. Links : p(V)-Diagramm der Expansion von p0 = 5 bar auf pf inal = 1 bar. Rechts : p(V)-Diagramm der Expansion von p0 = 5 bar auf Vf inal = 8 l. Aus den Graphen lassen sich die gesuchten Parameter Vf inal (links) und pf inal (rechts) ermitteln.
2 Joule-Thompson Eekt
(4 Punkte) Für den dierentiellen Joule-Thomson Eekt gilt :
dT dp
h
= 1 Cp
2a RT −b
. (45)
Wir stellen die Gleichung zunächst nach dp um : dT
1 Cp
2a
RT −b =dp (46)
Cp·RT dT
2a−b·RT =dp.
Um eine Beziehung für die nicht unendlich kleine Änderungen zu bekommen, trennen wir die Variablen und integrieren von T1 bis T2, beziehungsweise von p1 bis p2. Die ganze Integration passiert bei isenthalpischen Bedingungen:
Z T2
T1
Cp·RT dT 2a−b·RT =
Z p2
p1
dp= ∆p. (47)
Um die linke Seite zu integrieren, ersetzen wir RT = x und 2ab = α und schreiben das Integral nach der neuen Variable xum:
Z T2
T1
Cp·RT dT 2a−b·RT =
Z RT2
RT1
Cp·xdxR
2a−bx = (48)
Cp Rb
Z RT2
RT1
xdx
2a
b −x = Cp Rb
Z RT2
RT1
xdx
α−x = (49)
Cp
Rb[−x−α·ln(α−x)]RTRT2
1 = (50)
−Cp
Rb
R(T2−T1) + 2a b ·ln
2a−b·RT2
2a−b·RT1
. (51)
Als Resultat bekommen wir die Beziehung:
∆p=−Cp
Rb
R(T2−T1) + 2a b ·ln
2a−b·RT2
2a−b·RT1
. (52)
3 Brenn- und Heizwert von Wodka
(4 Punkte) In der Tabelle sind die Werte für xEtOH angegeben, die sich aus φEtOH mit Hilfe der Gleichung auf dem Frageblatt berechnen lassen :
xEtOH = VH2O
VEtOH
φEtOH −VEtOH+VH2O. (53)
Zusammengefasst sind die φEtOH/xEtOH-Wertepaare : φEtOH 0.95 0.70 0.50 0.1
xEtOH 0.854 0.419 0.236 0.033.
Unter Betrachtung der Bilanzgleichung folgt mit den Standardbildungsenthalpien für die Verbrennungsenthalpie∆CH für Ethanol :
C2H5OH(l) + 3O2(g)→2CO2(g) + 3H2O(l)
∆CH = 2∆fHCO2(g) + 3∆fHH2O(l)−∆fHEtOH(l) (54)
∆CH =−(2·393.52 kJ
mol)−(3·285.83 kJ
mol) + (277.65 kJ
mol) = −1366.88 kJ
mol. (55) Die Verbrennungsenthalpie ist gleichzeitig auch der Brennwert von reinem Ethanol.
Den Heizwert ∆HHeiz für die verschiedenen Mischungen erhält man aus :
∆HHeiz =xEtOH·(∆Hc+ 3·∆HV,H2O) + (1−xEtOH)·∆HV,H2O. (56) Für die einzelnen Wodka mit xEtOH ergeben sich folgende zugehörige Heizwerte :
φEtOH 0.95 0.70 0.50 0.1 xEtOH 0.854 0.419 0.236 0.033
∆HHeiz
kJ·mol−1 -1048.1 -491.8 -257.8 + 1.8.
Man sieht, dass ∆HHeiz mit dem Wassergehalt abnimmt und bei 10 Volumenprozent das Vorzeichen wechselt. Ein positives Vorzeichen des Heizwerts zeigt, dass verdünnter Ethanol nicht verbrennbar ist, ausser wenn ihm genügend Energie zugeführt wird.