Philipps-Universität Marburg Fachbereich Chemie
SoSe 2007
Seminar: Übungen im Experimentalvortrag
Leitung: Prof. B. Neumüller, Dr. P. Reiß, Prof. Koert
Kathrin Adam Altes Schloß 5 35043 Marburg
Das Hühnerei
Experimentalvortrag vom 21.06.2007
Hinweis:
Dieses Protokoll stammt von der Seite www.chids.de (Chemie in der Schule).
Dort können unterschiedliche Materialien für den Schulunterricht heruntergeladen werden, unter anderem hunderte von Experimentalvorträgen so wie der vorliegende:
http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html
Inhaltsverzeichnis
1. Allgemeines...3
1.1 Das Ei in der Mythologie...3
1.2 Aufbau und Zusammensetzung des Hühnereis...3
2. Die Schale...5
2.1 Zusammensetzung und Funktion...5
2.2 Versuch 1: Nachweis von CO32- in der Eierschale...5
2.3 Demo 1: Ein Ei – chemisch geschält...6
2.4 Versuch 2: Nachweis von Protoporphyrin...8
3. Das Eiklar...9
3.1 Zusammensetzung und Funktion...9
3.2 Proteine...9
3.3 Eiweißstrukturen...11
3.3.1 Primärstruktur...11
3.3.2 Sekundärstruktur...11
3.3.3 Tertiärstruktur...13
3.3.4 Quartärstruktur...13
3.4 Versuch 3: Biuret-Reaktion...14
3.5 Versuch 4: Nachweis schwefelhaltiger Aminosäuren...16
3.6 Versuch 5: Eiweißfällung durch Metallsalzlösung...17
3.7 Demo 2: Eiweißverdauung...18
4. Der Eidotter...20
4.1 Zusammensetzung und Funktion...20
4.2 Versuch 6: Cholesterin-Nachweis (Liebermann-Reaktion)...21
4.3 Versuch 7: Verseifung...23
5. Wissenswertes...25
5.1 Der Stempel...25
5.2 Frisch oder alt?...25
5.3 Eierzeugung in Europa und Pro-Kopf-Verbrauch...26
6. Literaturangaben...27
1. Allgemeines
1.1 Das Ei in der Mythologie
Das Ei gilt in den Schöpfungsmythen als der Ursprung des Lebens, so glaubte man in der finnischen Mythologie, dass das Universum aus sieben Eiern entstanden sei. Bei diesen sieben Eiern seien sechs aus Gold und eines aus Eisen gewesen.
Die oberen Schalenhälften der Eier hätten den Himmel gebildet, das Eigelb aufgrund der Farbe und Form, die Sonne, das Eiklar den Mond und die restlichen Schalen hätten die Sterne gebildet. Man glaubte in dieser Mythologie, dass das Eisen-Ei einen schwarzen Dotter besessen hätte und dieser habe die Gewitterwolken gebildet.
1.2 Aufbau und Zusammensetzung des Hühnereis
Das Hühnerei, so wie man es hauptsächlich kennt, hat eine ovale Form und besitzt eine braune oder weiße 0,2 – 0,4 mm dicke, poröse Kalkschale. Weiterhin besteht das Hühnerei aus dem Eiklar und dem Eidotter. Das Gewicht eines Hühnereis setzt sich folgendermaßen zusammen: 10 % des Gewichts macht die Kalkschale aus, 60 % das Eiklar und 30 % der Eidotter.
Das gesamte Ei enthält 74 % Wasser, 13 % Eiweiß, 12 % Fett und 1 % Kohlenhydrate, zudem liefert es viele wichtige Vitamine.
Abb.1: Aufbau des Eis
Keimfleck
In Abb. 1 kann man den Aufbau des Eis sehen. Ganz außen befindet sich das Oberhäutchen, das auch als Cuticula bezeichnet wird. Es sorgt dafür, dass das Ei nicht austrocknet und keine Keime in das Ei eindringen können. Darunter liegt die Kalkschale, die mit Poren durchsetzt ist. Dann folgt die Schalenhaut, die dem Schutz dient und das Eiweiß von der Schale abtrennt. Es schließt sich das Eiweiß an und letztlich der Eidotter mit dem Keimfleck. Der Keimfleck ist die Keimzelle, aus dem sich das Küken entwickeln wird. Der Eidotter ist durch die sogenannten Hagelschnüre in der Mitte des Eis aufgehängt, so dass er nicht an die Eischale schlagen kann. Auch kann man am stumpfen Ende des Eis eine Luftkammer erkennen, diese dient als erster Luftvorrat für das Küken, welches 17 Tage nach der Befruchtung im Ei anfängt zu atmen.
2. Die Schale
2.1 Zusammensetzung und Funktion
Die Eischale besteht zum größten Teil aus Calciumcarbonat (95 %), zu 2 % setzt sie sich aus Ca3(PO4)2, Mg3(PO4)2 und MgCO3 zusammen. Weiterhin sind 3 % organische Substanzen, vor allem Eiweiße, enthalten.
Die Schale muss mehrere Funktionen erfüllen. Zunächst einmal muss sie fest genug sein, damit sie dem Gewicht der Henne beim Brüten standhält, sie darf allerdings nicht zu dick sein, so dass das Küken die Schale auch durchpicken kann, wenn es schlüpft und die Schale muss luftdurchlässig sein, was durch die Poren gewährleistet ist. Die Luftdurchlässigkeit ist notwendig, damit ein Gasaustausch stattfinden kann, da das Küken ja bereits im Ei anfängt zu atmen.
Aufgabe der Schale ist es das sich entwickelnde Küken zu schützen.
Das Carbonat wird in Versuch 1 nachgewiesen.
2.2 Versuch 1: Nachweis von CO32- in der Eierschale
Geräte: Saugflasche, Stopfen, Rührfisch, Magnetrührer, Schlauch,
Schlauchschellen, Gaswaschflasche, Keckklemme, 2 Stativplatten, 2 Gewindestangen, 2 Doppelmuffen, 2 Klemmen, Trichter
Chemikalien:gesättigte Ba(OH)2-Lösung
R: 20/22-34 S: 2-26-36/37/39-45 C
HCl (w = 0,1)
R: 36/37/38 S: 26 Xi
Eierschalen
Durchführung:
Die Eierschalen werden in die Saugflasche gegeben, mit HCl(aq) übergossen und die Saugflasche mit einem Stopfen verschlossen. Zur besseren Durchmischung der Eierschalen mit der Salzsäure wird der Magnetrührer zur Hilfe genommen. Das entstehende Gas wird in die mit gesättigter Ba(OH)2-Lösung gefüllte Gaswaschflasche eingeleitet.
Beobachtung:
Es entsteht ein Gas. Beim Einleiten in gesättigte Ba(OH)2-Lösung trübt sich diese.
Erklärung:
Das in der Eierschale enthaltene Carbonat reagiert mit der Salzsäure, wobei sich das Gas CO2 bildet. Dieses reagiert mit den Ba2+-Ionen der Bariumhydroxidlösung und es bildet sich das schwerlösliche BaCO3.
CaCO3(s) + 2 HCl(aq) Ca2+(aq) + 2 Cl-(aq) + CO2 (g) + H2O CO2 (g) + Ba2+(aq) + 2 OH-(aq) BaCO3(s) + H2O
Um die dünne Schalenhaut besser sichtbar zu machen, kann man Demonstration 1 durchführen. Dieser Versuch eignet sich auch gut als chemische Hausaufgabe und ist sicherlich sehr interessant für die Schüler.
2.3 Demo 1: Ein Ei – chemisch geschält
Geräte: 250 mL Becherglas Chemikalien:rohes Hühnerei
Essigsäure (w = 0,1)
Durchführung:
Das rohe Hühnerei wird für 2-3 Tag in ein Becherglas mit Essigsäure gelegt.
Beobachtung:
Die Schale löst sich unter Gasentwicklung auf.
NH N
N N H
O H
O OH O
Erklärung:
Die Schale wird durch die Säure aufgelöst, hierbei entsteht CO2. CaCO3(s) + 2 H3O+(aq) Ca2+(aq) + CO2 (g) + 3 H2O
Abb. 2: Hühnerei – Kalkschale aufgelöst
Häufig wird die Frage gestellt, ob denn Hühner mit braunem Gefieder auch braune Eier legen. Aufgrund des Gefieders kann man keine Aussage über die Farbe der Eier treffen.
Die Eierschalenfarbe ist genetisch bedingt. Man hat festgestellt, dass Hühner mit weißen Ohrlappen weiße Eier legen und solche mit roten Ohrscheiben braune. Braune Eier enthalten den Farbstoff Protoporphyrin. Dieser gehört zur Gruppe der Tetrapyrrole.
Abb. 3: Struktur des Protoporphyrins
In Versuch 2 wird dieser Farbstoff nachgewiesen.
2.4 Versuch 2: Nachweis von Protoporphyrin
Geräte: 2 Demo-Reagenzgläser, UV Lampe, 20 mL Spritze, Peleusball, 10 mL Messpipette
Chemikalien:Ethylacetat
R: 11-36-66-67 S: 2-16-26-33 F, Xi
HCl (w = 0,1)
R: 36/37/38 S: 26 Xi
braune und weiße getrocknete Eierschalen
Durchführung:
In jeweils ein Demo-Reagenzglas werden braune bzw. weiße Eierschalen gefüllt und mit je 20 mL Ethylacetat versetzt. Anschließend werden jeweils 3 mL Salzsäure zugegeben und die Reagenzgläser leicht unter der UV Lampe geschüttelt.
Beobachtung:
Die Schalen werden aufgelöst, es steigen Gasblasen auf. Die Lösung, in der sich die braunen Eierschalen befinden, fluoresziert unter der UV Lampe (λ = 366 nm) rot, die Rotfluoreszenz wird immer stärker.
Erklärung:
Bestrahlt man braune Hühnereierschalen mit UV-Licht (λ = 366 nm), so kann man nur eine schwache Rotfluoreszenz feststellen. Fügt man Salzsäure hinzu, so steigen Gasblasen in der Lösung auf, da die Kalkschale unter Freisetzung von CO2 aufgelöst wird. Das gebundene Protoporphyrin wird dabei aus der Kalkschale herausgelöst und tritt in das Lösungsmittel Ethylacetat über. Die Fluoreszenz nimmt mit zunehmender Konzentration des herausgelösten Protoporphyrins zu. Durch die UV-Strahlen werden die π-Elektronen des Protoporphyrinringsystems vom Grundzustand in den angeregten Zustand angehoben, anschließend kehren die π-Elektronen in den Grundzustand zurück. Hierbei wird ein Teil der zuvor aufgebrachten Energie in Form von Licht wieder abgegeben. Es handelt sich dabei um längerwelliges Licht als zuvor eingestrahlt wurde, da etwas der zuvor aufgebrachten Energie dafür verwendet wurde die Moleküle in Schwingung zu versetzen.
3. Das Eiklar
3.1 Zusammensetzung und Funktion
Das Eiklar besteht zum größten Teil aus Wasser (87,9 %), daneben enthält es 10,6 % Eiweiß (Proteine), 0,9 % Kohlenhydrate, 0,6 % Mineralstoffe, 0,2 % Fett und die Vitamine A, E, K, B1, B2, B6, sowie Folsäure.
Es dient zum Schutz und zur Ernährung des Embryos.
Eiweiß ist für den menschlichen Körper sehr wertvoll, besonders, wenn es aus vielen verschiedenen Aminosäuren aufgebaut ist und der Körper diese zum Aufbau eigener Proteine nutzen kann.
Der menschliche Körper kann nahezu 100 % der Eiweiße aus dem Ei vollständig für den Aufbau eigener Eiweiße nutzen.
3.2 Proteine
Proteine sind makromolekulare Stoffe, die für den Organismus wichtige Funktionen erfüllen. So dienen sie als Bau- und Gerüstsubstanz in Sehnen oder in Form von Enzymen als Katalysatoren.
Die kleinste Einheit eines Proteins ist die Aminosäure, die durch mindestens zwei funktionelle Gruppen gekennzeichnet ist. Sie besitzt eine Amino- und Carboxylgruppe.
Abb. 4: Aminosäure
Durch Kondensationsreaktion können diese Aminosäuren miteinander unter Ausbildung einer Peptidbindung verknüpft werden. Sind mehr als 100 Aminosäuren miteinander verknüpft, spricht man von einem Protein.
N C C O O
R H
H H
H
N C CH2
C H
O SH
H O H
H N C
CH2 C H
O SH
H O H
H H2O
+ -
Kondensationsreaktion:
Cystein Cystein
Die Proteine werden aufgrund ihrer Funktion in die fibrillären und globulären Proteine eingeteilt.
Fibrilläre Proteine:
Sie dienen vor allem zum Aufbau von Muskeln und Geweben, sowie zur Bewegung und Strukturbildung. Bei ihnen handelt es sich um lang gestreckte Moleküle, die in Wasser unlöslich sind.
Globuläre Proteine:
Diese werden noch einmal aufgrund ihrer unterschiedlichen Wasserlöslichkeit in die Globuline und Albumine eingeteilt. Sie dienen dem Transport und der Steuerung von Prozessen im Organismus und übernehmen Schutz- und Abwehrmechanismen. Albumine bilden mit Wasser eine kolloidale Lösung, Globuline hingegen nicht. Sie zeigen eine erhöhte Löslichkeit in verdünnten Salzlösungen.
N H
C CH2
C H
O N C H
CH2 C H
O SH
SH
~ ~
3.3 Eiweißstrukturen
Nun betrachten wir den Aufbau der Eiweiße, die u.a. im Eiklar enthalten sind näher. Man unterteilt hierbei in die Primär-, Sekundär-, Tertiär- und Quartärstruktur.
3.3.1 Primärstruktur
Die Primärstruktur beschreibt die Aminosäuresequenz. Hier sind die Art, Anzahl und Reihenfolge der einzelnen L-Aminosäurebausteine in der Peptidkette festgelegt.
Abb. 5: Primärstruktur des Insulins
3.3.2 Sekundärstruktur
Die Sekundärstruktur beschreibt die räumliche Anordnung (Konformation) der L- Aminosäurebausteine. Diese kann entweder die Form einer Helix oder einer Faltblattstruktur annehmen.
Bei der α-Helix sind die Peptidketten schraubenförmig angeordnet. Der Abstand der einzelnen Windungen beträgt 540 pm. Die Struktur wird durch intramolekulare Wasserstoffbrückenbindungen zwischen CO- und NH-Gruppen verschiedener Peptide stabilisiert.
Abb. 6: α-Helix
Das β-Faltblatt entsteht durch die Zusammenlagerung gestreckter Polypeptidketten, woraus eine Zickzackanordnung resultiert. Durch die Ausbildung intermolekularer Wasserstoffbrückenbindungen zu gegenüberliegenden Polypeptidketten wird diese Struktur stabilisiert.
Abb. 7: β-Faltblatt
3.3.3 Tertiärstruktur
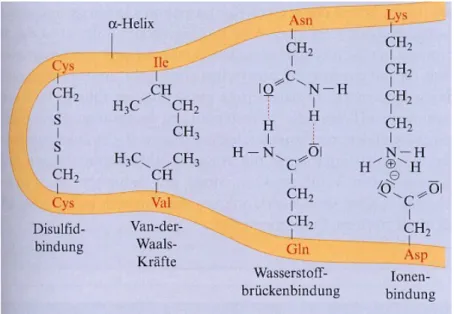
Durch Wechselwirkungen der Seitengruppen der Aminsäurebausteine kommt es zu einer dreidimensionalen Anordnung des gesamten Proteinmoleküls im Raum. Man bezeichnet diese Struktur als Tertiärstruktur. Zur Stabilisierung der Struktur können alle Bindungsarten dienen: Wasserstoffbrückenbindungen, Ionenbindungen, Elektronenpaarbindungen (Disulfidbrücken), Van-der-Waals-Kräfte zwischen unpolaren Atomgruppen.
Abb. 8: Bindungen
3.3.4 Quartärstruktur
Vereinigen sich mehrere Polypeptidketten zu einem Gesamtkomplex, so spricht man von der Quartärstruktur. Teilweise können auch Verknüpfungen mit anderen Atomen oder Molekülen bestehen.
Abb. 9: Quartärstruktur des Hämoglobins
In Versuch 3 soll nun durch die Biuret-Reaktion nachgewiesen werden, dass im Eiklar Eiweiße enthalten sind.
3.4 Versuch 3: Biuret-Reaktion
Vorbereitung: Eiweiß-Lösung
1 Eiklar wird mit ca. 150 mL physiologischer (w = 0,009) Natriumchloridlösung versetzt und geschüttelt.
Geräte: Demo-Reagenzglas, 10 mL Spritze, 10 mL Messpipette, Peleusball, Tropfpipette, Pipettenhütchen
Chemikalien:Eiweiß-Lösung Natronlauge (w = 0,1)
R: 35 S:26-36/37/39-45 C
CuSO4-Lösung (w = 0,05)
R: 22-36/38 S: 2-22 Xn
Durchführung:
9 mL Eiweiß-Lösung werden in ein Demo-Reagenzglas gefüllt und anschließend mit 9 mL Natronlauge und einigen Tropfen CuSO4-Lösung versetzt. Danach wird das Reagenzglas leicht geschüttelt.
Beobachtung:
Die Lösung färbt sich violett.
N H
C C O H
N H
C H
C O
R' R
R'' R''' OH H2O
2 + 4 -4
Erklärung:
violett
Zunächst kommt es zu einer Deprotonierung, wobei sich Anionen bilden, welche mit den zugegebenen Kupfer-Kationen einen Kupfer-Eiweiß-Komplex bilden, der violett ist.
Dass auch schwefelhaltige Aminosäuren am Aufbau der Proteine im Eiklar beteiligt sind, soll in Versuch 4 gezeigt werden.
Cu2+
C C
N R' HO
C C O H
R N R'''
R''
C C N N
R' H O
C C O H
R R'' R'''
Cu2+
2- N C C
O H
N C H
R C O
R'
R'' R'''
N C C O H
N C H
R C O
R'
R''' R''
2-
2
O H
S H N C
H C
C O SH
H
R1 R2
H H
N C H C
C O
SH
H
R1 R2
H H O
H
N C H C
C O H
R1 R2
H H O H +
+
3.5 Versuch 4: Nachweis schwefelhaltiger Aminosäuren
Geräte: Demo-Reagenzglas, Bunsenbrenner, Dreifuß, Drahtnetz, Glasstab, Tropfpipette, Pipettenhütchen
Chemikalien:Eiweiß
konz. Natronlauge
R: 35 S:26-36/37/39-45 C
AgNO3-Lösung
R: 34-50/53 S: 1/2-26-45-60-61 C, N
Durchführung:
Etwas Eiweiß wird mit konzentrierter Natronlauge versetzt und anschließend erhitzt. Nun gießt man etwa 5 mL der Lösung in das Demo-Reagenzglas und versetzt sie dort mit einigen Tropfen der AgNO3-Lösung.
Beobachtung:
Die Lösung färbt sich bräunlich-schwarz. Es bildet sich ein braun-schwarzer Niederschlag.
Erklärung:
Zunächst findet eine SN2-Reaktion statt, bei der es zu einem nucleophilen Angriff des freien Elektronenpaares der Hydroxidgruppe kommt. Es bildet sich ein trigonal- bipyramidaler Übergangszustand. Bindungsbruch und –anbindung verlaufen synchron. Das Hydrogensulfid wird abgespalten.
Das Hydrogensulfid reagiert wie folgt weiter:
HS-(aq) + OH-(aq) + 2 Ag+(aq) Ag2S(s) + H2O
Hierbei wird schwarzes Silbersulfid gebildet, welches ausfällt.
Wenn man ein Ei zu lange kocht läuft die gleiche Reaktion ab. Das im Eidotter enthaltene Eisen reagiert mit dem Sulfid eines Proteins, das im Eiklar enthalten ist. Es bildet sich Eisensulfid, welches man als grau-blaue Schicht um den Eidotter erkennen kann. Es handelt sich hierbei um eine natürliche Reaktion, das Ei wird dadurch keinesfalls ungenießbar.
3.6 Versuch 5: Eiweißfällung durch Metallsalzlösung
Geräte: 2 10 mL Spritzen, Demo-Reagenzglas, Stopfen Chemikalien:Eiweiß-Lösung (siehe Versuch 3)
CuSO4-Lösung (w = 0,05)
R: 22-36/38 S: 2-22 Xn
Durchführung:
10 mL der Eiweiß-Lösung werden in ein Demo-Reagenzglas gegeben und anschließend mit 5 mL der Kupfersulfat-Lösung versetzt. Danach schüttelt man kurz um.
Beobachtung:
Es bilden sich weiße Flocken in der Flüssigkeit.
Erklärung:
Durch die Zugabe des Metallsalzes kommt es zu einer Metall-Eiweiß-Verbindung und dadurch zu einer Konformationsänderung der Eiweißstruktur. Da sich die Konformation des Eiweißes ändert kommt es zur Denaturierung. Das Metallsalz bricht die stabilisierenden Bindungen innerhalb des Eiweißes auf und bildet neue Bindungen aus.
Beim Gerben von Häuten wird der Umstand ausgenutzt, dass diese Metall-Eiweiß- Verbindungen meist antibakteriell wirken. Die Giftwirkung von Schwermetallsalzen ist darauf zurückzuführen, dass es bei der Aufnahme dieser zu einer Denaturierung der Eiweiße im Organismus kommt.
3.7 Demo 2: Eiweißverdauung
Geräte: Stativplatte, Gewindestange, Klemme, Doppelmuffe, Heizplatte, 500 mL Becherglas, 3 Demo-Reagenzgläser, Thermosensor, 2 10 mL Messpipetten, Waage
Chemikalien:Pepsin
R: 36/37/38-42 S: 22-24-26-36/37 Xn
HCl (w = 0,1)
R: 36/37/38 S: 26 Xi
gekochtes Eiweiß
Durchführung:
In das erste Demo-Reagenzglas werden 0,1 g Pepsin und 10 mL Wasser gegeben.
In des zweite Reagenzglas werden 0,1 g Pepsin und 10 mL HCl gegeben und in das dritte nur 10 mL HCl. Zu allen drei Reagenzgläsern gibt man nun ein Stückchen des gekochten Eiweißes und stellt die Demo-Reagenzgläser für einige Minuten in das etwa 40 °C warme Wasserbad.
Beobachtung:
Im ersten und dritten Reagenzglas ist keine Veränderung zu erkennen. Im zweiten Reagenzglas hat sich die Lösung getrübt und das Stückchen Eiweiß ist ein wenig kleiner geworden.
Erklärung:
Pepsin ist ein Enzym, dass sich im Magen befindet und dort zusammen mit der Magensäure, in diesem Fall demonstriert durch die Salzsäure, und bei einer Temperatur von ca. 40 °C Eiweiße in Polypeptide und Aminosäuren spaltet, die dann so vom Organismus aufgenommen werden können. Diese Aminosäuren dienen dem Organismus zum Aufbau körpereigener wichtiger Eiweiße.
4. Der Eidotter
4.1 Zusammensetzung und Funktion
Der Eidotter besteht zu 48,7 % aus Wasser und 16,6 % aus Eiweiß, womit er prozentual mehr Eiweiß enthält als das Eiklar. Zu 32,6 % sind Fette und Lipide enthalten, 1 % machen Kohlenhydrate aus und zu 1 % enthält der Eidotter Mineralstoffe wie z.B. Fe und Ca.
Das Ei gilt als „Cholesterinbombe“, wobei eigentlich nur der Eidotter das Cholesterin enthält. In 100 g Eidotter sind 1260 mg Cholesterin enthalten, im Vergleich zu 100 g Butter, die 250 mg enthält, ist dies sehr viel. Jedoch haben Forscher im Tierversuch herausgefunden, dass im Ei ein Stoff enthalten ist (Lecithin), der eine „Cholesterin senkende“ Wirkung haben könnte. Das Lecithin bindet das Cholesterin so fest, dass es im Darm nicht aufgenommen werden kann. Ob dies allerdings auch auf den Menschen zutrifft ist noch nicht geklärt.
Abb.10: Aufbau des Dotters
Der Eidotter ist an der Bildung des Embryos beteiligt und für dessen Ernährung zuständig.
Keimscheibe
Nahrungs- (orange) und Bildungsdotter (gelb) Dotterbett
4.2 Versuch 6: Cholesterin-Nachweis (Liebermann-Reaktion)
Vorbereitung: Chloroformauszug
Etwa ein Teelöffel Eigelb wird mit 20 mL Chloroform versetzt und durch Rühren homogenisiert. Anschließend wird die Lösung abfiltriert.
Geräte: Trichter, Demo-Reagenzglas, Filterpapier, 2 10 mL Spritze,
25 mL Messpipette, Tropfpipette, Pipettenhütchen, 2 Bechergläser, Magnetrührer, Rührfisch
Chemikalien:gekochtes Eigelb Chloroformauszug
R: 22-38-40-48/20/22 S: 2-36/37 Xn
Essigsäureanhydrid
R: 10-20/22-34 S: 1/2-26-36/37/39-45 C H2SO4 (konz.)
R: 35 S: 26-30-45 C
Durchführung:
10 mL des Chloroformauszugs werden in ein Demo-Reagenzglas gegeben und 6 mL Essigsäureanhydrid zugesetzt. Man schwenkt kurz um und lässt dann vorsichtig einige Tropfen konzentrierte Schwefelsäure hinzufließen.
Beobachtung:
Es bildet sich zunächst eine tiefblaue Färbung aus. Innerhalb weniger Minuten entstehen blau-violett gefärbte Zonen, die nach einiger Zeit nach grün umschlagen.
Erklärung:
Zunächst kommt es zur Protonierung des Essigsäureanhydrids. Das hierbei entstandene Kation ist mesomeriestabilisiert. Anschließend kommt es zur Anlagerung des Cholesterins und zur Abspaltung eines Protons.
O H
CH3 CH3 O
O O H+
O O O+ H
O C+ O O H
O+
O O H
O O O H
O+ H R
H+
O O O H
O R +
-
O O O H
O R
OH O CH3
CH3
O O
H+
CH3 CH3 - HOAc
+
+
Bildung von verschiedenen Polyenen Reaktionsmechanismus noch ungeklärt
Nun folgt eine Eliminierung von Essigsäure und man erhält acetyliertes Cholesterin.
Danach folgt eine erneute Protonierung und Abspaltung von Essigsäure. Wie das dabei entstehende Molekül weiter reagiert ist noch nicht geklärt. Man vermutet, dass sich verschiedene Polyene bilden, die für die Farbgebung sorgen.
4.3 Versuch 7: Verseifung
Vorbereitung: Acetonauszug
2 Eigelb werden mit 100 mL Aceton übergossen und durch Rühren auf dem Magentrührer homogenisiert. Anschließend wird die Lösung abfiltriert. In der durch die ß-Carotinoide gelblich gefärbten Lösung befinden sich nun auch die Fette, die verseift werden sollen.
Geräte: Bechergläser, Magnetrührer, Rührfisch, Trichter, Filterpapier, Demo-Reagenzglas, Stopfen, 10 mL Messpipette
Chemikalien:Acetonauszug
Natronlauge (w = 0,32)
R: 35 S: 26-36/37/39-45 C
Durchführung:
10 mL des Acetonauszugs werden in ein Demo-Reagenzglas gegeben und mit einigen Tropfen konzentrierter Natronlauge versetzt. Das Reagenzglas wird mit einem Stopfen verschlossen und kräftig geschüttelt.
Beobachtung:
Es bildet sich ein beständiger Schaum.
C H2 O
C H
C H2
O
O C
C
C R1
R2
R3 O
O
O
Na+ OH
C H2 O
C H
C H2
O
O C
C
C R1
R2
R3 O
O
O OH
OH
OH
Na+
+ 3 + 3 + 3
C H2 O
C H
C H2
O
O
C R1 O O H
C R2 O
O H
C R3 O O H
Na+
C H2 OH
C H
C H2
OH
OH
C R1 O O
C R2 O
O
C R3 O O Na+ Na+ Na+
+ + 3 +
Erklärung:
Es kommt zur Verseifung der im Acetonauszug enthaltenen Fette. Hierbei läuft folgender Mechanismus ab (Mechanismus nur einmal exemplarisch beschrieben):
Zunächst kommt es zum nucleophilen Angriffs des freien Elektronenpaares des Hydroxids am positiveren Kohlenstoffs der Carboxylgruppe des Esters. Es bildet sich eine tetraedrische Zwischenstufe aus. Das Alkoholat-Ion ist eine gute Abgangsgruppe und spaltet sich daher im nächsten Schritt ab. Es bildet sich erneut eine Fettsäure. Aufgrund der höheren Basizität bildet sich im nächsten Schritt der dreiwertige Alkohol Glycerin und das Fettsäureanion. Zusammen mit den Natriumkationen bildet es Kernseife.
5. Wissenswertes
5.1 Der Stempel
Seit Januar 2004 befindet sich auf jedem Ei ein Stempel mit einer mehrstelligen Nummer z.B. 0-DE-0712001.
Die erste Ziffer gibt das Haltungssystem an:
0 = ökologische Haltung, maximal 6 Hühner leben auf einem Quadratmeter 1 = Freilandhaltung, maximal 9 Hühner pro Quadratmeter
2 = Bodenhaltung, maximal 7 Hühner pro Quadratmeter 3 = Käfighaltung, 20 Hühner leben auf einem Quadratmeter Die Buchstaben geben das Herkunftsland an:
DE = Deutschland AT = Österreich NL = Niederlande
Die anschließende Zahlenfolge ist die Kennnummer des Legebetriebs.
So kann anhand dieses Stempels auf einen Legebetrieb zurückgeschlossen werden und der Verbraucher kann Haltungssystem und Herkunftsland der Eier erkennen.
5.2 Frisch oder alt?
Eier sind ca. 28 Tage haltbar und sollten danach nur gut durchhitzt genossen werden. Um heraus zu finden, ob es sich bei einem Ei nun um ein frisches oder altes handelt, kann man den sogenannten Schwimmtest durchführen. Dafür füllt man in ein Glasgefäß kaltes Wasser ein und legt das Ei hinein. Sehr frische Eier liegen am Boden des Glases, frische Eier sind leicht aufgestellt, hierbei zeigt das stumpfe Ende des Eis nach oben und ist das Ei 2-3 Wochen alt, so ist es senkrecht aufgestellt, wobei die Spitze nach oben zeigt. Sollte das Ei älter als 4 Wochen sein, schwimmt es an der Wasseroberfläche.
altes Ei (>4 Wochen)
sehr frisches Ei frisches Ei
Abb. 11: Schwimmtest
5.3 Eierzeugung in Europa und Pro-Kopf-Verbrauch
Insgesamt wurden 2001 in Europa etwa 95 Milliarden Eier erzeugt, die meisten davon in Frankreich und Italien:
Frankreich: 17,1 Mrd.
Italien: 16,8 Mrd.
Deutschland: 14,2 Mrd.
Großbritannien: 11,2 Mrd.
Niederlande: 11,0 Mrd.
Spanien: 10,7 Mrd.
Beim Pro-Kopf-Verbrauch liegt Deutschland mit 222 Stück im EU-Durchschnitt:
EU: 223 Stück
Portugal: 150 Stück
Italien: 269 Stück
Deutschland: 222 Stück
Japan: 331 Stück
China: 260 Stück
USA: 260 Stück
6. Literaturangaben
Bücher:
Chemie im Kontext Sek II; Reinhard Demuth, Ilka Parchmann, Bernd Ralle; Cornelsen Verlag; 2006
Chemische Schulexperimente; Band 2 Organische Chemie; Hans Keune, Manfred Just;
Volk und Wissen Verlag; 1. Auflage; Berlin 1999
Reaktionsmechanismen; Reinhard Brückner; Spektrum Verlag; 3. Auflage; München 2004 Internet:
www.quarks.de/pdf/Q_Ei.pdf
www.climodien.de/html/lebensqualitaet/gesunde_ernaehrung/..
www.didaktik.mathematik.uni-wuerzburg.de/mathei/eibio/anatomie.htm www.wikipedia.org/wiki/H%C3%BChnerei
www.uni-saarland.de/.../files/seminare/eab/ws_05/Chromoropsaeure%20Liebermann- Burchard%20Dragendorff.pdf
www.dc2.uni-bielefeld.de/dc2/grundsch/eier/versuch8.htm www.tierlobby.de/rubriken/Tiergarten/voegel/huhn5_europa.htm Sonstige:
Lehrplan des Landes Hessen
Experimentalvortrag „Das Ei“ von Christina Erbar; FB Chemie; Marburg 2005 Experimentalvortrag „Hühnerei“ von Sonja Lauer; FB Chemie; Marburg 1994 Abbildungen:
Deckblatt: www.praxis-bieberau.de/images/cholesterin-huehnerei-thumb.jpg Abb.1: www.schoenecke.de/Eier-Info/ei-aufbau.jpg (bearbeitet)
Abb. 2, 3, 4: Kathrin Adam
Abb.5, 6, 7, 8, 9: Chemie im Kontext Sek II; Reinhard Demuth, Ilka Parchmann, Bernd Ralle; Cornelsen Verlag; 2006
Abb.10: www.schoenecke.de/Eier-Info/ei-aufbau.jpg (bearbeitet) Abb.11: www.dc2.uni-bielefeld.de/dc2/grundsch/eier/versuch11.htm