ORIGINAL ARBEITEN
Charakterisierung Heparin- beschichteter Titandioxide
mittels Raman-Spektroskopie und Zeta-Potenzial
Christine Schmidt, Uwe Gbureck, Roger Thull Schlagworte:
Titandioxid - Hämo- kompatibilität - Heparin - Zeta-Potenzial - Raman-Spektroskopie
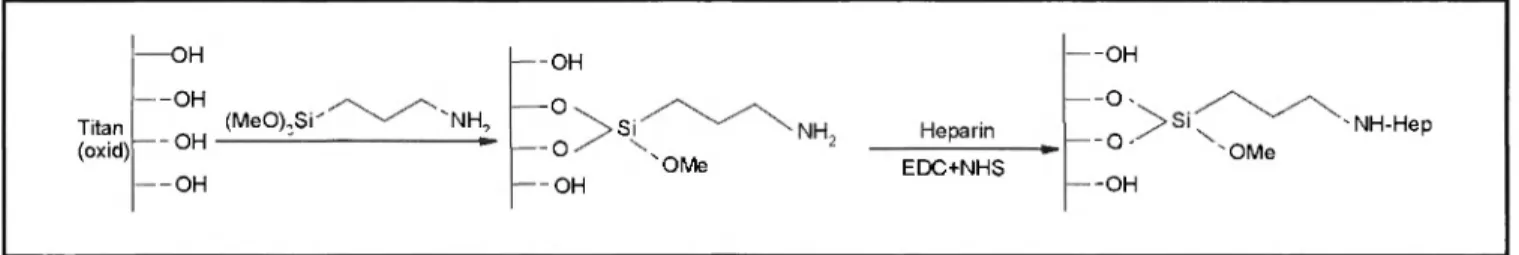
Die Funktionalisierungen von Titandioxid-Oberflächen mit Heparin wurde hier vorgenommen. Die kovalente Bindung des Wirkstoffs er- folgte mit Hilfe des Haftvermittlers 3-Aminopropyltrimethoxysilan.
Die funktionalisierten Oberflächen wurden durch Raman- und FT- IR-Spektroskopie hinsichtlich ihrer Zusammensetzung und durch Messung des Zeta-Potenzials im Hinblick auf die Oberflächenla- dung bei Kontakt mit wässrigem Elektrolyten charakterisiert. Die ko- valente Bindung des Wirkstoffs konnte schwingungsspektroskopisch über das Auftreten symmetrischer SO,-Valenzschwingungen im Mo- lekül nachgewiesen werden. Mit Hilfe des Zeta-Potenzials konnte der Schichtaufbau qualitativ im wässrigen Medium verfolgt wer- den, da die Zeta-Potenziale der aufgebrachten Schichten stark vari- ieren. Durch den Haftvermittler wird das Potenzial der unmodifi- zierten Anatas-Oberfläche (ca. -30mV) in den positven Bereich verschoben (+40mV), bedingt durch das Vorhandensein protonier- ter Aminogruppen. Die kovalente Anbindung von Heparin resul- tiert in einer stark negativ geladenen Oberfläche mit einem Zeta- Potenzial von zirka -50 mV. Die Ergebnisse dienen als Grundlage ßr die Anbindung weiterer Wirkstoffe an Implantatoberflächen,
beispielsweise Dermatansulfat oder Heparansulfat, zur Einstellung klinisch geforderter antithrombogener und proliferationshemmen- der Eigenschaften im Blutkontakt.
Einleitung
Die Entwicklung hämokompatibler, proteinadsorptions- resistenter Oberflächen ist ein Schlüsselelement für die Her- stellung von Implantaten und Instrumenten im Blutkontakt.
Beispiele sind blutführende Teile von Blutdialyse-Geräten, künstliche Blutgefäße, Katheter, Herzklappen, Gefäßstützen (Stents) oder Biosensoren zur Erfassung biochemischer Va- riabler im Blutstrom (p02, pCO, oder Glucose) [1], Die Pro- tein-Resistenz ist erforderlich um nichtspezifische Pro- teinadsorption, Plättchenadhäsion und -aggregation sowie die dadurch induzierte Thrombusbildung zu verhindern und Entzündungsreaktionen zu vermeiden. Neben der Hämo- kompatibilität erfordern Werkstoffe für dilatierbare Gefäß- stützen zusätzlich ausreichende mechanische und elektro- chemische Eigenschaften, bezüglich statischer und dynami- scher Festigkeit, axialer Flexibilität, Kaltumformbarkeit sowie der Korrosionsbeständigkeit [2], Kommerzielle Stents bestehen hauptsächlich aus Edelstahl (AISI 316L), Tantal oder der "shape memory" Legierung TiNi [3, 4]. Bei der Bal- londilatation (PTCA) des Stents zur Gefäßaufweitung wird der Stent einem Druck von bis zu 14 bar ausgesetzt [5]. Die
mögliche Verletzung der Endothelschicht, die nachfolgend zum verstärkten Wachstum der Neo-Intima führen kann, ist vermutlich die Hauptursache für das Auftreten von Reste- nosen, d. h. der erneuten Einengung des Blutgefäßes. Die Neo-Intima ist grundsätzlich die Anreicherung von glatten Muskelzellen innerhalb einer Proteoglycan-Matrix, die das vorher geweitete Gefäß umgibt [6]. Die Prävention einer Thrombusbildung während der akuten Heilungsphase, er- folgt durch medikamentöse Applikation von Antikoagu- lantien bis zirka vier Wochen nach der Stent-Implantation, ζ. B. durch Heparin, Acetylsalicylsäure, Ticlopidin. Die The- rapie mit Gerinnungshemmern hat den Nachteil möglicher unerwünschter Nebenwirkungen, ζ. B. Thrombocytopenie, erhöhte Blutungsneigung, und ist zudem nicht nur auf das zu behandelnde Koronargefäß lokalisiert.
Eine alternative Möglichkeit, die Thrombusbildung zu ver- meiden, besteht in der antithrombogenen Modifizierung der Stentoberfläche [7, 8, 9]. Zur Oberflächenmodifizierung wird häufig die Heparinisierung eingesetzt. Bisher wurde Heparin an zahlreichen Polymeren immobilisiert, ζ. B. an Polyurethanen, Polyvinylchlorid, Polystyren oder Silicon [10,
2 Q B l O m a t e r i a l i e n 4 (1), 2003
Christine Schmidt: Charakterisierung Heparinbeschichteter Titandioxide
ORIGINAL"! ARBEITEN
Titan (oxid)
O H - O H - O H - O H
(MeO),Si" "NH, - O H -O - O - O H
Si
NO M e E D C + N H S
- O H - O - - o - - O H
- NH-Hep
~OMe
Abb. I: Formeller Reaktionsablauf der Modifizierung des Titandioxids
11, 12]. H e p a r i n ist ein n a t ü r l i c h v o r k o m m e n d e s M u c o p o l y - s a c c h a r i d b z w . G l u c o s a m i n o g l y e a n m i t u n r e g e l m ä ß i g v e r - teilten P e n t a s a c c h a r i d e i n h e i t e n a u s 1 , 4 - v e r k n i i p f t e r L- I d u r o n s ä u r e u n d D - G l u c o s a m i n . Die D i s a c c h a r i d b l ö c k e sind d u r c h ß - G l u c o r o n s ä u r e u n d 6 - O - s u l f a t i e r t e m N-acetyl-oc-D- g l u c o s a m i n u n t e r b r o c h e n b z w . e r w e i t e r t . Die M o l m a s s e v a r i - iert ü b e r e i n e n w e i t e n Bereich v o n 6 0 0 0 - 3 0 0 0 0 Da. H e p a r i n b i l d e t mit A n t i t h r o m b i n III (ATIII) u n d T h r o m b i n t e r n ä r e K o m p l e x e . AT III e n t h ä l t h e p a r i n - b i n d e n d e u n d s e r i n - b i n - d e n d e D o m ä n e n . Die h e p a r i n - b i n d e n d e D o m ä n e e n t h ä l t viele s p e z i f i s c h a n g e o r d n e t e A r g i n i n - u n d Lysinreste, die s e l e k t i v a n die e n t s p r e c h e n d e n C a r b o x y l - u n d S u l f a t r e s t e d e s H e p a r i n s b i n d e n . Es k o m m t d a d u r c h zu K o n f o r m a t i o n s - ä n d e r u n g e n im H e p a r i n m o l e k ü l , w o d u r c h A r g i n i n r e s t e v o n AT III a n Serin als a k t i v e m Z e n t r u m des T h r o m b i n b i n d e n k ö n n e n . Es wirkt a n t i k o a g u l i e r e n d , i n d e m es die Ge- r i n n u n g s k a s k a d e u n m i t t e l b a r v o r d e r F i b r i n b i l d u n g u n t e r - b r i c h t . H e p a r i n a k t i v i e r t z u d e m die S y n t h e s e v o n H e p a r a n - s u l f a t a m E n d o t h e l u n d h e m m t die P r o l i f e r a t i o n g l a t t e r M u s k e l z e l l e n . Es k a n n j e d o c h bei Ü b e r d o s i e r u n g die P l ä t t - c h e n a g g r e g a t i o n b e g ü n s t i g e n [13, 14].
F ü r die a n t i k o a g u l i e r e n d e W i r k u n g v o n H e p a r i n w e r d e n v o r a l l e m die 0S03~ - G r u p p e n in 3 - P o s i t i o n v e r a n t w o r t l i c h g e - m a c h t . So w u r d e n v o n B a r b u c c i et al. [15] v e r s c h i e d e n s u l f a t i e r t e H y a l u r o n s ä u r e - D e r i v a t e s y n t h e t i s i e r t u n d e i n e K o r r e l a t i o n d e r a n t i k o a g u l i e r e n d e n A k t i v i t ä t mit d e m S u l - f a t i e r u n g s g r a d u n d d e r A n z a h l a n S u l f a t g r u p p e n festgestellt.
A u f Basis der E r g e b n i s s e w u r d e p o s t u l i e r t , d a s s e l e k t r o s t a - t i s c h e W e c h s e l w i r k u n g e n e b e n f a l l s z u r I n a k t i v i e r u n g v o n T h r o m b i n f ü h r e n . Die h o h e n e g a t i v e L a d u n g s d i c h t e in d i e - s e n M a k r o m o l e k ü l e n b e w i r k t s t a r k e e l e k t r o s t a t i s c h e A b - s t o ß u n g s k r ä f t e z u r n e g a t i v g e l a d e n e n M e m b r a n d e r T h r o m - b o z y t e n . N e b e n e i n e r h o h e n A n z a h l n e g a t i v e r O b e r f l ä c h e n - l a d u n g e n sind a u c h r e p u l s i v e s t e r i s c h e W e c h s e l w i r k u n g e n f ü r e i n e S t e i g e r u n g d e r H ä m o k o m p a t i b i l t ä t v o n Vorteil, w i e ζ. B. f ü r d a s C o p o l y m e r M M A / M e t h o x y - P E O - M M A / V i n y l - s u l f o n a t kürzlich g e z e i g t w u r d e [16]. M a ß s t a b f ü r die e f f e k - t i v e O b e r f l ä c h e n l a d u n g e i n e s W e r k s t o f f s im E l e k t r o l y t e n ist d a s Z e t a - P o t e n z i a l d e r O b e r f l ä c h e .
Ziel dieser S t u d i e w a r die B e s t i m m u n g v o n Z e t a - P o t e n z i a l e n z u n ä c h s t a m M o d e l l s y s t e m T i t a n / H e p a r i n , u m mit diesem P a r a m e t e r f ü r w e i t e r e M o d e l l s y s t e m e in F o r m v o n T i t a n - b a s i s w e r k s t o f f / G l u c o s a m i n o g i y c a n K o r r e l a t i o n e n z u r H ä m o - k o m p a t i b i l i t ä t a b l e i t e n zu k ö n n e n . Die B i n d u n g d e s H e p a r i n s e r f o l g t e , wie in A b b i l d u n g 1 d a r g e s t e l l t , k o v a l e n t ü b e r d e n S i l a n s p a c e r 3 - A m i n o p r o p y l t r i m e t h o x y s i l a n (APMS) a n T i t a n d i o x i d ( A n a t a s u n d Rutil) als M o d e l l v e r b i n d u n g f ü r T i t a n mit p a s s i v e r O x i d s c h i c h t . Die V e r w e n d u n g v o n M o n o - , Di- b z w . T r i - A l k o x y s i l a n e n f ü r e i n e b e s s e r e H a f t u n g z w i s c h e n o r g a n i s c h e r M a t r i x (Biomoleküle) u n d a n o r g a n i - s c h e m Träger (Metalle) ist ein S t a n d a r d v e r f a h r e n [17, 18].
Z u r A k t i v i e r u n g d e r C a r b o x y l f u n k t i o n e n des H e p a r i n s w u r d e ein w a s s e r l ö s l i c h e s C a r b o d i i m i d , wie es f ü r P e p t i d - s y n t h e s e n g e b r ä u c h l i c h ist, e i n g e s e t z t . Die h e p a r i n m o d i -
fizierten T i t a n d i o x i d e w u r d e n m i t t e l s Z e t a - P o t e n z i a l , R a m a n - s o w i e F T - I R - S p e k t r o s k o p i e c h a r a k t e r i s i e r t .
Material und Methodik
Materialien
T i t a n d i o x i d w u r d e v o n d e n F i r m e n Merck, D a r m s t a d t (LAB, A n a t a s - P h a s e ) b z w . A l f a Aesar, K a r l s r u h e (97°/o R u t i l - P h a s e ) b e z o g e n . 3 - A m i n o p r o p y l - t r i m e t h o x y s i l a n (APMS), N - 3 - D i - m e t h y l a m i n o p r o p y l - N ' - e t h y l c a r b o d i i m i d - H y d r o c h l o r i d (EDC) u n d N - H y d r o x y s u c c i n i m i d (NHS) w a r e n v o n F l u k a k o m m e r z i e l l e r h ä l t l i c h . H e p a r i n s o d i u m f r o m p o r c i n e i n t e s - t i n a l m u c o s a (Η 9 3 9 9 , 140 I.U./mg, M W : 1 7 - 1 9 kDa) u n d 2 - ( N - M o r p h o l i n o ) - e t h a n s u l f o n s ä u r e (MES) s o w i e die v e r w e n - d e t e n a b s o l u t e n L ö s u n g s m i t t e l w a r e n v o n S i g m a - A l d r i c h .
SUanisierung von Titandioxid
Die M o d i f i z i e r u n g des T i t a n d i o x i d s e r f o l g t e u n t e r V a r i a t i o n e i n e r v e r ö f f e n t l i c h t e n P r ä p a r a t i o n s v o r s c h r i f t in [23]. Es w u r - d e n 2 g T i 02 (25 m m o l ) u n d 2 ml (11.3 m m o l ) A P M S u n t e r A r g o n in 50 ml w a s s e r f r e i e s T o l u o l g e g e b e n . Die S u s p e n s i o n w u r d e a n s c h l i e ß e n d f ü r 2 h mit U l t r a s c h a l l (35 kHz , S o n o r e x RK 102, Fa. B a n d e l i n , Berlin) b e h a n d e l t . D a n a c h w u r d e d a s f u n k t i o n a l i s i e r t e T i 02 ü b e r e i n e G 4 - F r i t t e a b g e t r e n n t , m i t Toluol g e w a s c h e n u n d f ü r 2 h m i t E t h y l a c e t a t im S o x l e t h - E x t r a k t o r g e r e i n i g t . Die T r o c k n u n g d e r P r o b e n e r f o l g t e im V a k u u m bei R a u m t e m p e r a t u r .
Kovalente Bindung von Heparin
Eine M i s c h u n g v o n 5 0 0 m g m o d i f i z i e r t e m T i 0 2 ( A n a t a s ) in 50 ml M E S - P u f f e r (50 m M , 4 0 % ( v / v ) E t h a n o l / W a s s e r , pH 5.5) w u r d e 15 m i n g e r ü h r t . Z u r S u s p e n s i o n w u r d e n a n - s c h l i e ß e n d 0 . 2 5 b z w . 0 . 5 m m o l EDC, 0 . 0 5 b z w . 0.1 m m o l N - H y d r o x y s u c c i n i m i d s o w i e e n t s p r e c h e n d 50 b z w . 100 m g H e p a r i n g e g e b e n . Das R e a k t i o n s g e m i s c h w u r d e 6 h bei R a u m t e m p e r a t u r g e r ü h r t u n d d e r F e s t s t o f f a n s c h l i e ß e n d d u r c h Z e n t r i f u g i e r e n a b g e t r e n n t . Das P r o d u k t w u r d e j e d r e i - mal m i t 0 . I M N a2H P 04, 2M NaCl u n d e n t m i n e r a l i s i e r t e m W a s s e r g e w a s c h e n u n d im V a k u u m bei 4 0 ° C ü b e r N a c h t g e t r o c k n e t .
Charakterisierung
R a m a n - S p e k t r e n w u r d e n mit e i n e m R a m a n - S p e k t r o m e t e r Serie 1000 d e r Fa. R e n i s h a w , P l i e z h a u s e n , bei e i n e r A n - r e g u n g s w e l l e n l ä n g e des H e N e - L a s e r s v o n λ = 6 3 3 n m a u f - g e n o m m e n . Der L aserstrahl w u r d e m i t e i n e m PL F l u o t a r - Objektiv (Leica DMLM M i k r o s k o p ) bei 5 0 - f a c h e r V e r g r ö ß e - r u n g a u f die P r o b e f o k u s s i e r t . Die P r o b e n w u r d e n h i e r z u mit e i n e m G l a s - O b j e k t t r ä g e r a u f e i n e r a u h e , d i f f u s s t r e u e n d e M e t a l l p l a t t e g e p r e s s t . Die A n r e g u n g e r f o l g t e m i t 5 0 m W ( 4 0 0 0 - 9 0 0 c m1) b z w . 2 5 m W ( 4 0 0 0 - 1 0 0 cm '). Z u r A u s w e r - t u n g w u r d e die S o f t w a r e G R A M S / 3 2 d e r F i r m a G a l a c t i c I n - d u s t r i e s C o r p o r a t i o n v e r w e n d e t . F T - I R - S p e k t r e n w u r d e n mit e i n e m N i c o l e t 3 2 0 S p e k t r o m e t e r d e r Fa. Nicolet, O f f e n b a c h , im W e l l e n z a h l b e r e i c h 4 0 0 0 - 4 0 0 cm"1 u n d e i n e r A u f l ö s u n g
2 φ BlOmateriaüen 4 (1), 2003
ORIGINAL
ARBEITEN
Christine Schmidt: Charakterisierung Heparinbeschichteter Titandioxidev o n 8 cm 1 a u f g e n o m m e n . Schwingungsspektren von Hepa- rin als Referenz wurden als KBr-Pressling in Transmission vermessen. Die Charakterisierung der funktionalisierten Ti02-Pulver erfolgte in diffuser Reflexion (DRIFTS).
Die Bestimmung der Zeta-Potenziale erfolgte mit dem Zeta- sizer 3000 der Fa. Malvern Instruments, Herrenberg, ausge- stattet mit HeNe-Laser (λ =633 nm) und Standard-Elektro- phorese-Zelle bei einer elektrischen Feldstärke v o n
±150 mV. Das Suspensionsmedium w a r Wasser bzw. PBS (pH 7.4). Zur Datenerfassung diente die Software PCS Versi- on 1.36 v o n Malvern Instruments, Herrenberg.
Die Messung des Zeta-Potentials beruht auf der Erzeugung einer Relativbewegung zwischen suspendierten Partikeln u n d der Flüssigkeit durch Anlegen eines äußeren elektri- schen Gleichspannungsfeldes. Die Partikelgeschwindigkeit wird dabei mittels Laser Doppler Anemometrie erfasst. Nach Helmholtz-Smoluchowski [19] wird das Zeta-Potenzial be- rechnet nach (Gleichung 1):
Gleichung I: ζ = 4 π η ν / Ε ε ζ : Zeta-Potenzial [mVl
η: Viskosität des Dispersionsmediums [mPas]
v: Partikelgeschwindigkeit Lm/s]
E: Feldstärke [V/cm]
ε: Dielektrizitätskonstante des Dispersionsmediums
30000 -
D
\—
,, ,C
J
Γ J
V/ V ^ A J
. „ Λ α /
3500 3000 2500 2000 W e l l e n z a h l [ c m ' ]
Abb. 3: Raman-Spektren von aminofünktionalisiertem (A) sowie mit 10 Gew.% (B) bzw. 20 Gew.% (C) modifiziertem Titandioxid im Vergleich zu Heparin (D)
darauf hinweist, dass die A m i n o f u n k t i o n nicht frei vorliegt, sondern sich ein Addukt mit C02 in Form eines Carbamats (R-NH-CCV +NH3-R) gebildet hat (Abb. 3).
Ergebnisse
Raman-Spektroskopie/FT-IR-Spektroskopie
Das verwendete kommerzielle Titandioxid lag als A n a t a s - (v
= 640, 523, 395, 192, 144 c m1) bzw. Rutil-Phase (v = 607, 448, 236 cm-1) vor. Abbildung 2 zeigt die Raman-Spektren des modifizierten Titandioxids (Anatas) f ü r die Umsetzung
1,2 -
1.0 - 111
S, 0,8 -
W C
a>
0,6 - c 0) > 0,4 -
m
O) 0.2 -
0 , 0
A - A P M S _ _ 1
4000 3500 3000 2500 2000 1500 W e l l e n z a h l [ c m " ' ]
Abb. 2: Raman-Spektren von unmodifiziertem (A) und mit APMS (A- APMS) modifizierten Titandioxid
in Toluol im Vergleich z u m reinen Substrat. Die Signale des Haftvermittlers sind in Form schwacher Banden zu er- kennen. Signale der C-H-Streckschwingungen im Bereich 2 9 0 0 - 3 0 0 0 c n r1 sowie der C-H-Deformationsschwingungen v o n 1390-1490 c n r1 belegen, dass die Reaktion zwischen APMS u n d Titandioxid u n a b h ä n g i g v o n der Modifikation stattfindet. Die N-H-Streckschwingungen sind schwach zwi- schen 3 3 0 0 - 3 4 0 0 cm- 1 zu erkennen. Weiterhin wird f ü r A-APMS ein starker Peak bei ca. 1660 cm-1 erhalten, der
Die kovalente Bindung des Heparins am Silan-Spacer wird ebenfalls a n h a n d der Raman-Spektren (Abb. 3, Β und C) sichtbar. Identifizierungsmerkmal ist die symmetrische S 03- Schwingung. Es findet sich die typische A u f s p a l t u n g des Signals verursacht durch die Bindung der Sulfatgruppe in 2-N- (1051 c m1) bzw. 6 - 0 - P o s i t i o n (1070 cnr1) analog zu Heparin. Die 2 - 0 - S u l f a t g r u p p e , mit einer zu erwartenden Verschiebung um ca. 10 cm-1 zu höheren Wellenzahlen, ist sowohl f ü r das reine als auch g e b u n d e n e Heparin nicht zu erkennen [20].
Die Ergebnisse der IR-Spektren (Abb. 4) der a m i n o - und he- parin-funktionalisierten Titandioxide stehen mit den Raman-spektroskopischen Daten im Einklang. Bei zirka
1030 cm- 1 (Abb. 4, A) erscheint die Bande der Kombinati- o n s s c h w i n g u n g von Si-0-Si u n d Ti-0-Ti-(antisymmetrische Valenzschwingungen) sehr stark [23]. Die Kopplung des He- parins wird beispielsweise a n h a n d der symmetrischen S = 0 -
Abb. 4: FT-IR-Spektren von Anatas nach der Reaktion mit APMS (A) sowie mit 20 Gew.% Heparin (ß) im Vergleich zu Heparin (C)
/ J . Q | B I O m a t e r i a l i e n 4 (1), 2003
Christine Schmidt: Charakterisierung Heparinbeschichteter Titandioxide
ORIGINALI ARBEITEN
Valenzschwingung in Kombination mit den antisymme- trischen C-O-C-Schwingungen zwischen 1020-1070 cm"' deutlich [21]. Das DRIFT-Spektrum nach der Heparinisierung ist bis auf die Verbreiterung der S c h w i n g u n g s b a n d e n mit dem des Heparins identisch.
Zeta-Potenziale
Einen eindeutigen qualitativen Nachweis, dass sowohl H a f t - vermittler als auch Heparin kovalent ah der Substratober- fläche immobilisiert wurden, liefern die in Wasser gemesse- nen Zeta-Potenziale (Abb. 5). Für A n a t a s wurde in Wasser ein Wert von -30.9 ± 3.3 mV und f ü r Rutil von -42.6 ± 2.2 mV bestimmt. Nach der Modifizierung mit APMS ist die Partikeloberfläche positiv geladen. Das Zeta-Potenzial be-
60
40
> Ε
" 2 0 ' n £=
ω ο 0 α ra Ν -20
-40
- 6 0
Ί1
R A- R- A-APMS- A-APMS- A P M S A P M S HeplOO Hep50
Abb. 5: Zeta-Potenziale der reinen Substrate (A- Anatas, R: Rutil) sowie der aminofunktionalisierten (A-APMS, R-APMS) und heparinisierten (A- APMSHep50:10 Gew.% Heparin; A-APMSHep 100: 20 Gew.%Heparin) Ti- tandioxide
? -10
£
ro Ν C <d
Ζ -2 0' Q.
d>
Nl -30-
-40 A-APMS R-APMS
Abb. 6: Zeta-Potenziale der reinen Substrate (A: Anatas, R: Rutil) und der aminofunktionalisierten Titandioxide (A-APMS, R-AMPS) in PBS (pH 7.4)
trägt f ü r beide Modifikationen u n g e f ä h r +40 mV, da in Wasser die NH2-Gruppen protoniert als NH3+ vorliegen. Um Aussagen über das Verhalten des Haftvermittlers u n t e r physiologischen Bedingungen zu treffen, wurde das Zeta- Potenzial in PBS-Puffer (pH 7.4) untersucht (Abb. 6). Hierbei w u r d e n f ü r die aminofunktionalisierten Titandioxide u n a b - h ä n g i g vom verwendeten Ti02, Zeta-Potenziale v o n zirka
- 2 0 mV gemessen, bedingt durch oberflächliche Adsorption von H P 04 2- -bzw. H2P 04- I o n e n . Nach der Heparinisierung werden stärker negative Zeta-Potenziale als f ü r das reine Oxid im Bereich von ca. - 5 0 mV erhalten. Die starke Zu- n a h m e der negativen Ladung der Partikel durch das Heparin ist a u f g r u n d der großen Anzahl an Sulfat- und Carboxyl- gruppen nicht unerwartet. Durch die Immobilisierung von Heparin an der T i 02- 0 b e r f l ä c h e erfolgt eine Stabilisierung der Partikel in Wasser.
Diskussion
Das Titandioxid w u r d e in Pulverform als Modellverbindung f ü r eine oxidierte Titanoberfläche mit Passivschicht gewählt.
Die Modifizierungen mit dem Silanspacer bzw. Heparin sind an Titan(oxid)oberflächen analog d u r c h f ü h r b a r . Hauptanlie- gen dieser Arbeit war es, mit Hilfe von Zeta-Potenzialen qualitative Aussagen zu Oberflächeneigenschaften v o n m o - difizierten Titanoberflächen im Elektrolytkontakt zu treffen, und um Rückschlüsse zur Hämokompatibilität zunächst f ü r heparin-funktionalisiertes Titandioxid zu ziehen. Im Gegen- satz zur Messung an ebenen Metalloberflächen als stationäre Phase mit laminarer S t r ö m u n g der flüssigen Phase, ist die Erfassung des Zeta-Potenzials dispergierter Pulver messtech- nisch mittels Elektrophorese leicht d u r c h f ü h r b a r . Aus diesem Grund wurden im Rahmen der Arbeit Messungen an f u n k - tionalisierten Titandioxidpulvern d u r c h g e f ü h r t . Das Zeta- Potenzial ist ein wichtiger Parameter, der Aufschluß über die physikalische Stabilität von Suspensionen gibt. Im ü b e r t r a - genen Sinn lässt sich Blut ebenfalls als Suspension negativ geladener Blutbestandteile auffassen. Daher ist das Zeta- Potenzial sehr nützlich f ü r die qualitative Beurteilung eines Werkstoffs zur A n w e n d u n g im Blutkontakt. R a m a n - u n d FT-IR-Spektroskopie w u r d e n ergänzend hinzugezogen, da das Zeta-Potenzial keine Informationen über die strukturelle Z u s a m m e n s e t z u n g der Schichten liefert.
Die E i n f ü h r u n g reaktiver organischer Funktionalitäten an Hydroxylgruppen v o n Metalloberflächen mittels M o n o - , Di- bzw. Tri-Alkoxysilanen zur kovalenten Bindung v o n ζ. B.
Biomolekülen, ist ein Standardverfahren. Nicht alle dabei a b l a u f e n d e n Mechanismen sind bisher v o l l k o m m e n geklärt.
Ein Nachteil der kovalenten Bindung bioaktiver Moleküle, wie z.B. Heparin, besteht in K o n f o r m a t i o n s ä n d e r u n g e n , die wahrscheinlich zu einer A b n a h m e der biologischen Aktivität f ü h r e n . Um dies auszuschließen sind in vitro U n t e r s u c h u n - gen erforderlich, deren Ergebnisse derzeit noch nicht v o r - liegen.
Die R a m a n - und IR-Spektren belegen eindeutig die k o v a l e n - te Modifizierung der Titandioxidoberfläche mit Heparin nach vorheriger A m i n o f u n k t i o n a l i s i e r u n g . Es zeigte sich, dass die freien A m i n o g r u p p e n des Silan-Haftvermittlers als Carbamat infolge der Reaktion mit C02 vorliegen. Diese Ad- duktbildung bei längerer Lufteinwirkung ist f ü r Aminosilo- x a n e bekannt. Durch inerte A u f a r b e i t u n g bzw. Erhitzen im V a k u u m bei 120°C (C02-und H20-Freisetzung) sollte das freie Amin erhalten werden [22]. Es wurde vermutet, dass die nachfolgende Umsetzung mit Heparin dadurch nicht be- einträchtigt wird.
Es ist d a v o n auszugehen, dass bei der Umsetzung j e nach Wassergehalt des Toluol das Aminopropyl-trimethoxysilan an der Oberfläche polymerisiert und somit in Form eines dreidimensionalen Netzwerkes g e b u n d e n ist. Durch Feuch- tigkeitsspuren werden hierbei die M e t h o x y g r u p p e n h y d r o - lysiert u n d die so e n t s t a n d e n e n Silanolfunktionen mit der Oxidoberfläche kondensiert, parallel findet die V e r n e t z u n g über die A m i n o g r u p p e statt. Die Schichtfestigkeit w u r d e durch kontinuierliche Extraktion des Titandioxids mit Ethy-
] B l O m a t e r i a l i e n 4 (1), 2 0 0 3
ORIGINAL ARBEITEN
Christine Schmidt: Charakterisierung Heparinbeschichteter Titandioxidelacetat nachgewiesen. In welcher Konzentration das Heparin bzw. der Haftvermittler auf" der Ti02-0berfläche vorliegen und in diesem Zusammenhang auch welche Auswirkungen auf die Hämokompatibilität und Thrombogenität die Folge sind, steht im Interesse weiterer Untersuchungen.
Der Vorteil der Bindung des Silans im Ultraschall gegenüber der Umsetzung in der Siedehitze besteht darin, dass Agglo- merate durch die Vibrationen getrennt werden und somit eine größere Oberfläche zur Modifizierung zur Verfügung steht [23].
In Wasser wurde ein Zeta-Potenzial von unbeschichtetem Anatas -30.9 ± 3.3 mV und von Rutil von -42.6 ± 2.2 mV erhalten. Die negative Oberflächenladung von Titandioxid in Wasser ist zu erwarten, da der isoelektrische Punkt bei 4.7- 6.2 liegt [24]. Das deutlich höhere Zeta-Potenzial von Rutil weist darauf hin, dass die Hydroxylgruppen auf dieser Ober- fläche in Wasser stärker deprotoniert vorliegen. Wahr- scheinlich sind die stark differierenden Zeta-Potenziale von Anatas und Rutil durch die unterschiedliche Kristallstruktur und zusätzliche Einflüsse von Gitterdefekten infolge unter- schiedlicher Herstellungsverfahren bedingt.
Die gemessenen Zeta-Potenziale der aminofunktionalisierten Titandioxide in PBS lassen vermuten, dass bei nicht voll- ständiger Abschirmung des Haftvermittlers durch die Hepa- rinmoleküle, die Adhäsion von Thrombozyten wenig be- günstigt wird. Die Phasenzusammensetzung des silanisierten Titandioxids beeinflusste die effektive Oberflächenladung nicht. Die Heparinanbindung wurde daher, aufgrund der im Vergleich zu Rutil zehnfach größeren Oberfläche, zunächst nur an Anatas durchgeführt. Es besteht kein Unterschied der Zeta-Potenziale für 10 bzw. 20 Gew.°/o eingesetzter Aus- gangsmenge an Heparin. Das lässt darauf schließen, dass die Partikel-Oberfläche vermutlich mit einer Monolage Heparin gesättigt ist. Da das Zeta-Potenzial aber keine quantitative Meßmethode ist, sind auch Multischichten möglich, die eine vergleichbare Oberflächenladung aufweisen.
Abstract
The development of haemocompatible surfaces is a, key ele- ment in the fabrication of implants and medical devices in contact with human blood, for example haemodialysis sy- stems, extracorporal circulation systems, catheters, stents or heart valves. The contact of an artificial surface with blood results in a complex series of interacting events: protein-ad- sorption, platelet adhesion, activation and aggregation, ac- tivation of blood coagulation system, contact activation and finally fibrin and thrombus formation. Many investigations have been carried out to prevent an artificial surface from provoking thrombus formation in order to form a biocom- patible surface by means of surface modification of the ma- terials. Aim of this work was the functionalization of titani- um dioxide surfaces with heparin. The covalent bonding of the pharmacological active molecule was performed using the coupling agent 3-aminopropyltrimethoxysilane. The mo- dified surfaces were characterized by means of Raman- and FT-IR spectroscopy with regard to their composition and by measurement of the zeta potential according to the surface charge in contact with an aqueous electrolyte. The covalent bonding of the heparin could be accounted spectroscopically by the occurrence of a symmetrical S03-vibration within the molecule. Regarding the zeta potentials the layer struc- ture could be pursued qualitatively in the aqueous medium, because the potentials of the applied coating varied stron- gly. By use of the coupling agent the potential of the unmo- dified anatase surface (approx. -30mV) shifted into the posi- tive range (+40mV), caused by the presence of protonated
Dipl.-Chem.
Christine Schmidt
Korrespondenzanschrift:
Dipl.-Chem. Christine Schmidt, Abteilung für Funk- tionswerkstoffe der Medizin und Zahnheilkunde, ZMK-Kli- nik, Universität Würzburg, Pleicherwall 2,
97070 Würzburg,
Tel.: +49-(0)931 201 73550, Fax: +49-(0)931 201 73500
1993-1999 Chemiestudium an der Technischen Universität in Chemnitz
Thema der Diplomarbeit: Polaritätsun- tersuchungen an kristallinen Ami- nosäuren, Oligopeptiden und Polyami- nosäuren mittels solvatochromer Son- denmoleküle
11/1999-07/2001 Wissenschaftliche Mitarbeiterin an der Technischen Universität Chemnitz, Synthese und Charakterisierung von redoxschaltbaren, schwefelhaltigen Po- lyvinylformamid-co-Polyvinylamin- Netzwerken
Seit 02/2002 Wissenschaftliche Mitarbeiterin der Ju- lius-Maximilians-Universität Würzburg, Klinik und Polikliniken für Zahn-, Mund- und Kieferkrankheiten, Abtei- lung für Funktions-werkstoffe der Me- dizin und Zahnheilkunde, Oberflächen- funktionalisierung von Biomaterialien zur Anwendung im Blutkontakt
amino groups. Binding of heparin results in a strongly ne- gatively charged surface with a zeta potential of approx. -50 mV due to the presence of negatively charged S03" -groups.
The results serve as a basis for the covalent coupling of other pharmacological active substances (dermatan sulfate or heparan sulfate) at implant surfaces to adjust antithrom- bogenic and proliferation inhibiting properties, which are clinically demanded for materials in blood contact.
Literatur
[1] Huang N.-P., Michel R., Voros J., Textor M. Hofer R„
Rossi Α., Elbert D. L, Hubbell J. Α., Spencer N. D.: Poly-(L- lysine)-g-poly(ethylene glycole) Layers on Metal Oxide Sur- faces: Surface-Analytical Characterization and Resistance to Serum and Fibrinogen Adsorption. Langmuir 17: 489-498, 2001.
[2] Wintermantel Ε., Ha S. W.: Biokompatible Werkstoffe und Bauweisen. Springer, Berlin 1996.
[3] Serruys P. W.: Handbook of coronary stents. Martin Du- nitz, London 1997.
^ 2 B l O m a t e r i a l i e n 4 (1), 2003
Christine Schmidt: Charakterisierung Heparinbeschichteter Titandioxide
ORIGINAL· ARBEITEN
[4] Cragg Α., Lund G., Rysavy J.: Nonsurgical placement, of arterial Endoprotheses: a new t e c h n i q u e u s i n g nitinol wire.
Radiology 147: 2 6 1 - 2 6 3 , 1 9 8 3 .
[5] Hur S.-H., Kitamura K., Morino Y„ Honda Y., J o n e s M„
Korr Κ. S„ Reen 111 B., Cooper C. J., Niess G. S„ Christie L„
Corey W., Messenger J., Yock P. G„ C u m m i n s F., Fitzgerald P. J.: Efficiacy of p o s t d e v e l o p m e n t Balloon Dilatation for Current Generation Stents as Assessed by Intravascular Ul- t r a s o u n d . Am. J Cardiol 88: 1114-1119, 2001.
[6] Beck R. M.: Dissertation, Universität Tübingen, 2001.
[7] Qureshi Α. I., Luft A. R., S h a r m a M., G u t e r m a n L. R„
Hopkins L. N.: P r e v e n t i o n and T r e a t m e n t of T h r o m b o e m b o - lic a n d Ischemic Complications Associated with E n d o v a s c u - lar Procidures: Part I - Pathophysiological and P h a r m a c o l o - gical Features. Neurosurgery 4 6 : 1344-1359, 2000.
[8] Regar E., Sianos G., Serruys P. W.: Stent d e v e l o p m e n t a n d local d r u g delivery. Brit Med Bull 59: 227-248, 2001.
[9] Urban P., M a c a y a C., Rupprecht H.-J., Kiemeneij F., E m a - nuelsson H., Fontanelli Α., Pieper Μ., Wesseling Τ., S a g n a r d L.: Randomized Evaluation of A n t i c o a g u l a t i o n Versus A n t i - platelet Therapy A f t e r Coronary Stent I m p l a n t a t i o n in High- Risk Patients. Circulation 9 8 : 2 1 2 6 - 2 1 3 2 , 1998.
[10] Chen C., Z h a n g R., Kodama M., Nakaya T.: A n t i c o a g u - lant S u r f a c e Prepared by Heparinization of Ionic Polyuret- h a n e Film. J Appl Polym Sei 76: 382-390, 1996.
[11] a) Kang I. K„ Kwon 0 . H„ Kim M. K.. Lee Υ. M„ S u n g Y.
K.: In vitro blood compatibilizy of f u n c t i o n a l g r o u p - g r a f t e d and h e p a r i n - i m m o b i l i z e d p o l y u r e t h a n e s by plasma glow di- scharge. Biomaterials 18: 1099-1107, 1997. b) Kang I. K., Beak D. K„ Lee Υ. M„ S u n g Υ. K.: Synthesis and Surface Characterization of H e p a r i n - i m m o b i l i z e d P o l y e t h e r u r e t h a - nes. J Polym Sei A: Polym Chem 36: 2 3 3 1 - 2 3 3 8 , 1998.
[12] Kim H., Urban M. W.: Reactions of Thrombresistent Multilayered Thin Films on Poly(vinylchloride) (PVC) S u r f a - ces : A Spectroscopic Study. L a n g m u i r 14: 7 2 3 5 - 7 2 4 4 , 1998.
[13] Larm 0., Larrson R., Olsson P.: In: Lane, D.A., Lindahl, U. (Hrsg.), Heparin: Chemical and Biological Properties, Cli- nical Applications. Edward Arnold, London 1989.
[14] Opal S. M., Kessler C. M., Roemisch J., Knaub S.: Anti- t h r o m b i n , Heparin, and H e p a r a n sulfate. Crit Care Med 30 (Suppl.): S325-S331, 2002.
[15] Barbucci R., M a g n a n i Α., Rappuoli R., Lamponi S., Con- sumi M.: Immobilization of Sulphated Hyaluron for Impro- ved Biocompatibility. J Inorg Biochem 79: 119-125, 2000.
[16] Lee J. H„ Oh S. H.: MMM/MPEOMA/VSA Copolymer as a Novel Blood-Compatible Material: Effect of PEO a n d Ne- gatively Charged Side Chains on Protein A d s o r p t i o n and Platelet Adhesion. J Biomed Mater Res 60: 4 4 - 5 2 , 2002.
[17] Nanci Α., Wuest J. D„ Peru L„ Brunei P., S h a r m a V., Zalzal S., McKee M. D.: Chemical m o d i f i c a t i o n of t i t a n i u m surfaces for covalent a t t a c h m e n t of biological molecules. J Biomed Mat Res 40: 3 2 4 - 3 3 5 , 1998.
[18] Lin J., Siddiqui J. Α., Ottenbrite M.: S u r f a c e M o d i f i c a t i - on of I n o r g a n i c Oxide Particles With Silane C o u p l i n g A g e n t and Organic Dyes. Polym Adv Technol 12: 2 8 5 - 2 9 2 , 2001.
[19] v. S m o l u c h o w s k i M.: Phys Ζ 6: 530, 1905.
[20] Atha D. H„ Gaigalas A. K., Reipa V.: Structural A n a l y s i s of Heparin by R a m a n Spectroscopy. J P h a r m Sei 85(1): 52- 56, 1996.
[21] Schräder Β., Bougeard D.: Infrared and r a m a n s p e c t r o s - copy : m e t h o d s a n d applications, VCH, W e i n h e i m u.a. 1995.
[22] Battjes K. P., Barolo A .M, Dreyfuss P.: In: Mittal K. L.
(Hrsg.), Silanes a n d Other Coupling Agents. 199-213, VSP, Utrecht 1992.
[23] ShafI Κ. V. P. M„ Ulman Α., Yan X., Y a n g N.-L., H i m - m e l h a u s M., Grunze Μ.: S o n o c h e m i c a l p r e p a r a t i o n of Sila- ne-Coated Titania Particles. L a n g m u i r 17: 1726-1730, 2001.
[24] Parks G. Α.: The isoelectric points of solid oxids, solid h y d r o x i d s and h y d r o x y c o m p l e x systems. Chem Rev 6 5 :
177-198, 1965.
4 3 B l O m a t e r i a l i e n 4 (1), 2003