Einsatz der Laser-Scan-Mikroskopie zur Charakterisierung der Wundheilung
Application of laser scanning microscopy for the characterization of wound healing
Abstract
Optical non-invasive methods have become more and more important for the characterization of skin lesions and for therapy control. In vivo
Alena Alborova
1Jürgen Lademann
1laser scanning microscopy is a promising method which can be used
Lars Meyer
1for the analysis of cellular structures in the skin up to a depth of 250
Axel Kramer
2µm. Therefore, laser scanning microscopy (LSM) is well-suited for the characterization of wound healing processes. In contrast to measure-
Alexa Patzelt
1ments of the transepidermal waterloss (TEWL) the laser scanning micro-
Wolfram Sterry
1scopy allows the analysis of the healing process on a cellular level. The
Christina Antoniou
3course of wound healing determined by laser scanning microscopy was correlated with numerical values, which correspond to those used for measurements of TEWL, allowing the numerical characterization of the
wound healing process. 1 Bereich Hautphysiologie der
Klinik für Dermatologie, Laser scanning microscopy showed that wound healing starts not only
from the wound edges but also from "islands" inside the wound area. Venerologie und Allergologie, Charité - Universitätsmedizin, Berlin, Deutschland In contrast to TEWL measurements the LSM analysis is not influenced
by disturbing factors such as temperature, humidity and topically applied
2 Institut für Hygiene und Umweltmedizin der Ernst- substances. Therefore, the laser scanning microscopy is well-suited for
the characterization of different types of wound healing therapies in-
cluding the topical application of creams and lotions. Moritz-Arndt-Universität, Greifswald, Deutschland
Zusammenfassung
Optische, nicht invasive Verfahren finden in der Dermatologie zur Cha- rakterisierung von Hautzuständen und zur Therapiekontrolle eine zu-
3 Sygros Hospital, Dept. of Dermatology and Photobiology, University, Athens, Greece nehmende Anwendung. Besonders geeignet ist hierfür die In-vivo-Laser-
Scan-Mikroskopie, welche es ermöglicht, zelluläre Strukturen bis zu einer Tiefe von 250 µm in der Haut nachzuweisen. Damit eignet sich die In- vivo-Laser-Scan-Mikroskopie sehr gut, Wundheilungsprozesse zu cha- rakterisieren. Im Gegensatz zur klassischen Analyse von Wundheilungs- prozessen mit Hilfe des transepidermalen Wasserverlustes (TEWL) er- möglicht die In-vivo-Laser-Scan-Mikroskopie die Darstellung des Hei- lungsprozesses auf zellulärer Ebene. Mit Bewertungskriterien, welche die Stadien des Wundheilungsprozesses beschreiben, lässt sich der Heilungsprozess numerisch beschreiben.
Die Untersuchungen zeigen, dass die Wundheilung nicht nur von den Rändern her erfolgt, sondern auch innerhalb der Wunde "Inseln" entste- hen, von welchen die Erneuerung des Stratum corneum erfolgt. Im Ge- gensatz zu den TEWL-Messungen werden laser-scan-mikroskopische Untersuchungen nicht durch äußere Faktoren wie Temperatur, Luftfeuch- tigkeit und topisch applizierte Substanzen gestört.
Die In-vivo-Laser-Scan-Mikroskopie ist sehr gut dazu geeignet, die Wir- kung von verschiedenen Formen der Wundbehandlung einschließlich der Applikation von Wundsalben zu charakterisieren.
Schlüsselwörter:In-vivo-Laser-Scan-Mikroskopie, transepidermaler Wasserverlust, Wundheilungsanalyse, Saugblasentechnik
Einleitung
Die Haut stellt das Kontaktorgan zwischen der Umwelt und unserem Organismus dar. Sie besitzt vielfältige Funktionen wie Schutz gegen mechanische und chemi- sche Einwirkungen sowie gegen UV-Strahlung, hat Bedeu- tung für die Wärmeregulierung und den Tastsinn und besitzt damit eine große Bedeutung für den Gesamtorga- nismus [1]. Verletzungen führen zum Verlust der Integrität des Gewebes, wobei der Organismus versucht, diese Wunden schnell zu schließen und die Funktion des be- schädigten Gewebes wieder herzustellen [2].
Eine Verbesserung der Wundheilung ist in verschiedenen Bereichen der Medizin von besonderem Interesse und stellt eine wichtige Herausforderung im Klinikalltag dar [3]. Ein wichtiges Augenmerk liegt auf der Vermeidung von Wundinfektionen und der Beschleunigung der Epithe- lisierung.
Die Standardmethode zur Charakterisierung des Wund- heilungsprozesses besteht in der Messung des transepi- dermalen Wasserverlustes (TEWL) [4], [5], [6]. TEWL- Messungen haben den Nachteil, dass sie stark durch äußere Faktoren beeinflusst werden. Die Raumtempera- tur und Luftfeuchtigkeit müssen konstante Werte aufwei- sen, die Probanden dürfen nicht schwitzen [7]. Ein we- sentlicher Nachteil der TEWL-Messungen besteht darin, dass topisch applizierte Substanzen wie Pflegecremes und Wundsalben die TEWL-Messungen stören [8].
Eine Alternative zu dieser Methode stellt die bildgebende In-vivo-Analyse des Wundheilungsprozesses mit Hilfe der Laser-Scan-Mikroskopie (LSM) dar [9]. Dermatologische Laser-Scan-Mikroskope ermöglichen es, unter Einsatz von optischen Lichtleitfasern jedes Hautareal des menschlichen Körpers in vivo zu analysieren [10]. In der vorliegenden Arbeit werden die Möglichkeiten dieser neuen Technologie zur Charakterisierung des Wundhei- lungsprozesses beschrieben.
Materialien und Methoden
TEWL-Messungen
Die Messung des transepidermalen Wasserverlustes ist eine klassische, anerkannte, häufig eingesetzte Methode zur Untersuchung der Wundheilung und zur Charakteri- sierung der Barrierefunktion der menschlichen Haut [4].
Eine geschädigte Haut lässt mehr Wasser durch als eine intakte Barriere [8]. Nachteil dieser Methode ist, dass zu Beginn der Wundheilung, solange die Wunde feucht ist, keine Messung möglich ist. Ferner sind weder Aussagen zur Reepithelisierung auf zellulärer Ebene noch zur bak- teriellen Besiedlung der Wunde möglich. In den vorliegen- den Untersuchungen wurde der transepidermale Wasser- verlust mit Hilfe des TEWA-Meters TM 210®(Courage + Khazaka Elektronik GmbH Köln) gemessen.
In-vivo-Laser-Scan-Mikroskopie
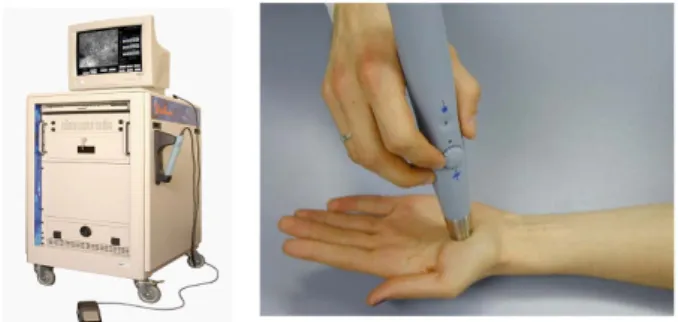
Die Untersuchungen zur Kinetik der Wundheilung wurden mit dem dermatologischen Laser-Scan-Mikroskop "Stra- tum" (OptiScan Ltd. Melbourne, Australien) unter In-vivo- Bedingungen durchgeführt. Bei diesem Gerät ist ein Handstück, das das optische Abbildungs- und Fokussie- rungssystem enthält, über Lichtleiter mit dem Laser- und Detektionssystem verbunden [10]. Dadurch ist es mög- lich, das Handstück auf jede beliebige Körperstelle auf- zusetzen (Abbildung 1). Die Position des Fokus im Gewebe kann manuell am Handstück geregelt werden. Dadurch ist es möglich, unterschiedliche Hautschichten zu analy- sieren. Die Messfläche beträgt 250 x 250 µm, die maxi- male Detektionstiefe beträgt 250 µm. Die zellulären Strukturen im Gewebe werden durch Auftragen eines fluoreszierenden Farbstoffs sichtbar gemacht [10].
Abbildung 1: In-vivo-Laser-Scan-Mikroskop "Stratum" mit frei beweglichem Handstück, das das optische Abbildungssystem
und die Fokusregulierung beeinhaltet
Erzeugung standardisierter Wunden
Mit Hilfe der von Kiistala [11] beschriebenen Saugblasen- technik ist es möglich, definierte, reproduzierbare Haut- defekte zu erzeugen. Dabei kommt es zur Trennung von Epidermis und Dermis auf der Ebene der Basalmembran.
Diese Methode wird häufig bei Wundheilungsstudien eingesetzt. Die Saugblase wird erzeugt, indem ein Unter- druck von 200 mm Hg über einen Zeitraum von 120 min auf die Hautoberfläche einwirkt [12]. Nach der Entfernung des Blasendachs entsteht eine oberflächliche Wunde, die innerhalb weniger Tage narbenfrei abheilt (Abbildung 2).
Ergebnisse und Diskussion
LSM-Untersuchungen am gesunden Gewebe
Mit Hilfe der LSM können unterschiedliche Gewebeschich- ten analysiert werden. Das Stratum corneum besteht aus abgeflachten, keratinisierten, kernlosen Korneozyten, die von Lipidschichten umgeben sind. Auch das darunter liegende Stratum spinosum kann mit Hilfe der LSM klar dargestellt werden. Die Zellen sind wesentlich kleiner, wobei Zellkerne zu erkennen sind. In einer Tiefe von ca.
200 µm ist die Papillarstruktur erkennbar (Abbildung 3).
Abbildung 3: Laser-Scan-mikroskopische Darstellung von zellulären Strukturen in unterschiedlichen Hautschichten
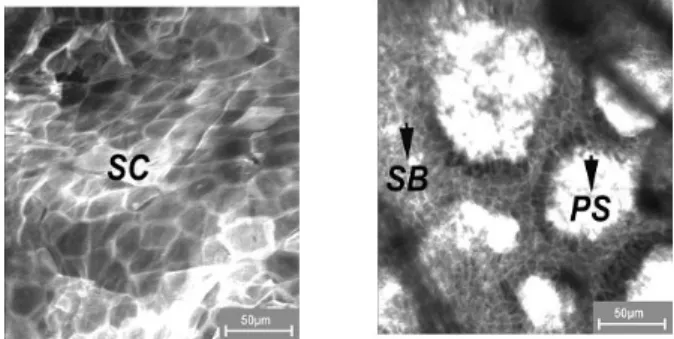
Während eine Biopsie normalerweise einen vertikalen Schnitt durch das Gewebe darstellt, wird durch die LSM eine horizontale Fläche im Gewebe analysiert. Zum bes- seren Vergleich zeigt Abbildung 4 zwei horizontale Schnitte einer Biopsie, die klar das Stratum corneum (SC) und das Stratum spinosum (SS) mit der Papillarstruktur (PS) zeigen.
Abbildung 4: Horizontale histologische Schnitte, die das Stratum corneum (SC) und das Stratum spinosum (SS) mit der
Papillarstruktur (PS) zeigen
Analoge Strukturen sind mit Hilfe der LSM darstellbar (Abbildung 5), wobei es sich hierbei um einen nichtinva- siven Prozess handelt. Eine wichtige Variable für die Charakterisierung der Wundheilung ist die Herausbildung des Stratum corneum.
Abbildung 5: In-vivo-laser-scan-mikroskopische Aufnahmen, die das Stratum corneum (SC) und das Stratum basale (SB)
mit der Papillarstruktur (PS) zeigen
Abbildung 6 zeigt einen vertikalen Schnitt einer Biopsie.
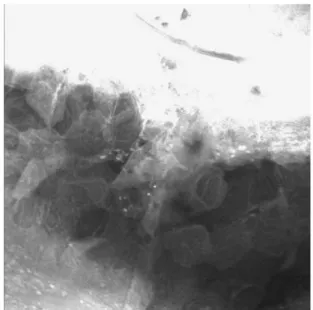
Das Stratum corneum ist klar erkennbar. Die reale Schichtdicke des Stratum corneum unter In-vivo-Bedin- gungen kann jedoch nicht anhand von Biopsien ermittelt werden, da sich während des Präparationsprozesses die Eigenschaften und die Abmessungen des Stratum corne- um ändern. Im Gegensatz dazu ermöglicht die LSM eine eindeutige In-vivo-Bestimmung der Schichtdicke des Stratum corneum (Abbildung 7). Hierzu ist es notwendig, den Abstand zwischen der Hautoberfläche und der Grenzschicht vom Stratum corneum zum Stratum spino- sum zu ermitteln. Das ist möglich durch eine Verschie- bung der Focusebene in tiefere Gewebeschichten. Das linke Bild in Abbildung 7 zeigt die Hautoberfläche mit dem Stratum corneum (SC), während das rechte Bild die Grenze zwischen Stratum corneum und Stratum granulo- sum darstellt. Im unteren Teil der Abbildung sind noch Korneozyten zu erkennen, während im oberen Teil die lebenden Zellen des Stratum granulosum (GS) sichtbar sind.
Abbildung 6: In histologischen Schnitten ist das Stratum corneum genau erkennbar
Abbildung 7: Laser-scan-mikroskopische Bestimmung der Schichtdicke des Stratum corneum; die Fokusebene wird von der Hautoberfläche (linkes Bild) bis an die Grenze zur lebenden
Epidermis (rechtes Bild) verschoben
Analyse der Wundheilung
Nach der Entfernung des Blasendachs ist die Hautober- fläche der Wunde mit Wundsekret bedeckt. Dieses trocknet ein und bildet eine krustenförmige Struktur.
Darunter sind klar die lebenden Zellen des Stratum gra- nulosum und des Stratum basale erkennbar. Nach einigen Tagen bildet sich die erste Schicht der Korneozyten her- aus (Abbildung 8). Die Neubildung des Stratum corneum erfolgt nicht nur von den Wundrändern her, sondern auch aus einzelnen "Inseln" im Bereich der Wundfläche, die sich vergrößern, so dass eine erste Zelllage von Korneo- zyten die Wundfläche bedeckt. Im Verlauf der Wundhei- lung bilden sich immer neue Zelllagen von Korneozyten heraus, bis sich das Stratum corneum vollständig erneu- ert hat. Die Anordnung der Korneozyten auf der Hautober- fläche ist in diesem Anfangsstadium noch sehr unregel- mäßig (Abbildung 9) und weist eine ähnliche Oberflächen- struktur auf wie die trockene Haut. Erst nach ca. 10 Tagen hat die Hautoberfläche ihre ursprüngliche homogene Struktur wieder erreicht (Abbildung 10).
Abbildung 8: Herausbildung der ersten Korneozytenschicht auf der Wunde
Abbildung 9: Hautoberfläche und unregelmäßige Anordnung der Korneozyten
Abbildung 10: Regelmäßige Anordnung der Korneozyten an der Hautoberfläche
Um die laser-scan-mikroskopische Analyse des Wundhei- lungsprozesses – ähnlich wie bei TEWL-Messungen – auch numerisch bewerten zu können, wurden folgende Kriterien eingeführt:
Stadium I: Die Wunde ist von Wundsekret bedeckt, das eine Kruste bildet.
Stadium II: Die erste Lage des Stratum corneum bildet sich heraus.
Stadium III: Das Stratum corneum ist voll ausgebildet.
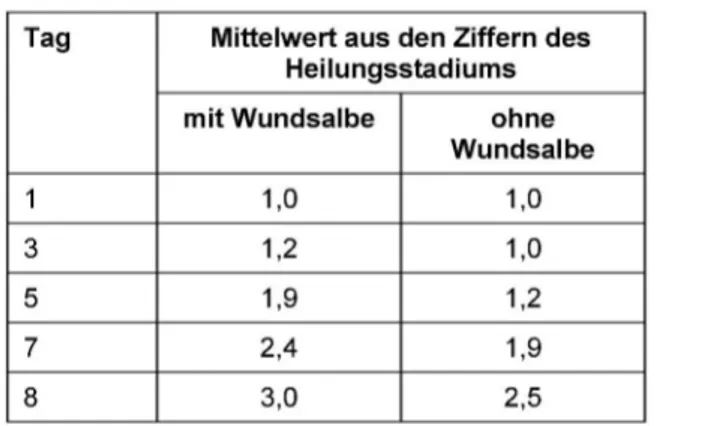
Diese Kriterien wurden genutzt, um im Rahmen einer Studie die Wundheilung mit und ohne Applikation einer Wundsalbe zu charakterisieren. Die laser-scan-mikrosko- pischen Untersuchungen erfolgten direkt nach der Entfer- nung des Blasendachs am Tag 1 sowie an den Tagen 3, 5, 7 und 8 an jeweils sechs Probanden.
Das Stadium I wurde durch die Zahl 1 charakterisiert.
Messungen an sechs Probanden ergeben, sind in Tabelle 1 dargestellt. Am Tag 1 sind alle Wunden mit Wundsekret bedeckt. Am Tag 5 hatte sich die erste Schicht der Kor- neozyten fast voll herausgebildet, wenn die Wunde mit der Wundsalbe behandelt wurde. Die unbehandelte Wunde zeigte hierbei einen wesentlich schlechteren Heilungsverlauf. Unter den Bedingungen der Behandlung mit Wundsalbe hatte sich das Stratum corneum nach 8 Tagen wieder voll herausgebildet, während die unbe- handelte Wunde nur einige wenige Zelllagen des Stratum corneum aufwies.
Tabelle 1: Bewertung der Wundheilung mit und ohne Behandlung mit Wundsalbe
Schlussfolgerung
Die In-vivo-LSM wird nicht, wie TEWL-Messungen, durch äußere Faktoren gestört und ist auch dann einsetzbar, wenn eine Behandlung der Wunde mit Salben oder Flüs- sigkeiten erfolgt. Die LSM ist gut geeignet, die Kinetik von Wundheilungsprozessen zu analysieren und stellt damit eine Grundlage für die Bewertung von topisch ap- plizierten Arzneimitteln und Pflegeprodukten sowie von therapeutischen Maßnahmen dar.
Die ortsaufgelösten LSM-Messungen zeigen, dass die Neubildung der Barriere in Form des Stratum corneum nicht nur vom Wundrand aus erfolgt. Auch in der Wund- fläche wurden einzelne "Inseln" beobachtet, wo sich das Stratum corneum neu bildet.
Danksagung
Wir danken der Stiftung für Hautphysiologie des Stifter- verbandes für die Deutsche Wissenschaft und der Dr.
med. h. d. Erwin Braun Stiftung Basel für die finanzielle Unterstützung.
Literatur
1. Braun-Falko 0, Plewig G, Wolff HH. Dermatologie und Venerologie.
Berlin: Blackwell; 1993. p. 134-6.
2. Johnson & Johnson Wound Management. Vorgänge der Wundheilung. MedizInfo® [homepage on the Internet, cited 2007 Oct 15]. Available from:
http://www.medizinfo.com/wundmanagement/wundheilung.htm 3. Li W, Dasgeb B, Phillips T, Li Y, Chen M, Garner W, Woodley DT.
Wound-healing perspectives. Dermatol Clin. 2005;23(2):181- 92.
4. Short RW, Chan JL, Choi JM, Egbert BM, Rehmus WE, Kimball A.
Effects of moisturization on epidermal homeostasis and differentiation. Clin Exp Dermatol. 2007;32(1):88-90.
5. Atiyeh BS, El-Musa KA, Dham R. Scar quality and physiologic barrier function restoration after moist and moist-exposed dressings of partial-thickness wounds. Dermatol Surg. 2003;
29(1):14-20.
6. Visscher M, Hoath SB, Conroy E, Wickett RR. Effect of semipermeable membranes on skin barrier repair following tape stripping. Arch Dermatol Res. 2001;293(10):491-9.
7. Weigmann HJ, Ulrich J, Schanzer S, Jacobi U, Schaefer H, Sterry W, Lademann J. Comparison of transepidermal water loss and spectroscopic absorbance to quantify changes of the stratum corneum after tape stripping. Skin Pharmacol Physiol. 2005;
18(4):180-5.
8. Siebert J. Bestimmung der individuellen Hornschichtdicke über die Abrissmethode [Dissertation Med]. Berlin: Charité- Universitätsmedizin; 2005
9. Lademann J, Richter H, Otberg N, Lawrenz F, Blume-Peytavi U, Sterry W. Application of a dermatological laser scanning confocal microscope for investigation in skin physiology. Laser Phys.
2003;13(5):756-60.
10. Lademann J, Otberg N, Richter H, Jacobi U, Blume-Peytavi U, Schaefer H, Sterry W. Application of laser scanning microscopy for penetration studies of topically applied substances. JDDG.
2004;2 (6):518.
11. Kiistala U, Mustakallio KK. In vitro separation of epidermis by production of suction blisters. Lancet. 1964; 42:1444-5.
12. Lademann J, Jacobi U, Richter H, Otberg N, Weigmann H-J, Meffert H, Schaefer H, Blume-Peytavi U, Sterry W. In vivo determination of UV-photons entering into human skin. Laser Phys. 2004;14(2);234-7.
Korrespondenzadresse:
Prof. Dr. Dr.-Ing. Jürgen Lademann
Bereich Hautphysiologie der Klinik für Dermatologie, Venerologie und Allergologie, Charité -
Universitätsmedizin, Charitéplatz 1, 10117 Berlin, Deutschland, Tel. 030/450 518 100, Fax 030/450 518 918
juergen.lademann@charite.de
Bitte zitieren als
Alborova A, Lademann J, Meyer L, Kramer A, Patzelt A, Sterry W, Antoniou C. Einsatz der Laser-Scan-Mikroskopie zur Charakterisierung der Wundheilung. GMS Krankenhaushyg Interdiszip. 2007;2(2):Doc37.
Artikel online frei zugänglich unter
http://www.egms.de/en/journals/dgkh/2007-2/dgkh000070.shtml
Copyright
©2007 Alborova et al. Dieser Artikel ist ein Open Access-Artikel und steht unter den Creative Commons Lizenzbedingungen
(http://creativecommons.org/licenses/by-nc-nd/3.0/deed.de). Er darf vervielfältigt, verbreitet und öffentlich zugänglich gemacht werden, vorausgesetzt dass Autor und Quelle genannt werden.