- 8 -
(Fortsetzung nächste Seite)
B 1 Kupfer
1 Zur Gewinnung von elementarem Kupfer werden Erze in einem vielstu- figen Prozess zu Rohkupfer mit einem Kupferanteil von 98 % verarbei- tet. In den restlichen 2 % sind neben unedlen Metallen, wie z. B. Eisen, auch Edelmetalle, wie z. B. Silber, enthalten. Zur Gewinnung von
Reinstkupfer wird u. a. eine elektrolytische Raffination von Rohkupfer durchgeführt: Hierbei wird in schwefelsaurer Kupfer(II)-sulfat-Lösung ei- ne Elektrode aus Rohkupfer und eine Elektrode aus Reinstkupfer ver- wendet und eine Spannung von ca. 0,3 V angelegt.
Erläutern Sie mithilfe der Teilgleichungen für die Anoden- und die Ka- thodenreaktion, welche Vorgänge während der Elektrolyse an den Elekt- roden stattfinden! Berücksichtigen Sie hierbei auch die als Beimengun-
gen aufgeführten Metalle! [10 BE]
2 Historische Batterien, die bis Anfang des 20. Jahrhunderts beispielswei- se die Stromversorgung in der Telegrafie sicherten, entsprachen in ih- rem Aufbau weitgehend einem Daniell-Element. Als Elektrodenmaterial wurden die Metalle Kupfer und Zink verwendet. Die Kupfer(II)-sulfat- Lösung wurde mit der Zink(II)-sulfat-Lösung vorsichtig überschichtet.
Aufgrund der deutlich höheren Dichte der Kupfer(II)-sulfat-Lösung durchmischen sich die Lösungen nicht, deshalb werden solche Elemen- te als „Gravity-Daniell-Elemente“ (gravity: Schwerkraft) bezeichnet.
Bei Inbetriebnahme der Elemente lag die Konzentration der Zink(II)- sulfat-Lösung bei c(ZnSO4) = 0,05 mol/l und die der Kupfer(II)-sulfat- Lösung bei c(CuSO4) = 1,7 mol/l.
Skizzieren Sie den Aufbau des oben beschriebenen Elements, formulie- ren Sie für die an der Anode und Kathode ablaufenden Vorgänge die Reaktionsteilgleichungen und berechnen Sie, welche Leerlaufspannung dieses Element bei Inbetriebnahme liefert! [12 BE]
3 Versetzt man elementares Kupfer mit halbkonzentrierter Salpetersäure, so bildet sich Stickstoffmonooxid. In Gegenwart von Sauerstoff entsteht daraus rasch Stickstoffdioxid. Stickstoffdioxid reagiert in einer Gleich- gewichtsreaktion zu Distickstofftetraoxid. Da Stickstoffdioxid ein braunes und Distickstofftetraoxid ein farbloses Gas ist, kann die Gleichgewichts- lage über die Farbe des Gemisches gut verfolgt werden.
- 9 -
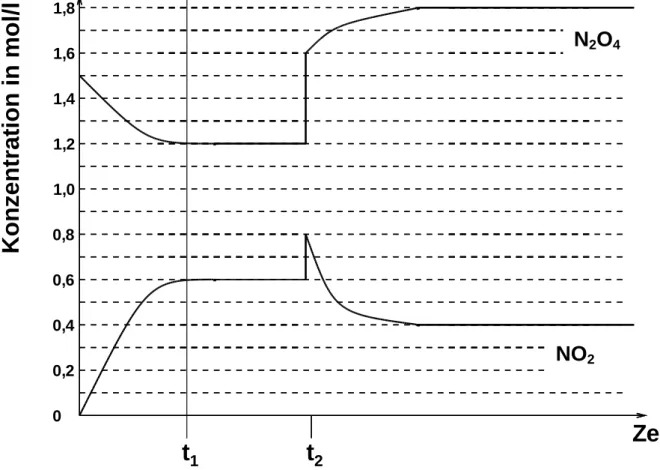
(Fortsetzung nächste Seite) Bei einem Versuch wird in einem geschlossenen Reaktionsgefäß Disti- ckstofftetraoxid vorgelegt und die Gleichgewichtseinstellung des Sys- tems bis zum Zeitpunkt t1 beobachtet. Zum Zeitpunkt t2 wird der Druck im Reaktionsgefäß geändert. Alle anderen Reaktionsbedingungen blei- ben gleich.
Abb. 1: Konzentrationen von Stickstoffdioxid und Distickstofftetraoxid im Verlauf des Experiments
3.1 Ermitteln Sie den Wert der Gleichgewichtskonstanten Kc zum Zeitpunkt
t1! [4 BE]
3.2 Begründen Sie, ob der Druck im Reaktionsgefäß zum Zeitpunkt t2 erhöht oder erniedrigt wurde, und erläutern Sie den Verlauf der Kurven ab dem
Zeitpunkt t2! [7 BE]
0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6 1,8
t
1t
2Zeit
K o n z e n tr a ti o n i n m o l/ l
N2O4
NO2 NO2
- 10 -
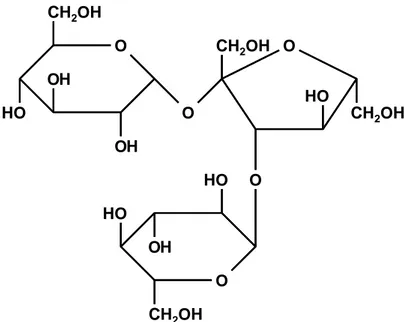
4 Bei der Charakterisierung von Kohlenhydraten mithilfe der Fehling- Probe spielen Kupfer(II)-Ionen eine wichtige Rolle. Neben anderen Koh- lenhydraten kommt im Honig das Trisaccharid Melezitose vor.
Abb. 2: Strukturformel von Melezitose
Beschreiben Sie die Durchführung der Fehling-Probe mit Melezitose und erklären Sie das zu erwartende Versuchsergebnis! [7 BE]
______
[40 BE]
O CH2OH
HO OH
OH
O
O
HO
CH2OH CH2OH
O
O HO
OH HO
CH2OH