Dissertation
zur Erlangung des akademischen Grades
Doctor rerum naturalium (Dr. rer. nat.)
vorgelegt
der Fakultät Mathematik und Naturwissenschaften der Technischen Universität Dresden
von
Dipl.-Chem. Annett Vahle geboren am 04. 11. 1968 in Radeberg
Gutachter: Prof. Dr. H. Nitsche TU Dresden / FZ Rossendorf Prof. Dr. H. W. Gäggeler Universität Bern / PSI Villigen Prof. Dr. J. V. Kratz Universität Mainz
Eingereicht am: 22. Juli 1996
Tag der Verteidigung: 09. Dezember 1996
1 Einleitung 1
2 Physikochemische Grundlagen 4
2.1 Chemische Charakterisierung von Transactinidenelementen ... 4
2.2 Hochtemperaturchemie der Oxid- und Hydroxidspezies der Elemente der 6. Gruppe ... 6
2.2.1 Kenntnisstand ... 6
2.2.1.1 Makroskopische Mengen ... 6
2.2.1.2 Spurenmengen ... 13
2.2.2 Abschätzung des chemischen Verhaltens von Spurenmengen ... 14
2.3 Voraussagen chemischer Eigenschaften des Seaborgiums ... 16
2.3.1 Extrapolative Prognose ... 17
2.3.2 Relativistische Molekülorbitalrechnungen ... 19
3 Gaschromatographie - physikochemische Trenn- und Untersuchungsmethode 21 3.1 Thermochromatographie ... 22
3.2 Isotherme on-line Gaschromatographie ... 23
3.3 Physikochemische Grundlagen des gaschromatographischen Transports... 24
3.3.1 Stofftransport in einem Temperaturgradientrohr ... 25
3.3.1.1 Transport makroskopischer Mengen ... 25
3.3.1.2 Transport von Spurenmengen ... 26
3.3.1.3 Das Programm TECPROF ... 30
3.3.2 Stofftransport mittels isothermer Gaschromatographie ... 32
3.3.3 Monte-Carlo-Simulation der Gaschromatographie ... 33
3.3.3.1 Monte-Carlo-Simulation einfacher Adsorptions-Desorptionsprozesse ... 34
3.3.3.2 Erweiterung des Modells auf reaktionsgaschromatographischen Transport ... 35
4 Experimente und Ergebnisse 40 4.1 Thermochromatographieexperimente ... 40
4.1.1 Experimentelles ... 40
4.1.1.1 Nukliderzeugung am FZR ... 40
4.1.1.2 Aufarbeitung der bestrahlten Metallfolien ... 41
4.1.1.3 Anordnung am FZR ... 44
4.1.1.4 Nukliderzeugung am PSI ... 46
4.1.1.5 Anordnung am PSI ... 47
4.1.2 Ergebnisse ... 49
4.1.2.1 Feuchtigkeitsabhängigkeit ... 49
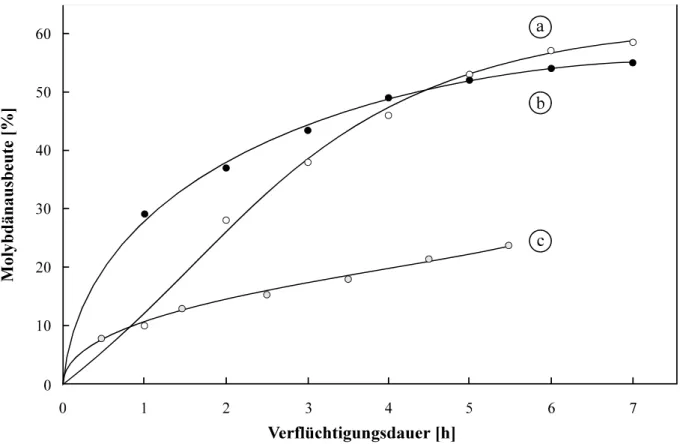
4.1.2.2 Zeitabhängigkeit des Transports ... 67
4.1.2.3 Zusatz eines homologen Trägers ... 76
4.2 Isotherme on-line Gaschromatographieexperimente ... 78
4.2.1 Experimentelles ... 78
4.2.1.1 Nukliderzeugung ... 79
4.2.1.2 Anordnung ... 79
4.2.2 Ergebnisse ... 81
4.2.2.1 Aerosolrückhaltung ... 81
4.2.2.2 Chromatographischer Transport... 82
4.2.2.3 Ausbeute ... 85
5 Zusammenfassung 90 6 Literatur 96 7 Anhang - Programmlistings 105 7.1 TECPROF... 105
7.2 Monte-Carlo-Simulation (Thermochromatographie) ... 119
7.3 Monte-Carlo-Simulation (isotherme Gaschromatographie) ... 123
Abb. 2.1: Ausschnitt aus der Nuklidkarte mit allen bisher bekannten Isotopen der Elemente 104 bis
106 ... 5
Abb. 3.1: Temperaturprofile für die TECPROF-Modellrechnungen ... 31
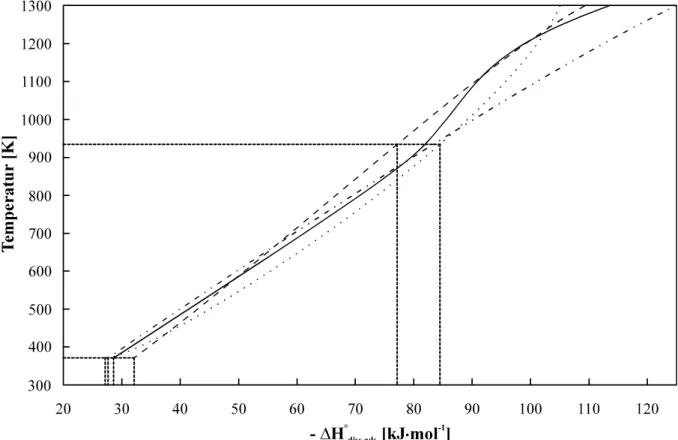
Abb. 3.2: Abhängigkeit der Abscheidungstemperatur von der Enthalpie der Grundreaktion des Transportprozesses für verschiedene Temperaturprofile ... 32
Abb. 3.3: Monte-Carlo-Simulation für Thermochromatographie ... 38
Abb. 3.4: Monte-Carlo-Simulation für isotherme Gaschromatographie ... 39
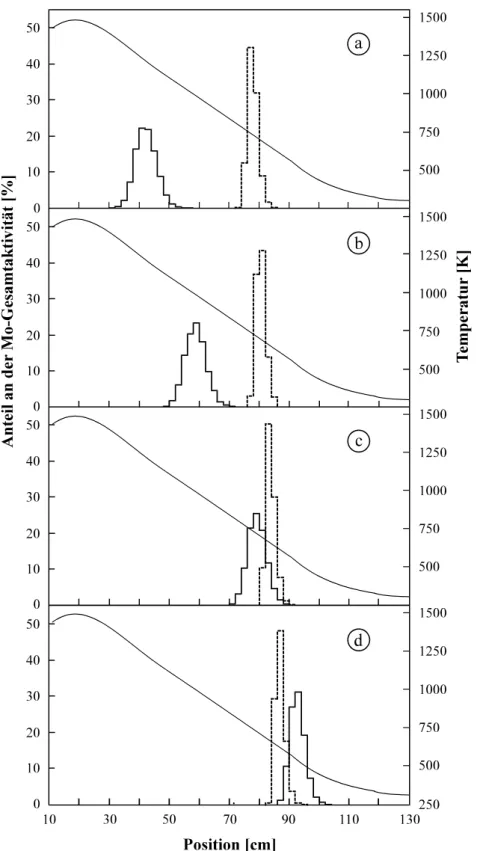
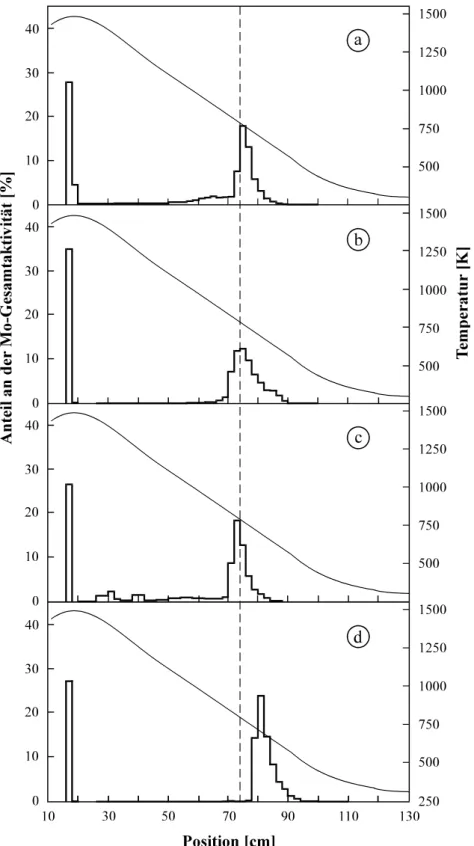
Abb. 4.1: Verteilung der Molybdänaktivität in bestrahlten Zirconiumfolien ... 42
Abb. 4.2: Experimentelle Anordnung zur Aufarbeitung bestrahlter Metallfolien der 4. Gruppe für nachfolgende off-line Thermochromatographieexperimente mit den Elementen der 6. Gruppe ... 42
Abb. 4.3: Abhängigkeit der Molybdänverflüchtigung aus Zirconiumfolien von der Feuchtig- keit der Luft und der Pulverisierung des ZrO2 ... 43
Abb. 4.4: Experimentelle Anordnung für off-line Thermochromatographieexperimente am FZR ... 45
Abb. 4.5: Experimentelle Anordnung für off-line Thermochromatographieexperimente am PSI ... 48
Abb. 4.6: Thermochromatogramme von Molybdän in makroskopischen Mengen (mMo = 10 µg) bei unterschiedlichen Wasserdampfpartialdrücken ... 52
Abb. 4.7: Thermochromatogramme von Molybdän in makroskopischen Mengen (mMo = 100 µg) bei unterschiedlichen Wasserdampfpartialdrücken ... 53
Abb. 4.8: Thermochromatogramme von Molybdän in makroskopischen Mengen (mMo = 1 mg) bei unterschiedlichen Wasserdampfpartialdrücken ... 54
Abb. 4.9: Thermochromatogramme von Molybdän in makroskopischen Mengen in Abhängig- keit von der eingesetzten Molybdänmenge ... 55
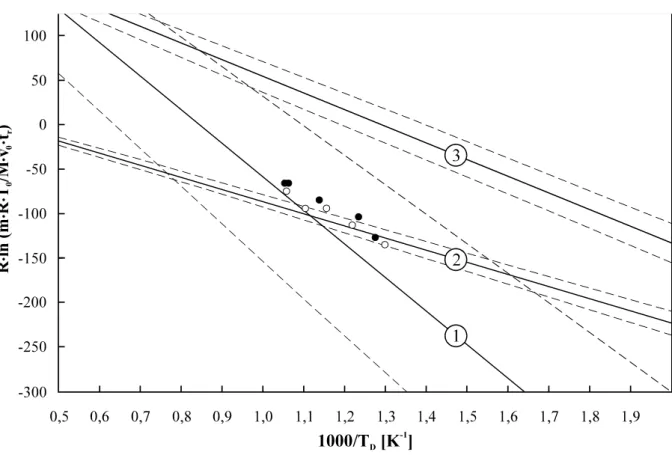
Abb. 4.10: Retentionsdaten makroskopischer Molybdänmengen über 1000/TD, der reziproken Abscheidungstemperatur ... 56
Abb. 4.11: Massenspektrum, erhalten durch Verflüchtigung der im Thermochromatographie- rohr abgeschiedenen Molybdänspezies ... 57
Abb. 4.12: (MoO3)3-Isotopenmuster ... 57
Abb. 4.13: Thermochromatogramme von Chrom in Spurenmengen bei unterschiedlichen Wasserdampfpartialdrücken ... 59
Abb. 4.14: Bestimmung der Adsorptionsenthalpie von Spurenmengen Chrom auf Quarz in feuchtem Sauerstoff ... 60
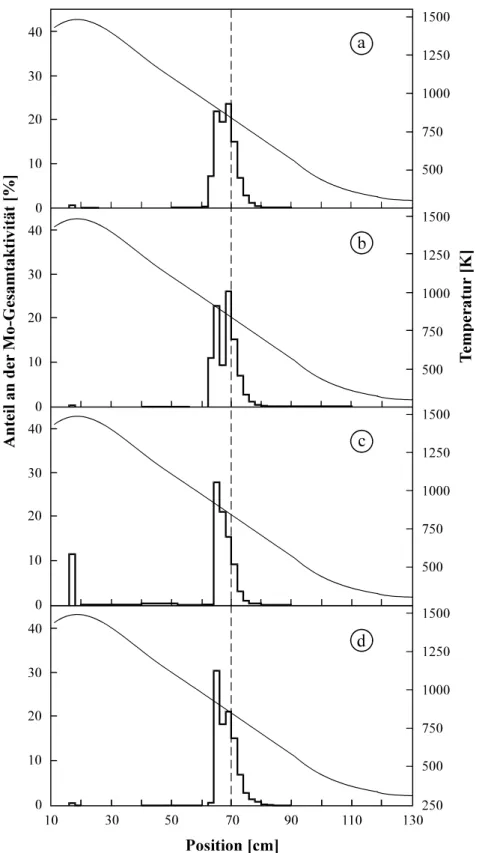
Abb. 4.15: Thermochromatogramme von Molybdän in Spurenmengen bei unterschiedlichen Wasserdampfpartialdrücken ... 62
Abb. 4.16: Bestimmung der Adsorptionsenthalpie von Spurenmengen Molybdän auf Quarz in feuchtem Sauerstoff ... 63 Abb. 4.17: Thermochromatogramme von Wolfram in Spurenmengen bei unterschiedlichen
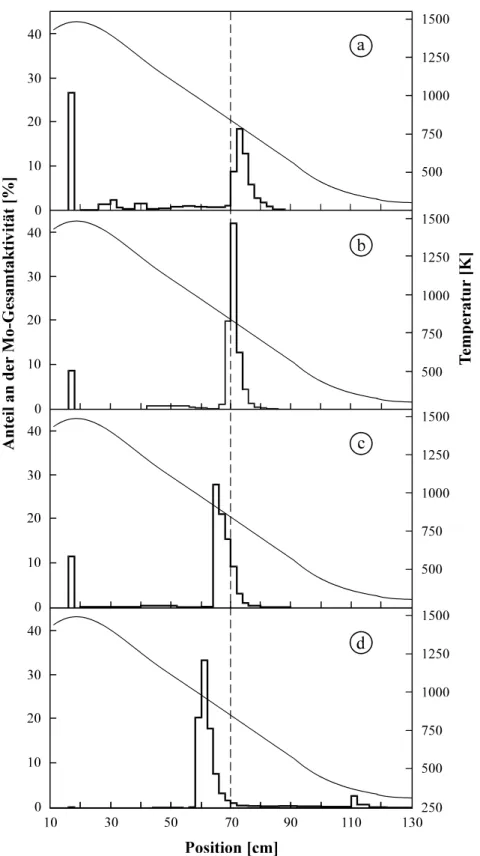
Wasserdampfpartialdrücken ... 65 Abb. 4.18: Bestimmung der Adsorptionsenthalpie von Spurenmengen Wolfram auf Quarz in
feuchtem Sauerstoff ... 66 Abb. 4.19: Abhängigkeit der Adsorptionsdauera von der Temperatur ... 68 Abb. 4.20: Thermochromatogramme von Chrom in Spurenmengen bei unterschiedlicher Expe-
rimentdauer ... 70 Abb. 4.21: Thermochromatogramme von Chrom in Spurenmengen bei unterschiedlicher Expe-
rimentdauer ... 71 Abb. 4.22: Lage des Chrom-Niedrigtemperaturpeaks in Abhängigkeit von der Experimentdauer ... 72 Abb. 4.23: Thermochromatogramme von Molybdän in Spurenmengen bei unterschiedlicher
Experimentdauer ... 73 Abb. 4.24: Vergleich experimentell erhaltener und mittels Monte-Carlo-Simulation ermittelter
Thermochromatogramme von Molybdän in Spurenmengen bei unterschiedlicher Experimentdauer ... 74 Abb. 4.25: Lage des Molybdän-Niedrigtemperaturpeaks in Abhängigkeit von der Experiment-
dauer ... 75 Abb. 4.26: Thermochromatogramme von Wolfram in Spurenmengen bei Zusatz eines homolo-
gen Trägers (MoO3) ... 77 Abb. 4.27: Experimentelle Anordnung für isotherme on-line Gaschromatographieexperimente
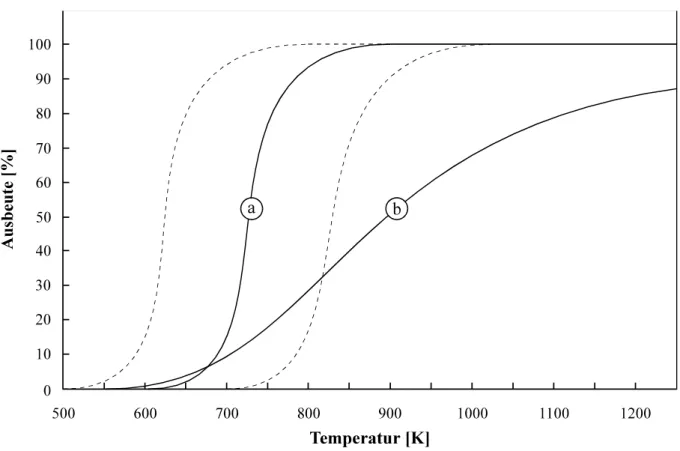
am PSI Villigen ... 80 Abb. 4.28: Relative Ausbeute verschiedener Wolframisotope in Abhängigkeit von der Tempe-
ratur der isothermen Zone ... 83 Abb. 4.29: Relative Ausbeute von 169W: experimentelle Daten und mittels Monte-Carlo-
Simulation bestimmte Kurvenverläufe ... 84 Abb. 4.30: Monte-Carlo-Simulation der Wolframausbeute bei unterschiedlichen Temperaturen
der isothermen Zone ... 86 Abb. 4.31: Monte-Carlo-Simulation der Ausbeute von 166W bei unterschiedlichen Wasser-
dampfpartialdrücken des Trägergases ... 87 Abb. 4.32: Monte-Carlo-Simulation der Ausbeute von 169W bei unterschiedlichen Wasser-
dampfpartialdrücken des Trägergases ... 88 Abb. 5.1: Thermochromatogramme von Spurenmengen der Elemente der 6. Gruppe im O2-
H2O(g)/SiO2(s)-System ... 92
Tab. 2.1: Standardenthalpien und -entropien von Elementen und Verbindungen im System
Chrom-Sauerstoff-Wasserdampf ... 8
Tab. 2.2: Standardenthalpien und -entropien von Elementen und Verbindungen im System Molybdän-Sauerstoff-Wasserdampf ... 9
Tab. 2.3: Thermodynamische Zustandsfunktionen für Reaktionen makroskopischer Molyb- dänmengen in Gegenwart von Sauerstoff und/oder Wasserdampf ... 11
Tab. 2.4: Standardenthalpien und -entropien von Elementen und Verbindungen im System Wolfram-Sauerstoff-Wasserdampf... 12
Tab. 2.5: Berechnete thermodynamische Zustandsfunktionen für Reaktionen von Spurenmen- gen der Elemente der 6. Gruppe im O2-H2O(g)/SiO2(s)-System ... 16
Tab. 2.6: Thermodynamische Zustandsfunktionen von Verbindungen der Elemente der 6. Grup- pe im System Metall-Sauerstoff-Wasserdampf ... 18
Tab. 4.1: Erzeugung trägerfreier Radionuklide am FZR ... 41
Tab. 4.2: Nukliderzeugung am PSI durch Bestrahlung von Hafniumfolie mit -Teilchen ... 47
Tab. 4.3: Nukliderzeugung am PSI durch Bestrahlung eines 152Gd-Targets mit 20Ne ... 78
Tab. 4.4: Ausbeuten verschiedener Wolframisotope bei Tiso = 900 °C ... 85
Tab. 5.1: Thermodynamische Zustandsfunktionen für Reaktionen von Spurenmengen der Ele- mente der 6. Gruppe im O2-H2O(g)/SiO2(s)-System, ermittelt aus Gaschromatographie- experimenten ... 93
A Standardmolfläche
a freie Oberfläche pro Längeneinheit (cm) der Kolonne cgas (H2O) Konzentration der Wassermoleküle in der Gasphase
c°ads Standardkonzentration im adsorbierten Zustand = 2,6791019 cm-2 c°gas Standardkonzentration im gasförmigen Zustand = 2,6791019 cm-3
D Diffusionskoeffizient
d Kolonnendurchmesser
Edes Aktivierungsenergie der Desorption Ei*(x) Exponentialintegralfunktion
E Energie der -Strahlung
Sprungweite
g Temperaturgradient
H°ads Standardadsorptionsenthalpie
H°diss.ads Standardenthalpie der dissoziativen Adsorption
H°des Standardenthalpie der Desublimation
H°diss.des Standardenthalpie der dissoziativen Desublimation
H°subl Standardsublimationsenthalpie
I Intensität
k BOLTZMANN-Konstante
ki korrigierter Verteilungskoeffizient
L Länge des isothermen Teils der Kolonne
M Molekulargewicht
m Masse
l Anzahl der Stöße pro Längeneinheit p(H2O) Wasserdampfpartialdruck
p0 Standarddruck = 101,325 kPa
Q Volumengeschwindigkeit
R Gaskonstante
r Kolonnenradius
S°ads Standardadsorptionsentropie
S°des Standardentropie der Desublimation
S°diss.ads Standardentropie der dissoziativen Adsorption
S°diss.des Standardentropie der dissoziativen Desublimation
T Temperatur
TD Abscheidungstemperatur
Tiso Temperatur der isothermen Zone
TS Starttemperatur
T
0Standardtemperatur = 298 K
t Zeit
tads Gesamtadsorptionsdauer
texp Experimentdauer
tgas Gesamtaufenthaltsdauer in der Gasphase
tr Retentionszeit
t1/2 Halbwertszeit
a Adsorptionsdauer
0 Periode der charakteristischen Schwingung des Adsorbats
u lineare Gasgeschwindigkeit
u0 lineare Gasgeschwindigkeit bei T0
V Standardmolvolumen
v freies Gasvolumen pro Längeneinheit (cm) der Kolonne
v0 Gasdurchsatz
z Längenkoordinate in der Kolonne
Querschnitt der Kolonne
1 Einleitung
Das Interesse an den Transactinidenelementen ist ungebrochen, seit 1964 erstmals über die Herstel- lung eines Isotops des Elementes 104 berichtet wurde. Inzwischen sind acht weitere Transactiniden- elemente bekannt, ihre chemischen Eigenschaften blieben jedoch weitgehend unerforscht. Ursache hier- für sind die extrem kurzen Halbwertszeiten bei äußerst geringen Bildungsquerschnitten, die die Ver- fügbarkeit der Transactinidenelemente auf einzelne Atome begrenzen. Um unter diesen Bedingungen ein Element chemisch charakterisieren zu können, sind schnelle chemische Methoden nötig. Mehr- stufige Verfahren bzw. häufig wiederholte Einstufenprozesse dienen der statistischen Absicherung.
Zur Untersuchung der chemischen Eigenschaften der Transactinidenelemente werden Gaschromato- graphie, Ionenaustausch und Extraktion eingesetzt. Selbst unter idealen Bedingungen ermöglichen diese Verfahren aber nur die Untersuchung von Isotopen mit Halbwertszeiten im Sekundenbereich.
Die chemische Charakterisierung von Transactiniden beschränkte sich deshalb bis vor kurzem auf die Elemente 104 und 105, zu denen bereits recht umfangreiche experimentelle Ergebnisse sowohl in der Gas- als auch in der flüssigen Phase vorliegen. Diese weisen das Element 104 als zur 4. Gruppe des PSE zugehöriges Eka-Hafnium aus. Auch die experimentellen Ergebnisse zum Element 105 lassen dieses als Vertreter der 5. Gruppe erscheinen. Allerdings weist das Element 105 Eigenschaften auf, die teils die allgemeinen Gruppentendenzen fortsetzen, andererseits mehr denen des Niobs als des Tantals ähneln. Damit unterscheiden sich die experimentellen Befunde von den auf simplen Extrapolationen der Tendenzen innerhalb der 5. Gruppe beruhenden Vorhersagen. Relativistische Berechnungen be- stätigen teilweise den zwiespältigen Charakter des Elementes 105.
Über die Entdeckung des Elementes 106 berichteten im Jahr 1974 die Gruppen aus Dubna [OGA 74]
und Berkeley [GHI 74]. Lange Zeit war die Frage nach der Erstsynthese des Elementes 106 strittig.
Erst 1993 wurde die 1974 in Berkeley genutzte Kernreaktion 249Cf (18O, 4n) 263106 durch GREGORICH
et al. bestätigt [GRE 94]. Die Gruppe in Berkeley gilt damit als Entdecker des Elementes. Es wurde vorgeschlagen, das Element 106 zu Ehren von Nobelpreisträger G. T. SEABORG Seaborgium (Sg) zu nennen. Eine endgültige Entscheidung der IUPAC zur Benennung des Elementes 106 und aller ande- ren Transactinidenelemente steht aber noch aus.
Über einen Zeitraum von fast 20 Jahren war 263Sg mit einer Halbwertszeit von 0,9 s das längstlebige be- kannte 106-Isotop. Erst 1993 gelang einer JINR/LLNL-Kollaboration die Synthese der Isotope 265Sg und
266Sg mit Halbwertszeiten von 7 1, 2 58 6,, s bzw.
34
15163 s mittels heißer Fusion gemäß 248Cm (22Ne, 4n bzw.5n) [LOU 94, SCH 96]. Die Chance, Seaborgium auch chemisch charakterisieren zu können, erhöhte sich durch die Entdeckung dieser Isotope deutlich. Der Vorteil der vergleichsweise langen Halb- wertszeiten wird allerdings durch die geringen Wirkungsquerschnitte der Reaktionen von
270
170360 pb bzw.50
41115 pb relativiert.Bislang liegen nur wenige gesicherte Erkenntnisse zur Chemie des Seaborgiums vor. Die bereits 1992 von einer Dubnaer Gruppe mitgeteilte „erstmalige chemische Identifizierung des Elementes 106“
[TIM 96] wurde international nicht als eindeutige Identifizierung anerkannt. Gegenwärtig arbeitet eine internationale Kollaboration an der chemischen Charakterisierung des Seaborgiums mit dem Ziel, Fragen bezüglich Trends innerhalb des PSE, des Einflusses relativistischer Effekte und der Gültig- keit theoretischer Voraussagen chemischer Eigenschaften zu beantworten. Erste, von dieser Kollabora-
tion 1995 durchgeführte Experimente deuten auf ein wolframähnliches Verhalten des Seaborgiums hin [SCH 96].
Die gaschemische Untersuchung der Eigenschaften des Seaborgiums wird im Rahmen der Kollabora- tion von den Arbeitsgruppen am Paul Scherrer Institut Villigen (Halogenid-/Oxyhalogenidsystem) und am Forschungszentrum Rossendorf (Oxid-/Hydroxidsystem) bearbeitet. Das Halogenidsystem wurde bereits erfolgreich bei der gaschemischen Charakterisierung der Elemente 104 und 105 eingesetzt.
Auch für die Charakterisierung des Seaborgiums ist die hohe Flüchtigkeit dieser Verbindungsklasse von Vorteil, die allerdings mit einer geringen Selektivität einhergeht. In der Reihe der Transactiniden ist Seaborgium das erste Element, das neben flüchtigen Halogeniden bzw. Oxyhalogeniden auch flüchtige Oxide bzw. Hydroxide bildet. Deren Flüchtigkeit ist zwar geringer als die der halogen- haltigen Verbindungen, bezüglich der leichteren Transactiniden ist die Selektivität jedoch wesentlich höher, da deren Oxide bzw. Hydroxide praktisch nichtflüchtig sind.
Die chemischen Eigenschaften der schwersten Elemente sind nur indirekt zugänglich. Durch den Ver- gleich von Daten aus Transactinidenexperimenten mit prognostizierten Daten bzw. dem Verhalten ho- mologer Elemente können aber auch Rückschlüsse auf chemische Eigenschaften der Transactiniden- elemente gezogen werden. Prinzipiell zugängliche Meßgrößen liegen aber auch für die Elemente der 6. Gruppe nicht oder nur teilweise vor. Als Vorstufe zur Untersuchung des Seaborgiums ergibt sich deshalb die Notwendigkeit von Experimenten mit kleinsten Substanzmengen der homologen Ele- mente.
Im Mittelpunkt der vorliegenden Arbeit stand die Untersuchung physikochemischer Eigenschaften der Seaborgiumhomologen Chrom, Molybdän und Wolfram im O2-H2O(g)/SiO2(s)-System. Chromatogra- phische Verfahren dienten der Untersuchung von Oberflächenreaktionen, aus denen sich Aussagen über physikochemische Eigenschaften ableiten lassen. Mit Erreichen der folgenden Teilziele sollten die Grundlagen für die methodische Vorbereitung der gaschemischen Charakterisierung des Seabor- giums als Oxid bzw. Hydroxid geschaffen werden:
Abschätzung des chemischen Verhaltens kleinster Substanzmengen der Elemente der 6. Gruppe aus dem bekannten Verhalten makroskopischer Mengen auf der Grundlage von Zusammenhängen zwischen makroskopischen und damit korrelierenden Meßgrößen von Einzelatomen
Untersuchung des Verflüchtigungs- und Abscheidungsverhaltens trägerfreier Radionuklide und Vergleich mit dem Verhalten makroskopischer Mengen
Untersuchung bzw. Aufklärung von Transportprozessen kleinster Substanzmengen unter Einbezie- hung des Gefäßmaterials als Adsorbens
Ermittlung thermodynamischer Zustandsfunktionen für die Grundreaktionen dieser Transportpro- zesse unter Nutzung bekannter physikochemischer Gesetzmäßigkeiten des gaschromatographischen Transports bzw. Schaffung der nötigen Voraussetzungen zur Bestimmung derartiger Zustandsfunk- tionen
Untersuchung der Beeinflussung des gaschromatographischen Transports durch Zusatz eines ho- mologen Trägers
Aussagen über die Eignung des gewählten chemischen Systems zur gaschemischen Charakterisie- rung des Seaborgiums anhand erster Modellexperimente mit kurzlebigen Wolframisotopen
Thermochromatographische off-line Experimente mit Chrom und Molybdän wurden im Forschungs- zentrum Rossendorf durchgeführt. Trägerfreies Wolfram wurde am Philips-Zyklotron des PSI Villi- gen (Schweiz) erzeugt und sowohl in off-line Thermochromatographieexperimenten als auch in iso- thermen on-line Gaschromatographieexperimenten eingesetzt. Für Experimente mit Spaltprodukten stand der SAPHIR-Reaktor des PSI zur Verfügung. Die Neutronenaktivierungsanalyse von Molybdän erfolgte am TRIGA-Reaktor der Universität Mainz.
2 Physikochemische Grundlagen
In den nachfolgenden Abschnitten wird auf Besonderheiten und Voraussetzungen bei der Untersu- chung chemischer Eigenschaften von Transactinidenelementen eingegangen. Der Kenntnisstand zur Hochtemperaturchemie der Homologen des Seaborgiums ist ebenso Bestandteil dieses Kapitels wie Abschätzungen des zu erwartenden Verhaltens der Homologen sowie Voraussagen chemischer Eigen- schaften des Seaborgiums im O2-H2O(g)/SiO2(s)-System.
2.1 Chemische Charakterisierung von Transactiniden- elementen
Abb. 2.1 zeigt einen Ausschnitt aus der Nuklidkarte, in dem die bislang bekannten Isotope der Ele- mente 104 bis 106, ihre Halbwertszeiten und Zerfallseigenschaften eingetragen sind. Hieraus läßt sich bereits eine Besonderheit der Transactinidenelemente erkennen: Alle bekannten Nuklide weisen ex- trem kurze Halbwertszeiten im Bereich von wenigen Millisekunden bis zu einigen Sekunden auf.
Hinzu kommt, daß die Produktionsraten für diese Nuklide nur bei wenigen Atomen pro Stunde oder gar Tag liegen. Diese beiden Merkmale führen dazu, daß praktisch die Chemie einzelner Atome unter- sucht werden muß. Daraus ergibt sich die Frage, ob aus Experimenten mit Einzelatomen erhaltene Er- gebnisse allgemeine Gültigkeit in Bezug auf das Verhalten des jeweiligen Elementes besitzen.
Theoretische Betrachtungen von BORG und GUILLAUMONT et al. beschäftigen sich mit diesem Aspekt der Einzelatomchemie [BOR 81, GUI 89, GUI 91]. Aus der klassischen Thermodynamik bekannte Formulierungen von Gleichgewichtszuständen wie z.B. das Massenwirkungsgesetz können auf Expe- rimente mit einzelnen Atomen nicht ohne weiteres angewendet werden. Die Einstellung eines chemi- schen Gleichgewichtes beruht auf der statistischen Verteilung von Spezies auf die möglichen Zustände des Systems. Im Falle von Einzelatomen ist eine solche Verteilung nicht möglich, da sich ein Teilchen zu einem bestimmten Zeitpunkt auch nur in einem bestimmten Zustand befinden kann. Um den thermodynamisch günstigsten Zustand zu erreichen, muß das Teilchen mehrfach zwischen den möglichen Zuständen wechseln. Dieser Prozeß nimmt eine gewisse Zeit in Anspruch, die von der Ak- tivierungsenergie, der Vibrationsfrequenz und der Temperatur abhängt und eine Mindestlebensdauer des Teilchens voraussetzt. Um in einer einstufigen Austauschreaktion das Gleichgewicht innerhalb von Sekunden zu erreichen, darf die Aktivierungsenergie einen Wert von 63 - 72 kJ nicht übersteigen.
Ausgehend von einer statistisch signifikanten Anzahl von Einzelexperimenten, in denen die relative Häufigkeit bestimmt wird, mit der ein Teilchen in einem der möglichen chemischen Zustände vorliegt, können Gleichgewichtskonstanten ermittelt werden.
Im Falle des Massenwirkungsgesetzes werden die thermodynamischen Aktivitäten durch die Wahr- scheinlichkeiten ersetzt, ein einzelnes Atom in einer bestimmten Form in einer gegebenen Phase zu finden. Verteilungskoeffizienten können danach aus dem Verhältnis dieser Wahrscheinlichkeiten auch für ein Einzelatom ermittelt werden. Voraussetzung ist die statistische Absicherung des Prozesses, die
entweder durch die wiederholte Anwendung von Einstufenprozessen oder durch den Einsatz mehr- stufiger, insbesondere chromatographischer Verteilungsverfahren erreicht werden kann.
Gestützt werden diese theoretischen Betrachtungen durch experimentelle Ergebnisse von RUMLER und REISCHMANN [REI 86, RUM 89], die bei der Untersuchung des chemischen Verhaltens kurzlebiger Astat- und Poloniumisotope die Anzahl der eingesetzten Atome variierten und auf minimal vierzig re- duzierten. Eine signifikante Veränderung des chemischen Verhaltens wurde mit keinem der ein- oder mehrstufigen Verfahren festgestellt.
Grundreaktionen gaschemischer Untersuchungen sind neben Umsetzungen in der Gasphase vor allem die an der Phasengrenze fest/gasförmig ablaufenden Oberflächenreaktionen, die mit chromatographi- schen Methoden untersucht werden. Die untersuchten Einzelatome werden nach Durchlaufen vielstu- figer, komplexer Transportprozesse möglichst on-line und mit kernspektroskopischen Methoden de- tektiert, um Aussagen zum Abklingverhalten, zu Energien, Koinzidenzen und Korrelationen zu erhal- ten und damit einen zweifelsfreien Nuklidnachweis führen zu können. Die Transportprozesse sollten möglichst elementspezifisch ablaufen, damit interferierende Nuklide die Detektion nicht stören. Auf der Grundlage einer eindeutigen und beschreibbaren funktionellen Abhängigkeit der Ausbeute von experimentellen Parametern können die untersuchten Elemente physikochemisch charakterisiert werden.
106
Sg 258 2,9 ms
SF
259 0,48 s
260 3,6 ms
, SF 261 0,26 s
,
263 0,9 s
265 7,1 s
266 34 s
105
256 2,6 s
SF
257 1,3 s
, SF 258 4,4 s
260 1,5 s
, SF 261 1,8 s
, SF 262 34 s
SF 263 27 s
SF 104
253 48 µs
SF
254 23 µs
SF
255 1,4 s
, SF 256 7,4 ms
, SF 257 4,8 s
, SF 258 13 ms
SF 259 3,1 s
, SF 260 21 ms
SF
261 65 s
262 1,2 s
SF
150 152 154 156 158 160
Abb. 2.1: Ausschnitt aus der Nuklidkarte mit allen bisher bekannten Isotopen der Elemente 104 bis 106 Da für die Elemente 104 und 105 inzwischen jeweils drei Namensvorschläge existieren und eine endgültige Entscheidung der IUPAC zur Namensgebung noch aussteht, wurden diese Elemente zur Vermeidung von Verwirrungen nur durch ihre Ordnungszahlen gekennzeich- net. Es wurden die in [MÜN 95, HES 96, SCH 96] angegebenen Daten für Halbwertszeiten und Zerfallseigenschaften verwendet.
Klassische analytische Methoden stoßen bei der Untersuchung einzelner Atome an ihre Grenzen.
Durch Experimente mit kleinsten Mengen kann deshalb kein direkter Beweis über den chemischen Zustand der untersuchten Spezies geführt werden. Um Aussagen hierüber zu erhalten, werden aus Li- teraturdaten über bekannte Korrelationen zwischen makroskopischen und mikroskopischen Eigen- schaften abgeschätzte Erwartungswerte (z.B. thermodynamische Zustandsfunktionen, Abscheidungs- temperaturen) mit den aus experimentellen Daten erhaltenen Werten verglichen. Bei Übereinstimmung von Voraussage und Experiment wird dies als indirekter Beweis für die Richtigkeit der Annahme ge- wertet. Ergebnisse aus Verteilungsexperimenten mit den in makroskopischen Mengen nicht verfügba-
ren Transactinidenelementen werden mit Ergebnissen gleichartiger Experimente mit unwägbaren Mengen der leichter zugänglichen chemischen Homologen verglichen. Die Prognose chemischer Ei- genschaften des jeweiligen Transactinidenelementes im gewählten System erfolgt ebenfalls auf der Basis bekannter Eigenschaften seiner Homologen.
Bei der Untersuchung äußerst geringer Substanzmengen oder gar einzelner Atome ist zu beachten, daß die Wahrscheinlichkeit des Zusammentreffens von zwei oder mehr Teilchen des betreffenden Ele- mentes verschwindend klein ist. Dies führt dazu, daß bestimmte, mit makroskopischen Mengen ablau- fende Prozesse und Reaktionen nicht möglich sind. So können Verbindungen, die mehr als ein Atom des zu untersuchenden Elementes beinhalten, nicht gebildet werden. Stattdessen ist mit dem Auftreten makroskopisch weniger stabiler Verbindungen oder Oxidationsstufen zu rechnen. Bei der Suche nach geeigneten chemischen Systemen zur Charakterisierung der Transactiniden sind diese Besonderheiten zu berücksichtigen.
2.2 Hochtemperaturchemie der Oxid- und Hydroxid- spezies der Elemente der 6. Gruppe
Die Homologen des Seaborgiums sind Chrom, Molybdän und Wolfram. Das folgende Kapitel faßt den gegenwärtigen Kenntnisstand über Verbindungen und chemische Eigenschaften dieser Elemente zusammen. Die Betrachtungen beschränken sich dabei auf das im Rahmen der Arbeit untersuchte chemische System, d.h. auf Spezies und Eigenschaften, die in Gegenwart von Sauerstoff und/oder Wasserdampf beobachtet wurden. Dabei wird deutlich, daß das Wissen über diese seit langem be- kannten und vielseitig verwendeten Elemente teilweise noch recht lückenhaft ist. Dies betrifft insbe- sondere das Verhalten kleinster Mengen, das für die Auslegung, Modellierung und Interpretation von Seaborgiumexperimenten aber von großem Interesse ist. Abschätzungen des chemischen Verhaltens kleinster Substanzmengen der Seaborgiumhomologen sind Gegenstand von Kapitel 2.2.2.
2.2.1 Kenntnisstand
2.2.1.1 Makroskopische Mengen
Im Hinblick auf die Untersuchung physikochemischer Eigenschaften von Spurenmengen der Seabor- giumhomologen ist auch das chemische Verhalten makroskopischer Mengen dieser Elemente von Be- deutung. Auf der Grundlage bekannter Korrelationen zwischen makroskopischen und mikroskopi- schen Eigenschaften können Voraussagen über das wahrscheinliche Verhalten kleinster Substanz- mengen getroffen werden. Aussagen bezüglich wahrscheinlich auftretender chemischer Spezies beim Einsatz von Spurenmengen sind unter Berücksichtigung der im vorangegangenen Kapitel gemachten Einschränkungen hinsichtlich des Auftretens von Polymeren bzw. Molekülen mit mehr als einem Atom des betrachteten Elementes möglich.
2.2.1.1.1 Chrom
Chrom ist das leichteste der Homologen des Seaborgiums und unterscheidet sich in vielen seiner Ei- genschaften deutlich von Molybdän und Wolfram. Es ist kaum zu erwarten, daß das Verhalten des Seaborgiums dem des Chroms ähnelt. Für ein vollständiges Bild der Eigenschaftsabstufungen inner- halb der 6. Gruppe und die Prognose chemischer Eigenschaften des Seaborgiums ist aber auch das gaschemische Verhalten des Chroms in Gegenwart von Sauerstoff und/oder Wasserdampf von Inter- esse.
Die Elektronenkonfiguration des Chroms ist (Ar)3d54s1. In seinen chemischen Verbindungen tritt Chrom hauptsächlich zwei-, drei- und sechswertig auf, doch existieren auch Verbindungen des vier- und fünfwertigen Chroms.
Bekannt sind mehrere oxidische Verbindungen des Chroms, die wichtigsten sind Cr2O3, CrO2 und CrO3. CrO3 ist die leichtflüchtigste dieser Verbindungen. Es beginnt bereits an seinem Schmelzpunkt (198 °C) zu verdampfen. Durch Wasserdampf wird die Flüchtigkeit von CrO3 durch die Bildung eines gasförmigen Hydroxides noch erhöht [GLE 62b]. Bei 250 °C zerfällt CrO3 über Zwischenstufen leicht in Cr2O3 und Sauerstoff, wobei als Zwischenprodukt CrO2 entsteht. Cr2O3 ist entsprechend der großen Stabilität der Oxidationsstufe +3 das stabilste der Oxide. Es entsteht bei der Reaktion von Chrom mit Sauerstoff bzw. Wasserdampf bei erhöhten Temperaturen und hinterbleibt ganz allgemein beim Glü- hen höherer Sauerstoffverbindungen des Chroms. Oberhalb 2000 °C weist Cr2O3 merkliche Verflüch- tigung auf, sein Dampfdruck bei dieser Temperatur beträgt etwa 400 Pa [GME 62]. Bei Temperaturen bis zu 1200 °C ist es praktisch nicht flüchtig [CAP 61]. In Gegenwart von Sauerstoff wird es jedoch auch bei niedrigeren Temperaturen verflüchtigt, was auf die Bildung von CrO3 zurückzuführen ist [CAP 61, GRA 71, FRY 77]. Durch Zusatz von Wasserdampf zum Sauerstoff kann die Flüchtigkeit von Cr2O3 noch weiter erhöht werden, da neben CrO3 auch CrO2(OH)2 gebildet wird bzw. das ent- standene CrO3 zu CrO2(OH)2 weiterreagiert [CAP 61, FRY 77]. Der Nachweis des gasförmigen CrO2(OH)2 erfolgte massenspektrometrisch [FAR 73, FRY 77]. Hinweise auf die Existenz dieser Verbindung im festen Zustand liegen nicht vor. Bei der Arbeit mit Spurenmengen kann Cr2O3 wegen der geringen Wahrscheinlichkeit des Zusammentreffens von zwei Chromatomen nicht gebildet wer- den. Daraus ergibt sich die Frage, welche Spezies anstelle dieser stabilen Verbindung entsteht. Litera- turangaben hierzu fehlen. Es ist zu vermuten, daß in Sauerstoffüberschuß CrO3 gebildet wird, wobei die Frage nach seiner Stabilität bei hohen Temperaturen offen bleibt. In Gegenwart von Wasserdampf sollte wie auch unter makroskopischen Bedingungen CrO2(OH)2 entstehen.
Thermodynamische Daten für Chrom, seine Oxide und Hydroxide sind in Tab. 2.1 zusammengefaßt.
Die Standardbildungsenthalpie der hypothetischen Spezies CrO2(OH)2 (s) und die Standardentropie von CrO2(OH)2(g) wurden durch direkte Extrapolation aus den Werten der entsprechenden Molybdän- bzw.
Wolframverbindung abgeschätzt:
H° CrO2(OH)2 (s) = A H° M (g) + B
S° CrO2(OH)2 (g) = A lg (Molekulargewicht) + B
Tab. 2.1: Standardenthalpien und -entropien von Elementen und Verbindungen im System Chrom- Sauerstoff-Wasserdampf (T = 298 K)
Berechnungen in der vorliegenden Arbeit wurden auf Grundlage der kursiv gedruckten Werte durchgeführt. Geschweifte Klammern kennzeichnen über Extrapolation abgeschätzte Daten. Unsichere Daten sind durch runde Klammern kenntlich gemacht.
Spezies H°
[kJmol-1]
S°
[Jmol-1K-1]
Literatur
H2O (g) -241,86
-241,83 0,04 -241,98 -242,62
188,82 188,73 188,85 188,85
[KNA 91]
[COR 90]
[BAR 77]
[BAR 73]
O2 (g) 0 205,15
205,04 205,15
[KNA 91]
[COR 90]
[BAR 73]
Cr (s) 0 23,65 0,21
23,78 23,66 23,78
[KUB 79]
[DEL 76]
[BAR 77]
[BAR 73]
Cr (g) 397,75 4,19
397,75
174,30 174,51
[KUB 79]
[DEL 76]
CrO (s) - -
CrO (g) 188,28
(222)
239,27 221,90
[KNA 91]
[DEL 76]
CrO2 (s) -582,80 8,37
-598,7 -581,97
51,08 8,79 (54,4) 51,08
[KUB 79]
[DEL 76]
[BAR 77]
CrO2 (g) -75,31
(-12,6) -12,6 29,3
269,24 259,58
-
[KNA 91]
[DEL 76]
[FAR 73]
CrO3 (s) -587,02
-579,87 10,47 -589,92 -578,62
73,22 72,01 10,47
(67,0) 72,01
[KNA 91]
[KUB 79]
[DEL 76]
[BAR 77]
CrO3 (g) -292,88
(-272,1) -270,47 29,3
266,20 266,28
-
[KNA 91]
[DEL 76]
[FAR 73]
Cr2O3 (s) -1140,56
-1130,44 10,47 -1140,48 -1130,44
81,17 81,22 0,84
81,22 81,22
[KNA 91]
[KUB 79]
[DEL 76]
[BAR 73]
Cr2O3 (g) - -
CrO2(OH)2 (s) {-907,6 58} -
CrO2(OH)2 (g) -736,9
-738,55 29,3
- - {353,6 4,7}
[DEL 76]
[FAR 73]
2.2.1.1.2 Molybdän
Molybdän besitzt die Elektronenkonfiguration (Kr)4d55s1. Es tritt ebenso wie Chrom in den Oxida- tionsstufen +2 bis +6 auf, die wichtigsten und zugleich auch beständigsten Verbindungen leiten sich jedoch vom sechswertigen Molybdän ab.
Stabile Sauerstoffverbindungen des Molybdäns sind MoO2 und MoO3. In Sauerstoffüberschuß wird MoO2 zu MoO3 weiteroxidiert, das oberhalb 600 °C sublimiert. In der Gasphase über MoO3 wurden Polymere des Typs (MoO3)n mit n = 2 bis 5 nachgewiesen, wobei als Hauptspezies das Trimer und das Tetramer identifiziert wurden [COR 90]. Oberhalb der Siedetemperatur von MoO3 (1105 °C) tritt hauptsächlich das Monomer auf [KNA 91]. In Experimenten mit kurzlebigen Isotopen des Molybdäns und Konzentrationen, die den Zusammenstoß zweier oder mehrerer Oxidmoleküle ausschließen, kön- nen Polymere nicht gebildet werden. Die Verflüchtigung des Molybdäns in Sauerstoff kann danach nur als MoO3 erfolgen.
Die Reaktion von Molybdän oder MoO2 mit Wasserdampf führt ebenfalls zur Bildung von MoO3 [KIL 65]. Dieses kann wiederum durch Polymerbildung verflüchtigt werden oder zum Hydroxid MoO2(OH)2 weiterreagieren, einer flüchtigen Verbindung, die nur bei höheren Temperaturen stabil ist [SÄF 73]. Beim Abkühlen zerfällt MoO2(OH)2 in das Trioxid und Wasser. Das gasförmige Hydroxid darf nicht mit dem festen Aquoxid verglichen werden, da letzteres kein Hydroxid, sondern ein echtes Oxidhydrat der Formel MoO3H2O ist [GLE 62a, GLE 63].
In Tab. 2.2 sind thermodynamische Daten des Molybdäns und seiner Verbindungen im System Mo- lybdän-Sauerstoff-Wasserdampf zusammengestellt.
Tab. 2.2: Standardenthalpien und -entropien von Elementen und Verbindungen im System Molyb- dän-Sauerstoff-Wasserdampf (T = 298 K)
Berechnungen in der vorliegenden Arbeit wurden auf Grundlage der kursiv gedruckten Werte durchgeführt. Unsichere Daten sind durch runde Klammern kenntlich gemacht.
Daten für H2O (g) und O2 (g) s. Tab. 2.1
Spezies H°
[kJmol-1]
S°
[Jmol-1K-1]
Literatur
Mo (s) 0 28,56 0,08
28,60 0,05 28,68 0,2
28,68 28,63 28,60
[COR 90]
[COR 90]
[KUB 79]
[DEL 76]
[BAR 77]
[BAR 73]
Mo (g) 657,6 5,0
658,98 3,8 660,08 658,58 5,44
658,58
181,84 181,79 181,96 181,96
[COR 90]
[COR 90]
[KAR 83]
[KUB 79]
[DEL 76]
Tab. 2.2: Standardenthalpien und -entropien von Elementen und Verbindungen im System Molyb- dän-Sauerstoff-Wasserdampf (T = 298 K), Fortsetzung
Spezies H°
[kJmol-1]
S°
[Jmol-1K-1]
Literatur
MoO (s) - -
MoO (g) 310,93
357 40 (389,4) 387,28
241,74 244,65 (238,6) 238,23
[KNA 91]
[COR 90]
[DEL 76]
[BAR 73]
MoO2 (s) -587,85
-589,5 1,0 588,2 1,7
-589,33 -588,25
46,46 46,46 0,42
50,03 1,3 46,31 50,03
[KNA 91]
[COR 90]
[KUB 79]
[DEL 76]
[BAR 73]
MoO2 (g) -8,31
-15 20 (12,6)
-13,0
276,99 273,80 (276,3) 278,00
[KNA 91]
[COR 90]
[DEL 76]
[BAR 73]
MoO3 (s) -744,98
-745,00 1,0 -745,7 0,8
-745,59 -745,67
77,76 77,76 1,3 77,83 0,63
77,79 77,87
[KNA 91]
[COR 90]
[KUB 79]
[DEL 76]
[BAR 73]
MoO3 (g) -346,44
-364,4 20,0 -360,9 20,9
(-355,9) -360,90
283,90 276,41 280,1 16,7
(280,5) 280,10
[KNA 91]
[COR 90]
[KUB 79]
[DEL 76]
[BAR 73]
(MoO3)2 (g) -984,89
-1120 40 -1176,5
407,37 405,50
[KNA 91]
[COR 90]
[DEL 76]
(MoO3)3 (g) -1878,29
-1859 40 -1925,9
526,74 549,6 45
[KNA 91]
[COR 90]
[DEL 76]
(MoO3)4 (g) -2570,12
-2563 40 -2620,9
653,97 671,1 60
[KNA 91]
[COR 90]
[DEL 76]
(MoO3)5 (g) -3255,98
-3249 40 -3311,8
771,54
788,4 85 [KNA 91]
[COR 90]
[DEL 76]
MoO2(OH)2 (s) -1037,2 1,1
-1046,7
115 10 (121,4)
[COR 90]
[DEL 76]
MoO2(OH)2 (g) -851,03
-850,3 5,0 -849,9
355,62 350,24 (355,9)
[KNA 91]
[COR 90]
[DEL 76]
Im Rahmen der vorliegenden Arbeit sollten einige gaschromatographische Experimente mit makro- skopischen Molybdänmengen durchgeführt werden, um den Transport makroskopischer Mengen vom Transport kleinster Substanzmengen abzugrenzen, den Übergangsbereich zu bestimmen und die am Transportprozeß beteiligten chemischen Spezies in Gegenwart von Sauerstoff und/oder Wasserdampf zu ermitteln.
Nach dem bisherigen Kenntnisstand erscheint in Gegenwart von Sauerstoff die Bildung gasförmiger Polymere des Typs (MoO3)n als wahrscheinlich. In Anwesenheit von Sauerstoff und Wasserdampf könnten sowohl Polymere des genannten Typs als auch das gasförmige MoO2(OH)2 auftreten. In kon- densierter Phase sollte das Trioxid die stabilste Spezies im untersuchten chemischen System sein:
n MoO3 (s) (MoO3)n (g) (1)
MoO3 (s) + H2O (g) MoO2(OH)2 (g) (2)
Tab. 2.3 faßt thermodynamische Zustandsfunktionen für verschiedene Reaktionen makroskopischer Molybdänmengen in Gegenwart von Sauerstoff und/oder Wasserdampf zusammen, die aus den in Tab. 2.2 zusammengestellten Daten berechnet wurden.
Tab. 2.3: Thermodynamische Zustandsfunktionen für Reaktionen makroskopischer Molybdänmengen in Gegenwart von Sauerstoff und/oder Wasserdampf
Reaktion (Abscheidung)
H°298 [kJmol-1]
S°298 [Jmol-1K-1]
Desublimation H°des S°des
MoO2(g) MoO2(s) -574,5 21 -230,5 0,4
MoO3(g) MoO3(s) -380,6 21 -206,1 1,3
MoO2(OH)2(g) MoO2(OH)2(s) -186,9 6,1 -240,6 10
dissoziative Desublimation H° diss.des S° diss.des
(MoO3)3(g) 3 MoO3(s) -376,0 43 -316,3 49
(MoO3)4(g) 4 MoO3(s) -417,0 44 -360,1 65
MoO3(g) MoO2(s) + ½ O2 (g) -225,1 21 -134,9 1,3
MoO2(OH)2(g) MoO3(s) + H2O (g) -136,5 6,0 -89,1 1,3
2.2.1.1.3 Wolfram
Wolfram steht Seaborgium innerhalb der 6. Gruppe am nächsten. Im Hinblick auf künftige Seaborgium- experimente dient es häufig als Testelement in Modellexperimenten.
Bedingt durch die Lanthanidenkontraktion unterscheiden sich die Atom- und Ionenradien des Molyb- däns und des Wolframs nur unwesentlich voneinander. Dies führt dazu, daß beide Elemente in vielen
ihrer Eigenschaften einander sehr ähnlich sind, während sich das leichtere Chrom von ihnen merklich unterscheidet.
Wolfram besitzt die Elektronenkonfiguration (Xe) 4f145d46s2. In seinen chemischen Verbindungen kann es wie seine leichteren Homologen zwei- bis sechswertig auftreten. Die Stabilität der sechswer- tigen Oxidationsstufe nimmt dabei weiter zu. Analogien zwischen Molybdän und Wolfram werden auch bei der Betrachtung ihres Verhaltens in Gegenwart von Sauerstoff und/oder Wasserdampf deut- lich. Allgemein weisen die Oxid- bzw. Hydroxidspezies des Wolframs aber eine geringere Flüchtig- keit als die entsprechenden Molybdänverbindungen auf. So bildet Wolfram mehrere stabile Oxide, von denen WO3 aber in Sauerstoffüberschuß die größte Bedeutung besitzt. Es beginnt bereits unterhalb seines Schmelzpunktes (1472 °C) zu sublimieren, wobei in der Gasphase Polymere der Form (WO3)n
mit n = 2 - 4 vorliegen. Trimer und Tetramer sind ebenso wie beim Molybdän die Hauptkomponenten.
Monomeres WO3 tritt unterhalb des Siedepunktes von WO3 (1942 °C) in der Gasphase nur in sehr geringer Menge auf [KNA 91]. Bei Verflüchtigungsexperimenten mit trägerfreien, kurzlebigen Wolframisotopen in trockenem Sauerstoff sollte eine Verflüchtigung des Wolframs aber ausschließ- lich als monomeres WO3 möglich sein.
Mit feuchtem Sauerstoff oder Wasserdampf können neben den Oxid- auch Hydroxidspezies wie WO2(OH)2 gebildet werden, das eine höhere Flüchtigkeit als WO3 aufweist [KIL 66, SÄF 73]. Dieses Hydroxid ist im festen Zustand nicht existent. Vielmehr handelt es sich hierbei um das Oxidhydrat WO3H2O, das bei 100 - 300 °C aber vollständig dissoziiert [GLE 62a, GLE 63, MIL 49].
Literaturdaten thermodynamischer Funktionen von Wolfram, seinen Oxid- und Hydroxidspezies sind in Tab. 2.4 zusammengestellt.
Tab. 2.4: Standardenthalpien und -entropien von Elementen und Verbindungen im System Wolfram- Sauerstoff-Wasserdampf (T = 298 K)
Berechnungen in der vorliegenden Arbeit wurden auf Grundlage der kursiv gedruckten Werte durchgeführt. Unsichere Daten sind durch runde Klammern kenntlich gemacht.
Daten für H2O (g) und O2 (g) s. Tab. 2.1
Spezies H°
[kJmol-1]
S°
[Jmol-1K-1]
Literatur
W (s) 0 32,6 0.4
32,66 32,68
[KUB 79]
[DEL 76]
[BAR 73]
W (g) 849,9 12.6
854,1
173,96 173,96
[KUB 79]
[DEL 76]
WO (s) - -
WO (g) 422,58
(427,0) 425,38
245,80 (247,0) 245,77
[KNA 91]
[DEL 76]
[BAR 73]
Tab. 2.4: Standardenthalpien und -entropien von Elementen und Verbindungen im System Wolfram- Sauerstoff-Wasserdampf (T = 298 K), Fortsetzung
Spezies H°
[kJmol-1]
S°
[Jmol-1K-1]
Literatur
WO2 (s) -589,69
-590,1 6,3 -590,09 -590,09
50,53 50,6 1,7
50,58 50,58
[KNA 91]
[KUB 79]
[DEL 76]
[BAR 73]
WO2 (g) 76,57
(62,8) 76,62
285,50 (284,7) 285,54
[KNA 91]
[DEL 76]
[BAR 73]
WO3 (s) -842,91
-843,4 2,9 -843,43 -843,47
75,90 75,95 1,256
75,95 75,95
[KNA 91]
[KUB 79]
[DEL 76]
[BAR 73]
WO3 (g) -292,88
(-293,1) -293,08
286,44 (284,7) 286,38
[KNA 91]
[DEL 76]
[BAR 73]
(WO3)2 (g) -1163,99
(-1159,7) -1164,77
415,60 (414,5)
415,75
[KNA 91]
[DEL 76]
[BAR 73]
(WO3)3 (g) -2022,91
-1958,0 (-2026,4)
-2024,74
504,67 (506,6) 504,93
[KNA 91]
[CHA 85]
[DEL 76]
[BAR 73]
(WO3)4 (g) -2804,12
(-2809,3) 2805,99
605,27 (607,1) 605,41
[KNA 91]
[DEL 76]
[BAR 73]
WO2(OH)2 (s) -1131,89
-1130,44 -1131,0 -1132,53
144,77 (138,2) 144,77 144,86
[KNA 91]
[DEL 76]
[CHA 85]
[BAR 73]
WO2(OH)2 (g) -905,84
(-908,5) -906,44
352,00 (351,7) 351,69
[KNA 91]
[DEL 76]
[BAR 73]
2.2.1.2 Spurenmengen
Beim Übergang von makroskopischen zu Spurenmengen ändern sich Verflüchtigungs- und Abschei- dungsmechanismus grundlegend. Spurenmengen können weder als reine feste Phasen charakterisiert werden noch ausgedehnte Monoschichten auf einer adsorbierenden Oberfläche bilden. Während bei makroskopischen Mengen insbesondere Wechselwirkungen der transportierten Moleküle untereinan- der das Verflüchtigungs- und Abscheidungsverhalten bestimmen und das Oberflächenmaterial prak-
tisch keinen Einfluß auf Verflüchtigung und Abscheidung einer Spezies ausübt, müssen bei der Un- tersuchung von Spurenmengen Wechselwirkungen mit der Oberfläche berücksichtigt werden.
Über das chemische Verhalten kleinster Substanzmengen der Elemente der 6. Gruppe im O2- H2O(g)/SiO2(s)-System war bisher nur wenig bekannt. Die verfügbaren, teilweise widersprüchlichen Informationen beschränken sich auf einige wenige Untersuchungen:
So wurden Spurenmengen Molybdän in einem trockenen Sauerstoffstrom bei Temperaturen zwischen 1050 °C und 1200 °C verflüchtigt und bei ca. 800 °C wieder abgeschieden [BEC 94]. Anderen Auto- ren gelang die Verflüchtigung von Molybdän bei einer Temperatur von 1000 °C im trockenen Sauer- stoffstrom nicht [BAY 78]. Bei der Verflüchtigung von Molybdän im trockenen Luftstrom wurde eine Abscheidungstemperatur von 990 °C erhalten [EIC 75]. Daraus wurde eine Adsorptionsenthalpie von
H°ads = -301 13 kJmol-1 ermittelt. In allen Fällen wird MoO3 als transportierte Spezies angegeben.
Trägerfreies Wolfram wurde in trockenem Sauerstoff bei einer Starttemperatur von 1160 °C nicht ver- flüchtigt [BAY 75].
In feuchtem Sauerstoff bzw. in feuchter Luft weisen sowohl Molybdän als auch Wolfram eine erhöhte Flüchtigkeit auf, was mit der Bildung von MO2(OH)2 mit M = Mo, W erklärt wird [BAY 75, BEC 94].
Aussagen zu Transportprozessen und thermodynamischen Zustandsfunktionen fehlen völlig.
2.2.2 Abschätzung des chemischen Verhaltens von Spuren- mengen
Ziel von Untersuchungen im Rahmen der vorliegenden Arbeit war u.a. die Untersuchung des Ver- flüchtigungs- und Abscheidungsverhaltens kleinster Substanzmengen der Elemente der 6. Gruppe in Gegenwart von Sauerstoff und/oder Wasserdampf und Quarz als adsorbierender Oberfläche (O2- H2O(g)/SiO2(s)-System), die Aufklärung von Transportprozessen sowie die Bestimmung thermodynami- scher Zustandsfunktionen für die Grundreaktionen dieser Prozesse aus experimentellen Ergebnissen.
Unter Berücksichtigung der wenigen Arbeiten zum Verflüchtigungs- und Abscheidungsverhalten von Spurenmengen der Elemente der 6. Gruppe in Gegenwart von Sauerstoff und/oder Wasserdampf und der in Kap. 2.2.1 beschriebenen Eigenschaften von Oxid- und Hydroxidspezies sollten im O2-H2O(g)/ SiO2(s)-System MO3 bzw. MO2(OH)2 (M = Cr, Mo, W) gebildet werden. MO2(OH)2 ist im festen Zu- stand nicht bekannt. Eine Adsorption dieser Spezies muß aber in die Betrachtungen einbezogen wer- den. Polymerbildung kann wegen der geringen Teilchenkonzentration ausgeschlossen werden, ebenso die Bildung des makroskopisch sehr stabilen Cr2O3. Als wahrscheinlich sind damit die folgenden Reaktionen einzustufen:
MO3 (g) MO3 (ads) (3)
MO2(OH)2 (g) MO2(OH)2 (ads) (4)
MO2(OH)2 (g) MO3 (ads) + H2O (g) (5)
Ein indirekter Nachweis der im untersuchten chemischen System vorliegenden Spezies kann durch die Voraussage chemischer Eigenschaften aufgrund bekannter Korrelationen und den Vergleich mit ex- perimentellen Ergebnissen geführt werden. Für den gaschemischen Transport von Spurenmengen ei- nes flüchtigen Oxides (Hydroxides) durch ein Quarzrohr sind Beziehungen zwischen der Standard- sublimationsenthalpie der Verbindung H°298, subl und ihrer Standardadsorptionsenthalpie H°ads und Abscheidungstemperatur TD bekannt [EIC 75]:
H°ads = (16,9 8,2) + (0,69 0,04) H°298, subl (2.1)
TD = (51,0 47,0) + (3,16 0,23) H°298, subl (2.2)
Die Korrelation zwischen den Adsorptions- und Sublimationsenthalpien weist darauf hin, daß der Ad- sorptionsprozeß vermutlich zu einer unvollständigen (einseitigen) Koordination der Teilchen des Oxidmoleküls mit den Oberflächenteilchen des Quarz führt und mit dem Desublimationsvorgang auf der Oberfläche des reinen festen Oxids vergleichbar ist [EIC 75].
Ein Ausdruck für die Bestimmung der Standardadsorptionsentropie S°ads wurde aus dem Modell der mobilen Adsorption abgeleitet [DEB 53, EIC 82]:
S R c
c
R T M
R
ads
gas ads
ln
0 2 2 (2.3)
R = Gaskonstante
c°gas/c°ads = cm-1 definiert den Standardzustand
0 = Schwingungsdauer des adsorbierten Teilchens senkrecht zur Oberfläche des adsorbieren- den Festkörpers Schwingungsdauer der Grundschwingung der stationären Phase ( 210-13 s für Quarz)
T = Temperatur
M = Molmasse des adsorbierten Moleküls
Enthalpie- und Entropiewerte für Reaktion (5) können mit den nach (2.1, 2.3) ermittelten Adsorptions- enthalpien und -entropien und den in Tab. 2.1 - 2.4 zusammengestellten Bildungsenthalpien und Entropien ermittelt werden:
H°diss.ads = H°f MO3 (g) + H°f H2O (g) - H°f MO2(OH)2 (g) + H°ads MO3 (2.4)
S°diss.ads = S° MO3 (g) + S° H2O (g) - S° MO2(OH)2 (g) + S°ads MO3 (2.5) In Tab. 2.5 sind Standardenthalpien, -entropien und Abscheidungstemperaturen für einige mehr oder weniger wahrscheinliche Reaktionen von Spurenmengen der Elemente der 6. Gruppe im O2-H2O(g)/ SiO2(s)-System angegeben. Die angegebenen Fehler setzen sich aus den Fehlern der Korrelationen (2.1, 2.2) und den Fehlern der verwendeten Literaturwerte zusammen. Häufig fehlen diese Angaben aber in der Literatur, so daß teilweise von größeren Fehlerbereichen als in Tab. 2.5 angegeben ausgegangen werden muß.
![Tab. 2.2: Standardenthalpien und -entropien von Elementen und Verbindungen im System Molyb- Molyb-dän-Sauerstoff-Wasserdampf (T = 298 K), Fortsetzung Spezies H ° [kJmol -1 ] S °](https://thumb-eu.123doks.com/thumbv2/1library_info/4564324.1599777/19.892.112.785.205.1133/standardenthalpien-entropien-elementen-verbindungen-sauerstoff-wasserdampf-fortsetzung-spezies.webp)