Gewürze
Philipps-Universität Marburg Fachbereich 15: Chemie Experimentalvortrag-OC
Griseldis Länder
Datum: 1. Juli 2009
Gliederung Seite
1. Einleitung……… 3
2. Inhaltstoffe verschiedener Gewürze……… 4
2.1 Farbstoffe………. 4
2.1.1 Demonstration 1: Löslichkeit von Gewürzfarbstoffen…... 6
2.1.2 Versuch 1: Chlorophyll in der Petersilie……….... 9
2.1.3 Versuch 2: Echter Safran?... 11
2.2 Ätherische Öle……….... 12
2.2.1 Demonstration 2: Chromatographie………... 14
2.2.2 Versuch 3: Vanillin-Darstellung……….... 17
2.3 Gerbstoffe………... 21
2.3.1 Versuch 4: Nelkenester……….. 22
2.3.2 Versuch 5: Eisengallustinte…….………... 23
2.4 Aminosäuren……….. 25
2.4.1 Versuch 6: Maggie………... 26
3. Schulische Relevanz……….. 29
4. Literatur………. 30
1. Einleitung
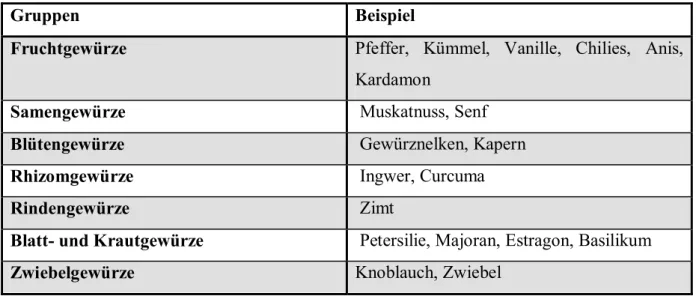
Unter Gewürzen versteht man den getrockneten Teil einer Pflanze, deren Inhaltstoffe Lebensmittel würzen können. Die Wirkung beruht meistens auf dem Gewürzbestandteil der ätherischen Öle. Von den entsprechenden Gewürzpflanzen werden Wurzeln, Wurzelstöcke, Zwiebeln, Rinde, Blätter, Kraut, Blüten, Früchte und Samen verwendet. Sie können weiterhin so unterteilt werden:
Gruppen Beispiel
Fruchtgewürze Pfeffer, Kümmel, Vanille, Chilies, Anis, Kardamon
Samengewürze Muskatnuss, Senf
Blütengewürze Gewürznelken, Kapern
Rhizomgewürze Ingwer, Curcuma
Rindengewürze Zimt
Blatt- und Krautgewürze Petersilie, Majoran, Estragon, Basilikum
Zwiebelgewürze Knoblauch, Zwiebel
Tabelle 1: Einteilung von Gewürzen
Eine weitere Definition lautet: „Gewürze sind Pflanzenteile oder ganze Pflanzen, die frisch, getrocknet oder chemisch konserviert, meist in relativ geringen Mengen Lebensmitteln bzw.
Lebensmittelzubereitungen überwiegend auf Grund ihres Gehaltes an aromatischen oder scharf schmeckenden Stoffen zur Verbesserung von Aroma und Geschmack zugesetzt werden.“ (vgl. F RANZKE 1996, S.569)
Im Allgemeinen haben Gewürze nur einen geringen Nährwert, wobei der Gehalt an
Mineralstoffen, Spurenelementen, sekundären Pflanzenstoffen und Vitaminen, vor allem im
frischen Zustand, beträchtlich sein kann. Gewürze dienen hauptsächlich zur Anregung von
Geruchs- und Geschmacksorganen und zur Förderung der Sekretion von Speichel im Mund
bzw. von Verdauungssäften im Magen und Darm. Viele Gewürze besitzen
gesundheitsfördernde und teilweise auch heilende Eigenschaften. Sie wirken zum Beispiel
druchblutungsfördernd, antibakteriell, antioxidativ, schmerzlindernd, immunstärkend, steigern
die Gallensekretion oder helfen gegen Übelkeit.
Kulturgeschichtlich gesehen wurden Pfeffer, Zimt, Ingwer und andere Gewürze schon zu Zeiten der Römer aus Indien importiert. Die Germanen lernten Gewürze durch die Römer kennen. Im späten Mittelalter lag der Gewürzhandel, besonders der Pfefferhandel, in den Händen der Araber und Venezianern. Im späten 15. und Anfang des 16. Jahrhunderts übernahmen dann die Portugiesen das Monopol, da sie einen direkten Seeweg nach Indien entdeckt hatten. Im 17. Jahrhundert eroberten die Niederländer das Gewürzmonopol. Sie wurden 1795 zunächst von den Briten verdrängt. Nach dem Wiener Kongress (1814/15) teilten sich schließlich die Niederlande und Großbritannien den Gewürzhandel (B ROCKHAUS
O NLINE – M UNZINGER . DE ).
2. Inhaltstoffe verschiedener Gewürze
Die Inhaltstoffe der Gewürze können nach Primären und Sekundären unterschieden werden.
Zu den primären Inhaltsstoffen zählen Zucker, Fettsäuren, Aminosäuren, Stärke, Cellulose und Lignin. Zu den sekundären Inhaltstoffen zählen ätherische Öle, Scharfstoffe, Bitterstoffe, Farbstoffe, Gerbstoffe, Harze und Glycoside. Im Weiteren werde ich mich mit den Aminosäuren, ätherischen Ölen, Farbstoffen und Gerbstoffen beschäftigen.
2.1 Farbstoffe
Die Farbe eines Lebensmittels hat auf dessen Beliebtheit oder Genusswertes eine großen
Einfluss. Die natürliche Farbe von Lebensmitteln wird durch mannigfache Pigmente
verursacht, so auch bei den Gewürzen. Pigmente können sowohl mineralischen, organischen
(Indigo) und anorganischen (Ocker) Ursprungs sein. Hier eine kleine Auswahl der wichtigsten
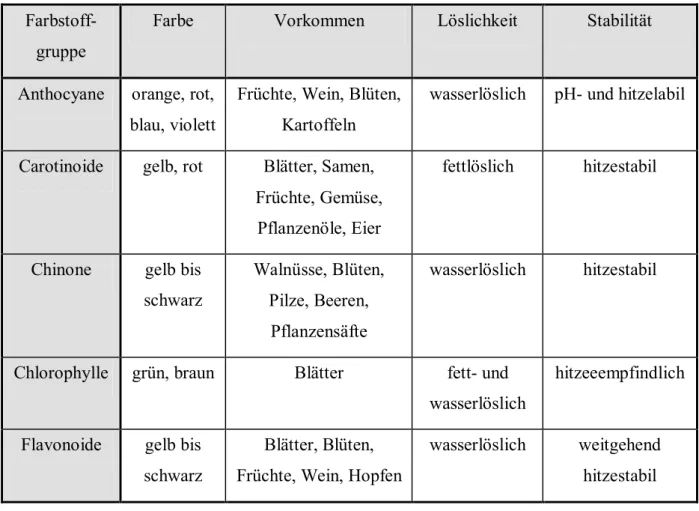
Gruppen natürlicher Lebensmittelfarbstoffe und deren Charakteristik:
Farbstoff- gruppe
Farbe Vorkommen Löslichkeit Stabilität
Anthocyane orange, rot, blau, violett
Früchte, Wein, Blüten, Kartoffeln
wasserlöslich pH- und hitzelabil
Carotinoide gelb, rot Blätter, Samen, Früchte, Gemüse,
Pflanzenöle, Eier
fettlöslich hitzestabil
Chinone gelb bis schwarz
Walnüsse, Blüten, Pilze, Beeren,
Pflanzensäfte
wasserlöslich hitzestabil
Chlorophylle grün, braun Blätter fett- und wasserlöslich
hitzeeempfindlich
Flavonoide gelb bis schwarz
Blätter, Blüten, Früchte, Wein, Hopfen
wasserlöslich weitgehend hitzestabil
Tabelle 2: Farbstoffgruppen
Um Farbstoffe richtig zu verstehen muss erst einmal Farbigkeit definiert werden. Wenn eine
chemische Verbindung aus dem sichtbaren Bereich des Spektrums (400 – 800 nm) einen
gewissen Wellenbereich selektiv absorbiert, erscheint sie farbig. Die Komplementärfarbe des
absorbierten Spektralteils ist das was unsere Augen als Farbe wahrnehmen. Im Allgemeinen
sind die gesättigten organischen Verbindungen farblos, da ihr Absorbtionsbereich außerhalb
des sichtbaren Bereiches liegt. Die Einführung von π-Bindungssystemen und insbesondere die
Begleitung von Konjugationen verschiebt die Absorbtionsbanden in den sichtbaren Teil des
Spektrums. Je stärker solche π-Elektronen delokalisiert sind, desto langwelliger ist das Licht,
welches die Verbindung absorbiert. Die Absorption kommt dadurch zustande, dass ein
Elektron aus dem HOMO in das LUMO angehoben wird, da diese Anhebung Energie
verbraucht. Die Absorption ist umso langwelliger, je geringer die Energiedifferenz zwischen
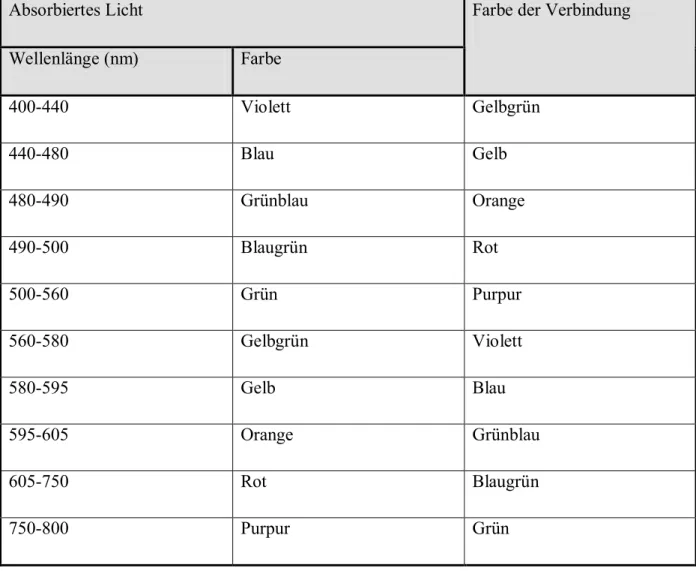
den beiden Zuständen ist. Im Folgenden eine Tabelle der verschiedenen absorbierten
Wellenlängen und die entsprechende Farbe der Verbindung:
Absorbiertes Licht
Wellenlänge (nm) Farbe
Farbe der Verbindung
400-440 Violett Gelbgrün
440-480 Blau Gelb
480-490 Grünblau Orange
490-500 Blaugrün Rot
500-560 Grün Purpur
560-580 Gelbgrün Violett
580-595 Gelb Blau
595-605 Orange Grünblau
605-750 Rot Blaugrün
750-800 Purpur Grün
Tabelle 3: absorbierte Wellenlänge und deren Farbe (vgl. B EYER & W ALTER 1988, S.592) Farbstoffe bzw. Gewürzfarbstoffe besitzen unterschiedliche Löslichkeiten, die in der 1.
Demonstration und in den Versuchen 1 und 2 näher untersucht werden.
2.1.1 Demo 1: Löslichkeit von Gewürzfarbstoffen
Materialien: 8 Reagenzgläser, Spatel, Reagenzglasgestell, Stopfen, Glasstab, Pipette Chemikalien: Wasser
Ethanol C 2 H 6 O R 11, S 7-16 F
getrocknete Petersilie, Curcumapulver, Safranfäden, Paprikapulver
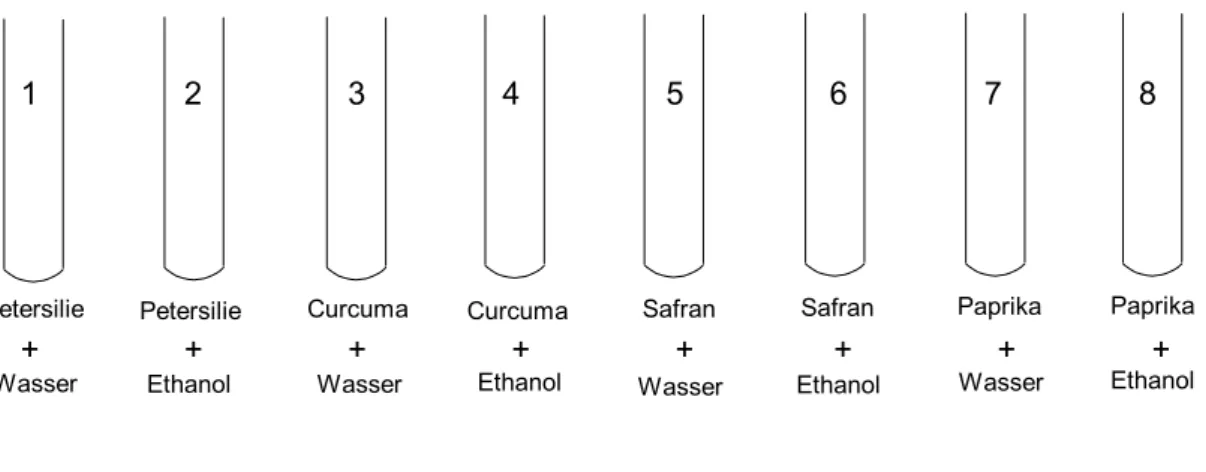
Durchführung: In jeweils zwei Reagenzgläser wird ein Spatel der verschiedenen Substanzen (Petersilie, Curcuma, Safran, Paprika) gegeben. Bei der Petersilie werden die getrockneten Blätter mit dem Glasstab zerdrückt.
Jeweils eines der beiden Reagenzgläser wird mit Wasser und das andere mit Ethanol, etwa zwei Finger breit, gefüllt. Anschließend werden alle Reagenzgläser geschüttelt, wobei gegebenenfalls die Öffnung mit einem Stopfen verschlossen wird. Nun lässt man die Reagenzgläser etwas stehen.
Petersilie Petersilie Curcuma Curcuma Safran Safran Paprika Paprika Wasser Ethanol Wasser Ethanol Wasser Ethanol Wasser Ethanol
+ + + + + + + +
1 2 3 4 5 6 7 8
Abb. 1: Versuchsaufbau (Skizze)
Beobachtung: Der Farbstoff der Petersilie, des Curcumas und der der Paprika lösen sich weniger gut in Wasser, aber dafür sehr gut in Ethanol. Der Farbstoff des Safrans löst sich sehr gut in Wasser.
Entsorgung: Alle Gemische können in den Ausguss gegeben werden.
Erklärung: Der gelbe bis orangerote Farbstoff des Safrans Crocin löst sich aufgrund seiner hydrophilen Eigenschaften. Der Farbstoff der Petersilie Chlorophyll, der Paprika Capsanthin und des Cucumas Curcumin sind hydrophob und lösen sich so nicht in Wasser. Zur Erklärung dienen die Sturukturformeln, die die entsprechenden Substituenten aufzeigen die zur Hydrophobie oder zur Hydrophilie führen.
Curcumin Capsanthin
O OH
OCH 3 O
H
OCH 3 OH
CH
3C H
3CH
3O
H
O CH
3CH
3CH
3CH
3CH
3OH
C H
3C
H
3Chlorophyll
Crocin
Der erste Versuch in diesem Experimentalvortrag dient zur weiteren Untersuchung des Farbstoffes Chlorophyll. Chlorophyll ist ein grüner und gelber Pflanzenfarbstoff, der als Zentralion ein Magnesium-Ion mit Oxidationsstufe +2 hat. Die Chlorophylle befinden sich in den Chloroplasten höherer Pflanzen. Sie treten in zwei verschiedenen Zusammensetzungen auf. Das Chlorophyll a besitzt als Rest eine Methylgruppe und das Chlorophyll b eine Aldehydgruppe.
N C
H 3
CH 2
N R
CH 3
N N C
H 3
Phytyl-O O
Mg
O O
OCH 3
CH 3
-CH 3
-CHO
Chlorophyll a R:
blaugrün Chlorophyll b R:
gelbrün
N C
H 3
CH 2
N
CH 3
CH 3 N N
CH 3
O H
COOCH 3 H
H C H 3
H 39 C 20 OOC
Mg
Beide Chlorophylle besitzen einen Dihydropyrrolring und werden den Farbwachsen zugerechnet, da sie mit Phytol und Methanol verestert sind. Ihre Fettlöslichkeit bewirkt auch eine Zuordnung zu den Lipochromen. In den Chloroplasten treten die Chlorophylle in Lamellen zwischen je einer Protein- und einer Lipidschicht auf.
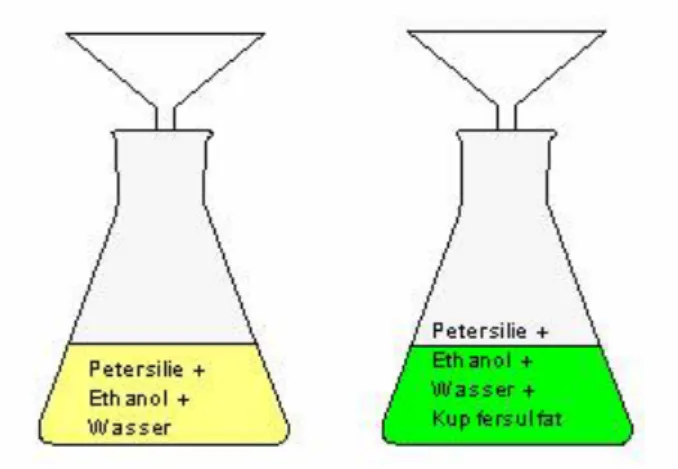
2.1.2 Versuch 1: Chlorophyll in der Petersilie
Materialien: 2 Reagenzgläser, Spatel, 2 Erlenmeyerkolben (100 mL), Glasstab, 2 Glastrichter, 2 Papierfilter, Bunsenbrenner, Feuerzeug
Chemikalien: getrocknete Petersilie, Wasser
Ethanol C 2 H 6 O R 11 S 7-16 F
Kupfersulfat CuSO 4 R 22-36/38-50/53 S 22-60-61 Xn N Durchführung: In beide Reagenzgläser werden je 3-4 Spatel getrocknete Petersilie
gegeben und anschließend mit dem Glasstab zerdrückt. Beide Reagenzgläser werden mit Wasser und Ethanol in gleicher Menge gefüllt, so dass die Flüssigkeitshöhe etwa 3 fingerbreit ist. Nun werden beide Reagenzgläser im Bunsenbrenner bis zur Siede erhitzt. In eines der beiden Reagenzgläser wird ein Spatel des Kupfersulfats gegeben und wieder erhitzt. Nach Abkühlung werden beide Gemische abfiltriert.
Beobachtung: In beiden Reagenzgläsern lässt sich eine Färbung der Flüssigkeiten erkennen.
Nach der Filtration weist das Petersilie-Wasser-Ethanol-Gemisch eine gelbe
Färbung und das Petersilie-Wasser-Ethanol-Kupfersulfat-Gemisch eine grüne
Färbung auf.
Abb. 2: Beobachtung Petersilie
Entsorgung: Das Gemisch ohne Zusatz des Kupfersulfats kann in den Ausguss gegeben werden. Die Lösung mit Kupfersulfat wird in den Abfall für Schwermetalle gegeben.
Erklärung: Der Ethanol durchdringt die Zellwände und löst die Chlorophylle von den Chloroplasten. Die Farbigkeit der Chlorophylle lässt sich durch den Aufbau des Chlorophyll-Moleküls erklären. Das aus vier aromatischen und heterozyklischen Fünfringen gebildete Molekül besitzt 11 konjugierte Doppelbindungen mit leicht anregbaren π-Elektronen. Diese Tatsache ist für die Lichtabsorption und Farbigkeit verantwortlich. Das π-Elektronensystem absorbiert vor allem Lichtquanten der Wellenlängen 430 nm bis 470 nm (blau und blaugrünes Licht) sowie 640 nm bis 660 nm (orangerotes Licht). Dies ergibt eine gelbe bis hellgrüne Farbe der Flüssigkeit. Fügt man nun Kupfersulfat zu der Mischung hinzu, so tritt das Kupfer-Ion an die Stelle des Magnesium-Ions und man erhält einen stabileren Komplex, der ein stärkeres Grün aufzeigt.
Um auch die anderen Farbstoffe des Safrans und des Curcumas zu betrachten dient der
nachfolgende Versuch 2. Es ist ein Versuch zur Unterscheidung der beiden Gewürze.
2.1.3 Versuch 2: Echter Safran?
Materialien: 2 Reagenzgläser, Reagenzglasgestell, Spatel Chemikalien: Safranfäden, gepulvertes Curcuma, Wasser
Natriumcarbonat NaCO 3 R 36 S 22-26 Xi
Durchführung: Etwa zwei Safranfäden werden in ein Reagenzglas gegeben und ein Spatel Curcuma in das andere. Nun werden etwa 2-3 mL Wasser hinzu gegeben. Anschließend werden beide Gläser mit einer Spatelspitze Natriumcarbonat versetzt und ein wenig geschüttelt.
Beobachtung: Wie auch schon in der Demonstration 1 zu erkennen ist, löst sich der Safran sehr gut in Wasser und das Curcuma weniger. Das Gemisch mit Safran ist gelb und das mit Curcuma trüb und fast farblos. Nach der Zugabe des Natriumcarbonats entsteht in dem Reagenzglas mit Curcuma sofort ein braunroter Niederschlag bzw. eine braunrote Verfärbung der Flüssigkeit. Das Gemisch mit Safran bleibt nach der Zugabe unverändert gelb.
Entsorgung: Beide Lösungen können nach einer Neutralisation in den Ausguss gegeben werden.
Erklärung: Curcuma enthält den gelben Farbstoff Curcumin. Dieser enthält zwei Phenylgruppen und phenolische OH-Gruppen. Im sauren Milieu bis pH 8 ist der Farbstoff gelb und im basischen Bereich ist er rot gefärbt, im Gegensatz zu Crocin das immer eine gelbe bis gelborangene Färbung aufweist.
Natriumcarbonat als Base deprotoniert die OH-Gruppen des Curcumin, was
eine andere Farbabsorption bewirkt und zwar im langwelligeren Bereich.
2.2 Ätherische Öle
Gewürze enthalten im Mittel etwa 2 bis 5 % ätherische Öle, in denen Verbindungen aus der Terpenreihe dominieren. Neben den Terpenen enthalten ätherische Öle auch aliphatische und aromatische Kohlenwasserstoffe, Alkohole, Aldehyde, Ester und Ketone.
Terpene sind miteinander verknüpfte Isoprenbausteine.
CH 3
C
H 2 CH 2 + CH 3
C
H 2 CH 2
CH 3
C
H 2 CH 2
CH 3
Man unterscheidet Terpene nach Anzahl der beteiligten Isoprenbausteinen in:
- Hemiterpene (1 Isoprenbaustein) - Monoterpene (2 Isoprenbausteine) - Sesquiterpene (3 Isoprenbausteine) - Diterpene (4 Isoprenbausteine) - Sesterterpene (5 Isoprenbausteine) - Triterpene (6 Isoprenbausteine) - Tetraterpene (8 Isoprenbausteine)
OH O
O H
OCH
3OCH
3OH
NaCO
3OH O
O H
OCH
3OCH
3O
-Curcumin, gelb
rotbraun OH O
-O H
OCH
3OCH
3O
- Polyterpene (mehr als 8 Isoprenbausteine)
Di-, Tri-, Tetra- und Polyterpene spielen für ätherische Öle keine Rolle. Monoterpene sind leicht flüchtig und besonders geruchsintensiv. Sie werden in acyclische, mono- und bicyclische Verbindungen eingeteilt. Zu den monocyclischen Monoterpenen gehören zum Beispiel Limonen, Menthol und Carvon. Zu den bicyclischen Monoterpenen gehört Fenchon.
Ätherische Öle sind also ein wichtiger Bestandteil von Gewürzen und somit ist ein näherer Blick auf die Definition und die Charakteristika dieser, elementar.
Unter ätherischen Ölen versteht man flüchtige, stark riechende Stoffgemische von ölartiger Konsistenz, die in Wasser schwer löslich sind und aus pflanzlichen Ausgangsstoffen hergestellt werden. Nach der ISO (International Organisation for Standardization) werden die Produkte als ätherische Öle bezeichnet, die durch Wasserdampfdestillation von Pflanzenteilen sowie durch Auspressen von Fruchtschalen einiger Zitrusarten gewonnen werden (S CHMIDKUNZ -E GGLER 2000).
Außer dass ätherische Öle im Wasserdampf flüchtig sind, zeichnen sie sich noch durch weitere gemeinsame Eigenschaften aus. Sie sind appetitanregend und verdauungsfördernd durch Stimulation der Magensaftsekretion. Sie hinterlassen auf Papier keine Fettflecken, sondern verdunsten rückstandslos, im Gegensatz zu fetten Ölen und Mineralölen. Chemisch gesehen haben reine ätherische Öle überwiegend eine Dichte unter 1, sind flüssig, farblos und in absolutem Ethanol, Benzin und Chloroform gut löslich. Manche der Öle sind optisch aktiv, das heißt sie sind links- oder rechtsdrehend und liegen in D- bzw. L-Form vor. Dies bewirkt häufig erheblich unterschiedliche sensorische Eigenschaften der entsprechenden Stereoisomere. Ätherische Öle sind fast immer Stoffgemische mit Einzelbestandteilen die recht unterschiedliche chemische Strukturen aufweisen. Meist dominiert eine Komponente mit über 90 % (F RANZKE 1996, S. 217).
Rein künstliche ätherische Öle verwendet man ausgiebig für Duftkompositionen in der
Parfümindustrie. Es gibt eine Unterscheidung zwischen den eigentlichen ätherischen Ölen
und den Extrakten, die aus Pflanzen mit ätherischem Ölgehalt gewonnen werden. Diese
Extraktionen, in der Regel mit Methanol- oder Ethanol-Wasser Gemischen, führen zu
Auszügen, welche neben lipophilen Stoffen auch eine Reihe polarer Verbindungen enthalten,
wie z.B. Zucker, Glykoside oder Phenole.
Zur Unterscheidung von Gewürzen kann die Chromatographie der ätherischen Öle herangezogen werden. Die Chromatographie ist ein physikalisch-chemisches Trennverfahren, bei denen sich die zu trennenden Substanzen aus einer Probe zwischen zwei Phasen verteilen.
Die eine Phase ist eine stationäre Phase, die fest liegt und die andere wird als mobile Phase bezeichnet, die die stationäre Phase durchströmt und die Substanzen der Probe unterschiedlich weit mit führt. Hier wurde eine Dünnschichtchromatographie durchgeführt, da hier simultan mehrere Proben auf einer einzigen Trägerplatte aufgetragen werden können. Die stationäre Phase ist ein so genanntes chromatographisches Bett, das aus Glas, Kunststoff oder Aluminiumfolie bestehen kann, auf dem eine dünne Schicht Kieselgel, Aluminiumoxid oder Cellulose liegt. Als mobile Phase wird eine Flüssigkeit verwendet, die auch Fließmittel genannt wird. Sind die Proben auf der DC-Platte aufgetragen wird diese für eine gewisse Zeit in eine Entwicklungskammer gestellt, bis das Fließmittel entsprechend weit geflossen ist.
2.2.1 Demonstration 2: Chromatographie:
Materialien: Kieselgelkarte 20x20 cm, DC-Entwicklungskammer, Glaskapillaren, Mörser mit Pistel, 12 Bechergläser (10 mL), Bleistift, Lineal
Chemikalien: Fließmittel Toluol/ Essigsäureethylester 93:7
Toluol C 7 H 8
CH3
R 11-38-48/20-63-65-67 S 36/37-62 F Xn Sprühreagenz A: 2,5 mL Schwefelsäure (w = 0,95-0,98) in 52 mL Ethanol
Schwefelsäure H 2 SO 4 R 35 S 26-30-45 C
Ethanol C 2 H 6 O R 11 S 7-16 F
Sprühreagenz B: 0,5 g Vanillin in 50 mL Ethanol
Vergleichs-Proben:
Eugenol C 10 H 12 O
O H
O CH3
CH2
R 22-38-43
S 23-24/25-37 Xn
Isoeugenol C 10 H 12 O 2
O H
O CH3
CH3
R 22
S 24/25 Xn
Carvon C 10 H 14 O CH
3
CH
2O C H
3- -
Menthol C 10 H 20 O CH
3C H
3C H
3O H
R 36 Xi
Limonen C 10 H 16 H
3C
CH
2CH
3R10-38-43-50/53 S 24-37-60-61
Xi N Citral C 10 H 16 O
C
H 3 H
CH 3 CH 3 O
R 38-43
S 24/25-37 Xi
Fenchon C 10 H 16 O
CH
3O
CH
3CH
3- -
Citronellal C 10 H 18 O H CH
3O CH
3CH
3R 38-43-51/53 S 37-61
Xi N Geranylacetat C 12 H 20 O 2
C
H
3O CH
3CH
3CH
3O
R 36/37/38-68
S 26-36/37 Xn
Gewürze: Wacholder, Fenchel, Kümmel, Ingwer, Gewürznelken, Zimt, Muskat, Salbei, Majoran, Pfeffer, Rosmarin, Gewürzmischung
Durchführung: Die verschiedenen Gewürze werden zur Vorbereitung gemörsert und
mit Ethanol versetzt, um Extrakte der ätherischen Öle zu erhalten. Die
Extrakte werden in ein Becherglas dekantiert. Zur Vorbereitung des
Auftragens der Proben werden zwei DC-Platten beschriftet. Hierfür
wird mit einem Bleistift und einem Lineal 1 cm vom unteren Rand der
DC-Karte vorsichtig eine Startlinie eingezeichnet. Nun werden die
Positionen der Proben in einem Abstand von 2 cm markiert und die
entsprechenden Namen bzw. Nummern unterhalb der Markierung
geschrieben. Auf eine DC-Karte werden die Vergleichproben mittels
Glaskapillaren vorsichtig auf die Markierungen gesetzt, wobei immer
eine Trocknungszeit zwischen jedem Auftragen von etwa einer Minute
liegen sollte. Mit den Extrakten wir genauso verfahren. Auf jeder Markierung sollten etwa 5 – 6 Tropfen der Probe sein. Die so präparierten Platten werden nacheinander in die Entwicklungskammer gestellt, bis das Fließmittel etwa 1 cm bis zum oberen Rand gelaufen ist. Nach dem Herausnehmen sollte die Höhe des Fließmittels gekennzeichnet werden, um später die Rf-Werte zu bestimmen. Sind die beiden DC-Karten trocken, werden sie anschließend erst mit dem Sprühreagenz I (ethanolische Schwefelsäure-Lösung) und danach mit dem Sprühreagenz II (ethanolische Vanillin-Lösung) besprüht. Die DC- Karten werden im vorgeheizten Trockenschrank etwa 5-10 Minuten bei 80°C getrocknet.
Beobachtung: Die Laufzeit betrug etwa 1,5 Stunden. Auf der DC-Karte war zuerst nichts zu erkennen, auch nachdem die beiden Sprühreagenzien nacheinander aufgesprüht wurden. Nach der fünf-minütigen Trocknung im Trockenschrank wurden die aufgetrennten Stoffe in Form von farbigen Flecken sichtbar.
Abb. 3: Chromatogramm Gewürze Abb. 4: Chromatogramm Vergleichsproben
Entsorgung: Alle entstanden Lösungen werden neutral in den Behälter für
organische Abfälle gegeben. Das Chromatogramm kann entweder zur
Entsorgung in die Feststofftonne gegeben werden oder einlaminiert
aufbewahrt werden.
Ergebnisse: Deutlich ist das in Nelken enthaltene Eugenol zu erkennen. Weiterhin kann das ätherische Öl Limonen im Pfeffer, Fenchel, Kümmel und Muskat nachgewiesen werden. Das im Fenchel enthaltene Fenchon und das im Kümmel enthaltene Carvon lassen sich bei genauerem Hinsehen auch fest machen. Die Rf-Werte können in der folgenden Tabelle verglichen werden.
Gewürz Rf-Wert Nelken 0,58 Pfeffer 0,91 Fenchel 0,3
0,91 Kümmel 0,8
0,91 Muskat 0,9
Tabelle 4: Rf-Werte Gewürze Tabelle 5: Rf-Werte Vergleichproben
Das in der Demonstration Chromatographie vorkommende Vanillin ist ein interessanter Aromastoff, der einer näheren Betrachtung bedarf. In Versuch 3 wird das Vanillin künstlich hergestellt.
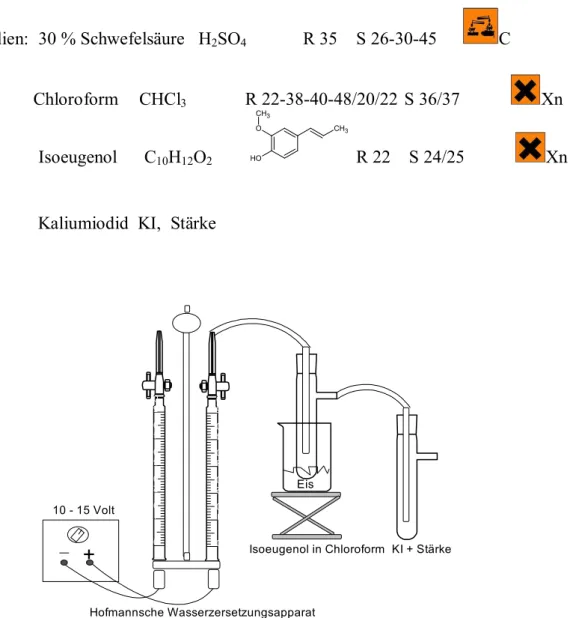
2.2.2 Versuch 3: Vanillin-Darstellung
Vanillin lässt sich durch Ozonolyse von Isoeugenol darstellen. Hierzu wird das Ozon mit dem Hoffmannschen Wasserzersetzungsapparat herzeugt und frisch in eine Isoeugenollösung geleitet.
Materialien: Hoffmannsche Wassersetzungsapparat, Platinelektroden, Verbindungskabel, Spannungsquelle, 2 Saugrohre, PVC-Schläuche mit Schlauchschellen, gebogene Glasrohre, Hebebühne, Becherglas (250 mL), Stativmaterial, Glastrichter
Vergleichsprobe Rf-Wert Eugenol 0,62 Limonen 0,92 Fenchon 0,4
Carvon 0,75
Chemikalien: 30 % Schwefelsäure H 2 SO 4 R 35 S 26-30-45 C
Chloroform CHCl 3 R 22-38-40-48/20/22 S 36/37 Xn Isoeugenol C 10 H 12 O 2
HOO CH3
CH3