Research Collection
Doctoral Thesis
Les Propriétés thermiques de l'ammoniaque et du chlorure de méthyle
Author(s):
Holst, Gilles Publication Date:
1914
Permanent Link:
https://doi.org/10.3929/ethz-a-000104594
Rights / License:
In Copyright - Non-Commercial Use Permitted
This page was generated automatically upon download from the ETH Zurich Research Collection. For more information please consult the Terms of use.
ETH Library
LES PROPRIÉTÉS THERMIQUES DE L'AMMONIAQUE
ET DU CHLORURE DE MÉTHYLE.
Les propriétés thermiques de l'ammoniaque
et du chlorure de méthyle.
THÈSE
approuvée par
l'École Polytechnique Fédérale de Zurich
pour l'obtention du titre de
Docteur es sciences naturelles
présentée par
GILLES HOLST,
de HAARLEM.
1f)1
Rapporteur:
M. le Prof. Dr.P.
Weiss.Co-rapporteur
: M. le Prof. Dr. A. Schweitzkr.1914.
TABLE DES MATIERES
Page.
Intboduction 1
Discussion des mesures faites
précédemment
§
1 Méthode 2§
2.L'équation
d'état . 2§
3. Les mesures surl'ammoniaque
7§
4. Le chlorure deméthyle
. 10§
5 La densité duliquide
.... 11§
6. Lapression
de la vapeur saturée 13§
7. La chaleur devaporisation
19§
8. La chaleurspécifique
duliquide
20§
9. La chaleurspécifique
de la vapeur 21§
10. Résumé . . 21Nouvelles mesures
§
1. Introduction 23§
2. Lapréparation
des gaz 23§
3. Lespiëzomètres
24§
4. Le manomètre 26§
5. Les isothermes 26§
6. La détermination du second coefficient du viriel au-dessousde zéro 30
§
7.Equations
d'état 32§
8. Les tensions de vapeur 36§
9. Formules 38§
10. Volume de la vapeur saturée 40§11.
La chaleur devaporisation
41Bibliographie
44Les discussions et mesures
qui
sontl'objet
de cettethèseformentla
première partie
d'une étudeplus
étendueentreprise
dans lelaboratoire
cryogène
de Leiden: la révision des constantes desgaz facilement
liquéfiables, employés
dans l'industrie.A
plusieurs reprises,
auxcongrès
et dans lespériodiques,
desspécialistes
de l'industrie du froid*),
ont attiré l'attention sur les difficultés causées par l'incertitude de ces constantes.Cette confusion a été
augmentée
encore par legrand
nombrede tableaux
publiés
pour ces gaz, tableaux dont les donnéesnumériques
ont été obtenues par desprocédés
douteux et souventincorrects,
à cause du manque de donnéesexpérimentales.
C'est
pourquoi
M. le Prof. H. Kamerlingh Onnes m'aproposé d'entreprendre
cette étude à la foiscritique
etexpérimentale
surles
propriétés thermodynamiques
del'ammoniaque
et du chlorure deméthyle
Dans la
première partie j'ai
réuni les résultats des observations antérieures d'autresexpérimentateurs.
Jeles aianalysés
etcomparés
entre eux pour établir
quelles
sont les donnéesqui
nousmanquent
encore et
parmi
celles dont nousdisposons, quelles
sont cellesqui
sont contradictoires. La seconde
partie
contient les résultats dequelques
nouvellesexpériences entreprises
pourcombler ceslacunes et pour lever les contradictions.1) Voir e.a. J. C. Bertsch, Z. Eis u. Kàlte Ind. 1913, 139; J. E. Stare, Ice and Kefng. 1912, 125, 352. J. Hybl. Z. Eis und Kàlte Ind. 1913, 120, etc.
PREMIÈRE PARTIE.
Discussion des mesures faites
précédemment.
§
1. Méthode.Les
propriétés thermodynamiques
d'un gazpeuvent
être calculées si on connait sonéquation
d'état et la chaleurspécifique
en unpoint
dechaque
isotherme. Carl'équation
d'état contient sousforme
implicite
lespropriétés
de la vapeur saturée. Elle nouspermet
de calculer la chaleur devaporisation
et la variation dela chaleur
spécifique
sur une isotherme en sortequ'on peut
déduire la chaleurspécifique
duliquide
de celle de la vapeur et inversement. A l'aide del'équation
d'état on peut donc comparer toutes les mesures despropriétés thermiques
etcalorimétriques
dans un
système
cohérent.Quoique
cette méthode soit laplus générale
ce n'est pas celle dont nous nous servirons. D'aborduneéquation
d'étatqui représente
exactement les résultats des
expériences
est forcémentcompliquée
et
puis
le calcul desgrandeurs
saturées offredesdifficultés numéri¬ques
énormes;
c'est pourcela,
que nous allons d'unepart.établir
une
équation plus simple qui représente
l'état gazeux aussi bien quepossible,
et de l'autre étudierséparément
lespressions
dela vapeur
saturée,
la densité duliquide
et leschaleursspécifiques
du gaz et du
liquide *).
§
2.L'équation
d'état.Jusqu'à présent
aucunedeséquations
d'étatfondées
surdes théories du mécanisme intérieur des gaz, n'apureprésenter
les observationsassez bien pour
qu'elle
soit utilisable pour les calculsnumériques.
!) Depuis lecommencement de cette étudeunerechercheanalogueaétépubliée par 6. A. Goodenough et W. M. EarlMosherUniv ofIllinoisBull.n°.66,1913.
Mais
quand
ils'agit
dedifférentiations,
il est nécessaire d'avoir desexpressions analytiques
pour les résultats desexpériences
Faute de mieux on est forcé de se contenter de formules
empiri¬
ques. M. H. Kamerlingh Onnes a fait une étude très détaillée de la forme d'une telle
équation.
Il a trouvé queles observationssur
l'hydrogène, l'oxygène, l'azote,
l'éther etl'isopentane peuvent
êtrereprésentées
par unpolynôme
de la forme:=t 1+i
v
a Kfi
t.4 -¥+*%\ (i)
ou p,v et t sont la
pression réduite,
le volume réduitetlatempé¬
rature
réduite,
Kk
=BTk
Pk vk
(2)
ou R est la constante des gaz,
Tk,
pk, vk latempérature critique absolue,
lapression
et le volumecritiques
d'unemolécule-gramme.
Les coefficients
3B, C, 3D,
etiF, appelés
coefficients duviriel,
sont des fonctions de la
température
de la forme:B=
bj
+-j- ?»
t2 j_"^h.
f4 _u~l_bA
t»(3)
La constante
K^
a été introduite pour éliminer le volumecritique
de laformule,
parcequ'
unedétermination directeetprécise
de cette
grandeur
n'estguère possible.
Les valeurs des coefficients pour un gaz
fictif, qui
secomporte
comme la moyenne des
cinq
gazcités,
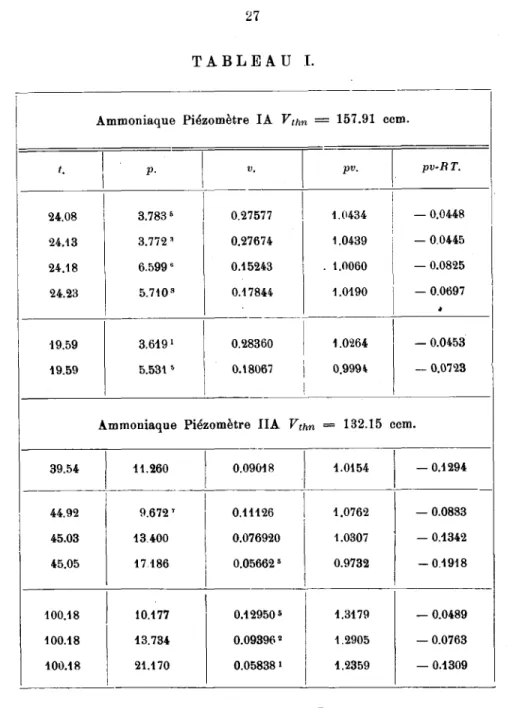
sontréuniesdans letableau I.TABLEAU I.
1 2 3 4 5
lu8 b 117,796 — 228,038 — 172,891 — 72,765 — 3,1718 10* i 135,580 — 135,788 295,908 160,949 51,1090 lu5 b 66,0235 — 19,9678 — 137,1572 55,8508 — 27,1218
•10' t — 179,9908 648,5830 — 490,6830 97,9402 4,58195 10» f 142,3482 — 547,2487 508,5362 — 127,7356 12,21046
Ces nombres ont été obtenus par le
procédé
suivant. On acalculé d'abord les
coefficients du
virielréduits
pourchaque
isotherme
expérimentale
de chacun de ces gaz,puis
on a calculédes formules
représentant
ces coefficients en fonction de latempérature
réduite.Comme cette
équation
est la moyenne pourcinq
gaz etrepré¬
sente très bien leurs
propriétés,
il estprobable qu'elle peut donner,
entre les limites de validité de la loi des états
correspondants,
une bonne
approximation
pourl'ammoniaque
et le chlorure deméthyle.
Voici une liste des valeurs
numériques
des coefficients du virielen
quelques points
de larégion
destempératures
réduitesqui
nous intéresse:
TABLEAU
II.t , <£ ai 0 £
0,500 —
2,397079
0,689378 —0,01364720,0,101473
—0,0618030
0,525 — 2,053138 0,551001 —0,01029740,0478318
—0,0615326
0,550 — 1,778132 0,447215 —0,0,793153 0,0461300
—0,0612634
0,575 — 1,5551300,368093
—0,0,623051 0,0448661
—0,0610197 0,600
— 1,371963 0,306858 —0,0,498617 0,0439189
—0,078104
0,650 — 1,091983 0,218584 —0,0,336067 0,0426587
—0,0,4961
0,700 — 0,890831 0,165025 —0,0,240330 0,0419203
—0,0,2982
0,800 —0,627141
0,101610 —0,0,140352 0,0412064
—0,0,1239 0,900
—0,465897
0,069150 —0,0,91400 0,059278
—0,08959 1,000
—0,359070 0,050776
—0,0,62372 0,068043
—0,071189
1,100 — 0,283885 0,039547 —0,0,42644 0,057359
—0,071523
1,200 — 0,228452 0,032265 —0,0,28013 0,0,6852
—0,0,1805
Pour discuter les
propriétés
d'un gazquelconque
à l'aide del'équation (1)
il faut connaître sesgrandeurs critiques.
Les résultats de
quelques
déterminations dupoint critique
setrouvent dans le tableau III. La
pression
pk estexprimée
enatmosphères
internationales de 76cm.demercure, latempérature
tken
degrés centigrades.
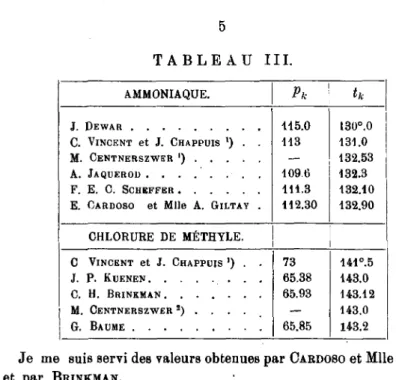
TABLEAU III.
AMMONIAQUE.
Pk
'h
115.0 113
1096 111.3 112.30
130°.0 131.0 132.53 132.3 132.10 132.90 C. Vincent et J. Chappuis ') . .
F. E. C. Schbffer
E. Cardoso et Mlle A. Giltay .
CHLORURE DE MÉTHYLE.
C Vincent et J. Chappuis') . .
M. Centnerszwers) . . ...
73 65.38 65.93
65.85
141°.5 143.0 143.12 143.0 143.2
Je me suis servides valeurs obtenues parCardosoetMlle Giltay et par Brinkman.
Ammoniaque: tk
= 132°.90 C.(405°.99 abs.) pk
= 112.30atm.Chlorurede
méthyle: tk=
143°.12 C.(416.21°abs.)pk=
65.93atm.J'ai dit
plus
hautquenous nousproposions
dereprésenter
paruneéquation
lespropriétés
de l'état gazeuxseulement, j'ajoute
iciuneseconde restriction: nous ne chercheronsla
représentation
quepour larégion
depressions
et detempératures employées généralement
dans l'industrie c. a.d. des
températures
entre —40° C. et 100°C,
des
pressions
au dessous de 30atmosphères
pourl'ammoniaque
etde 20
atmosphères
pour le chlorure deméthyle.
Alora notre
équation
sesimplifie
énormément. S'ils'agit
depressions
inférieures auxpressions
dites onpeut négliger
lestermes en
D,
<f et £ de sorte quel'équation
devient:_ = t
|
! +,__» +,_*_!.
p v et t sont
toujours exprimés
engrandeurs
réduites. Il seraavantageux d'introduire
de nouvellesunités, l'atmosphère,
ledegré centigrade
et le volume normalthéorique,
c'est le volume que le gazoccuperait
à 0° C. et sous uneatmosphère,
si àpartir
del'état gazeux
parfait
il obéissait à la loi de Mariotte.Cette unité a le
grand avantage
de contenir le même nombre de molécules pour tous les gaz. Le volume normalthéorique
dela
molécule-gramme
esttoujours 22,412
litres.pv=
BT\\
+- -r- -1»2i'
38
ph
E=1
Pk 273.09
B
Si nos deux gaz se
comportaient
conformément àl'équation
moyenne, les valeurs de B et C aux différentes
températures
seraient:
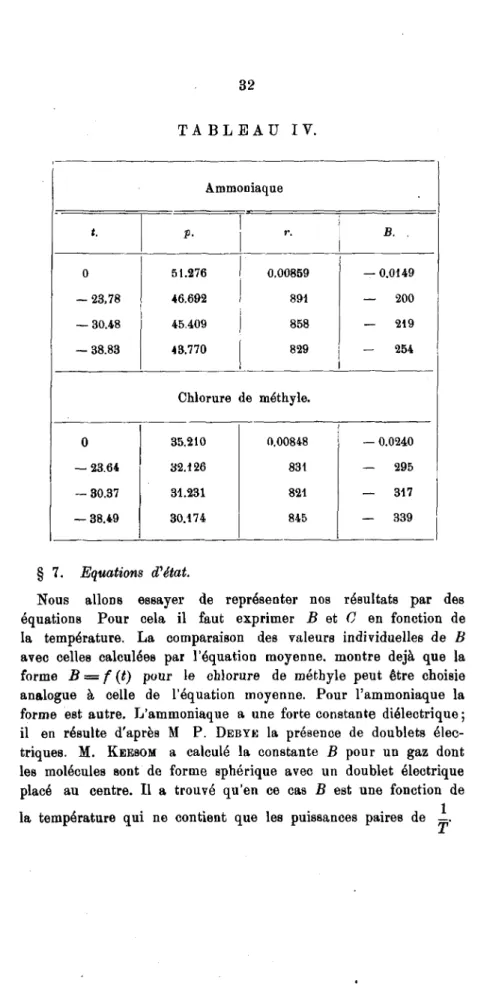
TABLEAU IV.
t B . 10* C . 106 B . 104 C 106
NH3 NH„ CH3C). CH3Cl.
—40°C — 207 65.0 — 388 220
—30 — 183 54.4 — 344 185
-20 — 464 46.3 — 305 175
—10 — 147 38.9 - 273 132
0 — 132 33.5 — 247 112
10 — 119 29.3 — 224 98,2
20 — 109 25.8 ' - 203 86,5
30 — 100 23.0 - 185 76,4
40 — 91 20.4 — 170 67,8
60 — 78 16.3 — 144 54,0
80 — 67 13.5 — 125 44,3
100 — 58 11.4 — 109 37,4
Pour la vapeur saturée de
l'ammoniaque
le terme —y serait environ0,4 %
à 40°C, 0,07 %
à 0° C. et0,004 %
à —40° C.Pour le chlorure de
méthyle
ce terme serait environ une fois et demieplus grande.
Pour discuter les mesures
qui
serapportent
àl'équation d'état, j'ai
admisqu'une équation
de la forme Apuisse représenter
cesmesures et
j'ai
calculé B et C en fonction de latempérature.
Les calculs se
simplifient
souventbeaucoup quand
on écritl'équation
d'état sous une autre forme:Vv=BT l
+ TTB {B T) •y
2 B3—{B T)3
3 BCp°
'
pv
7>p
~
RT +
(2dT)2
*'D.
Il ne faut pas oublier que le terme du troisième
degré
n'entrepas dans la
représentation pv=f(
—).
Il n'en est
plus
ainsi dansl'équation
pv =f (p).
Dans larégion
de
pressions
danslaquelle
unefonctiondu seconddegré
pv=f (
— Ipeut représenter
lesobservations,
il fautprendre
uneéquation
dutroisième
degré
de la forme pv=f (p).
D'après l'équation
moyenne le terme enp3
seraitégal
à0,25 %
de pv à
40° C,
1% à
60°0.
et 2%
à80° C
, pour la vapeurd'ammoniaque
saturée. Il faut doncpréférer
lareprésentation
pv=
f (ir)à Pv=f (p)-
§
3. Les mesures surl'ammoniaque.
Dans leur mémoire sur la détermination du
poids atomique
dequelques
corps M.M. Ph. A. Guye et A.Pistza
donnent les résultats de leurs mesures dupoids
du litre normald'ammoniaque.
Ils se servaient de la méthode du ballon et ils trouvaient
0,7708
gr. Cette valeur aétéconfirmée
remarquablement
par les recherches de E. P. Perman et J. H. Daviesqui
trouvaient comme valeurmoyenne de leurs
expériences 0,77085
gr. le litre.A.
Jaquerod
et O. Scheuer ont déterminé lacompressibilité
à 0°. La formule D nous
permet
de déduire la valeur de B de 1 ———, si l'onprend
enpremière approximation
la valeur dePo^o
C de
l'équation
moyenne. On trouve B=—0,0149
et il en résulte1,3172
litre pour le volumenormalthéorique
d'un gramme.Cette valeur diffère de
0,1 %
du chiffre1,3160
déduit despoids atomiques.
Dans la secondepartie j'ai poursuivi qualitative¬
ment la cause de cette différence mais
je
n'ai pas réussi à lacorriger quantitativement.
Seulement la valeur1,3172
est enmeilleur accord avec les
pesées
du ballon de Perman et Daviesà
quelques
autrestempératures.
Dans le tableau V la troisièmecolonne
contient les
valeurs de Bcalculées
avec la valeur1,3172,
la
quatrième
avec1,3160.
Les résultats de mesures à 50° et100° 0. m'ont conduit à donner la
préférence
à la valeur1,3172.
TABLEAU V.
t Litre par gramme B B'
— 20° C.
1,19575
— 0,0186 — 0.017750
1,5473
— 0083 — 0073100
1,7964
— 0024 — 0010On a encore déterminé la
compressibilité
àquelques tempéra¬
tures
plus
élevées. Tous ces déterminationssaufcelle deRegnatjltse-
placent
fort bien sur une courbe continue.TABLEAU VI.
t B
V. Regnault
')....
8M —0,0197
16° —0,0122
Lord Rayleigh .... 10.3 —0,0132
— 9.2 —
0,0128
— 9.6 —
0,0128
— 9.8 —
0,0125
A. Jaquebod et 1 . . . 0. SCHEUER .) . . .
11.91 —0.0128
15.71 —0,0124
Une autre série de valeurs de B
peut
être déduite desmesures du coefficient de
compressibilité
del'ammoniaque
dePerman et Davies.
t B
— 20
—0,0225
20 - 0101
40 — 0082
60 — 0064
80 - 0059
98.1 — 0045
Ces
valeurs necorrespondent
pas très bien avec celles obtenues par la méthode du ballon(tableau V).
Mais ces mesures sousfaibles
pressions
ne sont pas trèsappropriées
à la détermination deB.
Dans lafigure
I sontreprésentées
les valeurs individuelles de B calculéesd'après
lesexpériences
et la courbe B=f (f) d'après l'équation
d'état moyenne. Elle contient encore deuxpoints
£=
—0,0105
à29°,5
C. et B=-0,0039
à99°.6
C. déduites desisothermes
de F. Roth.B
OOtQ
mWO FIG I
O O/S
o\»o
•*
B ME B IN0
IN REDUGEDl IVlDUAt. AMM{
IUATI0N MA
00!0 -oA.
O OOS
°od ^
3*23~~~~~^
-50 -25 O 25 50 75
^ a
»*- PO
roo t
M.
C.
Dieterici et H. Drewes ontdéterminé
le volumespéci¬
fique
de la vapeur saturée entre 0 et 100° C.Aux
pressions
inférieures à 40 atm. onpourrait
utiliser leursmesures pour calculer C à l'aide de la valeur de B de lacourbe par les
points
des autres observateurs. Maismalheureusement
aux
températures
au dessus de 20° C B n'est pas connu assez exactement.Il en résulte la nécessité de la détermination de
quelques
isothermes pour calculer B et C. On voit
qu'aux températures
audessous de zéro une détermination de B
suffira,
C nejouant
qu'un
rôle secondaire.§
4. Le chlorure deméthyle.
Au dessus de 70° C. on
possède
deux sériescomplètes
d'isother¬mes déterminées par J. P. Kuenen et C. H. Brinkman. Une étude
comparative
des résultats de ces deuxphysiciens
montreque le chlorure deméthyle
étudiépar Brinkman étaitpresqu'
absolumentpur; d'autre
part
il y a desirrégularités
dans les valeurs de pv deBrinkman, qui
ne se trouvent pas chez Kuenen. Dans le tableau suivant sont contenues les valeursapproximatives
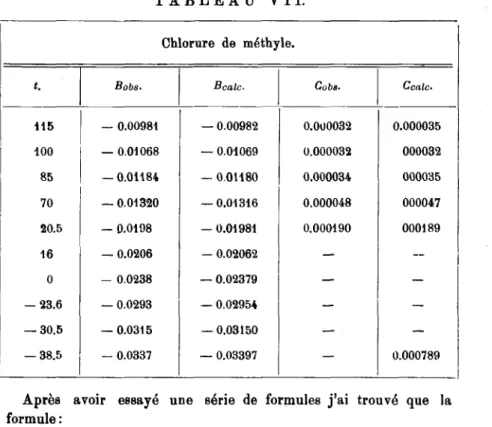
de B déduites de leurs isothermesTABLEAU VIL
t
BB BK
70° O —0,0116 —0,0131
85 —0,0110 —0,0121 100 —0,0102 —
0,0110
115 —
0,0094
—0,0098
On
peut
remarquerqu'il
y a une différencesystématique
entreles deux séries
A.
Leduc,
H. KamerlinghOnnesetC.Zakrzewski,
G.Baume,
ont déterminé la
compressibilifé
à 16°C,
20° C et 0°C. resp.TABLEAU VIII.
t B
Leduc K. O. and Z
16° C.
20 0
—0,0206
—0,0185
—0,0212
Les résultats de Kamerlingh Onnes et Zakrzewski concor¬
dent avec ceux de
Brinkman,
tandis que lepoint
obtenu par Leduc se trouve sur lacourbe, qui
passe par lespoints
deKuenen.
Baume a trouvé pour le
poids
du litrenormal2,3045
grammes.Le volume
théorique
normal d'un gramme calculé àpartir
desobservations de Baume est
égal à 0,44353 Litres,
tandisqu'on
tire
0,44393
despoids atomiques.
B.
FI G II
003
\
B ME 3 IM
(N «EOuCED E(
IVIDUAL METHr UATION
CtuORiDt
O Oî b"' ^^V*é
OOt
K(i~Z~-4.
~
~-^>
Br --a-^
-£~- X.
-SO 23 O 25 SO 75 roo C
Il sera donc nécessaire de faire
quelques
nouvellesdéterminations pour décider entre les deux sériesdiscordantesetquelques
mesuresaux
températures
au dessous de zéro.§
5. La densité duliquide.
L. Caillbtbt et E. Mathias ont
développé
une excellenteméthode pour discuter la densité du
liquide
sous lapression
dela vapeur saturée.
Quand
on trace une courbequi représente
ladensité du
liquide
et de la vapeur saturée en fonction de latempérature,
on voit que les moyennes de cesdensitésenfonction de latempérature
se trouvent très sensiblement sur unedroite, qui
passe par lepoint critique.
Dans le
diagramme
réduit une seule courbereprésenterait
lesfaits si la loi des états
correspondants s'appliquait
d'une manièrerigoureuse.
En réalité on obtient une série de courbes
qui
s'emboîtent nettement les unes dans les autres.Nous allons
comparer
les courbes pourl'ammoniaque
et lechlorure de
méthyle
avec celles de W. Ramsay et S. Youhgpour l'éther et de Young pour
l'isopentane.
La densité
critique
del'ammoniaque peut
être calculéeenpartant
des mesures de C. Dieterici et H.
Drewes, qui
ont déterminéi p.
15
•'*'^— ^^"
^r
>»
figue
i.y
. AMMON I
+ MtrHÏL A :hlorioe
f
«&£^^^
ï^è^^^
\
10 09 08
T T.
les densités du
liquide
et de la vapeur àquelques températures
entre 0° et 100° C. On en déduit par la méthode du diamètre
rectiligne
loK=0,2â8.
Pour le chlorure de
méthyle
Brinkman trouve par la méthode du diamètrepK=0,353.
M. Centnerszwer indique
pK=0,370,
tandis que la détermination directe de Kuenen donne une valeurapproximative
p#=0,345.
J'ai
dessiné lediagramme
des diamètres réduits en me servant des observations de C. Dieterioi et A. Lange pourl'ammoniaque,
de
Kuenen,
Brinkman et C. Vincent et Delachanal pour le chlorure deméthyle.
Lesmesuresdesdifférents
expérimentateurs
concordentassez bien.On
enpeut
déduire sanspeine
les valeurs de la densité duliquide
entre + 40° et —40° C.Dans la seconde
partie je
donne les densités duliquide
inter¬polées
etextrapolées graphiquement
à l'aide de cette courbeLes valeurs sont
probablement
exactes à 1% près,
desortequ'une
nouvelle détermination
peut
être considérée commesuperflue.
§
6. Lapression
de la vapeur saturée.Pour discuter les différentes observations sur la tension de la vapeur le
diagramme log
p=f ( -=-1
esttrès commode. Lacourbe est enpremière approximation
une droitequi
passe par lepoint critique
:ou
f
est une constante.Calculant sur la base des observations deRegnaultla
grandeur f
pour ladroite, qui
passe par lepoint critique
et0° C.on obtient:pour
l'ammoniaque f
=2,9284
pour le chlorure de
méthyle f
=2,7124
Dans le tableau IX on trouve les résultats des observations de V.
Regnault,
A.Blumcke,
0. Brill et J. H. Davies surl'ammoniaque.
Les nombres donnés par R.Pictetsont
probablement empruntés
à Regnault et non pas le résultat d'une nouvelle détermination.
On voit
qu'il
y a un écartsystématique
entre les deux sériesd'observations de Regnault aux
températures
au dessus de zéro.Dans la
première
série il se servait d'un manomètreouvert,
dans la seconde d'un manomètre fermé à aircomprimé.
Les déter¬minations de Blûhcke concordent très bien avec les résultats des
mesures de
Regnault
avec le manomètre terme.M
1-1«i
m
EH
:alc.
»< ^-4^<m(Mt-Oicoeo00mot-mCO•r*O05CDCO*O•*Oî00coo>^in«*COr~O1—oco*COt-COCOr~inmCOCDmin*tho1co^co•*•a^Ol>*CMco1Oo.oOoO-*OoooooooooOOo1
oooooCM—CMCMCM(M1
C5o'o"oo'Ooo"o'ooo"o'oo'o'o'o"o'o'o'O-oo"o'©Oo'oOo'o'42Oa,
+ 1 1 1 1 1 1 + 1 1 1 1 1 1 1 1 1 1 1 1 + + + + + + + + + + +
.2ai
't*
va)00O0000l>t^«o*""coSérCiCOa^mo0000oin*oo00CMmoT*T->mmC--in
CMt^00o«*•*t-oI>"*v*00i^oo«*incoCMCMCMo0000ot^00t~t*00CM
cd
a, oscmo_^(MmCD00oT^^^»
co.00r->l>oo0000e><M«**•*t^cor-
00_>rtt-iooCO -*cm"cmcm'oàai«jm'a;
<n"CMaiai«*«*inm'ininCDCDt>«"oôoôoiCM
mi CO
CDtuEMOQ
H
1
J^4r-inmotr~00CD
B
co<#COinot-t^00**o>ooCOor~CD«*o»coOCMoa>oCMt»
Omes ocm*oOan^"o00t^(M<Mco-*enO00oCM«*CM(Ni*coCMt^CMœoaijaCMo^-^-,m«Or^O<
t-;o_o_COCOCOcoœCBr~>00CMCM«*inmt-coOo«*min
a,•«*<MCMcmaisi*m'cmci>**'ininiriirico"t-'00*OÔoo'oCM
1coo:00awr~>CMCDt^00COr~T"*or-metCMIIcoCM>*inCMCMmo>como1o!>•lOoœt^OCO"*.CO•*l>CDcoco«*w
1
lgesC0#co.•**.mthCMCMcoc^
•o'00coCD-co'cmco'*'O*J^-'l>t-^oiai00oôo'oo'o'COr»t^*oo^^co'OÔesOSiriCM
-*^*^*•**^*COCOcoa*CM<NCM^-<^h^->T*^t^*t-"•^CM00
1 1 1 1 1 + + 1 1 1 1 1 1 1 T 1 1 1 +
t. Pobs. • ^calc. i'obs. ^calc.
Regnault. — Troisième Série. Manomètre ouvert.
—25.70 1.471 1.490 —0.019
—25.84 1.443 1.480 —0.037
—23.92 1.562 1.612 —0.050
—18.31 1.999 2.053 —0.054
—18.10 2.013 2.071 -0.058
— 16.17 2.197 2.245 —0.048
—13.15 2.458 2.541 —0.083
—13.55 2.447 2.500 —0.053
— 9.21 2.924 2.974 —0.050
— 5.03 3.421 3.496 —0.075
— 0.10 4.157 4.204 —0.047
+ 6.24 5.216 5.279 ~0.063
Kegnaxjlt. — Troisième Série. Manomètre fermé.
9.98 5.987 6.009 —0.022
14.38 6.976 6.967 +0.009
19.70 8.313 8.283 +0.030
30.49 11.583 11.548 +0.035
38.90 14.784 14.726 +0.059
48.93 19.303 19.353 —0.050
55.47 22.808 22.922 —0.114
64.35 28.447 28.541 —0.094
73 32 35.218 35.211 +0.007
81.72 42.330 42.456 —0.126
BlÛMCKE.
—18.5 1.91 2.04 —0.13
0 4.22 4.22 0.
34.0 12.80 12.80 0.
63.5 28.04 27.96 +0.08
Brill.
—50.7 0.407 0.429 —0.022
—46.2 0.531 0.548 —0.017
—45.0 0.575 0.584 —0.009
—41.5 0.687 0.700 —0.013
—39.8 0.748 0.763 —0.015
—38.2 0.803 0.827 —0.024
—33.0 1001 1.064 —0.063
Davies.
—49.8 0.392 0.451 —0.059
—41.0 0.699 0.718 —0.019
—30.0 1.141 1.225 —0.084
—20.0 1.833 1.911 —0.078
—15.0 2.271 2.356 —0085
—10.0 2.824 2.883 —0.059
— 5.0
*
3.443 3.500 —0.057
Au dessous de 0° C. il y a de nouveau une
petite
différencesystématique
entre les observations de Regnault etDavies
etencore entre celles de Davies et Brill.
LOG P
O 6
/
01
FIG N
02
0
/
Z
fi 98
/ .'
•96
REGNAUL OAVies BBILL
r
0.004 S 0.0043 0.0041 0 0039 0 0037 .T
La différence entre Regnault et Davies
peut
êtreexpliquée
par une erreur de
0,2°
C. sur latempérature.
La
figure
IVreprésente log
p en fonction de -= au dessous de 0° C.On voit
qu'il
sera nécessaire de fairequelques
mesures danscette
région
destempératures
à fin de choisir entre les résultats.Aux
températures plus
élevées il fallait déterminer la tension de la vapeur enquelques points
pour décider entre les deux séries de Regnault.V.
Regnault,
C. Vincent etChappuis,
J. P.Kuenen,
C. H.Brinkman, Ch.
M. A.Hartman,
H. Kamerlingh Onnes et C. Zakrzewski ont fait des déterminations delapression
maximalede la vapeur du chlorure de
méthyle.
Les résultats de leursobservations et leurs différences avec les valeurs calculées
d'après
la formule de van der Waals sont
consignés
au tableau X.TABLEAUX X
t Pohs. Pcalc. _Pcalc. ^obs.
Vincent
etChappuis.
35 7.50 7.37 —013
40 8.75 8.43 —0.32
50 11.20 10.91 —0.31
60 14.30 13.88 —0.42
70 17.87 17.42 —0.45
80 22.15 21.60 —055
90 27.65 2646 —1.19
100 33.90 3205 —1.85
110 41.00 38.44 —2.56
120 49.80 4567 —4.13
130 61.00 53.82 —7.18
135 65.00 58.26 —674
140 70.60 62.91 —7.69
141 72.00 63.90 —8.10
1 1
H*.t-à-*a-iJ*k^> cote00(^to00œ03O00~4-JutinOO'to*toO*•ootO *•oOtAotototo00too^t^ OtetoO'otteo>teenteM s
tS w t-1osW*•03kAwIf*wte•-^ tsoOtOo»wh^^tes» OttO 00OS*»eno»**•i^*-*»00 taZOtrioO!oto01^a*•to*O
taw
>w
BritaXiQa es 00aw- CB>> taa SiCTt03teNJ»Ht*»03to^.oot»-03coto03^j*•to*-3 OttoW*00tOoto#•«ttoOo* *^toOt03Ooo*-oOJto-JZEW8KI 1 1 i + + + + + + + + + + ooO*A.-^•^N^o^>oo-A.o ooote*..*•~-l00CO~-la>Otoo*tototeot^0503ooto
cecotot-^H^>1 1 1 1 1 1
te1
to1
101
te1
*»o03OSO*o*•oo»**•tot-^to#O)to 00otOw~aOtI03oH*.eOt~atono~.tVJo0303to00O)1
toteteto00Ot#^jo ~4O»Ot*03tetote^^N*oo©^
*•Oïtetoo>to*H^r»Oï*.AOote00"-aO OSOttenoOii^-toteenen*jce00OSOt~Jtooi-*00tote00*•»4O'to00*03^03 m 0 d tri H ^osOt*»03toteteoOo"« 03enteeuOtto*»t.^00en*»teooto00*Jteo03onotetoco-Jen*Joto*»en0000Oto^100en00otco00—3^O"co*00te "8 ta 1 1 + + 1 1 1 + + + 1 ++++++
aie ooOoooooooOooooooI
1-^1-^Ooor>Ioooooooooo •J.t^Ottetete1
esoo^H^ *>*.o»oOS*OSOSte03*^oOSOt**O
À l'exception
des résultats obtenus par VincentetChappuis la concordance est satisfaisante.Malheureusement Regnaultseservait d'un thermomètre à mercuredontil n'avait déterminéles correctionsqu'aux températures supérieures
à 100° C. Cette correctionpeut
atteindre à
0,3°
à —30° C. Mais elle est très incertaine. J'aidoncpréféré
fairequelques
nouvelles déterminations que l'on trouvera dans la secondepartie.
§
7. La chaleur devaporisation.
Dans son mémoire de 1871 sauvé des ruines desonlaboratoire Regnault a
publié
les résultats de 12déterminations de la chaleur devaporisation
del'ammoniaque.
Il ne donne pas cettegrandeur
elle même mais une
quantité
dont onpeut
la tirerquand
onconnait la chaleur
spécifique
duliquide.
Maintenant que Dietericia déterminé cette dernière
quantité
onpeut
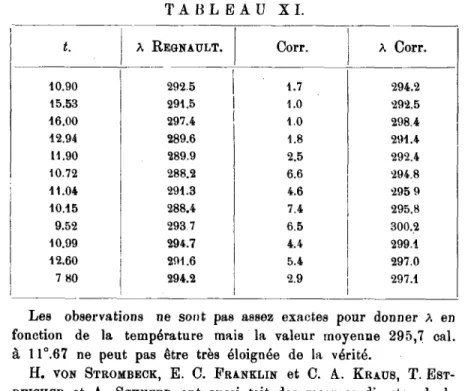
utiliser les résultats de Regnault.TABLEAU XL
t. A Regnault. Corr. A
Corr.
10.90 292.5 1.7 294.2
15.53 291.5 1.0 292.5
16.00 297.4 1.0 298.4
12.94 289.6 1.8 291.4
11.90 289.9 2.5 292.4
10.72 288.2 6.6 294.8
11.04 291.3 4.6 2959
10.15 288.4 7.4 295.8
9.52 2937 6.5 300.2
10.99 294.7 4.4 299.1
12.60 291.6 5.4 297.0
780 294.2 2.9 297.1
Les observations ne sont pas assez exactes pour donner A en fonction de la
température
mais la valeur moyenne295,7
cal.à 11°.67 ne
peut
pas être trèséloignée
de la vérité.H.
vonStrombeck,
E. C. Franklin et C. A.Kraus,
T. Est-rbicher et A. Schnerr ont aussi lait des mesures directes de la chaleur de
vaporisation.
TABLEAU XII.
t. X
17.°C. 296.5
Franklin et Kraus . . .
—33°.4 341 ESTREICHER et SCHNERR . .
—33°.4 321.3
D'autres auteurs ont calculé la chaleur de
vaporisation
à l'aidede la formule de Clapeyron. Nous
procéderons
de la mêmemanière.On trouvera les résultats de ces calculs dans la seconde
partie.
Une
seule détermination directe de la chaleur devaporisation
du chlorure de
méthyle
à 0° C. a été faite par J. Chappuis aumoyen du calorimètre de Bunsen. Il a trouvé A =96.9 cal.
Nous calculerons cette
grandeur
àpartir
de nos observations.§
8. La chaleurspécifique
duliquide.
Une étude
systématique
de la chaleurspécifique
del'ammoniaque liquide
enfonctionde latempérature
aétéentreprise
parC.
Dieterici et H. Drewes. Entre 0° et 70° leurs résultatsexpérimentaux peuvent
sereprésenter
parl'équation
:d
=1,118 +
0.00208 *C. Ludeking et J. E.
Starr,
L. A. Elleau et W. D. Ennistrouvaient des valeurs
plus petites
tandis que les observations de H. v. Strombeck concordent très bien avec celles de Dieterici.TABLEAU XIII.
t. C.
Ludekinget Starr .... 0—16 0.878
26—46 0.894
Elleau et Ennis .... 10 1.021
v. Strombeck ... . . 33- 62 1.229
Au dessous de 0°C. les observations font défaut de sorte
qu'il
est nécessaire
d'y
fairequelques
mesures.Pour le chlorure de
méthyle,
la chaleurspécifique
duliquide
n'a pas encore été mesurée.
§
9. Chaleurspécifique
de la vapeurW. Nernst a discuté récemment les mesures de la chaleur
spécifique
du gazammoniaque
La formule suivante contient les résultatsdesespropresmesures combinées avec celles de
Voller,
F.Keutel,
V". Regnault et E. Wiedemann:C°p
=0,506
+0,000117
+0,423^.
La
plus grande
différence entre les valeurs observées et cal¬culées est inférieure à 3
%.
Dans la thèse de Keutel on trouve encore une discussion des
mesures antérieures de A.
Cazin,
A. Wullner et P. A. Muller.Les résultats de Wullner s'accordent très bien avec la formule de Nernst.
On
.peut
déduire encore la chaleurspécifique
des mesures deWobsa sur l'effet Joule-Kelvin. Je me propose de revenir sur
ces mesures dans la seconde
partie.
P. A. Muller et J. W. Capstick ont mesuré le
rapport
deschaleurs
spécifiques
du chlorure deméthyle.
Muller k = 1.199 Capstick k= 1.219.
La valeur de Capstick est
préférable
à l'autre(Voir Keutel).
Il estdonc nécessaire de faire une détermination de la chaleur
spécifique
en fonction de latempérature.
§
10. Résumé.Cette étude
critique
nous a donc démontré la nécessité d'unesérie de mesures nouvelles
ayant
trait auxpoints
suivants.Pour
l'ammoniaque:
1.




![TABLEAU II. Ammoniaque. t B. C. 19.6 — 0.01163 — 0.000100 24.1 — 0.01110 — 0 000064 39.5 — 0.00953 - 0.000057 [45.0] [— 0.00752] [— 0.000102] 100.2 — 0.00468 — 0.000053](https://thumb-eu.123doks.com/thumbv2/1library_info/5302935.1678016/34.648.59.549.87.713/tableau-ii-ammoniaque-t-b-c.webp)