EXPERIMENTALVORTRAG ORGANIK
Monika Preis SS 2007
Leitung: Dr. P. Reiß, Prof. Dr. Neumüller
VON ASPIRIN BIS
SCHLEIMLÖSER
Abb. 1 Aspiringefäß 1 Abb. 2 Braustablette in Wasser 2
Inhaltsverzeichnis
1 Arzneimittel 1
1.1 Definition Arzneimittel 1
Demonstration 1 Apothekenschauglas 2
2 Herstellung von Arzneimitteln 5
2.1 Von der Weidenrinde zum modernen Arzneimittel 5
2.2 Technische Synthese von Acetylsalicylsäure 7
Versuch 1Herstellung von ASS 8
2.3 Wirkung von ASS im Körper 11
3 Analyse von Arzneistoffen 13
3.1 Vitamin C / L-Ascorbinsäure 13
3.2 Wirkung von Ascorbinsäure 14
Versuch 2 Nachweis von Vit. C 16
4 Wirkung von Arzneistoffen 19
4.1 Penicillin und ß-Lactam Antibiotika 19
4.2 Wirkmechanismus von Penicillin 24
Demonstration 2 Hemmung durch Penicillin 26
4.3 Galle und ihre Gallensäuren 28
4.4 Wirkung von Gallensäuren 33
Versuch 3 Wirkung von Gallensalzen 34
4.5 Wirkung von ACC 36
Versuch 4 Wirkung von ACC akut 37
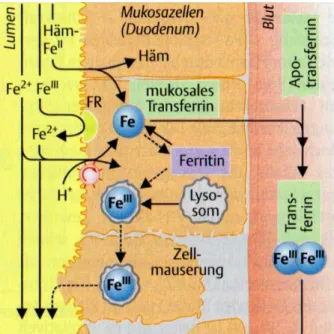
5 Wechselwirkung zwischen Eisen & Tee 40
Versuch 5 Eisen und Tee- Wechselwirkung 43
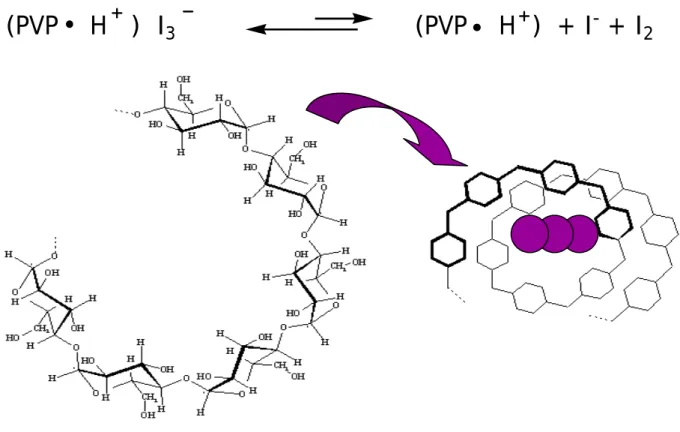
6 Darreichungsformen 46
6.1 Antiseptika 46
6.2 Wirkungsweise von Povidon Iod 48
Demonstration 3 Verzögerte Freisetzung von Iod 49
7 Arzneistoffe- ein Thema für den Chemieunterricht 51
7.1 Themenkomplex Arzneimittel 51
7.2 Lehrplanbezug 53
8 Literaturvereichnis 53
9 Abbildungsverzeichnis 55
1 Arzneimittel
1.1 Definition Arzneimittel
Nach dem Arzneimittelgesetz von 1978 (§ 2, Abs. 1) sind Arzneimittel Stoffe und Zubereitungen aus Stoffen, die dazu bestimmt sind, durch Anwendung am oder im menschlichen Körper
1. Krankheiten, Leiden, Körperschäden oder krankhafte Beschwerden zu heilen zu lindern, zu verhüten oder zu erkennen,
2. die Beschaffenheit, den Zustand oder die Funktion des Körpers oder seelische Zustände erkennen zu lassen,
3. vom menschlichen oder tierischen Körper erzeugte Wirkstoffe oder Körperflüssigkeiten ersetzen,
4. Krankheitserreger, Parasiten oder körperfremde Stoffe abzuwehren, zu beseitigen oder unschädlich zu machen oder
5. die Beschaffenheit, den Zustand der die Funktion des Körpers oder seelische Zustände zu beeinflussen.
Als Stoffe, die zur Herstellung von Arzneimittel herangezogen werden dürfen, gelten nach Arzneimittelgesetz § 3
• chemische Elemente und Verbindungen und deren natürlich vorkommenden Gemische und Lösungen;
• Pflanzen, Pflanzenteile und Pflanzenbestandteile in unbearbeitetem oder bearbeitetem Zustand;
• Tiere, Tierkörper, Körperteile, Körperbestandteile und Stoffwechselprodukte von Mensch und Tier in bearbeitetem oder unbearbeitetem Zustand;
• Mikroorganismen und Viren sowie deren Bestandteile und Stoffwechselprodukte.
Schon immer haben Menschen Produkte der belebten und unbelebten Natur als Arzneien zur Behandlung von Krankheiten genutzt.
Demonstration 1
Apothekenschauglas
Geräte: Glasgefäß 1000 mL
Chemikalien: von den Flüssigleiten je 100 mL Trichlormethan
Glycerin
Rizinusöl + SudanIII (1 Spatelspize) EtOH/ H2O-Gemisch Dichte: 0,935 g/cm3 Lebertran
Methanol + Methylenblau in EtOH ( 1mL)
Leichbenzin z.B.: Ligroin
Versuchsdurchführung:
Die 100 mL Trichlormethan (Chloroform) werden durch Chlorophyll grün gefärbt. Dazu werden einige Blätter mazeriert. Das bedeutet, dass der grüne Blattfarbstoff bei Raumtemperatur durch Einlegen in Chlorophyll und Mörsern mit etwas Sand und Natriumcarbonat extrahiert wird. Glycerin stellt die farblose Phase dar. Das Rizinusöl wird durch SudanIII rot gefärbt. Das Ethanol/Wasser-Gemisch stellt wiederum eine farblose Phase dar. Lebertran ist gelb. Die methanolische Phase wird durch Methylenblau angefärbt. Das Leichtbenzin ist wieder farblos. Beim Einfüllen muss darauf geachtet werden, dass die verschiedenen Phasen nicht am Rand in die Flasche einlaufen gelassen werden, sonst können sich andere Phasen anfärben.
Hinweise für den Vortrag:
Die Flasche darf nicht geschüttelt werden, sonst vermischen sich die Phasen! Das Apothekenschauglas sollte nicht zu lange vor dem Vortrag hergestellt werden, da sich z.B. die chlorophyllhaltige Phase von grün nach gelb verfärbt und die EtOH/Wasser Phase ihre Dichte geringfügig ändern kann und ihren Platz wechseln kann.
Abb. 3 Schauglas 3
Versuchsauswertung:
Die Schichtung der Flüssigkeiten geschieht auf Grund ihrer unterschiedlichen Dichten. Die einzelnen Phasen sind jedoch durchaus mischbar, weshalb Schütteln vermieden werden sollte.
Chloroform ρ = 1,49 g/mL
Im Oktober 1846 gelang W. Morton die erste klinische Narkose mit Äther. 1847 führte J.
Simpson in Edinburgh Chloroform als Narkosemittel ein. Bei einer Narkose werden durch Lähmung von Teilen des Zentralnervensystems die Schmerzempfindung, das Bewusstsein, die Abwehrreflexe und die Muskelspannung reversibel ausgeschaltet.
Glycerin ρ = 1,26 g/mL
Glycerin (1,2,3-Propantriol) ist eine viskose, hygroskopische Flüssigkeit mit süßem Geschmack. Sie findet außer zur Bereitung pharmazeutischer Präparate auch in der Kosmetik umfangreiche Anwendung.
OH
H O
H
H2C CH
CH2
OH OH
OH
Cl Cl
H
Cl CH3
CH3
CH2OH
H H
H
OH
C H2 HO
O
7 C
H2 C
H2 CH3 OH
5
3
1 2 3 4 5 6 7
5
4 1
6 7
2
Abb. 4 Apothekenschauglas 4
Rizinusöl ρ = 0,96 g/mL
Dieses Öl besteht hauptsächlich aus dem Triglycerid der Ricinolsäure (12-Hydroxyölsäure).
Aus dem unwirksamen Triglycerid wird im Dünndarm durch Lipasen der eigentliche Wirkstoff, die Ricinolsäure freigesetzt. Ricinolsäure bewirkt eine Reizung der Dünndarmschleimhaut und über Histaminfreisetzung eine Verstärkung der Darmpersiataltik.
Ethanol/Wasser ρ = 0,93 g/mL
Aufgrund seiner Molekülstruktur ist Ethanol ein ausgezeichnetes Lösungsmittel für polare und unpolare Substanzen und in jedem Verhältnis in Wasser mischbar. Alkoholische Extrakte werden häufig aus Blüten, Blättern, Früchten und Wurzeln gewonnen. Auch synthetische Wirkstoffe können in Ethanol gelöst werden. Ethanol hat nach wie vor als Desinfektionsmittel eine große Bedeutung.
Lebertran (Oleum Jecoris) ρ = 0,9 g/mL
Lebertran ist Fischleberöl mit hohem Gehalt an Vitamin A und D und an Omega 3- Fettsäuren. Schon im 18. Jahrhunderts erkannte man seine therapeutische Wirkung als Kräftigungsmittel, zur Verbesserung des Immunsystems und zur Rachitisprophylaxe. Vitamin D-Mangel verursacht bei Säuglingen und Kleinkindern eine Rachitis. Die dabei auftretende Kalkarmut und abnorme Weicheit des Knochensystems führt zur Deformierung des Skeletts.
Zur Deckung des menschlichen Bedarfs ist der relative geringe Gehalt von Milch, Milchprodukten, Eidotter und Leber ausreichend. Hohe Konzentrationen finden sich in Leberölen von Meeressäugetieren und Fischen, insbesondere in Heilbuttleberöl.
Methanol/ Holzgeist ρ = 0,79 g/mL
Früher wurde Methanol durch die trockene Destillation (Erhitzen unter Luftausschluss) von Holz gewonnen, daher auch der Name Holzgeist. Im Holzdestillat befanden sich ca. 1,5 - 3 % Methanol. Methanol ist für den Menschen giftig, da die Flüssigkeit und die Dämpfe
Schädigungen des Zentralnervensystems verursachen.
Benzin ρ = 0,7 g/mL
Gemisch gesättigter aliphatischer und ungesättigter, aromatischer Kohlenwasserstoffe. Wird als Lösungsmittel, Extraktionsmittel und auch in medizinischen Wasch- und Lösungsmitteln verwendet. Als Wundbenzin kann man mit ihm wegen seiner fettlösenden Eigenschaften Ölreste oder Rückstände von Heftpflastern entfernen. Kann zu Rauschzwecken missbraucht werden. Da es leicht flüchtig ist kann es inhaliert werden und zu Rauschzuständen führen.
Nach unserem heutigen Verständnis sind Arzneimittel jedoch vor allem Waren, die für einen Markt industriell hergestellt, angeboten und vertrieben werden.
Der enorme Erkenntniszuwachs in der Chemie führte dazu, dass z.B. eine Fülle von wirksamen Inhaltsstoffen aus Arzneipflanzen isoliert wurden so wie etwa die Alkaloide Chinin, Morphin, Strychnin oder die Salicin aus der Weidenrinde. Erst seitdem man bestimmte Wirkstoffe in chemisch reiner Form synthetisieren konnte hat sich ein Arzneimittelmarkt entwickelt, so wie wir ihn heute kennen entwickelt.
2 Herstellung von Arzneimitteln
2.1 Von der Weidenrinde zum modernen Arzneimittel
Geschichte
Jahr Ereignis
1860 Kolbe Synthese, Darstellung der
Salicylsäure
1874 Beginn der industriellen Produktion der Salicylsäure
1897 Dr. Felix Hoffmann:
Synthese der Acetylsalicylsäure
1899 Einführung der Acetylsalicylsäure als Aspirin® auf dem Arzneimittelmarkt
1915 Aspirin® wird in Tablettenform hergestellt
20er Jahre Anwendungsgebiete: Schmerzen, Rheumatismus, Lumbago und Neuralgien
1948 Beobachtungen zur Herzinfarktprophylaxe 1969/
Anfang der 70er Jahre
Einführung von ASS als Brausetablette, Entdeckung des Wirkmechansimus der Schmerztherapie (John Vane), Entdeckung des Blutplättchen-Aggregations-
hemmenden Effektes
1980 Zulassung von Aspirin® zur Schlaganfall- Risikoreduktion
1985 Zulassung zur Herzinfarktprävention 1990 Einführung von ASS als Kautablette
1992 Entwicklung einer magensaftresistenten, niedrigdosierten Tablette durch die Firma Bayer
1996 Zulassung zur Behandlung von akutem Herzinfarkt oder Verdacht auf solchen
1997 100. Geburtstag der Synthese des Aspirins
Schon in der Antike kannte man die schmerzlindernde Wirkung des Saftes, der aus der Rinde von Weiden gewonnen wurde. Auch Indianer bestrichen die Stirn mit einem Brei aus Weidenrinde, wenn sie an Kopfschmerzen litten.
Dieser enthielt Salicylsäure, die sozusagen der wirksame Vorläufer der Acetylsalicylsäure war.
Im Mittelalter kochten Kräuterfrauen die Weidenrinde auf und verabreichten das bittere Gebräu schmerzgeplagten Mitmenschen. Später wurde das Pflücken der Weidenrinde verboten, da man die Ruten für die Korbherstellung benötigte. Zu Beginn des 19.
Jahrhunderts trat dann eine Wende ein. Im Jahre 1806 verhängte Napoleon die Kontinentalsperre, was zur Folge hatte, dass kein Chinin mehr von Peru nach Europa eingeführt werden durfte. Chinin war damals das bekannteste fiebersenkende Mittel. Die Suche nach Alternativen begann und im Jahre 1828 kochte ein Münchener Pharmazieprofessor aus der Weidenrinde eine gelbliche Masse, die er Salicin nannte. Wenige Jahre später brachte ein französicher Chemiker Salicin in eine kristalline Form. 1838 stelle ein Italiener Salicylsäure her.
Abb. 5 Salix caprea 5
Die Inhaltsstoffe der natürlichen Weidenrinde variieren je nach Weidenart.
Substanzgruppe Vertreter Salicylate
(Salicylglykoside)
Salicin Salicortin Populin Aldehyde und Säuren Salirosid
Salicylsäure Vanillinsäure
Salicylalkohl Saligenin Flavonoide Isoquercitin
Naringin
Für die Wirkung sind vor allem Salicin und die in Salicin übergehenden Salicylglycoside verantwortlich.
2.2 Technische Synthese von Acetylsalicylsäure
Kolbe Elektrolyse
Die Aufklärung der Struktur und somit der Erarbeitung einer Synthese gelang schließlich dem Marburger Chemiker Professor H. Kolbe (1860). Ihm ist es zu verdanken, dass 1874 die industrielle Produktion der Salicylsäure begann. Die so produzierte Salicylsäure kostete nur ein Zehntel des Preises, der für die natürlich gewonnene Salicylsäure bezahlt werden musste und enthielt nicht die zahlreichen Verunreinigungen. Die Weidenrinde spielt seit der Einführung der chemischen Synthese von Salicylsäure und Acetylsalicylsäure keine pharmazeutische Rolle mehr. Bei dem von Kolbe entwickelten Verfahren handelt es sich um eine Carboxylierung von Natriumphenolat mit Kohlenstoffdioxid unter anschließender Hydrolyse, wobei man die Salicylsäure in nahezu quantitativer Ausbeute erhält. Die Carboxylierung über einen elektrophilen Angriff des CO2 am Aromaten. Als Zwischenprodukt tritt ein Chelatkomplex auf. Die ursprüngliche Kolbe-Synthese wurde später durch Schmitt noch verbessert und trägt seither den Namen Kolbe-Schmitt-Synthese.
Am 10. August 1897 wurde von Dr. Felix Hoffmann die Acetylsalicylsäure in dem Bestreben synthetisiert, ein besser verträgliches Salicylsäurederivat zu schaffen. Am 6. März 1899 wurde Aspirin® in die Warenzeichenrolle des Kaiserlichen Patentamtes in Berlin aufgenommen. Die Synthese baute auf die Kolbe-Schmitt-Synthese auf und überführte die dargestellte Salicylsäure durch Reaktion mit Essigsäureanhydrid (Acetylierung) unter Protonenkatalyse in Acetylsalicylsäure.
Versuch 1
Herstellung von Acetylsalicylsäure
Geräte: Magnetrührer mit Rührfisch
Kristallisierschale für siedendes Wasser 100 mL Erlenmeyerkolben mit Rührfisch
Stativplatte, Stativstange und Klammer
Kristallisierschale für Eisbad
400 mL Becherglas mit Eiswasser
Saugflasche Büchnertrichter mit Filterpapier
Absaugpumpe
Chemikalien: 2,5 g Salicylsäure
5 mL Essigsäureanhydrid 5 Tropfen konz. Schwefelsäure
Versuchsdurchführung:
In einer Kristallisierschale wird Wasser bis zum Sieden erhitzt. In einen 100 mL Erlenmeyerkolben werden 2,5 g Salicylsäure und 5 mL Essigsäureanhydrid gemischt.
Abb.6
Asprinpackung 6
Anschließend gibt man 5 Tropfen konzentrierte Schwefelsäure hinzu und hängt den Erlenmeyerkolben mit Hilfe der an der Stativstange befestigten Klammer in das siedende Wasserbad. Das Ganze wird für 2 Minuten erhitzt. Danach nimmt man den Erlenmeyerkolben aus dem Wasserbad und stellt ihn in ein Eisbad. Nach dem Abkühlen schüttet man den Inhalt des Erlenmeyerkolbens in ein Becherglas mit 100 mL Eiswasser. Der Niederschlag wird abfiltriert und mit kaltem Wasser gewaschen.
Hinweise für den Vortrag:
Die Herstellung von Acetylsalicylsäure kann im Vortrag nur in zeitlich geraffter Form vorgeführt werden. Dazu sind folgende Zwischenschritte bereits vorzubereiten:
9 Becherglas mit 100 mL Eiswasser mit auskristallisierten ASS Kristallen 9 Abfiltrierte ASS Nadeln in einer Petrischale zum rumgeben.
Versuchsauswertung:
Säurekatalysierte Veresterung:
H3C O CH3
O O
1. Protonierung der Carboxygruppe der Säurekomponente
+ H
H3C O CH3
O O H
Essigsäureanhydrid Hydroxycarbenium-Ion
H3C O CH3
O O
H
H3C O CH3
O O
H
Hydroxycarbenium Ion
Im ersten Schritt wird die Säure protoniert. Dadurch wird ein nucleophiler Angriff des Alkohols möglich. Durch die Abspaltung eines Protons entsteht ein tetraedrisches Zwischenprodukt, welches in unserem Falle durch Aufnahme eines Protons in Richtung Produkt weiterreagiert, jedoch auch wieder zur Ausgangsverbindung zurückreagieren könnte.
Durch die Aufnahme des Protons kommt es schließlich zur Wasserabspaltung, bei der Aspirinsynthese zur Abspaltung von Essigsäure und zur Esterbildung. Alle Schritte sind reversibel. Will man einen Ester synthetisieren wird dies durch Alkoholüberschuss sowie Wasserentfernung aus dem Gleichgewicht begünstigt. In unserem Versuch wurde ebenfalls
2. Angriff des Alkohols
H3C O CH3
O O
H O H
COOH
H3C O O
O O
H
CH3 H
H3C O O
O O
H
CH3
COOH
-H COOH
Hydroxycarbenium-Ion Salicylsäure
tetraedrisches Zwischenprodukt 3. Abspaltung von Essigsäure
H3C O O
O O
H
CH3
+ H
H3C O O
O O
H
CH3
H
H3C O O
H
Essigsäure
O O
H
H3C
- H O
COOH COOH
COOH COOH
O
H3C
2-Acetylsalicylsäure ASPIRIN
tetraedrisches Zwischenprodukt
mit Alkoholüberschuss gearbeitet. Die Esterhydrolyse ist unter wässrigen Bedingungen begünstigt.
Durch die Veresterung der phenolischen Hydroxylgruppe der Salicylsäure mit Essigsäureanhydrid erreicht man eine bessere Verträglichkeit
Das Aspirin wurde zunächst als Pulver in einer Flasche auf den Markt gebracht. Bald darauf, 1915, wurde der Wirkstoff aber auch in Tablettenform angeboten. Somit war die Acetylsäure eine der ersten großindustriell hergestellten Tabletten der Welt. Damit endete jedoch nicht die Weiterentwicklung und neue Anwendungsgebiete wurden erforscht. 1948 beobachtete man, dass bei der Einnahme von ASS weniger Herzattacken auftraten. Auch auf dem galenischen Gebiet hielt die Entwicklung nicht inne. 1969 wurde die Brausetablette und 1990 die Kautablette eingeführt.
2.3 Wirkung von ASS im Körper
Prostaglandine
Prostaglanine gehören zu der Stoffklasse der Lipide. Mit den Prostaglandinen verwandt sind die Prostacycline, Thromboxane und Leukotriene. Sie werden unter dem Begriff Eicosanoide zusammengefasst, da sie alle C20-Verbindungen sind (griech.: eikosi, zwanzig). Im menschlichen Organismus ist der wichtigste Vorläufer der Eicosanoide die Arachidonsäure, eine mehrfach ungesättigte Fettsäure mit 4 Doppelbindungen. Die Prostaglandine enthalten einen 5gliedrigen Ring von C-Atomen, die ursprünglich zur Arachidonsäurekette gehörten.
Wirkung
Aspirin hemmt die Umwandlung von Arachidonsäure (5, 8, 11, 14 Eicosatetraensäure) zu den eicosanoiden Prostaglandinen, die weiter zu Thromboxanen (wirken auf die Blutgerinnung) und Leukotrienen (kontrahieren glatte Muskelfasern) verarbeitet werden. Prostaglandine sind an der Entstehung des Schmerzes und des Fiebers sowie an entzündlichen Reaktionen wesentlich beteiligt. Verbindungen, die die Bildung von Prostaglandinen unterdrücken sind gleichzeitig schmerzunterdrückend, fiebersenkend und entzündungshemmend.
Diese fettlöslichen Zellhormone haben dann in der jeweiligen Zelle Signalfunktion. Der erste Schritt der Prostglandinsynthese ist eine oxidative Cyclisierung von Arachidonsäure. Die COX werden durch Aspirin an einer strukturbestimmenden Serin OH-Gruppe im aktiven Zentrum des Enzyms acyteliert und dadurch irreversibel unwirksam gemacht. Sie werden allerdings in den Zellen langsam wieder nachgebildet. Die Arachidonsäure kann nicht an das aktive Zentrum des Enzyms binden.
Epithelzellen und Wundzellen habe eine eigene Cyclooxigenase (COX). Isoenzym COX-1 vermittelt die Synthese von Prostacyclin, dass die Schleimhäute schützt. Isoenzym COX-2
Zellmembran
Zellschädigung
Arachidonsäure
Prostaglandine Prostacycline Thromboxane Entzündung,
Schmerz Magenschleimhaut- schutz
Thrombozyten- aggregation
COX 2 ASS COX 1 COX 1
COOH
ASS ASS
Ser O
COO O
H3C
OH O C
O
CH3
OH
COO
Ser
Prostaglandin- Endoperoxid Synthase
Aspirin
(Acetylsalicyclat)
Salicylat Acetyliertes
inaktiviertes Enzym
Abb. 7 Früchte mit Vitamin C Strukturformel 7
startet die verstärkte Synthese von Prostaglandinen in Entzündungs- und Wundzellen, also dort, wo man die Wirkung gerne sähe. Aspirin hemmt beide Isoenzyme. Wenn es gelänge, Aspirin so abzuwandeln, dass es nur noch COX-2 blockiert, hätte man ein nebenwirkungsfreies Medikament.
3 Analyse von Arzneistoffen
3.1 Vitamin C / L-Ascorbinsäure
Vitamine
Vitamine sind organische Wirkstoffe, die in Pflanzen in kleinster Menge erzeugt werden und für den normalen Stoffwechsel im menschlichen Organismus und tierischen Organismus unentbehrlich sind. Fehlen diese organischen Katalysatoren oder Wirkstoffe der Nahrung, so treten Mangelkrankheiten, die „Avitaminosen“, auf. Der Name Vitamin leitet sich vom zuerst untersuchten Vitamin
B1 ab, bei dem festgestellt wurde, dass es lebensnotwendig (vita = Leben) ist und zum Anderen aminartig reagiert. Der Name hat sich durchgesetzt, obwohl die meisten Vitamine ihrer chemischen Natur nach keine Amine sind.
Ascorbinsäure
Ascorbinsäure gehört zu den wasserlöslichen Vitaminen und findet sich besonders in Früchten (Hagebutten, schwarze Johannisbeere, Apfelsinen und Zitronen) sowie in Paprikaschoten und Kohlarten.
Vitamin C findet sich fast im gesamten Pflanzen und Tierreich. Tiere produzieren Vitamin C in der Leber aus D-Glucose über eine vierstufige Synthese:
D-Glucose → D-Glucuronsäure → D-Glucuronsäure γ-lacton → L-Gluonsäure γ-lacton → Vitamin C.
Das Enzym, das die letzte Oxidation katalysiert, die sogenannte L-Gulonolacton-Oxidase, fehlt beim Menschen, einigen Affenarten, Meerschweinchen und Vögeln. Der Grund hierfür ist möglicherweise ein defektes Gen, das bei der Mutation, die vielleicht vor 60 Millionen Jahren stattgefunden hat, entstanden ist. Daher müssen wir Menschen Vitamin C mit der Nahrung zu uns nehmen. Dabei kann es sich entweder um Vitamin C aus natürlichen Quellen oder um synthetisches handeln.
Eigenschaften
Ascorbinsäure löst sich leicht in Wasser, die Lösungen wirken stark reduzierend, was auf die α-Oxoendiolstruktur zurückzuführen ist (eine Endiol- oder Redukton- Gruppierung mit einer in α-Stellung benachbarten Carbonylfunktion). Endiole sind tautomere Formen der α- Hydroxycarbonylverbindung. Eine zusätzliche Carbonylfunktion ermöglicht die Ausbildung von zwei intramolekularen Wasserstoffbrücken (Bildung eines Doppelfünfringchelats).
Dadurch wird die α-Ketoendiolform gegenüber anderen tautomeren Formen begünstigt. Diese Struktur ist auch für die Acidität der Ascorbinsäure verantwortlich, denn die OH-Gruppe am C3 ist Bestandteil einer vinylogen Carbonsäure, ihr pKS beträgt 4,2. Das entstehende Anion ist resonanzstabilisiert.
3.2 Wirkung von Ascorbinsäure
Ascorbinsäure nimmt an physiologischen Reduktions-Oxidationsprozessen, sogenannten biochemischen Redoxsystemen, teil. Die Ascorbinsäure wirkt vor allem als Reduktionsmittel.
Sie wird reversibel zur Dehydroascorbinsäure oxidiert, die dann durch NADH-abhängige Reduktasen wieder in Ascorbinsäure zurückverwandelt werden.
O O
HO OH R
H
O O
O OH R
H
O O
O OH R
H
- H -
- +
Sie ist u.a. beteiligt an:
der Oxidation von Prolin und Lysin zu Hydroxyprolin und Hydroxylysin in den Kollagenfasern. Das Enzym Prolyl-Hydroxlase benötigt Vitamin C als Cofaktor um seine enzymtische Aktivität zu entfalten. Fehlt Vitamin C, so können sich die neu synthetisierten Kollagenfasern nicht richtig ausbilden. Dies führt zu Hautläsionen, brüchigen Blutgefäßen, gestörter Wundheilung und letztlich auch zum Tode führen.
Vitamin C spielt als Antioxidans eine Rolle. Antioxidantien wirken Abbaureaktionen von Fetten, Proteinen und der DNA entgegen. Diese sind für Krankheiten wie Arteriosklerose, grauer Star oder Krebs verantwortlich. Als Radikalfänger reagiert Ascorbinsäure mit reaktiven Sauerstoffverbindungen wie Peroxo- oder Nitrosylradikalen.
Der Vitamin C-Bedarf des Menschen ist im Vergleich zu anderen Vitaminen sehr hoch. Die tägliche Mindestmenge beträgt 50 – 70 mg.
Die klassische Mangelkrankheit ist der Skorbut, welcher im Mittelalter vor allem bei Seefahrern aufgrund der fehlenden Versorgung mit Frischobst und Gemüse auftrat. Ist die Vitamin C-Zufuhr über einen Monat geringer als 10 mg/d, so kommt es zu typischen Mangelerscheinungen: Mangel an Ascorbinsäure zeigt sich zuerst im Stützgewebe, und es kommt zu Zahnfleischblutungen, schlechter Wundheilung und leichter Ermüdbarkeit.
Allgemein ist die Resistenz gegen Immunkrankheiten herabgesetzt.
Speicherung und Ausscheidung
Vitamin kann wie alle wasserlöslichen Vitamine nur in geringen Mengen vom Körper gespeichert werden. Die Speicherfähigkeit der einzelnen Gewebe ist unterschiedlich und meist dem Bedarf angepasst. Ascorbinsäure ist besonders in der Muskulatur, der Augenlinse, der Milz, der Leber und der Hypophyse angereichert. Die Leber ist aufgrund ihrer Größe Hauptspeicher für Ascorbinsäure. Die Granulozyten haben einen hohen Ascorbinsäuregehalt, der wahrscheinlich ihre Aufgabe bei der Infektionsabwehr unterstützt.
Abb. 8 Vitamin C Retard Tabletten 8
Vitamin C in Retard- Präparaten
Oral verabreichte Ascorbinsäure wird gut resorbiert. Die temporäre Sättigung des Plasmas und der umliegenden Gewebe wird schnell erreicht. Überschüssige Ascorbinsäure wird rasch ausgeschieden und Tagesdosen von mehr als 200 mg führen nicht zu einer wesentlichen Steigerung der Plasmakonzentration. Wird der Resorptionsprozess bei Einnahme höherer Dosen Vitamin C allerdings zeitlich ausgedehnt, kann die bioverfügbare Menge erhöht werden. Konzentrationsspitzen, wie sie bei nicht retardierten Präparaten auftreten, bei denen der Plasmaspiegel durch die einmalige Freisetzung des Inhaltsstoffes zunächst stark ansteigt, dann aber aufgrund der Ausscheidung mehr oder weniger rasch abfällt, werden nicht aufgebaut. Die Retardpräparate werden vornehmlich als Pelletzubereitungen angeboten. Als retardierender Überzug der Pellets dient Schellack, ein wasserunlösliches Ausscheidungsprodukt weiblicher Lackschildläuse, das vorwiegend aus langkettigen Hydroxycarbonsäuren besteht. Im Magen und im Darm diffundiert Wasser durch den Schellackfilm, wodurch in den Pellets ein so hoher Innendruck herrscht, dass der Wirkstoff freigesetzt wird. Im Fall der in unserem Versuch eingesetzten Cetebe Pellets erfolgt die retardierte Freisetzung durch abwechselnde Schichten von Vitamin C und Schellack in den Pellets selbst. Der Wirkstoff wird vor allem im vorderen Dünndarm bei einer Verweildauer von 6 bis 8 Stunden aus den Pellets freigesetzt.
Versuch 2
Nachweis von Vitamin C
Geräte: Demoreagenzglasständer mit weißem Hintergrund
2 Demoreagenzgläser
2 Uhrgläser
Abb. 8 Zitronen 8 Abb.9 Strukturformel 9
Chemikalien: Lösung von Tillmans Reagenz:
100 mL dest. Wasser
8 mL Essigsäure w = 10 %
→ (1 g Essigsäure auf 10 g Wasser) 80 mL Tillmans Reagenz:
2,6 Dichlorphenolindophenol Na- Salzdihydrat
→ (1,38 mmol/L = 250 mg / 500 mL Lösung)
¼ pulversisierte Aspirin plus C Tablette Pellets aus 2 Cetebe Retard Fläschen
Versuchsdurchführung:
Die Lösung von Tillmans Reagenz wird in den oben angegebenen Mengen- und Konzentrationsverhältnissen hergestellt. Die Lösung von Tillmans Reagenz muss vor dem Versuch immer frisch angesetzt werden. Das reine 2,6 Dichlorphenolindophenol Na- Salzdihydrat (DCPIP) in Wasser kann in einer braunen Flasche aufbewahrt werden. Vor Versuchsbeginn werden 100 mL dest. Wasser, 8 mL Essigsäure und 80 mL Tillmans Reagenz zusammengeschüttet und jeweils 50 mL in die beiden Demoreagenzgläser gefüllt. Die Lösung ist rosa gefärbt. Auf eines der beiden Uhrgläser wird ¼ Tablette Aspirin Plus C, die zuvor pulverisiert wurde, gegeben, auf das andere die Pellets von 2 Cetebe Retard Fläschen. Diese werden dann zeitgleich in das dafür vorgesehene Demoreagenzglas geschüttet.
Hinweise für den Vortrag:
Da das Vitamin C aus den Retard Pellets verzögert freigesetzt wird, ist es sinnvoll, den Versuch im Vortrag so früh wie möglich durchzuführen, um die Entfärbung der Lösung noch vor Ende des Vortrags zu erkennen.
Versuchsauswertung:
DCPIP ist ein Redoxindikator. Ascorbinsäure wirkt als Reduktionsmittel und wird zu Dehydroascorbinsäure oxidiert. Das zuvor rosa erscheinende DCPIP wird zur farblosen Leukoform reduziert.
Synthese von Vitamin C
Käufliches Vitamin C wird praktisch ausschließlich synthetisch hergestellt. Die Weltproduktion beträgt etwa 40.000 t/Jahr.
O O
OH HO
HO
H H HO
O O
O O
HO
H H HO
Oxidation
Reduktion
Ascorbinsäure Endiolstruktur
Dehydroascorbinsäure Diketon
2 H 2 e
O O
O O
HO
H H HO
H H
O N Cl
OH
O O
OH HO
HO
H H HO
Tillmans Reagenz oxidierte Form
in saurer Lösung rot Ascorbinsäure
NH HO
Cl
Cl
OH
O O
O O HO
H H HO
Dehydroascorbinsäure Tillmans Reagenz
reduzierte Form farblos
Cl
Abb. 10 Alexander Fleming 10
4 Wirkung von Arzneistoffen
4.1 Penicillin und ß-Lactam Antibiotika
Alexander Fleming entdeckte 1928 als erstes Antibiotikum das Penicillin (Penicillin G). Der Schimmelpilz Penicillium notatum hatte seine Bakterienproben verunreinigt. Die Bakterien wuchsen in direkter Umgebung des Pilzes nicht.
1940 gelang es Chain, Florey und Mitarbeitern das erste Mal Penicillin zu isolieren. 1941 fand die erste Behandlung eines Menschen statt, der jedoch auf Grund der beschränkten Vorräte nicht lange genug behandelt werden konnte und schließlich verstarb. Später gelang es erstmals in den USA, einen sehr leistungsfähigen Pilzstamm zu finden. Pro mL Nährlösung gewann man 100 Einheiten Penicillin, Mutanten dieses Pilzes lieferten schließlich bis zu 3000 Einheiten pro mL Nährlösung.
Für ihre Forschung erhielten Alexander Fleming, Howard Florey und Ernst Chain 1945 den Nobelpreis für Medizin.
ß-Lactamantibiotika
Die ß-Lactamantibiotika umfassen die
Penicilline,
Cephalosporine,
Carbapeneme und
Monobacteme
Penicillin gehört zu der Gruppe der ß-Lactamantibiotika. Alle ß-Lactam Antibiotika besitzen als Grundstruktur ein bicyklisches Ringsystem aus einem 5 gliedrigen- Thiazolidinring und einem 4 gliedrigen ß-Lactamring, welcher antibiotische Wirkung besitzt.
Diese Grundstruktur wird als Penam bezeichnet:
Abb. 11 Struktur von Penicillin G 11
N S O
H
1 2 4 3 5 6 7
Biogenetisch entsteht der Bizyklus aus L-Cystein und D-Valin aus denen 6- Aminopenicillansäure gebildet wird (6-APS). 6-APS enthält drei Symmetriezentren (2S, 5R, 6R) und ist entlang der N-1/ C-5 Achse gewinkelt. Die Konfiguration der Chiralitätszentren muss der der natürlichen Substanzen entsprechen, um bakterizide Wirkung zu zeigen.
N S
O H N H2
C H3
CH3
H O
OH
Das ß-Lactamsystem ist äußerst reaktionsfreudig. Der ß-Lactamring ist planar, der Stickstoff ist jedoch so fixiert, dass sich sein freies Elektronenpaar senkrecht zur Carbonylgruppe anordnen muss. So kann es nicht, wie bei aliphatischen Säureamiden, mit der Carbonylgruppe in Resonanz treten. Aliphatische Säureamide sind weniger aktiv, weil das Elektronenpaar des Stickstoffs in einer Ebene mit der Carbonylgruppe liegt und sich dadurch ein partieller Doppelbindungscharakter ausbildet.
Penicilline sind Acylderivate der 6-APS. Ein variabler Rest R ist über eine Peptidbindung an den ß-Lactamring geknüpft.
N S
O H N
C H3
CH3
H O
OH R
O
H
Hemmung der Zellwandsynthese
Penicilline hemmen die D-Alanin-Transpeptidase, so dass keine Peptidbrücken mehr geknüpft werden können. Dabei binden die Antibiotika unter Öffnung des ß-Lactamringes kovalent an das aktive Zentrum der D-Alanin-Transpeptidase und blockieren diese irreversibel. Die neusynthetisierte Zellwand besitzt nicht mehr die notwendige Stabilität, um dem osmotischen Druck des Zytoplamas standzuhalten. Nach Plasmolyse erfolgt der Zelltod.
Der Wirkmechanismus beruht auf der Strukturanalogie der Penicilline zum D-Alanyl-Alanin- dipeptid. Im Dipeptid und im Penicillin befinden sich die an der Reaktion mit dem Enzym beteiligten Bindungen in einer ähnlichen räumlichen Lage.
Strukturvergleich Penicillin Bizyklus und D-Alanyl-Alanin-Dipeptid:
N S
O N
C H3
CH3 O O
N
O H O O N Penicillin
D-Alanyl-D-Alanin
Die Alanin-Transpeptidase akzeptiert die ß-Lactam Antibiotika deswegen als Substrat und wird durch die Ausbildung einer kovalenten Bindung zwischen Enzym und Antibiotikum irreversibel blockiert.
An menschliche Enzyme bindet Penicillin nicht und ist aus diesem Grunde auch nicht toxisch.
Wenn Bakterien gegen Penicillin resistent sind, sezernieren sie das Enzym ß-Lactamase, welches die Amidbindung im ß-Lactamring spaltet. Die Aktivität des Bakterienenzyms wird von der Struktur der Penicillinseitenkette R beeinflusst. Durch die Entwicklung von halbsynthetischen Penicillinen, wie zum Beispiel Ampicillin, bei dem der Rest R eine Aminobenzylgruppe darstellt konnten wirksame Medikamente gegen penicillinresistente Bakterienstämme gewonnen werden.
*
N
*
*
S H3C
CH3
HN
H
O
H
O
OH O
Penicillin G (Benzylpenicillin) Ampicillin:
N S
O H N
C H3
CH3
H O
O OH H NH2
Gewinnung
Klassisch werden Penicilline auf mikrobiologischem Wege gewonnen. Die beiden natürlichen Penicilline sind Penicillin G (Benzylpenicillin) und Penicillin V (Phenoxymethylpenicillin).
Die Ausbreitung von Bakterien, die gegen bestimmt Penicilline resistent waren, hat zur Herstellung von halbsynthetischen Penicillinen geführt. Dazu wird den biotechnisch hergestellten, natürlichen Penicillinen die Seitenkette abgespalten und im Anschluss die 6- APA mit synthetischen Seitenketten chemisch verknüpft.
An der Penicillinbildung sind α-Aminoadipinsäure, L-Cystein und L-Valin beteiligt. Des Weiteren setzt man sogenannte Praecursoren, d.h. zusätzliche Bausteine, für das zu produzierende Penicillin ein. Zum Beispiel Phenylessigsäure für Benzylpenicillin und Phenoxyessigsäure für Phenoxymethylpenicillin, was die Penicillinausbeute wesentlich erhöhte.
Penicillin G wird nur auf biologischem Wege gewonnen. Die Synthese ist zwar gelungen (Sheehan), verläuft aber in so geringen Ausbeuten, dass die synthetische Darstellung praktisch bedeutungslos ist. Da Penicillin 3 asymmetrische C-Atome enthält, muss bei der Synthese stereospezifisch gearbeitet werden.
NH2 HOOC COOH
+
H N SH2
COOH
+
H N2
COOH
CH3 CH3
NH2
HOOC N
O H
SH
O
N H
CH3 CH3
HOOC
Alpha-Aminoadipinsäure L-Cystein L-Valin
L-Alpha-amino-adipyl-cysteinyl-valin (ACV)
NH2
HOOC N
O H
O N
S
CH3 CH3
COOH Isopenicillin N
N H2
O N
S
CH3 CH3
COOH
6- Aminopenicillansäure (6-APS)
* *
*
COOH
N
O N
S
CH3 CH3 O
H
* *
* Penicillin G
ACV-Synthetase
Isopenicillin N Synthetase
Acyltransferase
4.2 Wirkmechanismus von Penicillin
Bakterien und Resistenzen
Bakterien besitzen extrachromosomale Elemente, die Plasmide genannt werden und genetische Informationen tragen. Plasmide tragen Gene, die das Bakterium resistent gegen antibakterielle Mittel machen. So können Plamide ein Gen für das Enzym ß-Lactamase tragen. Die Bakterien, die dieses Gen tragen sind somit resistent gegen ß-Lactamantibiotika, wie zum Beispiel Penicillin. Plasmide können von einer antibiotikum resistenten Zelle auf eine antibiotikum empfindliche Zelle derselben oder einer anderen Bakterienart übertragen werden und dieser dadurch Resistenz verleihen.
Die verbreitete Anwendung von Antibiotika hat bei krankheitserregenden Bakterien zu einem starken Selektionsdruck zugunsten dieser Plasmide geführt. Die hat zur Folge, dass multiresistente Bakterienstämme entstehen.
Nicht alle Antibiotika weisen heute noch dieselbe Wirksamkeit wie vor einigen Jahrzehnten auf. Die Zahl der Bakterienklassen, die effiziente Abwehmechanismen gegen Antibiotika entwickelt haben, hat zugenommen. Die häufigste Form der Resistenz ist die Bildung von ß- Lactamasen, die in der Lage sind, den Lactamrung hydrolytisch zu spalten.
Die Bakterienzellwand
Die Zellwand der Bakterien ist von medizinischer Bedeutung, da sie für die bakterielle Virulenz (krankheitsverursachende Kraft) verantwortlich ist. Die Bakterienzellwand enthält charakteristische Antigene.
Bakterien werden in zwei große Klassen, die grampositiven und die gramnegativen Bakterien eingeteilt. Die Einteilung hängt von ihrem Verhalten in der Gramfärbung (benannt nach Christian Gram 1884) ab.
Grampositive Bakterien haben eine 25 nm dicke Zellwand ohne äußere Membran. Aus diesem Grund besitzt die Zellwand eine im Vergleich zu den Gramnegativen Bakterien hohe Permeabilität. Gramnegative Bakterien besitzen eine 3 nm dünne Zellwand mit einer äußeren Membran einer Lipoprotein- Lipopolysaccharidschicht. Die äußere Membran wehrt toxische Substanzen und auch die Gramfärbung ab. Die Gramnegativen Bakterien besitzen somit auch eine höhere Resistenz gegenüber Antibiotika.
Die Zellwand ist aus verknüpften Polysaccharid- und Polypeptidketten aufgebaut. Man spricht von einem Peptidoglykan.
Der Polysaccaridanteil besteht aus linearen Ketten aus ß 1-4 verknüpften N-Acetylglucosamin (GlcNAc) - und N-Acetylmuraminsäure (MurNAc) - Einheiten.
Tetrapeptid MurNAc
Tetrapeptid MurNAc
Peptidbrücke GINAc
GINAc
Peptidbrücke Tetrapeptid
Tetrapeptid
MurNAc
GINAc
MurNAc
GINAc Transpeptidase Penicillin
Ausschnitt aus der Bakterienzellwand
Zellmembran
Murein Saure
Polysaccharide
Grampositiv
z.B. Staphylococcus aureus
Gramnegativ z.B. Escherischia coli
Lipoproteine Lipo-
polysaccharide Polysaccharide Murein
Äußere Membran Hohe
Permeabilität
Geringe Permeabilität - 5 nm
- 20 nm
- 10 nm
- 2 nm
Noch in der Zelle bindet die Säuregruppe der N-Acetylmuraminsäure an ein D- Aminosäurenhaltiges Tetrapeptid. Statt des endständigen D-Alanins wird ein D-Alanyl-D- Alanindipeptid eingebaut, so dass ein Pentapeptid entsteht. Es entsteht ein N- Acetylmuraminpentatpeptid. Die D- Aminosäuren in der Seitenkette verleihen den Peptidoglykanen eine weitgehende Resistenz gegenüber Proteasen, die meist spezifisch für L- Aminosäuren sind.
An der Zytoplasmamembran bindet dann N-Acetylglucosamin an die mit dem Pentapeptid verbundenen N-Acetylmuraminsäure. Auch die Peptidbrücke verbindet sich hier mit dem Pentapeptid.
Direkt in der Zellwand müssen die Peptidbrücken untereinander geschlossen werden. Dazu wird das terminale D-Alanin abgespalten. Es wird eine Peptidbindung vom vorletzten Alaninrest zum Brückenpeptid (z.B. Pentaglycin) ausgebildet.
Demonstration 2
Hemmung des Wachstums von E.coli durch Penicillin
Geräte: 10 Agarplatten
20 mL sterile Glaspipette 10 sterile Pasteurpipetten 10 sterile Eppendorfspitzen
Chemikalien/
Medikament: Penicillin Stammlösung: 80 mg/mL
Übernachtkultur von E. coli 5 mL
Abb. 12 Bakterienstämme 12
Abb. 13 Hemmhof in einer E.coli Kultur durch Penicillin 13
Versuchsdurchführung:
Je 0,1 mL einer ausgegebenen E.coli Kultur sorgfältig auf den Agarplatten ausplattieren und trocknen lassen. Mit dem Ende einer Pasteurpipette 1 Loch/ Platte aus dem Agar ausstechen.
Bei der niedrigsten Verdünnung 3 Löcher/ Platte ausstechen. Pro Loch 30 µL Antibiotikalösung der entsprechenden Konzentration vorsichtig in die Löcher pipettieren.
Zuvor müssen noch die Böden der Petrischalen beschriftet werden, am besten mit den entsprechenden Konzentrationen. Die Inkubation erfolgt bei 37°C, wobei die Platten umgedreht hingestellt werden dürfen.
Je 2 Platten werden für die folgenden Penicillin Konzentrationen verwendet: 80, 40, 20, 10 und 5 mg/mL. Dazu wird die Stammlösung jeweils 5 mal 1:2 verdünnt.
Hinweise für den Vortrag:
Das Penicillin kann aus Tabletten oder Kapseln erhalten werden. Die E.coli Bakterienkultur wurde über die Mikrobiologie FB Biologie bezogen, dort wurde die Kultur auch inkubiert und bis zum Vortrag steril gehalten. Die Agarplatten, die den Hemmhof am besten zeigen, können im Vortrag präsentiert werden.
Versuchsauswertung:
Alle ß-Lactamantibiotika greifen am Peptidoglycangerüst der Bakterienzellwand an.
Die Bakterienzellwand besteht aus sich abwechselnden N-Acetylglucosamin und N- Acetylmuraminsäure Einheiten. Das Enzym Transpeptidase vernetzt die Stränge untereinander. Das eigentliche Substrat der Transpeptidase ( D-Alanyl-D-Alanin) ähnelt dem ß-Lactamgrundgerüst, welches nun an das Enzym bindet und diese blockiert. Die neue Zellwand besitzt durch den „enzymatischen Baustopp“ die notwendige Stabilität nicht mehr.
Es kommt zum Zelltod. Die Größe des Hemmhofs ist konzentrationsabhängig. Der Hemmhof kennzeichnet den Bereich, in dem das durch den Agar
diffundierte Penicillin die neue Zellwandsynthese unterbunden hat. Um den Hemmhof herum konnten die E.coli-Stämme wachsen.
4.3 Galle und ihre Gallensäuren
Galle
Die Gallenblase ist ein birnenförmiges Organ mit einem Fassungsvermögen von 30 bis 50 ml.
Die Gallenblase sitzt an der Leberunterfläche und hat die Aufgabe, Gallenflüssigkeit, die in der Leber gebildet wird, zu speichern.
Bei der Gallenflüssigkeit handelt es sich um ein Sekret der Leber, grün-braun, pH 5,6 bis 8,0, 75% Wasser. Hauptbestandteile der schwach alkalischen Galle sind die Salze der Gallensäuren, Cholesterin (Cholesterol), Phospholipide (Lecithin), Gallenfarbstoffe (Bilirubin) und Steroidhormone. Die Gallensalze dienen der Emulgierung der Fette im Speisebrei.
Die Galle (0,7 L/Tag) wird von den Leberzellen direkt in die zwischen den Zellen liegenden Gallenkanälchen sezerniert.
Aus Cholersterin synthetisiert die Leber Cholat und Chenodeoxycholat, die sogenannten primären Gallensalze. Die Gallensalze werden in der Leber mit Taurin und Glycin konjugiert und in dieser Form in die Galle sezerniert (Glykocholsäure und Taurocholsäure). Dort dienen sie der Micellenbildung in Galle und Darm. Im Darm wandeln Darmbakterien die konjugierten Gallensäuren in sekundäre Gallensalze um (Dekonjugation) z. B.
Desoxycholsäure. Die Gallensäuren unterliegen dem enterohepatischen Kreislauf. Dieser verringert die Menge der Stoffe, die neu gebildet werden müssen, da die Stoffe wieder verwendet werden können.
Unkonjugierte Gallensäuren werden gleich wieder resorbiert, während die konjugierten Gallensäuren erst nach ihrer Verwendung bei der Fettverbrennung wieder resorbiert werden. Der gesamte Gallensalzbestand des Körpers (2-4 g) durchläuft diesen Kreislauf je nach dem Fettgehalt der Nahrung 6 bis 10 mal pro Tag, da für die tägliche Fettresorption ca. 20 bis 30 g Gallensäuren benötigt werden. 0,4 – 0,8 g der Gallensäuren werden täglich mit dem Stuhl ausgeschieden.
Abb. 14 Kreislauf der Gallensalze 14
Abb. 15 Mischungspyramide der Bestandteile der Gallenflüssigkeit 15
Ist der Sphinkter zwischen Gallengang und Duodenum geschlossen, gelangt die laufend produzierte Lebergalle in die Gallenblase, wo sie auf 1/10 eingedickt und gespeichert wird.
Das Gallenblasenepithel resorbiert vor allem Na+ und Cl- zusammen mit Wasser, so dass sich die Konzentration der Gallenbestandteile (Gallensalze, Bilirubin, Cholesterin…) auf ein Vielfaches erhöht. Wir die Gallenblase zur Fettverdauung benötigt, kontrahiert sich die Gallenblase und der Inhalt mischt sich Portionsweise dem Speisebrei im Duodenum unter.
Cholesterin- Gallensteine
Cholesterin wird in der Galle in Micellen transportiert. Diese werden mit Lecithin und den Gallensalzen gebildet. Ändert sich das Mischungsverhältnis dieser Stoffe zugunsten des Cholesterins kommt es in der hochkonzentrierten Gallenblase zur Ausfällung von Cholesterinkristallen in der Gallenblase oder in den Gallengängen. Es können sich Solitärsteine bilden oder mehrere Steine. Die kleinsten Steine werden als Gallengrieß bezeichnet.
Der rote und der grüne Punkt symbolisieren beispielhaft zwei Mischungsverhältnisse.
Gallensteinleiden ist die häufigste Erkrankung der Gallenwege und der Gallenblase. Frauen sind dreimal häufiger betroffen als Männer. Je nach ihrer Zusammensetzung unterscheidet man
Cholesterolsteine (häufig solitär)
Pigmentsteine (Bilirubinsteine)
Calciumbilirubinatsteine
Am häufigsten sind sogenannte gemischte Gallensteine.
Gallensteine
Klassifikation der häufigsten Gallensteine
Steintyp Häufigkeit Lage Charakterisierung
Cholesterinstein Über 90 % aller Steine
Gallenblase Hart, rund, mit zunehmendem Alter polygonal
Pigmentstein Schwarzer Stein
Ca. 6% aller Steine Gallenblase Sehr hart, klein, zackig,
maulbeerförmig Calciumbilirubinatstein 40-50% aller
Gallengangsteine
Gallengänge Erdig, groß, tonnenförmig
Ursachen für die Gallensteinbildung sind
Hypercholesterolämie durch cholesterinreiche Ernährung, Adipositas, hormonale Kontrazeption, erbliche Veranlagung,
Gallenwegstauung,
Gallenwegentzündungen bei denen die auftretenden Proteine als Kondensationskerne wirken und
Stress
Das Vorhandensein von Gallensteinen kann mit Gallenkolliken einhergehen.
Eine medikamentöse Auflösung ist nur erfolgsversprechend, wenn es sich um reine Cholesterolsteine handelt. In solchen Fällen kann bei 60% der behandelten Patienten
innerhalb von 6- 24 Monaten mit einer Steinauflösung gerechnet werden. Eines der möglichen Medikamente ist die Ursodeoxycholsäure von der täglich ca. 10 mg/kg Körpergewicht eingenommen werden müssen. Eine Person mit einem Körpergewicht von 70 kg müsste somit 3 Tabletten pro Tag einnehmen, wenn das uns vorliegende Produkt (UDC AL 250 mg) zur Therapie verschrieben worden wäre. Die Wirkung kommt zum Einen durch die Hemmung der Cholesterolsynthese und zum Anderen durch die Emulgatorwirkung der Gallensäuren. Durch die Gabe von UDC wird das Gleichgewicht zwischen Salzen und Cholesterin wiederhergestellt und die Steine werden zur Auflösung gebracht.
Choleretika und Cholekinetika
Choleretika: erhöhen die Gallenproduktion in der Leber. Choleretisch wirken zum Beispiel Gallensäuren, die gleichzeitig die wichtigsten Bestandteile der Galle
darstellen.
Cholekinetika:fördern die Entleerung der Gallenblase bei Störungen des Gallenflusses aus der Gallenblase und den Gallengängen (Fleischextrakte, Eigelb, Fette, Sorbit, Magnesiumsulfat und verschiedene ätherische Öle.)
Steroide
In den Steroiden sind drei Cyclohexanringe in der Sesselform aneinander kondensiert. Der vierte Ring ist ein Cyclopentan. Alle 4 zusammen ergeben die charakteristische Steroidstruktur. Man bezeichnet die Ringe als A, B, C und D und das Steroidgerüst wird in einer bestimmten Reihenfolge nummeriert. Gruppen oberhalb der Ebene des Steroidmoleküls bezeichnet man als ß-Substituenten, unterhalb der Ebene befindliche Gruppen als α- Substituenten.
Gallensäuren
Digitaloide
Nebennierenrinden Hormone (Cortison)
Sexualhormone (Androgene, Östrogene, Progestine)
Cholesterin gehört zu den am weitesten verbreiteten Steroiden.
CH3
H3C H3C
H CH3
H H
H CH3
HO
Cholesterin
Gallensäuren
Gallensäuren gehören zur Stoffklasse der Steroide. 1919 wurde die gemeinsame Grundstruktur des Cholesterols und der Gallensäuren erkannt. Ihr Grundkörper kommt in der Natur nicht vor. Er wird durch Dehydratisierung und Hydrierung der natürlichen Gallensäuren gewonnen.
Die mengenmäßig vorherrschende Gallensäure ist die Cholsäure. Ungefähr 10mal geringer konzentriert findet man die Desoxycholsäure.
Die Ringverknüpfung ist A/B-cis, B/C-trans, C/D-trans
O
H R1
R2
COOH
H H
H
H
Gallensäure R1 (C7) R2 (C12)
Cholsäure OH OH
Chenodesoxycholsäure OH H
Desoxycholsäure H OH
COOH H3C
H CH3
H H
H CH3
HO
H
Ursodeoxycholsäure OH
4.4 Wirkung von Gallensäuren
Nahezu das gesamte Fett einer Mahlzeit erreicht den Dünndarm völlig unverdaut. Die tägliche Fettaufnahme von Menschen in den Industrieländern beträgt etwa 60-100 g und deckt damit etwa 40% des Energiebedarfs. Zum größten Teil sind dies Triglyceride (90%), die langkettige Fettsäuren wie Palmiat (16 C) und Oleat (18 C) enthalten. Die restlichen 10 % sind Cholesterinester und Phospholipide. Die Hydrolyse der Fette ist ein besonderes Problem, weil die Fettmoleküle in Wasser nicht löslich sind. Um überhaupt verdaut zu werden müssen sie fein emulgiert werden. Dafür sind die Gallensäuren zuständig. Gallensäuren ummanteln die Fetttröpfchen und emulgieren diese. Gallensalze haben detergenzähnliche Eigenschaften.
Sie enthalten mit ihrem Steroidkern eine lipophile Seite und mit ihren Carboxyl- und Hydroxylgruppen eine hydrophile Seite. An der Phasengrenze von Wasser und Lipiden legen sie sich zu einer monomolekularen Schicht gleich ausgerichteter Moleküle zusammen, deren lipophile Seite dem Fett und die hydrophile Seite dem Wasser zugewandt ist. Durch die Scherkräfte der Darmperisitaltik werden die so umhüllten Fetttröpfchen in immer kleiner werdende Einheiten aufgeteilt. Im feinverteilten Endzustand erreichen die Fetttröpfchen eine Größe von 0,5- 1,5 µm. Dadurch bieten sie eine große Fett-Wasser Grenzfläche und die Pankreaslipase kann angreifen und die Esterbindung der Fette spalten. Auch das Cholesterin der Nahrung wird durch die Cholsterinesterase in Cholesterin und freie Fettsäuren gespalten.
Ursodeoxycholsäure
+ Cholesterin
Micelle hydrophile
Seite hydrophobe
Seite
Cholesterin
Versuch 3
Wirkung von Gallensalzen
Geräte: Demoreagenzglasständer mit schwarzem Hintergrund
2 Demoreagenzgläser
2 Demoreagenzglasstopfen
2 Schliffflaschen mit Stopfen für je 50 mL NaOH 3 kleine Messzylinder
Chemikalien: 100 mL NaOH (c = 1 mol/L)
Lösung von UDC in EtOH (w = 1 %)
→ 1 Tabletteninhalt in 25 mL EtOH
Lösung von Cholesterin in Aceton ( w = 1%)
→ 1 g/ 100 g Aceton Medikament: UDC
Versuchsdurchführung:
Die NaOH wird in der angegebenen Konzentration und Menge hergestellt. Je 50 mL werden in den Schliffflaschen aufbewahrt. Die Lösung von UDC wird hergestellt, davon werden 6 mL in einen 10 mL Messzylinder geschüttet. Von der Cholesterinlösung werden jeweils 3 mL in zwei 5 mL Messzylinder geschüttet.
Zuerst gibt man je 50 mL NaOH in die Demoreagenzgläser. Anschließend werden in beide Demoreagenzgläser je 3 mL Cholesterinlösung geschüttet. Nun gibt man in eines der Demoreagenzgläser 6 mL der UDC-Medikamentlösung. Beide Reagenzgläser werden mit einem Stopfen verschlossen und geschüttelt.
Abb. 16 Galle & umliegende Organe 16
Hinweise für den Vortrag:
UDC (Ursodeoxycholsäure) ist ein verschreibungspflichtiges Medikament und muss daher früh genug besorgt werden. Musterpackungen können evtl. über den Hausarzt bezogen werden.
Es muss geprüft werden, ob Chlolesterin in der Chemikaliensammlung vorhanden ist bzw.
über die Chemikalienausgabe bestellt werden kann.
Versuchsauswertung:
Gibt man Cholesterin in das wässrige, leicht basische Milieu kommt es in beiden Reagenzgläsern zu einer Trübung, weil Cholesterin sich schlecht in der wässrigen Phase löst und sich mit der Zeit absetzt. Gibt man in eines der beiden Reagenzgläser das Medikament UDC hinzu, bilden sich Micellen. Das Salz der UDC fördert die Micellenbildung um das lipohile Cholesterinmolekül. Das Cholesterin wird länger in der Schwebe gehalten und setzt sich nicht so schnell ab, was bedeutet, dass es seltener zur Gallensteinbildung kommt, bzw.
cholesterinhaltige Gallensteine mit der Zeit durch dieses Medikament aufgelöst werden können.
Die Gallensalze gehören zu den anionischen Tensiden:
Sie tragen negative Ladungen und die polaren Gruppen bestehen zum Beispiel aus Carboxylat-, Sulfonat- oder Sulfatgruppen.
Das bekannteste in der Natur vorkommende Tensid ist das Lecithin. Als weiteres Beispiel ist die Gallensäure zu nennen.
Tenside sind zur Micellenbildung fähig, dabei wird die hydrophobe Substanz von den unpolaren Kohlenwasserstoffresten eingeschlossen. Die polaren Reste richten sich zum polaren Lösungsmittel hin aus und die Substanz wird „löslich“ gemacht.
Charakteristisch für Tenside ist ihr Aufbau. Sie bestehen aus einem fettlöslichen (lipophilem) und einem wasserlöslichen (hydrophilem) Teil.
COO H3C
H CH3
H H H CH3
HO
H
Streichholzmodell eines Gallensalzes:
4.5 Wirkung von ACC
Expektorantien
Als Expectorantien (lat. expectorare = aus der Brust verscheuchen) fasst man Arzneimittel zusammen, die eine Verflüssigung von Brochialsekret (Mucolytika) und/oder seinen Abtransport fördern. Die Viskosität des Brochialschleims wird u.a. durch die Konzentration und den Polymerisationsgrad der enthaltenen Glycoproteine bestimmt, deren Proteinanteil zahlreiche Disulfidbrücken enthält.
Die Mukolytika im engeren Sinne verändern die physiko-chemischen Eigenschaften und setzen die Viskosität des Schleims herab.
Zu den Mukolytika gehören pflanzliche Stoffe und Stoffgemische (saponinhaltige Drogen, ätherische Öle), anorganische Salze (Ammoniumchlorid und Kaliumiodid) sowie organische Verbindungen (Bromhexin und dessen Metabolit Ambroxol, Acetylcystein und Carbocystein).
Rein reflektorisch wirken saponinhaltige Drogen und erbrechenerregende Drogen bzw.
Substanzen. Dabei werden im Magen parasympathische Nerven stimuliert. Diese werden im Brechzentrum des Gehirns auf den Nervus vagus umgeschaltet, der die Bronchialdrüsen zu vermehrter Schleimsekretion stimuliert. Kaliumiodid und Ammoniumchlorid haben neben dieser reflektorischen Wirkung auch eine direkte stimulierende Wirkung auf
schleimproduzierende Zellen. Ausschließlich auf die Zellen wirken ätherische Öle. In allen Fällen hat die vermehrte Sekretion eine geringere Viskosität des Schleims zur Folge.
Bromhexin bewirkt eine Sekretvermehrung, die die Abnahme der Schleimviskosität zur Folge hat. Ambroxol, auch bekannt als Mucosolvan®, stimuliert zusätzlich die Bildung oberflächenaktiver Substanzen („Surfactants“), die die Adhäsion des Schleims am Bronchialepithel verhindern.
Der Wirkmechanismus von Acetylcystein beruht auf der reduktiven Spaltung der Disulfidbrücken im Proteinanteil des Schleims. Hierdurch wird die Viskosität des Schleims und dessen Abtransport erleichtert.
Husten
Beim Vorgang des Hustens handelt es sich um einen komplizierten Reflex. Das plötzliche, explosive Ausatmen dient zur Selbstreinigung der Atemwege.
Man unterscheidet produktiven und unproduktiven Husten, je nachdem ob Bronchialsekret vermehrt auftritt und abgehustet werden kann oder nicht. Unproduktiver Husten wird mit Antitussiva (Codein) behandelt, die den Hustenreiz zentral (d.h im Gehirn) unterdrücken.
Produktiver Husten kann mit Expektorantien unterstützend behandelt werden.
Die Krankheiten, bei denen Husten als Symptom auftritt sind zahlreich (z.B. Bronchitis, Mucoviscidose, Asthma bronchiale).
Versuch 4
Schleimlösende Wirkung von ACC akut
Abb. 17 ACC Packung 17
Geräte: Overheadprojektor
2 Plastikpetrischalen
4 Bechergläser 50 mL
1 Holzspieß
Chemikalien: 5,9 g Na2HPO4 2,3 g KH2PO4
Tintenpatrone „blau“
1 Hühnereiweiß
Medikament: 1 ACC 200 Brausetablette
Versuchsdurchführung:
Das Ei wird aufgeschlagen und das Eiweiß vom Eigelb getrennt. Das Eiweiß wird anschließend in zwei 50 mL Bechergläser aufgeteilt.
Die abgewogenen 5,9 g Dinatriumhydrogenphosphat werden in 213 mL dest. Wasser gelöst und die 2,3 g Kaliumdihydrogenphosphat in 250 mL dest. Wasser. Dann werden beide Lösungen vereint. Die Pufferlösung kann in einer Schliffflasche, für mehrere Versuchsdurchführungen und Probedurchgänge, aufbewahrt werden.
Es werden 15 mL reine Pufferlösung in die 2 weitere Bechergläser gegeben, die Lösungen werden mit wenigen Tropfen Tinte blau angefärbt.
Im Vortrag wird dann eine ACC 200 Brausetablette in einem Becherglas mit 15 mL Pufferlösung aufgelöst.
Auf den Overhead werden 2 Petrischalen gestellt, in die die beiden Eiweißportionen geschüttet werden. Dann werden gleichzeitig die Pufferlösungen zugeschüttet.
Nach einer geringen Wirkungszeit kann mit dem Holzspieß die Konsistenz der Eiweiße geprüft werden.
Hinweise für den Vortrag:
Die Petrischalen bzw. einen Folienstreifen mit „+ ACC 200“ und „-ACC 200“ beschriften.
Versuchsauswertung:
Cystein kann durch Oxidation der beiden Thiolgruppen eine Disulfidbrücke ausbilden. Das Dimer wird als Cystin bezeichnet. Das wasserlösliche Cystein geht durch diese Oxidation in das praktisch wasserunlösliche Cystin über, das durch Reduktion wieder in Cystein
zurückverwandelt werden kann. L- Cystein und L- Cystin besitzen R- Konfiguration, weil die Gruppierung CH2-SH eine höhere Priorität als die Carboxylgruppe besitzt.
Disulfidbrücken in Proteinen haben strukturstabilisierende Funktion. Sie verknüpfen die Aminosäureketten intra- und intermolekular.
Der Wirkmechanismus von Acetylcystein beruht auf der reduktiven Spaltung der
Disulfidbrücken im Proteinanteil des Schleims. Hierdurch wird die Viskosität des Schleims herabgesetzt und dessen Abtransport erleichtert.
NH C HC CH2
NH C
S S CH2 CH C HN
NH C
2 HS
NH O
OH
C CH3
NH C HC CH2
NH C
SH HS CH2 CH C HN
NH C
2 S S
NH NH
O HO
O OH
C C
CH3 CH3
Glycoprotein mit Disulfidbrücke N-Acetylcystein, ACC
Glycoprotein mit gespaltener Disulfidbrücke -I
-I
-I -I -II
-II -II
oxidiertes N-Acetylcystein O
O
O
O O
O
O
O
O O O