Mikrobiozide Wirksamkeit, weitere biologische Wirkungen, Verträglichkeit und Abbaubarkeit von
Octenidindihydrochlorid
Microbicidal efficacy, further biological activities, tolerance and biodegradation of octenidine-dihydrochlorid
Abstract
An overview of octenidine is given on the basis of microbicidal and virucidal activity as well as on mechanism of action and wound tolerance
Axel Kramer
1Gerald Müller
1in comparison to other often used antiseptic agents. For the assessment of the active agent in due to its suitability for antisepsis of wounds, ad- ditionally, other biological effects were demonstrated and a toxicological assessment has been done.
1 Institut für Hygiene und Umweltmedizin der Ernst- Moritz-Arndt-Universität, Greifswald, Deutschland
Zusammenfassung
Es wird ein Überblick über die mikrobiozide und viruzide Wirksamkeit einschließlich des Wirkungsmechanismus und über die Wundverträg- lichkeit von Octenidin im Vergleich zu anderen häufig eingesetzten an- tiseptischen Wirkstoffen gegeben. Zur Einschätzung des Wirkstoffs In Hinblick auf seine Eignung zur Wundantiseptik werden weitere biologi- sche Wirkungen dargestellt und eine toxikologische Bewertung vorge- nommen.
Schlüsselwörter:Octenidindihydrochlorid, Chlorhexidin, PVP-Iod, Polihexanid, Triclosan, Benzalkoniumchlorid, Silberverbindungen, mikrobiozide Wirksamkeit, Zytotoxizität, Biokompatibilitätsindex, Resorption, Toxikologie
Mikrobiozide Wirksamkeit, weitere biologische Wirkungen,
Verträglichkeit und Abbaubarkeit von Octenidindihydrochlorid
Einleitung
Octenidindihydrochlorid ist ein mikrobiozider Wirkstoff, der vor allem in Haut-, Schleimhaut- und Wundantiseptika eingesetzt wird. Auf Grund seines breiten Wirkungsspek- trums auf der einen Seite und der guten Verträglichkeit auf der anderen Seite gewinnt dieser Wirkstoff zuneh- mend an Bedeutung in der Praxis der Antiseptik und hat in einigen Indikationsbereichen klassische antiseptische Wirkstoffe wie Chlorhexidin und PVP-Iod bereits abgelöst.
Aus diesem Grund soll der Wirkstoff einer Nutzen-Risiko- Bewertung im Vergleich vor allem zu Chlorhexidin, Triclo- san und PVP-Iod unterzogen werden.
Physiko-chemische Eigenschaften
Octenidin ist kationisch und oberflächenaktiv, unterschei- det sich aber explizit von Quats wie Benzalkoniumchlorid und von Guanidinen wie Chlorhexidin, weil weder die Amid- oder Ester- noch die Anilinstruktur im Molekül ent- halten sind. Der Wirkstoff ist im pH-Bereich von 1,6-12,2 sowie unter Lichteinfluss stabil und in wässriger Lösung bis 130°C dampfsterilisierbar [1].
Mikrobiozide Wirksamkeit
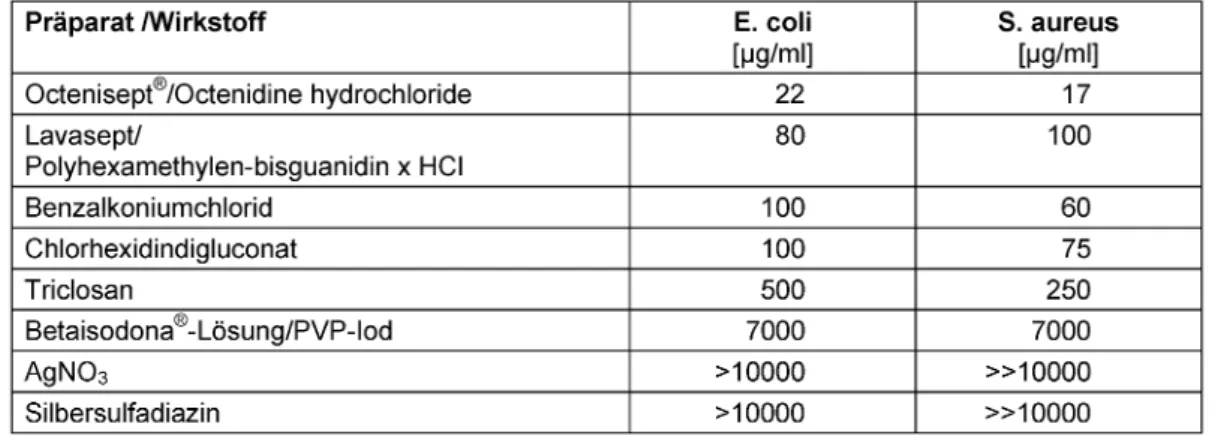
Octenidin ist mikrobiozid hoch wirksam. Lediglich gegen C. albicans zeigt sich bei Anwesenheit von Muzin eine gewisse Wirkungsschwäche (Tabelle 1).
Im Vergleich zu derzeit international in unterschiedlicher Häufigkeit angewandten antiseptischen Wirkstoffen übertrifft Octenidin diese ausnahmslos deutlich an mikro- biozider Wirksamkeit (Tabelle 2). Bei 30 min Einwirkungs- zeit ist Octenidin noch in der Verdünnung von 22 bzw.
17 µg/ml (=0,0022% bzw. 0,0017%) wirksam, was etwa
Tabelle 1: Mikrobiozide Wirksamkeit von Octenidin im quantitativen Suspensionstest [18]
Tabelle 2: Schwellenkonzentration für Mikrobiozidie (~ 3 lg-Stufen) gegenüberE.coli und S. aureus nach 30 min bei 37°C in Zellkulturmedium
1/50 der Anwendungskonzentration im Octenisept®ent- spricht.
Es ist keine bakterielle Resistenzentwicklung induzierbar [2] und auf Grund des Wirkungsmechanismus (s.u.) auch nicht zu erwarten.
Octenidin wirkt nicht gegen Bakteriensporen, ist aber gegen HSV wirksam, was z. B. bei HSV-Infektion von Ver- brennungswunden [3], [4] relevant sein kann.
Wirkungsmechanismus
Octenidin wird stark an negative Zelloberflächen adsor- biert. Dort reagiert es mit anionischen Polysacchariden der mikrobiellen Zellwand und Phospholipiden der Zell- membran, greift in die enzymatischen Systeme ein, zer- stört die Zellfunktion [5], [6] und führt zur Leckage der Cytoplasmamembran [7]. Dadurch wird die Funktion der Mitochondrien gestört [8]. Eigene Untersuchungen weisen auf eine starke Adhärenz an Lipidkomponenten in Zell-
membranen hin (z.B. Cardiolipin), was die hohe antimikro- bielle Wirkung bei gleichzeitig guter Verträglichkeit für menschliches Epithel und Wundgewebe erklären könnte.
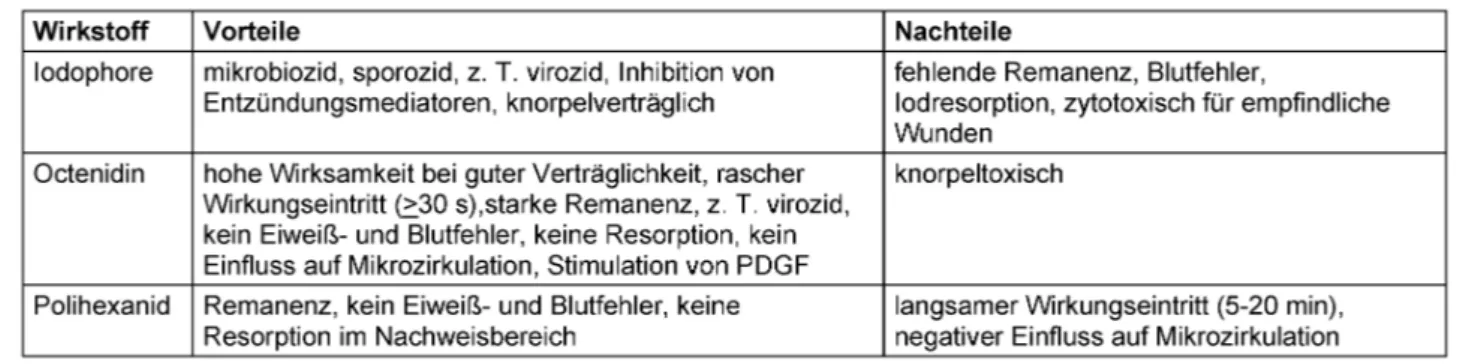
Verträglichkeit
Für Octenidin sind keine toxisch-resorptiven Risiken be- kannt. Bei Anwendung auf Wunden und vaginal ist keine Resorption nachweisbar. Bei dermaler Applikation am Versuchstier ergaben sich keine Hinweise auf neurotoxi- sche Nebenwirkungen [9]. Es gibt keine Anhaltspunkte für karzinogene, mutagene, teratogene, embryotoxische und fertilitätsbeeinträchtigende Risiken. Allergien gegen Octenidin wurden bisher nicht bekannt [1].
Ältere Befunde zur höheren Zyto- und Gewebetoxizität der Kombination Octenidin mit Phenoxyethanol im Ver- gleich zu Iodophoren und Polihexanid bedürfen der kriti- schen Einordnung, da inzwischen nachgewiesen wurde, dass Octenidin mit Zellen bzw. Proteinen stabile Komplexe
Tabelle 3: Vergleich der Zytotoxizität in der Zellkultur bei 30 min Exposition
Tabelle 4: Biokompatibilitätsindex für ausgewählte Wundantiseptika bei 30 min Einwirkungszeit [11], [19]
bildet, die unter Erhalt der antimikrobiellen Wirksamkeit eine stark reduzierte Zytotoxizität aufweisen [10]. Diese ungewöhnliche, bisher nicht beschriebene Wechselwir- kung eines Antiseptikums mit Zellen bzw. deren Matrix- bestandteilen dürfte sich in vivo günstig auf die Verträg- lichkeit auswirken, weil nur die oberste Zellschicht mit dem Wirkstoff exponiert wird, dieser aus den gebildeten Komplexen in geringen nicht zytotoxischen Konzentratio- nen in die Umgebung abgegeben wird und damit biover- fügbar bleibt. Es ist davon auszugehen, dass durch die Wundversiegelung eine nachfolgende bakterielle Koloni- sation unterbunden wird. Offensichtlich ist dieses Phäno- men die Erklärung der Diskrepanz zwischen den in vitro Befunden mit Octeniseptâ und den günstigen tierexperi- mentellen und klinischen Beobachtungen.
Die Zytotoxizität einer Chlorhexidin-haltigen Brandsalbe mit Dexpanthenol (B) entsprach bei Verdünnung auf 1,25% zellabhängig etwa der von Octenisept (O) in einer Verdünnung von 2,5% (Tabelle 3), d.h. Octenisept ist deutlich besser zellverträglich.
Um Antiseptika miteinander vergleichen zu können, wurde der Biokompatibilitätsindex (BI) eingeführt [11].
Er basiert darauf, dass unter gleichen Versuchsbedingun- gen die Mikrobiozidie und die Zytotoxizität ermittelt wer- den. Ist der BI >1, ist die Wirksamkeit höher als die Zyto- toxizität. Von allen bisher geprüften Wirkstoffen besaß Octenidin den günstigsten BI (Tabelle 4).
In einer doppelblinden, randomisierten, stratifizierten, kontrollierten Studie in Parallelgruppen an oberflächlichen Wunden am Schwein war die Kombination von Octenidin mit Phenoxyethanol in Bezug auf die Wundheilung Ringer- Lösung gleichwertig [12]. In einer doppelblinden, rando- misierten, kontrollierten klinischen Studie an chronischen Wunden wurde die Granulation über einen vierwöchigen
Beobachtungszeitraum im Vergleich zu Ringer-Lösung sogar signifikant verbessert [13].
Erythrocyten und Granulozyten werden bei 30 min Inku- bation bis 0,05% nicht durch Octenidin geschädigt [14].
Weitere biologische Wirkungen
In vitro war in einem Vollblutmodell ohne und mit LPS- Zugabe keine Stimulation von TNF-a nachweisbar. Ferner war ohne LPS-Zugabe keine Freisetzung des Wachstums- faktors PDGF-AB, dagegen mit LPS-Zugabe dosisabhängig eine Stimulierung nachweisbar [15].
Am Mäuseohr wurde der Einfluss einer lokalen Applikation auf die Mikrozirkulation untersucht. Die stärkste Arterio- lenverengung wurde durch Ethanol und ein Alkohol-ba- siertes Hautantiseptikum ausgelöst. Zwei Antiseptika auf Basis von Octenidin bzw. Polihexanid induzierten eine signifikante Erweiterung. Die funktionelle Kapillardichte und die Erythrocytenfließgeschwindigkeit wurden durch die Alkohole und ebenso durch Polihexanid signifikant reduziert, dagegen durch Octenidin nicht beeinflusst bzw.
die Fließgeschwindigkeit war nach 10 min sogar leicht erhöht. Durch die Alkohole und Polihexanid wurde die Leukozyten-Endothel-Interaktion signifikant verstärkt, während sie bei Octenidin und Kontrolle (Kochsalzlösung) unbeeinflusst blieb. Außer Octenidin verursachten alle Antiseptika ein signifikantes Leakage für FITC-Dextran.
Damit wurden durch Octenidin keine negativen Effekte induziert [16].
Tabelle 5: Vergleichende Bewertung von Octenidin, Polihexanid und PVP-Iod
Ökotoxizität
Im geschlossenen OECD-Flaschentest wird Octenidin nach 5 d vollständig abgebaut, d. h. es besteht kein ökotoxi- sches Risiko [17].
Schlussfolgerung für die Eignung zur Wundantiseptik
Octenidin-basierte Wundantiseptika sind als Wirkstoff der ersten Wahl für infizierte akute Wunden anzusehen.
Bei reduzierter Anwendungskonzentration erscheinen sie vergleichbar wie Polihexanid auch zur Behandlung infizier- ter chronischer Wunden geeignet (Tabelle 5).
Aus folgenden Gründen erscheint die Ausweitung der Anwendung von Octenidin auch auf chronische Wunden aussichtsreich:
• Die hohe Effektivität gewährleistet eine mikrobiozide Wirksamkeit bis zur Verdünnung von 0,01%, dann kommt der günstige BI zum Tragen.
• Die starke Bindung an die Zellmatrix führt zur Bildung eines lokalen Wirkstoffdepots mit der Möglichkeit der Applikation in größeren Abständen.
• Auf Grund der fehlenden Resorption sind keine resorp- tiv-toxischen Nebenwirkungen zu befürchten.
Literatur
1. Kramer A, Müller G. Octenidindihydrochlorid. In: Kramer A, Assadian O, Hrsg. Wallhäußers Praxis der Sterilisation, Desinfektion, Antiseptik und Konservierung. Stuttgart: Thieme;
im Druck.
2. Al-Doori Z, Goroncy-Bermes P, Gemmell CG, Morrison D. Low- level exposure of MRSA to octenidine dihydrochloride does not select for resistance. J Antimicrob Chemother. 2007;59(6):1280- 1.
3. Zhou L, Zhang K, Sun T. Clinical investigation of burn wound infection with type I herpes simplex virus. Zhonghua Shao Shang Za Zhi. 2001;17(2):105-7.
4. Chen CC, Chen CL, Chiang CH, Pan SC. Herpes simplex infection in a minor burn wound: a case report. J Burn Care Rehabil.
2005;26(5):453-5.
5. Harke HR, Streck M. Octenidin - ein neuer antimikrobieller Wirkstoff. Hyg Med. 1989;14:372-4.
6. Kramer A. Chlorhexidin, Octenidin. In: von Bruchhausen F, Ebel S, Frahm AWr Hakkenthal E, Holzgrube U, Dannhardt G, Hrsg.
Hagers Handbuch der Pharmazeutischen Praxis, Bd 7, Stoffe A- O. Berlin: Springer; 1993.
7. Ghannoum MA, Elteen KA, Ellabib M, Whittaker PA. Antimycotic effects of octenidine and pirtenidine. J Antimicrob Chem.
1990;25(2):237-45.
8. Ellabib M, Ghannoum MA, Whittaker PA. Effects of the pyridinamines octenidine and pirtenidine on yeast mitochondrial function. Biochem Soc Trans. 1990;18(2):342-3.
9. Kramer A, Mersch-Sundermann, Gerdes H, Pitten F-A, Tronnier H. Toxikologische Bewertung für die Händedesinfektion relevanter antimikrobieller Wirkstoffe. In: Kampf G, Hrsg. Hände-Hygiene im Gesundheitswesen. Berlin: Springer; 2003. S.105-60.
10. Müller G, Kramer A. Wechselwirkung von Octenidin und Chlorhexidin mit Säugerzellen und die resultierende Mikrobiozidie (Remanenzverhalten) der Reaktionsprodukte. GMS
Krankenhaushyg Interdiszip. 2007;2(2):Doc46. Verfügbar unter:
http://www.egms.de/en/journals/dgkh/2007- 2/dgkh000079.shtml.
11. Müller G, Kramer A, Karkour Y. Biokompatibilitätsindex silberhaltiger Wundantiseptika. GMS Krankenhaushyg Interdiszip.
2006;1(1):Doc31. Verfügbar unter:
http://www.egms.de/en/journals/dgkh/2006- 1/dgkh000031.shtml
12. Kramer A, Roth B, Müller G, Rudolph P, Klöcker N. Influence of the antiseptic agents polihexanide and octenidine on FL-cells and on healing of experimental superficial aseptic wounds in piglets. A double-blind, randomised, stratified, controlled, parallel- group study. Skin Pharmacol Physiol. 2004;17:141-6.
13. Vanscheidt W, Bar M, May TW, Siebert J. Beeinflussung der Wundheilung bei chronischen Beinulzera durch ein lokales Octenidin-dihydrochloridhaltiges Wundantiseptikum. Hyg Med.
2005;30(5):153-8.
14. Wagner KH, Jurss A, Zarembach B, Elmadfa I. Impact of antiseptics on radical metabolism, antioxidant status and genotoxic stress in blood cells: povidone-iodine versus octenidine dihydrochloride. Toxicol In Vitro. 2004;18(4):411-8.
15. Menke H, Pelzer M, Raff T, Siebert J, Germann G. Ein neues lokales Antiseptikum zur Oberflächenbehandlung bei Schwerstverbrannten. Akt Traumotol. 2001;31:211-5.
16. Langer S, Sedigh Salakdeh M, Goertz O, Steinau HU,
Steinstraesser L, Homann HH. The impact of topical antiseptics on skin microcirculation. Europ J Med Res. 2004;9(9):449-54.
17. Zöllner H, Kramer A, Youssef P, Youssef U, Adrian V. Orientierende Untersuchungen zur biologischen Abbaubarkeit von ausgewählten mikrobioziden Wirkstoffen. Hyg Med. 1995;20:401-7.
18. Pitten FA, Werner HP, Kramer A. A standardized test to assess the impact of different organic challenges on the antimicrobial activity of antiseptics. J Hosp Infect. 2003;55(2):108-15.
19. Müller G, Kramer A. Biocompatibility index of antiseptic agents by parallel assessment of antimicrobial activity and cellular cytotoxicity. Chem Biol Interaction. Submitted.
Erratum
Als Vorname des Autors Müller wurde irrtümlich "Georg"
angegeben.
Korrespondenzadresse:
Prof. Dr. med. Axel Kramer
Institut für Hygiene und Umweltmedizin der Ernst-Moritz- Arndt-Universität, Walther-Rathenau-Straße 49 a, 17489 Greifswald, Deutschland, Tel.: +49-(0)3834-515542, Telefax: +49-(0)3834-515541
kramer@uni-greifswald.de
Bitte zitieren als
Kramer A, Müller G. Mikrobiozide Wirksamkeit, weitere biologische Wirkungen, Verträglichkeit und Abbaubarkeit von
Octenidindihydrochlorid. GMS Krankenhaushyg Interdiszip.
2007;2(2):Doc49.
Artikel online frei zugänglich unter
http://www.egms.de/en/journals/dgkh/2007-2/dgkh000082.shtml
Veröffentlicht:28.12.2007
Veröffentlicht mit Erratum:08.04.2008
Copyright
©2007 Kramer et al. Dieser Artikel ist ein Open Access-Artikel und steht unter den Creative Commons Lizenzbedingungen
(http://creativecommons.org/licenses/by-nc-nd/3.0/deed.de). Er darf vervielfältigt, verbreitet und öffentlich zugänglich gemacht werden, vorausgesetzt dass Autor und Quelle genannt werden.
![Tabelle 4: Biokompatibilitätsindex für ausgewählte Wundantiseptika bei 30 min Einwirkungszeit [11], [19]](https://thumb-eu.123doks.com/thumbv2/1library_info/4839942.1628870/3.892.146.754.323.533/tabelle-biokompatibilitätsindex-ausgewählte-wundantiseptika-min-einwirkungszeit.webp)