Chemie Eigenschaftsvergleich II: Alkane und Alkanole – die Löslichkeit
Datum:
Klasse 10
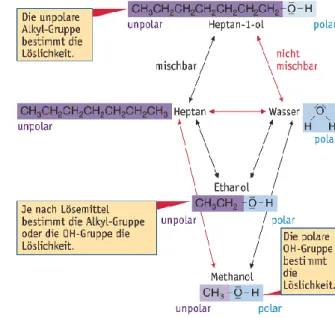
Die ersten Alkanole der homologen Reihe – Methanol, Ethanol und Propanol – mischen sich in jedem Verhältnis mit Wasser. Bei den darauf folgenden Alkanolen nimmt die Löslichkeit mit steigender Anzahl der Kohlenstoff-Atome stark ab. Schon Hexanol ist in Wasser nahezu unlöslich (Abb . 1). Die polare Hydroxy- Gruppe bewirkt die Löslichkeit der kurzkettigen Alkanole in Wasser: Die O–H-Bindung in der Hydroxy-Gruppe eines Alkohol-Moleküls ist ähnlich polar wie die O–H-Bindungen in einem Wasser-Molekül . Zwischen den OH-Gruppen der Alkohol-Moleküle und den Wasser- Molekülen können sich daher Wasserstoffbrücken bilden.
Kurzkettige Alkanole sind deshalb hydrophil (wasserfreundlich). Die unpolaren Alkyl-Reste der Alkanol- Moleküle begründen die Löslichkeit der Alkanole in Alkanen und anderen lipophilen Lösemitteln:
Zwischen den Alkanol-Molekülen und den Alkan- Molekülen wir ken Van-der-Waals-Kräfte (Abb . 3).
Höhere Alkanole sind deshalb lipophil (fettfreundlich) und hydrophob (wasserfeindlich).
Bei Methanol ist derEinfluss der CH₃-Gruppe so gering, dass die Wasserstoffbrücken zwischen den Methanol- Molekülen bei Zugabe von Heptan nicht getrennt werden können. Methanol ist daher als einziges Alkanol in Heptan nur geringfügig löslich.
Methanol ist hydrophil (wasserliebend) und lipophob (fettfeindlich).
Alkanol-Moleküle besitzen eine unpolare Alkyl-Gruppe und eine polare OH-Gruppe. Zwischen den Alkohol-Molekülen wirken Wasserstoffbrücken. Die Siedetemperaturen sind daher höher als die von vergleichbaren Alkanen. Kurzkettige Alkanole sind hydrophil und lösen sich in Wasser. Ethanol und die höheren Alkanole lösen sich in Alkanen.
Aufgaben:
1. Entwickle ein Experiment, das den Einfluss des Alkyl-Restes von Alkanolen auf die Löslichkeit in Wasser zeigt.
2. Interpretiere Abb. 2.
3. Bei der Lösung von 100 ml Ethanol in 100 ml Wasser ist das Gesamtvolumen der Mischung deutlich kleiner als 200 ml. Erkläre diese Beobachtung.
4. Zeichne die Strukturformel der Verbindung mit der Molekülformel C₄H₉ – SH und beurteile den hydrophilen Charakterder Verbindung.
5. Zwischen Heptan-1-ol-Molekülen und Wasser-Molekülen liegen Wasserstoffbrücken vor.
Begründe, warum die beiden Flüssigkeiten trotzdem nicht miteinander mischbar sind.
Quelle (eigene Bearbeitung nach): Chemie heute 9/10, Schroedel Verlag Braunschweig 2019, S.76-77
Abb. 1: Löslichkeit von Alkanolen in Wasser
Abb. 2: Die Molekülstruktur beeinflusst die Löslichkeit
Chemie
Isomerie der Alkohole Datum:
Klasse 10
Beim Propanol und den höheren Alkanolen tritt Isomerie auf: Die OH-Gruppen können an unterschiedliche C-Atome gebunden sein. Beim Butan-1-ol ist das C-Atom, das die OH-Gruppe trägt , mit einem weiteren C-Atom verbunden . Man spricht in einem solchen Fall von einem primären Alkanol.
Butan- 2-ol ist ein Beispiel für ein sekundäres Alkanol: Das C- Atom , das die OH-Gruppe trägt, ist mit zwei weiteren C-Atomen verbunden. 2-Methylpropan-2-ol ist ein tertiäres Alkanol: Hier ist das C-Atom mit der OH-Gruppe mit drei weiteren C-Atomen verknüpft.
Aufgaben:
1. Begründe die unterschiedliche Löslichkeit der isomeren Butanole in Wasser.
2. Ordne die folgenden Stoffe nach steigender Löslichkeit in Heptan: Propan-2-ol, tert- Butanol, Methanol, Butan-1-ol. Begründe deine Anordnung.
3. Hexadecan-1-ol schmilzt bei 49 ° C. Beschreibe, was beim Schmelzen geschieht.
4. Beschreibe modellhaft, was beim Mischen von Methanol mit Wasser und beim Mischen von Butan-1-ol mit Heptan geschieht.