Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen
Volltext
Abbildung

ÄHNLICHE DOKUMENTE
4 Ein Nutzennachweis nach Satz 2 kann nur anerkannt wer- den, wenn eine Zuordnung der jeweiligen Studie zu einem der Anwendungsbereiche nach § 22 Absatz 1 Nummer 1 bis 9 und Absatz
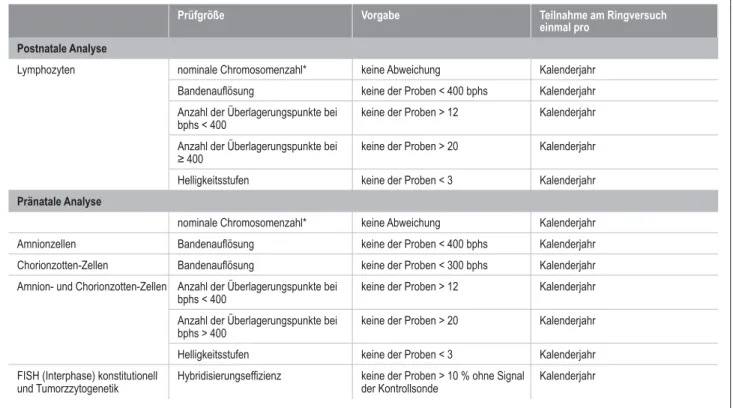
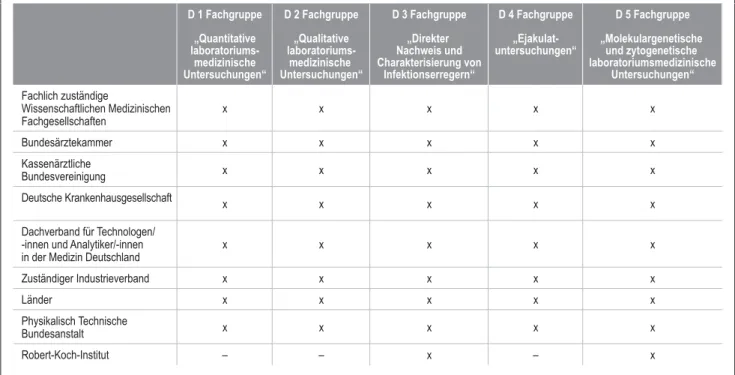
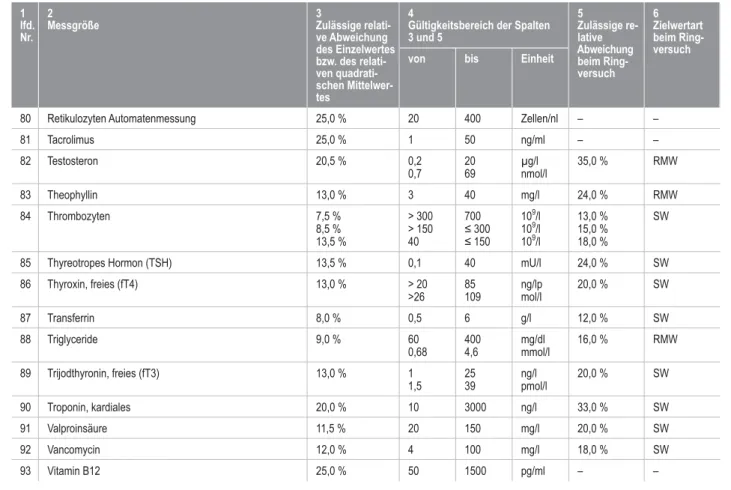
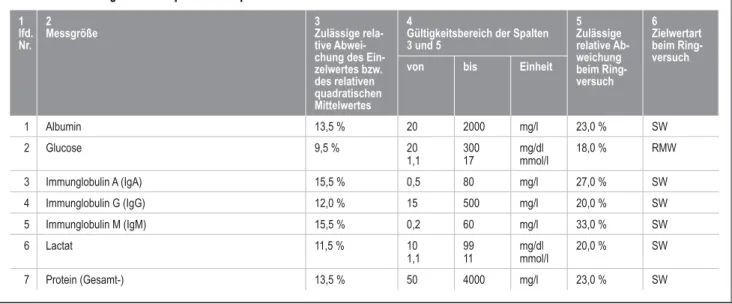
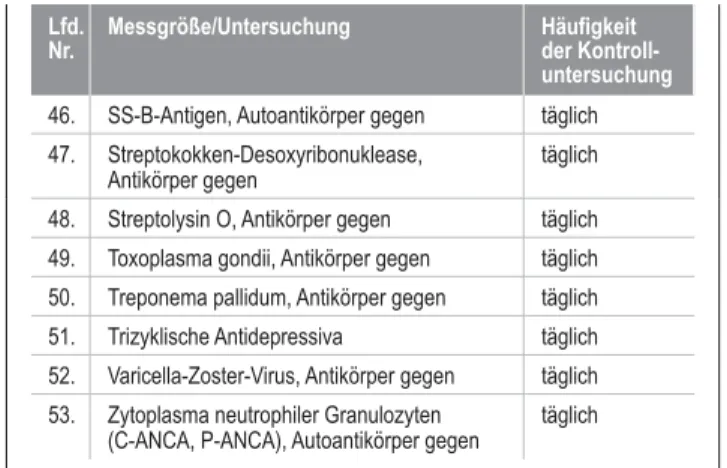
Gemäß Beschluss des Vorstands der Bundesärztekammer vom 23.08.2013 wird in der Tabelle B 2.2 (Externe Qualitätssicherung [Ringversuche]) in Abschnitt B 2 –
Echinococcus, Antikörper gegen Entamoeba histolytika, Antikörper gegen Glutaminase, Antikörper gegen Zytoplasma neutrophiler Granulozyten (C-ANCA, P-ANCA), Antikörper gegen..
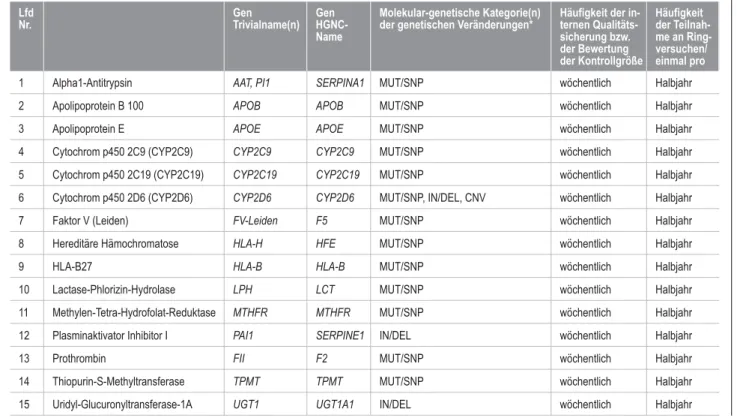
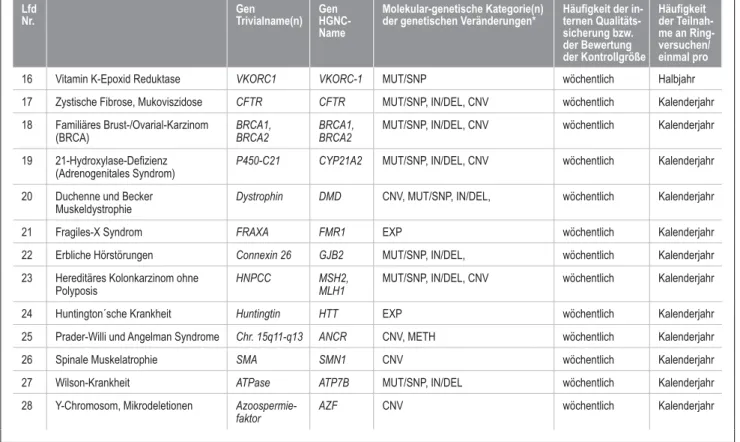
Für molekulargenetische Untersuchungen, die nicht in Tabelle B 5–1 Spalte 7 gelistet sind, ist die externe Quali- tätssicherung durch die Teilnahme an einem Ringversuch, welcher
Glatte Muskulatur, Autoantikörper gegen Glutaminase, Antikörper gegen HBc-Antigen, Antikörper gegen HBe-Antigen, Antikörper gegen HBs-Antigen, Antikörper gegen
Es muss immer der Handelsname des jeweiligen Präparats und, wenn möglich, die Chargennummer angegeben werden, damit jede Meldung genau zugeordnet werden kann (6).. Allerdings sollte
(1) Die Referenzinstitutionen stellen jeweils sicher, dass für alle genannten Untersuchungen Ringversuche in so aus- reichender Zahl angeboten werden, dass jedes medizini-
Wenn das Untersuchungsmaterial einem Patienten nicht zwei- felsfrei zuzuordnen ist, aber das Untersuchungsmaterial in glei- cher Qualität nicht wieder gewonnen werden kann oder