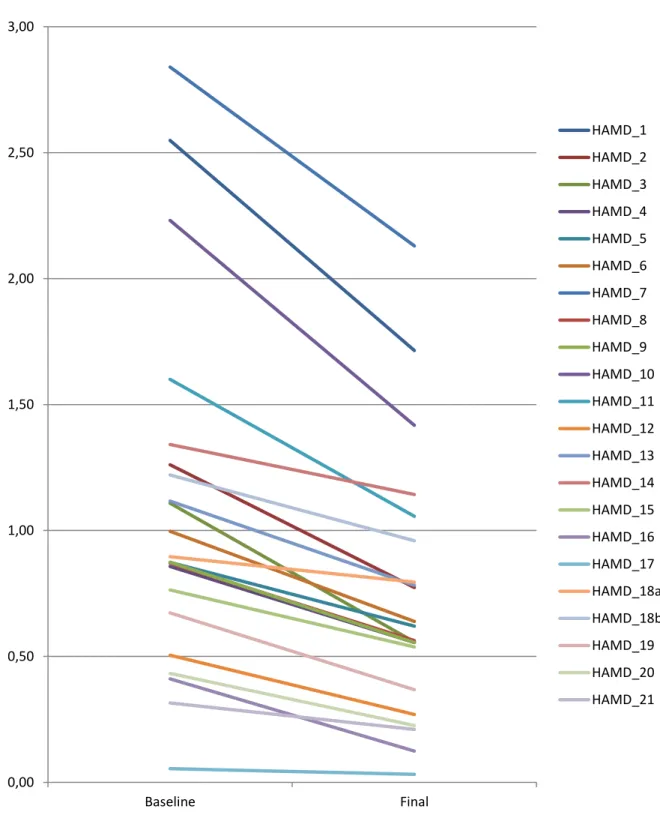
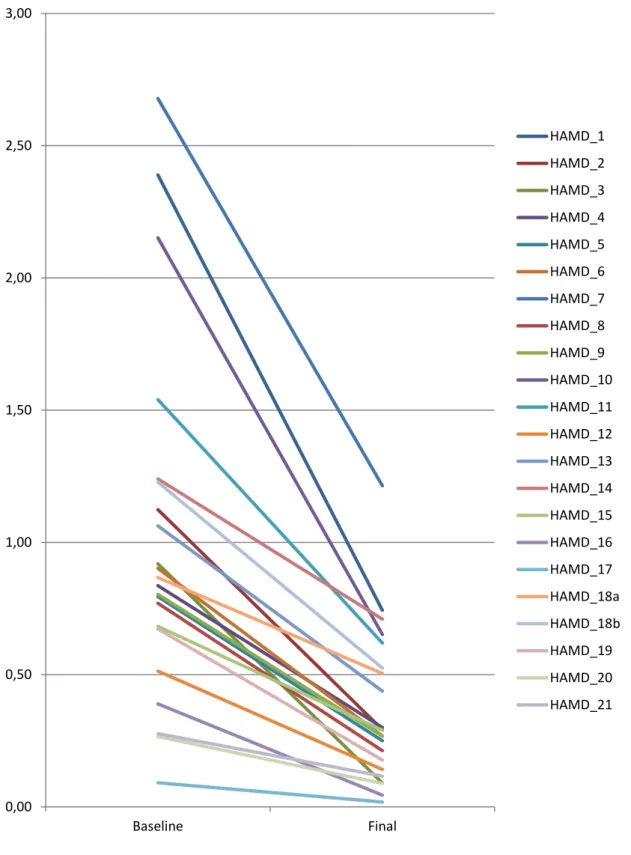
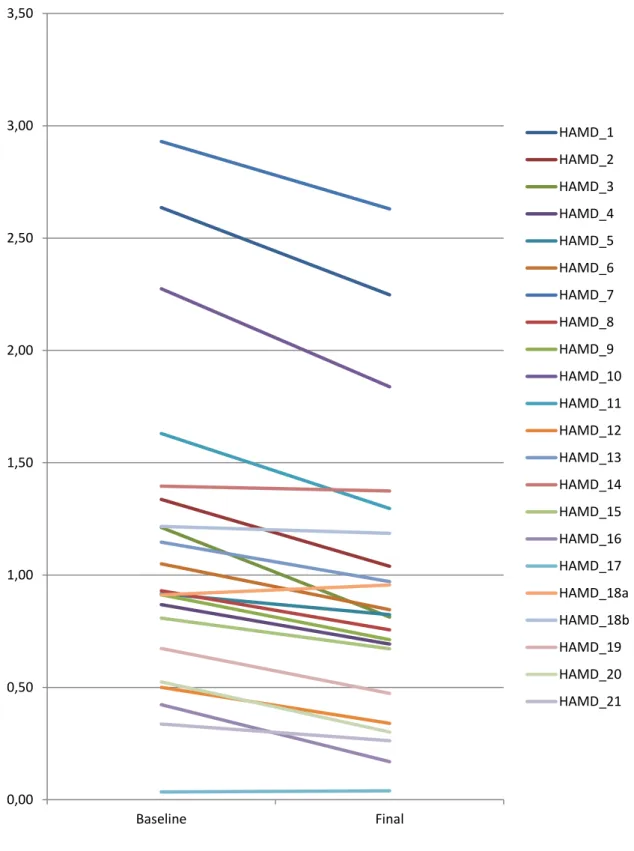
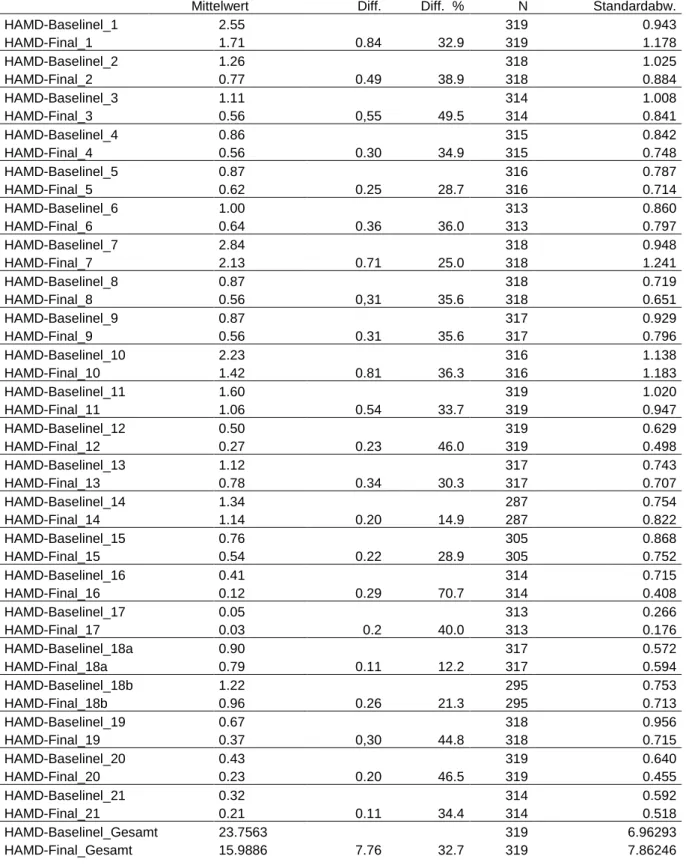
PSYCHOPATHOLOGISCHE EFFEKTE DER RTMS-BEHANDLUNG BEI DEPRESSION: ITEM-ANALYSEN DER HAMILTON DEPRESSION RATING SCALE IN EINEM GROSSEN PATIENTENKOLLEKTIV
Volltext
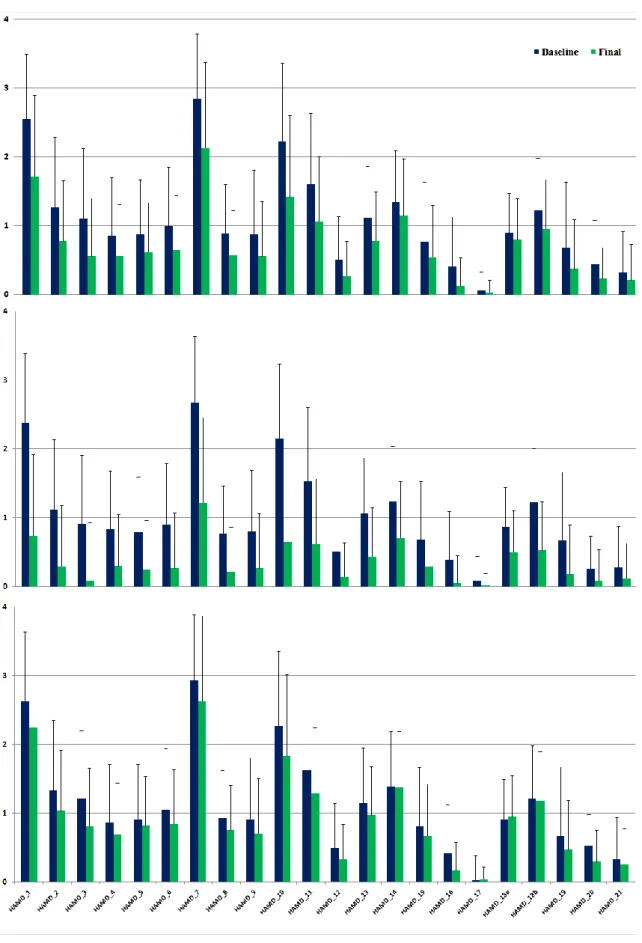
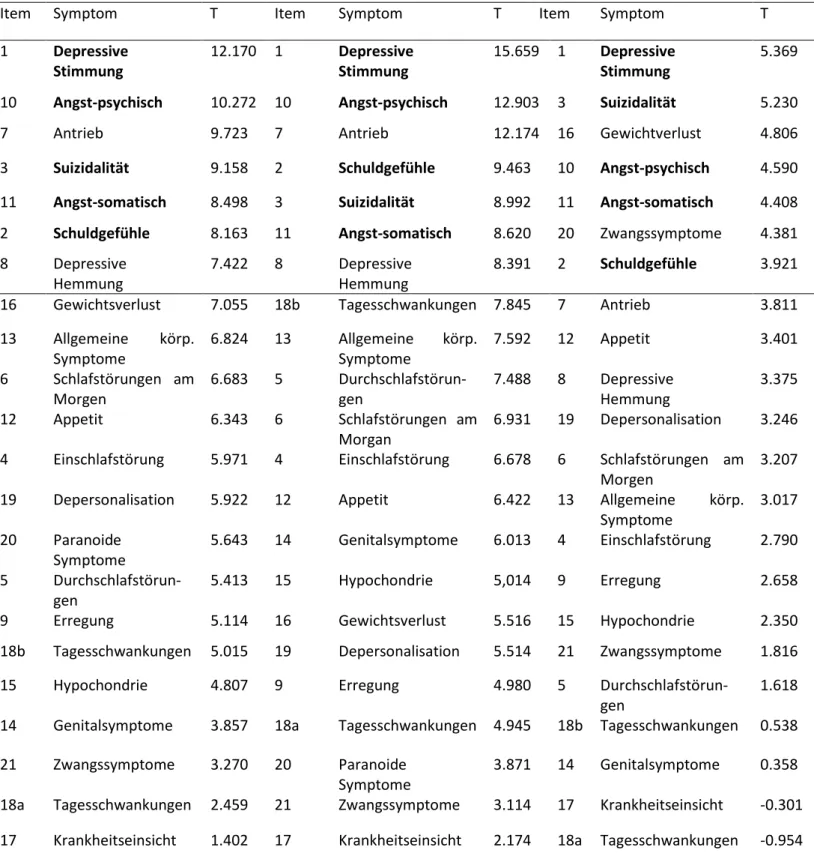
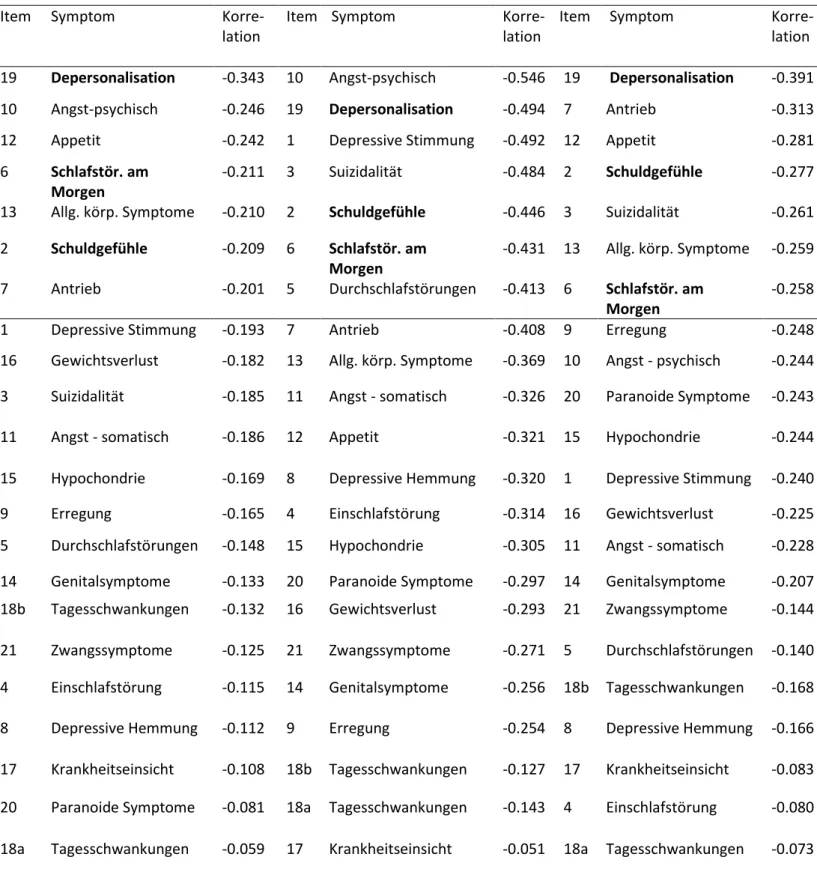
Abbildung

ÄHNLICHE DOKUMENTE
Dies spielt neben dem Aspekt der Aktualität auch eine wichtige Rolle für die Rezeption der Werke dieser Autoren sowohl in Polen als auch im deutschsprachigen Raum, da die Leser
Wenn du also glücklich werden willst und es auch bleiben möchtest, dann musst du dir über- legen, was du ab JETZT denken willst, weil deine Ge- danken deine
Besides, prevalence by depression suspicion method was also per- formed: 6 studies (503 patients) diagnosed this disorder using hospital and anxiety depression scale (HADS), 5
HDRS: Hamilton Depression Rating Scale (Hamilton, 1967); YMRS: Young Mania Rating Scale (Young et
Deutsches Ärzteblatt 100, Ausgabe 8 vom 21.02.2003, Seite A-504 Als Therapie der zweiten Wahl ist die EKT angezeigt bei:. therapieresistenter (pharmakoresistenter) Major
Die Dauer der Episode ist zwar ein ähnlicher Prädiktor wie chronische Depression, allerdings konnte in der vorliegenden Studie die Dauer der Episode im Gegensatz zum Vorliegen einer
Therapie: Depressive Erkrankun- gen sind heute gut behandelbar Die medikamentöse Behandlung ist State of the Art bei rezidivierenden und schweren depressiven Erkrankungen sowie
Besonders betrof- fen von dem Dilemma des „Publication-BIAs“ sind Meta-Analysen aus Bereichen, in denen aufgrund geringer Ereignisanzahl und somit sehr hoher Fallzahl zur