- 13 -
C 2 Meilensteine der organischen Chemie
1 Im Jahr 1859 stellte der deutsche Chemiker Peter Grieß den ersten Azofarbstoff, das Anilingelb, her. Er schuf damit die Grundlage für die moderne Farbstoffindustrie. Azofarbstoffe bilden seitdem die größte kommerziell genutzte Farbstoffklasse.
N N
NH2
Abb. 1: Strukturformel von Anilingelb
1.1 Erstellen Sie die Reaktionsgleichungen für die Synthese von Anilingelb aus Anilin (Phenylamin, Aminobenzol) und benennen Sie die Teilschritte der
Synthese! [7 BE]
1.2 Erklären Sie am Beispiel des Anilingelbs unter Mitverwendung von Fachbegriffen den Zusammenhang zwischen Molekülstruktur und Farbigkeit! Ermitteln Sie mithilfe des Farbkreises in Abb. 2, in welchem
Wellenlängenbereich Anilingelb das Licht absorbiert! [8 BE]
orange gelb
gelbgrün
blaugrün
grünblau blau
violett rot
595 nm
580 nm
500 nm
490 nm
480 nm 440 nm
605 nm
700 nm
400 nm
Abb. 2: Farbkreis
(Fortsetzung nächste Seite)
- 14 -
2 Der Begriff Isomerie wurde 1830 vom schwedischen Chemiker Jöns Jakob Berzelius in die Chemie eingeführt. Er verstand darunter Stoffe, die „die gleichen Elementaratome, aber in ungleicher Weise zusammengelegt“
enthalten.
Die folgenden Strukturen kennzeichnen Moleküle, an denen verschiedene Isomerietypen aufgezeigt werden können:
COOH C C COOH
H OH O
H H
C H
C H
C H
O
OH OH
CH2OH
C C
CH OH
OH CH2OH O
H H
A (Fischer-Projektion) B (Fischer-Projektion) C
C C
CH H
OH CH2OH O
H O
H
COOH
C C COOH
OH OH H
H
COOH C C COOH
OH H H
O H
D E (Fischer-Projektion) F (Fischer-Projektion) Leiten Sie aus der Tabelle vier Isomerietypen ab, benennen Sie diese und geben Sie je ein zugehöriges Isomeriepaar an! [6 BE]
3 Im Jahr 1894 veröffentlichte der deutsche Chemiker Emil Fischer sein weg- weisendes Modell zur Wirkungsweise von Enzymen. Für die Entdeckung der Kristallisierbarkeit von Enzymen erhielt der US-amerikanischer Bio- chemiker James Sumner 1946 den Chemie-Nobelpreis.
Das Enzym Urease katalysiert die Hydrolyse von Harnstoff (H2NCONH2) zu Kohlenstoffdioxid und Ammoniak. Die Konzentration der Hydrolyseprodukte lässt sich mithilfe der dazu proportionalen elektrischen Leitfähigkeit
ermitteln.
3.1 Formulieren Sie die Reaktionsgleichung für die Hydrolyse von Harnstoff
und begründen Sie, warum sich die Leitfähigkeit der Lösung erhöht! [5 BE]
(Fortsetzung nächste Seite)
- 15 -
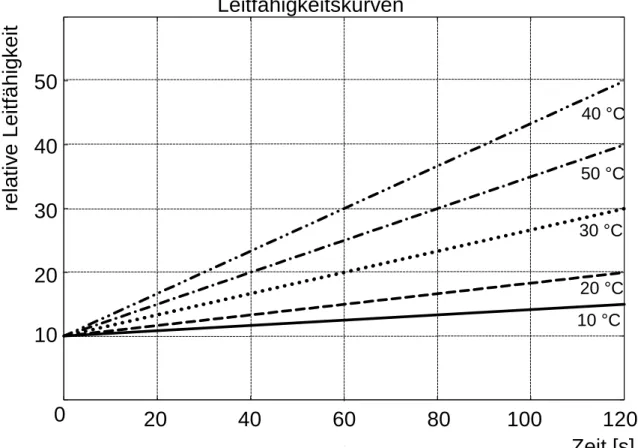
3.2 Verfolgt man den zeitlichen Verlauf der Leitfähigkeit in Abhängigkeit von der Temperatur, so erhält man Ergebnisse, die im folgenden Diagramm dargestellt sind:
0
10 20 30 40 50 60
0 20 40 60 80 100 120
relative Leitfähigkeit
Zei t [s]
Zeit [s]
relative Leitfähigkeit
10 20 30 40 50
20 40 60 80 100 120
0
10 °C 20 °C 30 °C 40 °C
50 °C
Leitfähigkeitskurven
Abb. 3: Leitfähigkeitskurven bei unterschiedlichen Temperaturen (c(S) = 10-2 mol/l)
Erläutern Sie vergleichend den Verlauf der Leitfähigkeitskurven! Erklären Sie den bis zum Ende der Reaktionen in den entsprechenden Versuchs- ansätzen zu erwartenden weiteren Verlauf der Kurven bei 30 °C und 40 °C
und skizzieren Sie diese Kurvenverläufe! [10 BE]
3.3 Im Thioharnstoff ist das Sauerstoffatom des Harnstoffmoleküls durch ein Schwefelatom ersetzt. Versucht man Thioharnstoff mit Urease zu
hydrolysieren, so beobachtet man keine Reaktion.
Erklären Sie diesen Befund anhand eines Modells unter Mitverwendung
einer beschrifteten Skizze! [4 BE]
_______
[40 BE]