Philipps-Universität Marburg
Fachbereich Chemie Lehramt
Sommersemester 2006
Seminar: Übungen im Experimentalvortrag (OC)
Experimentalvortrag vom 08.06.06
Ina Böckler Auf der Heide 4 35085 Hachborn
Mit einem Menü durch die
Organische Chemie
Hinweis:
Dieses Protokoll stammt von der Seite www.chids.de (Chemie in der Schule).
Dort können unterschiedliche Materialien für den Schulunterricht heruntergeladen werden, unter anderem hunderte von Experimentalvorträgen so wie der vorliegende:
http://online-media.uni-marburg.de/chemie/chids/veranstaltungen/uebungen_experimentalvortrag.html
Inhaltsverzeichnis:
1. Einleitung………...………1
2. Definition Nahrungsmittel………...……….2
3. Klassifizierung der Nahrungsmittel………3
4. Das Menü………...8
4.1 Vorspeise: Baguette mit „Lachskaviar“ à la Ferran Adrià …………..8
4.1.1 Das Baguette, die Stärke, die α-Amylase und der Geschmack…………8
Demo 1: Stärkeabbau durch Speichel……….……….9
Versuch 1: Stärke-Smiley……….………16
Versuch 2: Fehling-Probe……….18
4.1.2 Lebensmittelfärbung und Alginate in der Lebensmittelindustrie…...….20
Versuch 3: Darstellung von E 110 (Gelborange S)……….……….22
Versuch 4: Kaviar aus Alginat………...27
4.2 Hauptgericht: Schweinefilet an neuen Kartoffeln ………31
4.2.1 Fleisch und Fleischzartmacher………...…31
Demo 2: Enzymwirkung von Papaya...…...…...…...…...35
Versuch 5: Aminosäure-Nachweis mit Ninhydrin………...……...36
4.2.2 Food-Design: Der etwas andere Stärkenachweis………...40
Versuch 6: Die Kartoffelschrift………41
4.3 Nachspeise: Obstsalat ………...42
4.3.1 Das natürliche Übel………..42
Demo 3: Enzymatische Bräunung………...………..43
4.3.2 „Omas Tricks und Tipps“………..43
Versuch 7: Reduktionswirkung von Ascorbinsäure……...……….46
4.3.3 Guten Appetit!!!...49
Demo 4: Geschmack von Obstsalat………...49
5. Schulrelevanz………...49
5.1 Das Thema im Lehrplan………49
5.2 Bedeutung von Essen und Trinken: Eine Rechtfertigung für die Behandlung im Chemieunterricht…….50
6. Literaturverzeichnis………...……….51
1. Einleitung:
Bei dem Experimentalvortrag mit dem wohlklingenden Titel „Mit einem Menü durch die Organische Chemie“ handelt es sich um einen Vortrag, der sich mit der Chemie bestimmter Nahrungsmittel beschäftigt.
Die ausgewählten Nahrungsmittel sind so aufeinander abgestimmt, dass sie ein sinnvolles dreigängiges Menü mit Vorspeise, Hauptgericht und Nachspeise ergeben. Durch diese Menüabfolge und die dazugehörigen wohlbekannten oder auch mal etwas exotischeren Zutaten ergibt sich ein natürlicher roter Faden, an dem sich der Vortrag entlang hangelt.
Das erstellte Menü liefert dabei neben interessanten Untersuchungsansätzen, die sich oft als alltagsrelevante Fragen oder naturwissenschaftliche Betrachtungen der
„Geheimtipps von Oma“ entpuppen, auch viele mögliche chemische Experimente zum Thema der Nährstoffe, insbesondere der Kohlenhydrate und Proteine.
Darüber hinaus werden weitere Nahrungsmittelbestandteile bzw. deren Inhaltsstoffe und Zusatzstoffe wie z.B. Lebensmittelfarbstoffe, untersucht. Die meisten der durchgeführten Experimente sind auch als Schülerversuche denkbar.
Im Rahmen dieses Themas werden dann die Inhaltsstoffe und Eigenschaften der ausgewählten Nahrungsmittel genauer untersucht und mit bekannten Reaktionen der Organischen Chemie nachgewiesen und überprüft. Um die bekannten chemischen Reaktionen interessanter zu gestalten, sind sie oftmals in einen neuen Zusammenhang und in eine andere Gestalt gebracht. Auf die Fette wird im Rahmen dieses Experimentalvortrags nicht eingegangen, da diese als eigenständiges Thema innerhalb eines anderen Vortrags in diesem Semester behandelt wurden.
Letztendlich soll dieser Vortrag dazu beitragen, dass das Fach Chemie von Schülern als wichtiges Fach erkannt wird, mit dessen Hilfe man alltägliche Phänomene wie das Zubereiten von Nahrungsmitteln und die Eigenschaften der Inhaltsstoffe besser verstehen und im optimalen Fall auch seinen Mitmenschen wie z.B. Geschwistern oder Eltern erklären kann. Dadurch soll gewährleistet werden, dass der Schulstoff nicht als isoliertes Wissensgut in der unendlichen Weite eines Schülerkopfes verloren geht, sondern durch ständiges Wiederholen im Zusammenhang mit der Lebensumwelt eines Schülers gefestigt wird. Darüber hinaus ist das Thema der Chemie von Nahrungsmitteln für das Fach Chemie an sich sehr wichtig, da es sein Image aufbessern kann, wenn Schüler merken, dass
alles in ihrem Leben aus Chemie besteht und mithilfe ihres gelernten Wissens erschlossen werden kann. Dies würde neben der „Chemie ist wenn es knallt und stinkt-Philosophie“ eine neue Abteilung der „Chemie ist unser Leben und unsere Umwelt-Philosophie“ erschließen und somit ein weites Interessenfeld für Schüler eröffnen.
2. Definition Nahrungsmittel:
Um die Chemie von Nahrungsmitteln hinreichend untersuchen zu können, muss man sich zuerst darüber im Klaren sein, was überhaupt durch den Begriff
„Nahrungsmittel“ alles eingeschlossen wird. Zu Beginn muss erwähnt werden, dass es sich bei diesem Begriff um einen veralteten Begriff handelt, der längst durch den Begriff „Lebensmittel“ verdrängt wurde. In diesem Vortrag wurde aber auf den Begriff „Nahrungsmittel“ zurückgegriffen, da so auch die Bezeichnung des Themas im Hessischen Lehrplan für den Gymnasialen Bildungsgang lautet.
Die allgemeine Definition aus der Deutschen Basisverordnung Lebensmittelrecht (DBL, Artikel 2) lautet wie folgt:
„Lebensmittel (früher Nahrungsmittel) sind alle Stoffe oder Erzeugnisse, die dazu bestimmt sind oder von denen nach vernünftigem Ermessen erwartet werden kann, dass sie in verarbeitetem, teilweise verarbeitetem oder unverarbeitetem Zustand von Menschen aufgenommen werden.
Zu Lebensmitteln zählen auch Getränke, Kaugummi sowie alle Stoffe, einschließlich Wasser, die dem Lebensmittel bei seiner Herstellung oder Ver- oder Bearbeitung absichtlich zugesetzt werden.“
Der Begriff „Lebensmittel“ impliziert, dass es sich dabei um Mittel handelt, von denen man lebt. Manchmal wird die Bedeutung dieses Wortes auch abgeändert und dient dann auch als Abgrenzung zu Nahrungsmitteln, die nicht leben, wie z.B.
pasteurisierte Milch, die keinerlei Mikroorganismen enthält.
Außerdem wird der Begriff „Lebensmittel“ oft als übergeordneter Begriff für Nahrungs- und Genussmittel verwendet, wobei zwischen reiner Nahrungsaufnahme und Genuss nicht immer eine scharfe Grenze zu ziehen ist.
Eine Unterscheidungsmöglichkeit besteht darin, dass im Gegensatz zu Nahrungsmitteln der Nährwert bei Genussmitteln kaum von Bedeutung ist. Dieser
Öle und Fette
Kohlenhydratreiche Nahrungsmittel: Brot, Kartoffeln, Reis, Nudeln
Gemüse Obst
Milch und Milchprodukte
Fisch, Fleisch und Fleischprodukte
Getränke
kleine Überblick veranschaulicht, dass es viele Möglichkeiten gibt, Lebensmittel zu definieren. Im Folgenden werde ich aber die allgemeine Definition aus der DBL als zugrunde liegende Auffassung des Begriffes verwenden.
Da es sich dieser allgemeinen Definition zufolge bei den Lebensmitteln um ein sehr weites Feld handelt, ist es ratsam, eine Klassifizierung vorzunehmen, mithilfe welcher man einen besseren Überblick über die Lebensmittel bekommt.
3. Klassifizierung von Nahrungsmitteln:
Entsprechend unseres Speiseplans kann man die Nahrungsmittel in 7 Nahrungsmittelklassen unterteilen.
Der Ernährungskreis gibt Aufschluss über die Anteile an Lebensmitteln, die zur Ernährung herangezogen werden sollten. Dabei stehen Getränke in der Mitte und nehmen eine Sonderstellung ein, da man zwar 30 Tage ohne feste Nahrung-, aber nur 3 Tage ohne Trinken überleben kann. Ergänzt wird dieses „Überlebens- Schema“ noch durch die Tatsache, dass man nur 3 Minuten ohne Atmen überleben kann.
Abb. 1: Die 7 Nahrungsmittelklassen im Ernährungskreis [2]
Auf dem abgebildeten Kuchenschema findet man ihrem Anteil an unserer Ernährung entsprechend um die Getränke kreisförmig angeordnet noch folgende Nahrungsmittelklassen: Kohlenhydratreiche Nahrungsmittel (Brot, Nudeln, Reis, Kartoffeln), Gemüse, Obst, Milch und Milchprodukte (Käse), Eiweißreiche Nahrungsmittel (Fisch, Fleisch und Fleischprodukte) sowie die Klasse der Fette und Öle. Aus der Übersicht geht deutlich hervor, dass der Hauptanteil der täglich aufgenommenen Nahrung aus Kohlenhydraten, Gemüse und Obst bestehen sollte.
Eingeschränkt werden sollte der Konsum von Fleisch, Fisch, Fett und fetthaltigen Lebensmitteln.
Neben dieser groben Einteilung in die 7 Nahrungsmittelklassen, erfolgt die geläufigste- und lebensmittelchemisch sinnvollste Einteilung im Allgemeinen nach natürlichen Inhaltsstoffen. Diese gliedert man wiederum in Nährstoffe, Begleitstoffe und Zusatzstoffe. [1]
Nahrungsmittel
Nährstoffe Begleitstoffe Zusatzstoffe
Essen:
30 Tage
Trinken:
3 Tage Atmen:
3 Minuten Abb. 2: Das Überlebensschema (stark vereinfacht und nicht maßstabsgerecht)
Abb. 3: Klassifizierung nach natürlichen Inhaltsstoffen
Zu den Nährstoffen zählen Nahrungsmittelinhaltsstoffe, die dem Aufbau und Erhalt der Körpersubstanz dienen, sowie als Energielieferant und biochemischer Funktionsträger fungieren können [1].
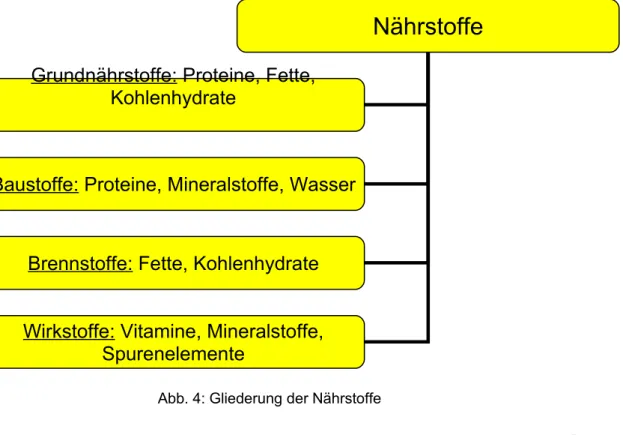
Die Nährstoffe besitzen einen experimentell bestimmbaren Nährwert, welcher den energieliefernden Beitrag eines Nahrungsmittels angibt. Die Nährstoffe lassen sich ihren spezifischen Aufgaben entsprechend nochmals unterteilen in Grundnährstoffe, Baustoffe, Brennstoffe und Wirkstoffe.
Grundnährstoffe sind Eiweißstoffe (Proteine), Fette und Kohlenhydrate, deren Energiewert in Joule (J) angegeben wird. Geläufiger ist hierbei aber wohl immer noch die Angabe in Kilokalorien (kcal), obwohl es sich nicht um eine SI-Einheit handelt.
Neben der Zugehörigkeit zu den Hauptnährstoffen spielen Eiweißstoffe auch als Baustoffe des Körpers eine große Rolle. Zu den Baustoffen zählen darüber hinaus auch Mineralstoffe und Wasser. Brennstoffe im engeren Sinne sind Fette und Kohlenhydrate, die der Energielieferung dienen. Die Wirkstoffe, zu denen neben Vitaminen auch die Spurenelemente und Mineralstoffe zählen, werden im Vortrag nicht behandelt. Eine Ausnahme stellt die Ascorbinsäure (das Vitamin C) dar, deren reduzierende Eigenschaft untersucht wird. Die Eigenschaft als Vitamin zu wirken, bleibt dabei aber außen vor.
Nährstoffe
Grundnährstoffe: Proteine, Fette, Kohlenhydrate
Baustoffe: Proteine, Mineralstoffe, Wasser
Brennstoffe: Fette, Kohlenhydrate
Wirkstoffe: Vitamine, Mineralstoffe, Spurenelemente
Abb. 4: Gliederung der Nährstoffe
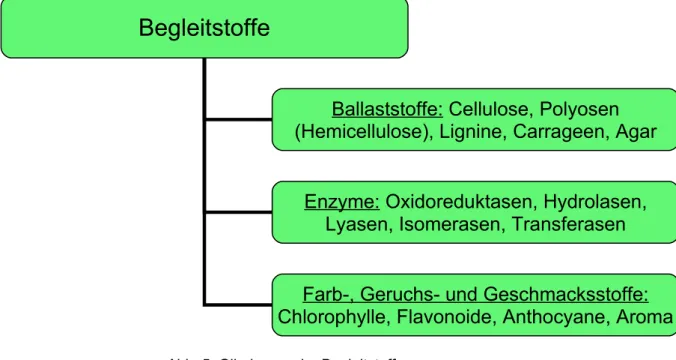
Neben den angesprochenen Nährstoffen, sind die sog. Begleitstoffe für die lebensmittelchemische und auch für eine ernährungsphysiologische Beurteilung eines Nahrungsmittels wichtig. Zu diesen werden neben den Ballaststoffen und Enzymen auch Farbstoffe, Geruchsstoffe und Geschmacksstoffe gezählt.
Ballaststoffe im Allgemeinen sind hierbei strukturbildende Bestandteile pflanzlicher Nahrungsmittel, die im menschlichen Dünndarm nicht aufgeschlossen werden können. Ein bekanntes Beispiel hierfür ist die Cellulose.
Diese Stoffe sind zwar unverdaulich, zeichnen sich aber durch darmanregende Tätigkeit als nützlich aus.
Im Rahmen dieses Vortrags werden neben chemischen Aspekten natürlicher Nahrungsmittelinhaltsstoffe auch Themen aus dem Bereich der Lebensmittelzusatzstoffe behandelt. Nach § 2 des Lebensmittel- und Bedarfsgesetzes (LMBG) sind Zusatzstoffe „Stoffe, die dazu bestimmt sind, Lebensmitteln zur Beeinflussung ihrer Beschaffenheit, oder zur Erzielung bestimmter Eigenschaften oder Wirkungen zugesetzt zu werden.“ [1]
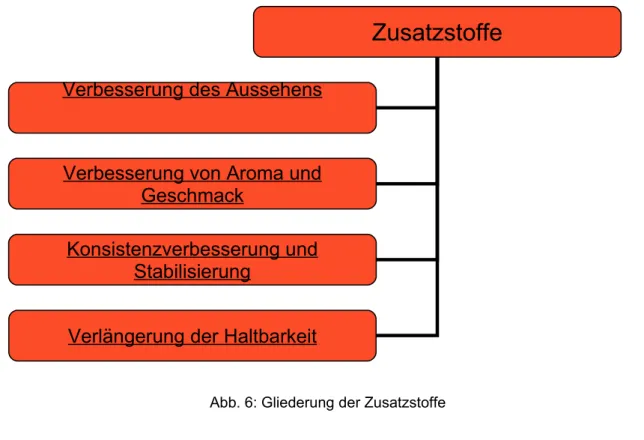
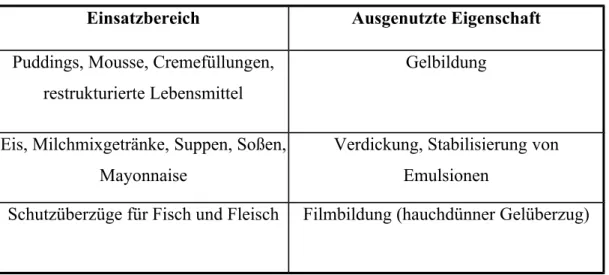
Die Zusatzstoffe kann man entsprechend ihrer Funktion grob einteilen. Es gibt demnach Stoffe zur Verbesserung des Aussehens, Stoffe zur Verbesserung von Aroma und Geschmack, Stoffe zur Konsistenzverbesserung und Stabilisierung und Stoffe zur Verlängerung der Haltbarkeit [1].
Begleitstoffe
Ballaststoffe: Cellulose, Polyosen (Hemicellulose), Lignine, Carrageen, Agar
Enzyme: Oxidoreduktasen, Hydrolasen, Lyasen, Isomerasen, Transferasen
Farb-, Geruchs- und Geschmacksstoffe:
Chlorophylle, Flavonoide, Anthocyane, Aroma
Abb. 5: Gliederung der Begleitstoffe
Zusatzstoffe
Verbesserung des Aussehens
Verbesserung von Aroma und Geschmack
Konsistenzverbesserung und Stabilisierung
Verlängerung der Haltbarkeit
In diesem Vortrag werden aus dem großen Bereich der Lebensmittelzusatzstoffe aber nur die Lebensmittelfarbstoffe, speziell der Vertreter mit der E-Nummer 110 (Gelborange S) als Stoff zur Verbesserung des Aussehens und die Alginate aus Braunalgen als Stoffe zur Konsistentverbesserung und Stabilisierung behandelt.
Diese beiden Exkurse in den Bereich der Lebensmittelzusatzstoffe wurden gewählt, da durch sie stellvertretend ein aktueller Trend unter den Starköchen beschrieben werden soll. Dieser Trend wurde durch einen spanischen Koch eingeführt: Ferran Adrià.
Mittlerweile gibt es viele Köche, die diesen Trend unter unterschiedlichsten Mottos mitgehen. Beispiele für solche Mottos sind „Cooking Chemistry“ oder „La cuisine scientific“. Allen Mottos ist gemein, dass die Köche die Verfahrensweisen der Chemie oder allgemein Laborpraktiken wie z.B. das Kühlen mit flüssigem Stickstoff für ihre Küche entdecken und damit (verrückte) Speisen mit ganz neuen Geschmacksrichtungen und –Erlebnissen kredenzen. In Abschnitt 4.1.2 dieses Experimentalvortrags wird der Trendsetter Ferran Adrià kurz charakterisiert und ein berühmtes Gericht im Labormaßstab nachempfunden. Dadurch soll ein anderes Anwendungsgebiet der experimentellen Chemie, das gut zum Thema Nahrungsmittel passt, aufgezeigt werden: Die Küche.
Abb. 6: Gliederung der Zusatzstoffe
4. Das Menü:
Zu Beginn dieses Abschnitts soll ein Menüplan einen Überblick über den gesamten experimentellen Bereich dieses Vortrags bieten.
Im Verlauf des Vortrags wurden einige der angepriesenen Speisen auch wirklich serviert. Darunter als Vorspeise das Baguette mit echtem Lachskaviar, da das selbst hergestellte Alginat-Äquivalent aufgrund der Calciumchloridlösung zu bitter schmecken würde, und als Nachspeise wurde leckerer Obstsalat angeboten.
Vorspeise:
Baguette mit Lachskaviar à la Ferran Adrià
(D1, V1, V2, V3, V4)
Hauptgericht:
Schweinefleisch an neuen Kartoffeln
(D2, V5, V6)
Nachspeise:
Obstsalat
(D3, V7, D4)
Guten
Men ü:
4.1 Vorspeise: Baguette mit „Lachska viar“ à la Ferran Adrià
4.1.1 Das Baguette, die Stärke, die α-Amylase und der Geschmack
Begonnen wurde das Menü mit dem Hauptbestandteil der Vorspeise: dem Baguette.
Bei dem Baguette handelt es sich um ein französisches Stangenweißbrot, das eines von vielen verschiedenen Brotsorten auf der Welt darstellt. Das Baguette besteht im Allgemeinen aus Weizenmehl, Hefe, Kochsalz und Wasser. Zu diesen Zutaten können dann je nach belieben noch verschiedene Gewürze und Kräuter hinzugefügt werden. Für die Experimente mit dem Baguette ist im Folgenden aber nur die Weizenstärke aus dem Weizenmehl relevant. Um die genauere Betrachtung der Weizenstärke zu beginnen, wurde das Publikum innerhalb von Demonstration 1 darum gebeten, bereitgestelltes Baguette zu essen.
Materialien: Baguette-Kauproben in beschrifteten Schüsselchen, Speichel
Durchführung: Das Baguette wird vom Publikum möglichst lange gekaut und darf erst heruntergeschluckt werden, wenn eine Geschmacksveränderung festzustellen ist.
Ergebnis: Durch längeres Kauen schmeckt das Baguette süß
Erklärung: Die im Baguette enthaltene Stärke wurde durch den menschlichen Speichel, von dem jeder Mensch mehr als 1 Liter pro Tag produziert [5], und durch die mechanischen Kaubewegungen des Kiefers abgebaut und somit vor dem Weitertransport im den Magen vorverdaut. Das Abbauprodukt der Stärke schmeckt süß. Bei der Stärke handelt es sich um ein pflanzliches Polysaccharid, das keinen homogenen Stoff darstellt, sondern aus zwei Komponenten besteht:
Demo 1: Stärkeabbau durch Speichel
Abb. 7: Amylose (links) und Amylopektin schematisch
Der Amylose und dem Amylopektin. Dabei macht das Amylopektin einen Anteil von 70 – 90% aus, während die Amylose nur zu einem Anteil von 10 – 30%
vertreten ist. In den Pflanzen stellt die Stärke das Reservepolysaccharid dar, das sie nutzen, um die aus der Photosynthese gewonnene Glucose in einer osmotisch inaktiveren Form abzuspeichern. Würden die Pflanzen direkt die synthetisierte Glucose abspeichern, würde dies zwangsläufig zum Platzen der Zellen führen, da aufgrund des hohen osmotischen Wertes der Glucose Wasser bis zum isoosmotischen Umgebungswert aufgenommen werden würde. Die Stärke ist osmotisch nahezu unwirksam, da sie ein großes Molekül aus vielen Glucose- Monomeren darstellt und deshalb kaum zu osmotischen Wert der Zelle beiträgt.
Sowohl die Amylose, als auch das Amylopektin bestehen ausschließlich aus Glucose-Monomeren, so dass man die Stärke im Allgemeinen als Homoglucan bezeichnen kann. Die beiden Komponenten unterscheiden sich nur in ihrem strukturellen Aufbau. Während die Amylose
durch eine α-1,4-glycosidische Verknüpfung lineare Ketten bildet, die aufgrund des Bindungswinkels eine helicale Struktur aufweisen, ist das Amylopektin durch eine zusätzliche α-1,6-glycosidische Bindung, die ca. alle 25 Glucose-Einheiten stattfindet, viel stärker verzweigt.
Um den molekularen Aufbau der Stärke zu zeigen, wurde an dieser Stelle die Haworth-Projektion gewählt, da diese auch in der Schule verwendet wird. Sie ist sowohl aufgrund des Vorkommens in den Schulbüchern, als auch aufgrund der einfacheren Schreibweise der Sesselschreibweise vorzuziehen. Man muss die Schüler aber darauf hinweisen, dass es sich bei den Knicken in der glycosidischen Bindung keinesfalls um Kohlenstoffatome handelt.
O
O H H
H OH
H OH
H OH O
H H H
OH
H OH
H OH O
H H H
O OH
H OH
H OH
O O ...
...
n
1 4 1
Abb. 8: Amylose (Haworth-Projektion)
1 1
1
6 4
4
Beim Kauen des Baguettes wurde eine Geschmacksveränderung festgestellt, da im menschlichen Speichel ein Enzym vorhanden ist, welches die Stärke in Maltose und größere Grenzdextrine spaltet. Diese Abbauprodukte schmecken im Vergleich zur geschmacksneutralen Stärke und dem etwas salzigen Baguette süß.
Bei dem Enzym aus dem menschlichen Speichel handelt es sich um die α- Amylase. Die α-Amylase ist ein Endoenzym, welches wie der Name sagt, die Stärke vom Inneren des Moleküls her spaltet. Beim Menschen liegt das pH- Optimum der α-Amylase bei pH = 6,9. Sie ist stabil bis zu einem pH-Wert von 4.
Dies bedeutet, dass die Speichel-Amylase im Magen (pH ≈ 1) inaktiviert wird.
Dieses Faktum macht eine Vorverdauung im Mund bei angemessenem pH-Wert notwendig, da wir Menschen sonst keine Stärke verdauen könnten. Als Cosubstrat verwendet das Enzym Ca2+-Ionen, welche im menschlichen Speichel vorhanden sind.
Neben der α-Amylase und den Calcium-Ionen sind im menschlichen Speichel noch Natrium-Ionen, Chlorid-Ionen, Hydogencarbonat und Isocyanat enthalten.
Das Hydrogencarbonat dient dabei als Puffer zur Aufrechterhaltung eines pH- Wertes im pH-Wirkungsbereich der α-Amylase (6,5 – 7,0). Das Isocyanat dient als natürliches Desinfektionsmittel. Darüber hinaus sind im Speichel noch Glycoproteine, die Mucine, enthalten, die die Gleitfähigkeit des Speisebreis erhöhen und dadurch das Schlucken ermöglichen [6].
O
O H H
H OH
H OH
H CH2
O H H
H OH
H OH
H OH O
H H H
O OH
H OH
H OH
O O ...
...
O O H H
H OH
H OH
H OH
O O
H H H
O OH
H OH
H OH
...
n Abb. 9: Amylopektin (Haworth-Projektion)
Zusätzliche α-1,6- glycosidische Bindung
1 4
O H H
H
O OH
H OH
H OH
... O
O
O H H
OH
H OH
H OH
...
H
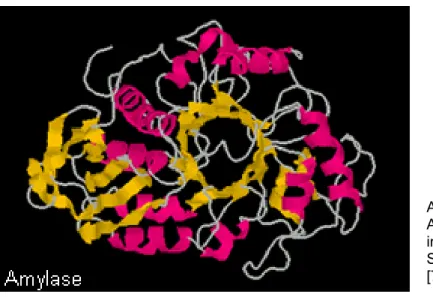
Ein Modell des stärkeabbauenden Enzyms zeigt besonders gut die Faltung der Proteinkette.
Es lassen sich unterschiedliche Faltungsmuster erkennen. α-Helicale Bereiche des Moleküls sind in roter Farbe dargestellt, während die vorkommenden β-Faltblätter gelb dargestellt sind. Die Strukturelemente sind über weiß dargestellte Schleifen miteinander verbunden. In der Mitte des Moleküls befindet sich das aktive Zentrum, welches in Form einer Tonnen-Domäne ausgebildet ist. Die Tonne wird durch ein α-β-8 Fass gebildet, in welchem die Tonne aus Faltblättern besteht, die von 8 Helices umgeben sind. Bei der Spaltung der Stärke wird nun mit diesem aktiven Zentrum das Stärkemolekül entlanggefahren. Dabei werden die α-1,4- glycosidischen Bindungen hydrolytisch gespalten, während die α-1,6- Verknüpfungen übersprungen werden.
Die Bindungsspaltung innerhalb der glykosidischen Bindung der Stärkepolysacchridkette durch die α-Amylase kann man sich entsprechend einer säurekatalysierten Stärkespaltung vorstellen. Der Ort der Bindungsspaltung, hier vereinfacht durch eine Schere dargestellt, soll im Folgenden an einem Reaktionsmechanismus erläutert werden.
Abb. 10: Die α-
Amylase:Proteinfaltung in der
Supersekundärstruktur [7]
Abb. 11: Die Enzymaktivität bei der Stärke-Spaltung vereinfacht durch eine Schere dargestellt
Säurekatalysierte Stärkespaltung:
O
O H H
H OH
H OH
H OH O
H H H
O OH
H OH
H OH
O ...
...
n Ausschnitt aus einem Stärkemolekül
H+ / H2O 2n
O
OH H H
H
O H
OH
H OH
H OH
Reaktionsmechanismus:
Die Spaltung der glykosidischen Bindung findet dadurch statt, dass an das freie Elektronenpaar des Sauerstoffatoms der glykosidischen Bindung ein Proton angelagert wird und daraufhin die Bindung so gespalten wird, dass die positive Ladung durch das Heteroatom des Glucosemoleküls, sprich dem Sauerstoffatom, stabilisiert wird (Heteroatomstabilisierung der positiven Ladung).
O
O H H
H OH
H OH
H OH O
H H H
O OH
H OH
H OH
O ...
...
n
+ H+
Die Stabilisierung findet dadurch statt, dass das entstandene Carbeniumion in Mesomerie mit einem Oxoniumion steht.
O
O H H
H OH
H OH
H OH O
H H H
O OH
H OH
H OH
O+ ...
...
H
n
O C+ H H
H
O H
OH
H OH
H OH
O
OH H H H
OH
H OH
H OH
OH
+
Durch nucleophilen Angriff eines Wassermoleküls an das positiv geladene Kohlenstoffatom wird letztendlich nach Entfernen des katalytisch wirkenden Protons ein weiteres Glucosemolekül gebildet.
Durch das Überspringen der α-1,6-Verknüpfungen des Amylopektins während der Stärkehydrolyse bei der amylaseinduzierten Vorverdauung im Mund, entstehen an diesen Stellen keine Glucosemoleküle wie im Reaktionsmechanismus zu sehen, sondern größere Grenzdextrine. Die außerdem als Abbauprodukt entstehende Maltose ist für den süßen Geschmack des intensiv gekauten Baguettes verantwortlich. Die Verdauung der Stärke findet nach der beschriebenen Vorverdauung durch das Speichelenzym im Mund dann durch Resorption im Dünndarm statt. Dort wird die Maltose, ein Disaccharid aus zwei Glucose Monomeren, die α-1,4 glycosidisch verknüpft sind, in ihre Bausteine gespalten und unter ATP-Verbrauch aktiv resorbiert.
Dass die im Mund aus der Stärke gebildete Maltose süß schmeckt, liegt letztendlich daran, dass das Maltose-Molekül von den Geschmacksrezeptoren der Zunge erkannt wird. Im Gegensatz zum Geruch ist der Geschmack ein Nahsinn, bei dem die für den Geschmack verantwortlichen Substanzen direkt mit den Geschmacksrezeptoren auf der Zunge in Kontakt treten müssen. Diese
O H2
O H H
H
O H
OH
H OH
H OH
O+ H H
- H+ O
OH H H
H
O H
OH
H OH
H OH O
C+ H H H
O H
OH
H OH
H OH
+
O C+ H H
H
O H
OH
H OH
H OH
O+ H C H H
O H
OH
H OH
H OH
Carbeniumion Oxoniumion
Geschmacksrezeptoren kann man ihrer Empfindlichkeit entsprechend in 5 Geschmacks-Grundqualitäten einteilen. Neben „süß“ gibt es noch die Grundqualitäten sauer, salzig, bitter und umami.
Die Geschmacksqualität „umami“ taucht in dieser Abbildung nicht auf, da ihre Wahrnehmungsregion auf der Zunge noch nicht ganz geklärt ist. Diese Geschmacksqualität ist für die Empfindung „köstlich“ verantwortlich. Der Ausdruck stammt aus dem Japanischen und bedeutet wörtlich übersetzt auch
„köstlich, lecker“. Man geht heute davon aus, dass der Geschmackseindrück
„umami“ durch den Neurotransmitter Glutamat vermitteln wird, was der Grund dafür ist, dass man in vielen Fertiggerichten und vor allem beim Japaner „um die Ecke“ häufig Mononatriumglutamat als Geschmacksverstärker im Essen findet.
Der gesamte Geschmackseindruck einer Speise resultiert aus dem Zusammenspiel von Geruch und Geschmack, da viele flüchtige Verbindungen, die auch zum Flavour eines Nahrungsmittels beitragen, nur über den Fernsinn, sprich den Geruchssinn, aufgenommen werden können.
Mit dem ersten Versuch möchte ich nun an dieser Stelle zeigen, dass die Stärke durch das Enzym α-Amylase tatsächlich abgebaut wird.
süß sauer salzig bitter Papille
Abb. 12: Die Geschmacksgrundqualitäten (ohne umami) mit ihrem Vorkommen auf den einzelnen Zungenregionen. Rechts: eine Geschmackspapille [6]
Versuch 1: Stärke-Smiley
Materialien: 1 große Petrischale mit Stärke-Agar (mit Deckel), Eppendorf-Cup mit Speichel, Pinsel, Edding, Magnetrührer mit Heizfunktion, Erlenmeyerkolben (200 mL)
Chemikalien: Agar, Stärke, Lugolsche Lösung (I2/KI-Lösung)
Durchführung: Man stellt sich durch Autoklavieren eine Agarlösung aus 4 g Agar, 0,1 g CaCl2 und 100 mL Leitungswasser her, zu der man 1 g Stärke hinzufügt. Diese Lösung lässt man bei ca. 90°C einige Zeit rühren, biss sich die Stärke vollständig gelöst hat. Die noch heiße Stärke-Agar-Lösung wird dann vorsichtig in die Petrischale gegossen und bis zum Aushärten stehen gelassen.
Man sollte diese Arbeit unbedingt schon einen Tag vor dem Vortrag vorbereiten, da das Festwerden des Agars einige Zeit dauert.
Auf den Boden der Petrischale zeichnet man nun mit Hilfe eines Eddings ein Smiley-Gesicht, das auch noch durch die Agarschicht auf der Oberseite der Petrischale zu sehen ist. Während des Vortrags bepinselt man dann die Bereiche der Mund- und Augenpartie auf dem Agar mit zuvor gesammeltem Speichel. Da der Speichel nun für ein gutes Ergebnis einige Zeit auf die im Agar befindliche Stärke einwirken muss, sollte man dies auch schon in einer anderen Petrischale vorbereitet haben. Auf diese vorbereitete Agarplatte gießt man nun etwas Lugolsche Lösung, welche eine Lösung von Iod in wässriger Kaliumiodidlösung darstellt.
Ergebnis: An den Stellen, wo kein Speichel auf den Stärkeagar eingewirkt hat, sprich außerhalb der Augen und des Smiley-Mundes, ist eine deutliche Blaufärbung zu erkennen. Dort, wo Stärke-Agar in Kontakt mit dem aufgetragenen Speichel gekommen ist, bleibt die Agarplatte farblos
Erklärung: Durch das Aufpinseln des Speichels wird an den Stellen, an denen der Speichel mit dem Stärkeagar in Kontakt kommt, die enthaltene Stärke wie bereits in Demonstration 1 beschrieben, abgebaut. Das Übergießen mit der Lugolschen
Lösung dient dem Stärkenachweis und fällt an den Stellen des Einspeichelns negativ aus (keine Blaufärbung). Alle anderen Stellen färben sich blau, da die in der Lugolschen Lösung enthaltenen Polyiodid-Ionen in die Amylose-Helix der Stärke eingelagert werden. Das Agar dient in diesem Fall nur als Matrix für die Stärke, um eine feste Struktur zu erzeugen. Das Aushärten des Agars (Heteropolysaccharid aus Rotalgen; Monomere: Galactose/Galacturonsäure) kann damit beschrieben werden, dass sich Wasser in maschenartige Strukturen einlagert. Die blaue Farbe des positiven Stärkenachweises kommt durch Charge- Transfer(CT)-Übergänge zustande. Für diese CT-Übergänge ist die starre Ausrichtung der Polyiodidionen innerhalb des Amylosemoleküls notwendig.
An den Stellen, wo die Stärke durch die α-Amylase des Speichels abgebaut wurde, findet keine Einlagerung der Polyiodidionen mehr stett, so dass auch keine CT-Übergänge mehr vonstatten gehen können. Als Ergebnis bleibt die Agarplatte an diesen Stellen farblos.
Mit Hilfe dieses 1. Versuchs wissen wir nun, dass durch den Speichel in unserem Mund die Stärke abgebaut wurde. Mit einem nächsten Versuch soll nun gezeigt werden, dass aus der Stärke durch die Spaltung tatsächlich Maltose und Grenzdextrine entstanden sind, die für den süßen Geschmack verantwortlich sind.
Die Maltose und auch die Grenzdextrine unterscheiden sich von der Stärke dadurch, dass sie reduzierende Verbindungen darstellen. Diese Eigenschaft müsste man demnach mit der Fehling-Probe nachweisen können.
Abb. 13: Einlagerung von Polyiodid-Ionen in die Amylose-Helix der Stärke
Versuch 2: Fehling-Probe
Materialien: Baguette, Speichel, Wasserbad, Heizplatte, 2er-Demo- Reagenzglasständer, 2 Demo-Reagenzgläser, 1 Schüsselchen für Baguette, das mit Speichel versetzt wurde, 1 Schüsselchen für Baguette ohne Speichel (Blindprobe), Spatel, 2 Pipette, 2 Pipettenhütchen, 4 Messzylinder (10 mL)
Chemikalien:
FEHLING I
(7 g CuSO4 in 100 mL H2O)
N
X n
Einstufung in Bezug auf Kupfersulfat
R22 Gesundheitsschädlich beim Verschlucken
R36/38 Reizt die Augen und die Haut
R50/53 Sehr giftig für Wasserorganismen, kann in Gewässern längerfristig schädliche Wirkungen haben
S22 Staub nicht einatmen S60 Dieser Stoff und sein Behälter sind als
gefährlicher Abfall zu entsorgen
S61 Freisetzung in die Umwelt vermeiden.
Besondere Anweisungen einholen /
Sicherheitsdatenblatt zu Rate ziehen
FEHLING II (3,5 g
Kaliumnatriumtartrat (Seignette-Salz) mit 1 g Natriumhydroxid in 10 mL H2O)
C
Kaliumnatriumtartrat: Keine Einstufung
NaOH:
R35 Verursacht schwere Verätzungen
S26 Bei Berührung mit den Augen gründlich mit Wasser abspülen und Arzt konsultieren
S37/39 Bei der Arbeit geeignete
Schutzhandschuhe und Schutzbrille/Gesichtsschutz tragen
S45 Bei Unfall oder Unwohlsein sofort Arzt zuziehen (wenn möglich dieses Etikett vorzeigen) Durchführung: Man gibt jeweils zwei Spatelspitzen eingespeicheltes Baguette und Baguette aus der Blindprobe in ein Demo-Reagenzglas und fügt zu jeder Probe etwas entionisiertes Wasser und je 10 mL von Fehling 1 und Fehling 2 Reagenz. Daraufhin stellt man die Demo-Reagenzgläser in ein siedendes Wasserbad.
Ergebnis: Bei Zugabe der Fehling-Reagenzien färben sich die Baguette- Suspensionen dunkelblau. Im Wasserbad beginnt sich dann die Farbe der Lösung im Reagenzglas des eingespeichelten Baguettes nach ca. 30 Sekunden von
blau
(aq)
+ 2 + 5 OH-(aq)
+1
+ 7 H
2O
OH
OH O H H H
H O H H R
OH
OH
OH O H H H
H O O H R
OH
rostrot + Cu
2O + 2 C4H4O62- (aq)
+ 3
+1 O
H O
O H
O O
O
Cu
O H
O O
H O
O O H
H
4-
Abbauprodukt:
z.B. Maltose (schematisch)
(aq)
(s) Cu +2
O
O O
OH
OH O
H2O O
O
O O
Cu H2O
HO H2O HO
OH2 +2
+2
+
(aq) (aq)
(aq)
blau
dunkelblau nach rostrot zu verändern. Bei der Blindprobe bleibt diese Farbänderung aus.
Erklärung: Das Fehling-Reagenz (Fehling 1 und 2) vermag es, die reduzierende Wirkung der Abbauprodukte der Stärke in dem eingespeichelten Baguette anzuzeigen. Bei dieser Reaktion handelt es sich um eine Redoxreaktion, in der das in Fehling 1 enthaltene Kupfer-Ion der Oxidationsstufe +2 reduziert wird, so dass Kupfer in der Oxidationsstufe +1 vorliegt. Gleichzeitig wird die als Abbauprodukt der Stärke vorkommende Maltose oxidiert. Das Kupfer der Oxidationsstufe +1 fällt dann gut sichtbar gemäß folgender Reaktionsgleichung als rostrotes Kupfer(I)oxid aus.
Das Kupfer-Ion der Oxidationsstufe +2 liegt im Fehlingreagenz als Ditartratotetraaquadikupfer(II)-Komplex vor. Dies ist vonnöten, da das Cu2+-Ion sonst im alkalischen Milieu des Reagenzes als Kupferhydroxid ausfallen würde.
Bei der Blindprobe, sprich dem Baguette, das nicht eingespeichelt wurde, fand keine Farbänderung statt, da keine reduzierend wirkenden Abbauprodukte der Stärke vorhanden waren. Somit konnte das im Fehling-Reagenz enthaltene Kupfer-Ion der Oxidationsstufe +2 nicht reduziert werden und die Lösung blieb dunkelblau aufgrund des enthaltenen Ditartratotetraaquadikupfer(II)-Komplexes.
4.1.2 Lebensmittelfärbung und Alginate in der Lebensmittelindustrie
Nachdem wir uns nun mit dem Baguette als Grundlage der Vorspeise ausreichend beschäftigt haben, ist es an der Zeit, sich dem Belag zu widmen: dem Lachskaviar.
Der Lachskaviar stellt aber keinen handelsüblichen-, sondern einen selbst hergestellten Lachskaviar à la Ferran Adrià dar.
Bei Ferran Adrià handelt es sich um einen spanischen Koch, der es wagt, mit Hilfe chemischer Verfahren seinen Speisen einen verrückten Touch zu verpassen.
An dieser Stelle sollen zwei Zitate helfen, diesen Koch näher zu charakterisieren.
Das erste Zitat entstammt einem Artikel aus der „Zeit“ mit dem Titel „der Chemiker“. Das zweite Zitat ist von dem besagten Koch selbst und trifft meiner Ansicht nach sehr gut das Motto seiner Küche.
• „Ferran Adrià serviert Gemüse als Gelatine und würzt Speisen auch mal mit Holzkohle. In Barcelona versucht der verrückteste Koch auf Erden seinen Beruf neu zu erfinden- in einer Küche, die ein Labor sein könnte.”
Wolfgang Lechner (Die Zeit: “Der Chemiker“ )
• „Die magischen Rezepte sind jene, die die einen ekelhaft finden und die anderen fantastisch…“
(Ferran Adrià)
Frei nach diesem Motto Ferran Adriàs soll nun ein Lachskaviar zubereitet werden.
Bei diesem speziellen Lachskaviar handelt es sich aber keinesfalls um die bekannten orangen Fischeier, obwohl kaum ein Unterschied erkennbar ist.
Vielmehr stellt der zubereitete „Lachskaviar“ ein, mit dem Lebensmittelfarbstoff E 110 angefärbtes, Duplikat aus Calciumalginat dar. Diese Verfahrensweise aus Alginat ein Gericht zu imitieren, ist bei Ferran Adrià sehr beliebt und oft gesehen.
Dadurch kam ich auf die Idee, ein solches chemisches Küchen-Experiment nachzustellen. Durch Zufall fand ich heraus, dass es sich bei dem Lebensmittelfarbstoff Gelborange S mit der E-Nummer 110 um den perfekten Farbstoff für diesen Lachskaviar handelt. Lebensmittelfarbstoffe stellen die größte Zahl an Zusatzstoffen dar. Sie werden im Allgemeinen eingesetzt, um die visuelle Attraktivität eines Nahrungsmittels zu erhöhen. Der Farbeindruck eines Nahrungsmitteln hat psychische und physische Wirkungen. Er vermag die Sekretion der Verdauungssäfte zu fördern. Daher stammt auch die Redewendung
„beim Anblick läuft mir das Wasser im Mund zusammen“. Bei diesem „Wasser“
handelt es sich um den sekretierten Speichel. Die zugelassenen Lebensmittelfarbstoffe sind in der Gruppe der Zusatzstoffe mit den Hunderter-E- Nummern (E 100 - ...) zusammengefasst. Man unterscheidet zwischen wasser- fett- und unlöslichen Farbstoffen, wobei letztere als Pigmente bezeichnet werden.
Einer Reihe von Nahrungsmitteln werden Farbstoffe zugesetzt, um Farbveränderungen oder –verluste auszugleichen. Diese Veränderungen können z.B. im Verlauf der Produktion durch Kochen oder Sterilisierung entstehen. Schon im Altertum wurden Lebensmittel gefärbt. Man verwendete dazu verschiedene Pflanzenfarbstoffe wie Chlorophyll oder Anthocyane. Im Mittelalter wurde die Palette der zur Verfügung stehenden Lebensmittelfarbstoffe durch Mineralfarben wie Ultramarin oder sogar durch stark giftige bleihaltige Farbstoffe wie z.B. das postautogelbe Bleisulfid ergänzt. Erst zum Ende des 19. Jahrhunderts verbot man den Einsatz solcher Farbstoffe. Da viele natürliche Farbstoffe wie z.B. das
Chlorophyll nicht sehr beständig sind und beispielsweise beim Kochen völlig verblassen, wurden dank der Fortschritte auf dem Gebiet der organischen Farbstoffsynthese Naturfarben im Laufe der Zeit immer mehr durch beständigere synthetisierte Farbstoffe ersetzt. Den größten Bereich der synthetischen Lebensmittelfarbstoffe stellen die Azofarbstoffe dar. Auch das von mir zu Färben des Alginats gewählte Gelborange S gehört zur großen Familie dieser Azofarbstoffe. Das Gelborange S (E 110) soll nun in einem Versuch selbst hergestellt werden.
Diesen Versuch kann man entweder in einer Kurzversion in Präparategläschen durch Zusammengießen der vorgekühlten Substanzen durchführen (Vortragsversion), oder unter Rühren im Eisbad mittels Tropftrichter vollziehen (sichere, aber zeitintensivere Version).
Chemikalien: Sulfanilsäure, Natriumnitrit, 2-Naphthol-6-Sulfonsäure Sulfanilsäure
X i
R36/38 Reizt die Augen und die Haut
R43 Sensibilisierung durch Hautkontakt möglich S24 Berührung mit der Haut vermeiden
S37 Geeignete Schutzhandschuhe tragen 2-Naphthol-6-sulfonsäure
X i
R36/37/38 Reizt die Augen, Atmungsorgane und die Haut S26 Bei Berührung mit den Augen gründlich mit Wasser abspülen und Arzt konsultieren
S36 Bei der Arbeit geeignete Schutzkleidung tragen Salzsäure, HCl(aq)
1:3 (~ 9%)
C
R36/37/38 Reizt die Augen, Atmungsorgane und die Haut S26 Bei Berührung mit den Augen gründlich mit Wasser abspülen und Arzt konsultieren
Versuch 3: Darstellung von E 110
A US AN
1000 A N
750 U/min
o 500 C
0
AUS
1500 250
50 100 150 200 300 LaboBib© 250 mL
100 150
50 200
100 mL 40
80
20 60
100 mL 40
80
20 60 75
100 mL
50
25
Natronlauge, NaOH(aq)
c = 2 mol/L
C
R35 Verursacht schwere Verätzungen
S26 Bei Berührung mit den Augen gründlich mit Wasser abspülen und Arzt konsultieren
S36/37/39 Bei der Arbeit geeignete Schutzkleidung, Schutzhandschuhe und Schutzbrille/Gesichtsschutz tragen Natriumnitrit, NaNO2(s)
N O
R8 Feuergefahr bei Berührung mit brennbaren Stoffen R25 Giftig beim Verschlucken
S45 Bei Unfall oder Unwohlsein sofort Arzt zuziehen (wenn möglich dieses Etikett vorzeigen)
Materialien: lange Version
Waage, Eisbad, Becherglas (250 mL), 2 Bechergläser (100 mL), Spatel, Glasstab, Tropftrichter, Magnetrührer mit Rührfisch
Aufbau lange Version (Skizze):
Versuchsdurchführung der langen Version:
1.) Auf der Digitalwaage werden 0,9 g Sulfanilsäure in ein 250 mL Becherglas abgewogen.
2.) Man gibt mit der Vollpipette 25 mL Natronlauge c = 2 mol/L zu der Sulfanilsäure und rührt mit dem Glasstab rühren bis sich fast alles gelöst hat.
Anschließend stellt man das Becherglas beschriftet ins Eisbad.
Eisbad Sulfanilsäure in
NaOH(aq)
Tropftrichter mit 35 mL HCl(aq)
Natriumnitrit in Wasser
2-Naphthol-6-sulfonsäure in NaOH(aq)
3.) 0,4 g Natriumnitrit werden in ein 100 mL Becherglas eingewogen, mit 5 mL entionisiertem Wasser versetzt und nach kurzem Vorkühlen im Eisbad zu der gekühlten Sulfanilsäure gegeben.
4.) Man lässt vorsichtig 25 mL Salzsäure (1:3) aus dem Tropftrichter unter Rühren hinzutropfen und rührt ca. 5 Minuten lang.
5.) Währenddessen werden 1,2 g 2-Naphthol-6-sulfonsäure in ein 100 mL Becherglas eingewogen und mit 30 mL Natronlauge (3 mal 10 mL Messpipette) versetzt und für ca. 3 Minuten ins Eisbad gestellt.
6.) Die gekühlte 2-Naphthol-6-sulfonsäure wird in einem Schuss und unter weiterem Rühren zu der gekühlten Mischung aus Sulfanilsäure und Natriumnitrit gegeben.
Die Mischung darf vor und während des Zutropfens nicht über 5°C ansteigen, da sonst das gebildete Diazoniumsalz zerfällt.
Materialien Vortragsversion: Eisbad, Eppendorf-Cup, 2 Präparategläschen
Durchführung Vortragsversion: Man gibt die vorgekühlte Sulfanilsäure zu der vorgekühlten Natriumnitrit-Lösung und schüttelt kurz. Nachdem man die Lösung für ca. 1 Minute im Eisbad gekühlt hat, gibt man in einem Schutt die 2-Naphthol- 6-Sulfonsäure hinzu und schüttelt gut durch.
Beobachtung: Nach Zugabe der 2-Naphthol-6-Sulfonsäure nimmt die Lösung eine orange Farbe an.
Erklärung: Bei dem hergestellten orangen Farbstoff handelt es sich um den Lebensmittelfarbstoff Gelborange S (E110). Wie bereits erwähnt, stellt der Lebensmittelfarbstoff E 110 ein Azofarbstoff dar. Diese Zeichnen sich durch eine im Molekül vorhandene Azogruppe (-N=N-) aus. Bei der Synthese eines Azofarbstoff laufen im Prinzip immer die gleichen Reaktionen ab. Diese gliedern sich in drei Schritte:
1. Bildung eines Nitrosylkations
S O
O O
H N
H N O
N-Nitroso-Verbindung H+
S O
O O
H N
H N+ OH
- H2O S O
O O
H N+ N
Diazonium-Ion S
O
O O
H NH2 + N+ O -H0°C+ S
O
O O
H N
H N O
N-Nitroso-Verbindung
2. Herstellung eines Diazoniumsalzes: Diazotierung 3. Azo-Kupplung
Durch Protonierung des Nitrits entsteht im ersten Schritt Salpetrige Säure (HNO2), aus welcher gemäß folgender Reaktionsgleichung das Nitrosylkation gebildet wird:
Reaktionsmechanismus:
1. Bildung eines Nitrosylkations
Im zweiten Schritt greift nun das freie Elektronenpaar des Stickstoffatoms der Sulfanilsäure das Nitrosylkation nucleophil an. Dadurch entsteht eine N- Nitrosoverbindurng, welche durch Protonierung und Wasserabspaltung in das Diazoniumion übergeht. Diesen Prozess bezeichnet man als Diazotierung.
2. Herstellung eines Diazoniumsalzes: Diazotierung
N O
O
H
+
H+ H HO+ N O - H N+ O2O
Diese Reaktion muss im Eisbad durchgeführt werden, da ansonsten das Diazoniumsalz bei einer Temperatur > 5°C unter Stickstoffabspaltung zerfallen würde. Das gebildete Diazoniumion stellt ein schwaches Elektrophil dar und reagiert nur mit aktivierten Aromaten weiter. Dafür wird bei diesem Versuch die Kupplungskomponente 2-Naphthol-6-Sulfonsäure hinzugefügt. Mit dieser Kupplungskomponente findet dann der dritte und letzte Schritt statt: Die Azokupplung.
3. Azo-Kupplung:
Durch die Azo-Kupplung ist eine farbige Lösung entstanden. Die Farbe der Lösung wird durch den gebildeten Azofarbstoff, das Gelborange S, verursacht.
Dieser liegt in der E-Konfiguration vor.
Die Farbigkeit der Azofarbstoffe beruht auf zweierlei Dingen: Einerseits ist durch die Azokupplung ein größeres Molekül entstanden, das ein ausgedehntes konjugiertes π-Elektronensystem aufweist, während andererseits ein elektronischer Effekt der Azogruppe zur Farbigkeit des Moleküls beiträgt. Dieser
S O O
O-
OH Na+
+
SO
O O- N
N+ Na+
-H+
elektrophile Substitution
Na+ S O O
O-
OH
N N S
O
O O-
Na+
Gelborange S (E 110)
elektronische Effekt ist auch schon beim gelben Diimin (N2H2) feststellbar. Durch die Molekülstruktur der Azogruppe, die eine ungünstige ekliptische Anordnung der nichtbindenden Elektronenpaare der Stickstoffatome zufolge hat, kommt es zu einer starken Wechselwirkung der sp2-Hybridorbitale, die mit den nichtbindenden Elektronenpaaren besetzt sind. Die resultierende große energetische Aufspaltung führt dazu, dass das höchst besetzte Molekülorbital (HOMO), in diesem Fall das n-Orbital, dem niedrigst unbesetzten Molekülorbital (LUMO), dem π*-Orbital, sehr nahe kommt, so dass der n → π* Übergang im sichtbaren Bereich der elektromagnetischen Strahlung liegt.
Gelborange S, auch Sunsetgelb FCF genannt, ist ein künstlicher, oranger Azofarbstoff mit der E-Nummer E110. Gelborange S gilt für den Menschen als gesundheitlich unbedenklich. Es führte aber in Tierversuchen bei hohen Dosen zu Nierentumoren.
In Einzelfällen kann es beim Menschen allergieauslösend wirken, vor allem bei Unverträglichkeit von Acetylsalicylsäure (ASS). Verwendet wird Gelborange S zum Färben von Seelachs, Zuckerüberzügen, Marzipan, Likören, Fruchtkonserven, Getränken, Aprikosenmarmelade, Kaugummi, Fertigsuppen, Krabben, Garnelen, Süsswaren, Backwaren, Biskuits mit Orangengelee, Speiseeis, Kunsthonig, Fruchtkonserven, Marzipan, Paniermehl, Zitronenquark… und vielem mehr. Neben Lebensmitteln wird Gelborange S auch zur Färbung von Arzneimitteln verwendet Die zugelassenen Farbstoffkonzentrationen für die verschiedenen Anwendungsgebiete liegen bei 5-50g/100kg [8].
Nun haben wir den Farbstoff hergestellt, mit dem wir den falschen Lachskaviar anfärben wollen. Fehlt nur noch der Lachskaviar selbst. Diesen möchte ich wie bereits erwähnt in einem Versuch aus Alginat herstellen.
Versuch 4: Kaviar aus Alginat
Materialien: Porzellanschale, Stativ, Klammer nach Kaufmann, Klistierspritze mit Adapter (Innendurchmesser der Auslaufspritze: d = 1,5 mm), Becherglas (100 mL, niedrige Form), Becherglas (250 mL, niedrige Form), Becherglas (600 mL, hohe Form), Messzylinder (50 mL), 2 Glasstäbe, 2 Magnetrührer (davon einer heizbar), 2 Rührfische (l = 4 cm), Haushaltssieb (d = 7 cm), Stabthermometer, Löffelspatel zum herausholen des Kaviars, Waage.
Chemikalien: Natriumalginat-Sol (ρ* = 20 g/L), Calciumchlorid-Dihydrat (Xi; R:
36, S: 22-24) (c = 1 mol/L), Gelborange S
Durchführung: Zur Herstellung von 50 mL eines Natriumalginat-Sols der angegebenen Massenkonzentration erwärmt man in einem Becherglas (250 mL) unter Rühren mittels Magnetrührer und Rührfisch zuerst ca. 40 mL entionisiertes Wasser auf 70°C. Nach Abstellen der Heizung des Magnetrührers wird die Rührgeschwindigkeit dann so stark erhöht, dass sich um den Rührfisch ein Vortax (Strudel bis zum Boden) bildet. Mit Hilfe eines Haushaltssiebs siebt man dann 1 g Natriumalginat in sehr kleinen Portionen auf die obere Vortaxwand und rührt so lange weiter, bis sich alles gelöst hat. Bilden sich dabei kleine Klumpen, kann man diese mit einem Glasstab beseitigen. Man muss bei der Natriumalginat- Zugabe wirklich langsam vorgehen, da man sonst die Klumpenbildung nicht beseitigen kann.
Nachdem das homogenisierte Sol auf Raumtemperatur abgekühlt ist, entfernt man den Glasstab und füllt bis zur 50 mL-Marke des Becherglases mit entionisiertem Wasser auf. Daraufhin durchmischt man sorgfältig mit einem Glasstab.
Das so hergestellte Natriumalginatsol kann über mehrere Tage in PET-Flaschen im Kühlschrank aufbewahrt werden.
Für die Herstellung des falschen Lachskaviars wird das Natriumalginat-Sol nun durch Zugabe des hergestellten Lebensmittelfarbstoffs E 110 bis zum gewünschten Farbton angefärbt. Daraufhin füllt man es in die Auslaufspritze und lässt es in eine langsam gerührte Calciumchloridlösung (c = 1 mol/L) eintropfen.
Die fertigen Kaviar-Kügelchen holt man mit einem Löffelspatel aus der Lösung heraus und präsentiert diese in einer Porzellanschale.
![Abb. 1: Die 7 Nahrungsmittelklassen im Ernährungskreis [2]](https://thumb-eu.123doks.com/thumbv2/1library_info/3939399.1533021/5.892.65.830.427.828/abb-die-nahrungsmittelklassen-im-ernährungskreis.webp)