Research Collection
Doctoral Thesis
Zur Kenntnis der Cellulose und des Lignins
Author(s):
Zechmeister, László Publication Date:
1913
Permanent Link:
https://doi.org/10.3929/ethz-a-000088882
Rights / License:
In Copyright - Non-Commercial Use Permitted
This page was generated automatically upon download from the ETH Zurich Research Collection. For more information please consult the Terms of use.
ETH Library
Zur Kenntnis der Cellulose und des Lignins
Von der
Eidgenössischen Technischen Hochschule in Zürich
zur
Erlangung
der Würde einesDoktors der technischen Wissenschaften genehmigte
Promotionsarbeit
vorgelegtvon
Lâszlô Zechmeister, dipl. Chemiker,
aus
Györ
(Ungarn).Referent:Herr Prof. Dr. M. Cérésole.
Korreferent: Herr Prof. Dr. H.
Staudinger.
Zürich 1913
Spamersche Buchdruckerei Leipzig
Leer Vide Empty
gewidmet
Leer Vide Empty
ratorium der
Eidgenössischen
Technischen Hochschule inZürich,
teilsim
Kaiser-Wilhelm-Institut
fürChemieinBerlin-Dahlem,
unterLeitung
des HerrnProf.
Dr.Richard Willstätter
ausgeführt.
Es ist mir ein lebhaftesBedürfnis,
meinem verehrten Lehrer auch an dieser Stelle meinenaufrichtigen
Dankauszusprechen.
Leer Vide Empty
Theoretischer Teil.
Seite
A. Zur Kenntnis der Cellulose 9
I. Geschichtliches zur Konstitution und Abbau 9
IL Zur optischen Inaktivität der Cellulose 13
III.
Hydrolyse
der Cellulose mit starker Salzsäure 14 IV. Acetolyse der Cellulose mitAcetylbromid
171. Lösung der Cellulose in Acetylbromid; Einfluß des Grades seiner
Hydrolyse auf den Abbau 18
2. Verlauf der Acetolyse 20
B. Zur Kenntnis des
Lignins
21I. Über die Natur der Holzsubstanz 21
1. Vorkommen und Zusammensetzung 21
2. Aromatische Bestandteile. — Das aktive Carbonyl 22 3. Beziehung zwischen der Cellulose und dem Lignin 24
4. Über den Vergleich der Aminreaktionen des
Lignins
und deraromatischen Aldehyde 25
II. Zur Konstitution und Farbe der Schiffschen Basen aromatischer
Aldehyde
261. Isomeriemöglichkeiten 26
2. Bisherige Arbeiten über mehrere Formen von Anilen 26 3. Über dieFarbe undKonstitutionvonfesten undgeschmolzenenAnilen 29
4. Zur Farbe der Anile in Lösung 31
5. Salzbildung und Spaltbarkeit 32
6. Aromatische Aldehyde und sekundäre Amine 35 HL
Glucoaldehydanile
und ihre Beziehung zum Anil desHolzaldehyds
36Experimenteller
Teil.A. Zur Kenntnis der Cellulose 37
I.
Hydrolyse
der Cellulose mit starkenHalogenwasseratofisäuren
... 371. Löslichkeit derCellulose inHalogenwasserstoffen 37
2. Drehungsvermögen der Glucose in Salzsäure 38
3. Ausbeute an Glucose 40
4. Verlauf der Hydrolyse 41
Seite II.
Acetolyse
der Cellulose mitAcetylbromid
451. Löslichkeit der Cellulose in Acetylbromid 45 2. Einfluß des Grades der
hydrolytischen
Zersetzung desAcetylbromidsauf den Reaktionsverlauf 50
3. Verlauf der
Acetolyse
53B. Zur Kenntnis des
Lignins
55I. Schiffsche Basen aromatischer
Aldehyde
551. Vanillalanilin 55
2. p-Oxybenzalanilin 57
3.
Vanillal-p-toluidin
574. p-Oxybenzal-o-anisidin 58
5.
Syringalanilin
, 586. Salicylalanüin 61
7.
p-Methoxysalicylalanilin
628.
Pyrogallolaldehydanilin
649. Anisalanilin 65
10. Isovanillalanilin . 66
11. m-Oxybenzalanilin 67
12. Benzalanilin 68
13. Schifische Basen von sekundären Aminen 69 II. Schiffsche Basen von
Glucoaldehyden
701. Helicinanilin 70
2. Glucovanillalanilin 73
A. Zur Kenntnis der Cellulose.
I. Geschichtliches
zurKonstitution und Abbau.
Die Cellulose ist in den letzten Jahrzehnten der
Gegenstand
zahl¬reicher
Untersuchungen
gewesen. Ihrewichtige
Rolle in der Pflanzen¬welt,
die theoretisch interessantenEigenschaften
unddiemannigfaltige
technische
Verwendung
machten dieAufklärung
der Konstitution wünschenswert. Dennoch sind unsere Kenntnisse über die Struktur des Zellstoffs lückenhaftgeblieben.
Nicht einmal dieempirische
Zu¬sammensetzung (C6H10O5)x
ist einwandfreifestgelegt,
weil dieAnalysen¬
zahlen auch für die Formel
(C6H10O5)
x-f-H20 stimmen,
sobald x den Wert 16—18 erreicht oderüberschreitet1).
DieFrage
nach der Größe diesesWertes,
somit nach derMolekulargröße
desKohlenhydrats,
ist viel umstritten worden. Sie blieb
unbeantwortet,
weil die üblichen Methoden derMolekulargewichtsbestimmung
bei dem Kolloid ver¬sagten2).
Dievielversprechende
Methode derViscositätsbestimmung
von E. Berl und R.
Butler3)
erfordert noch eine genauere Kenntnis desZusammenhangs
zwischenMolekulargröße
und Viscosität. Auf chemischemWege
haben Zd. H.Skraup
und E.Geinsperger4)
dieErmittlung
derMolekulargröße versucht;
durchgelinde Einwirkung
von
Acetanhydrid-Salzsäure
haben sie einChloracetylderivat
darzu¬stellen
versucht,
dessenAnalyse
mit einemChlorgehalt
von0,36%
aufdie Formel
(C6H10O5)34 (Molekulargewicht
=5508)
deuten soll. Die Einheitlichkeitdieseramorphen
Substanz ist aber sehr unwahrscheinlich.Man wird nicht
fehlgehen,
wenn man dem Zellstoff ein wesentlich höheresMolekulargewicht
als der Stärkezuspricht, gestützt
auf diex) Näheres siehe bei A. P. N. Franchimont, R. %, 244 (1883).
»)
G. Bumcke und G.Wolffenstein finden B. 38, 2507 (1899) x= 12;A.Nastukoff hatx=40 ermittelt. B. 33, 2241 (1900); 34, 3591 (1901).
3) Z. f. d. ges. Schieß- u.
Sprengwesen
5, 82 (1910).4) M. 86, 1467 (1905).
geringere Hydrolysierbarkeit,
auf die Unlöslichkeit und auf diegrößere
Viscosität der
Lösungen
von Derivaten.Hydrolytischer
Abbau.Mehr
Erfolg
erbrachtenUntersuchungen
über denhydrolytischen
Abbau der Cellulose.
Grundlegend
war dieEntdeckung
von H. Bra-connot1),
der Leinwand in konzentrierter Schwefelsäuregelöst
unddie
Lösung
nach dem Verdünnengekocht hat;
durch Ausfällen der Schwefelsäure undEindampfen
erhielt er einenvergärbaren Zucker,
den er für identisch erklärte mit der Glucose aus Weintrauben oder Stärkemehl. Braconnots Ausbeutebetrug 23,3
g aus 20,4g Lein¬wand,
während die theoretische Ausbeute22,6
gbetragen würde;
abersein
Präparat
war weder einwandfreigetrocknet
noch rein. Es istkeinem vonden vielen
Forschern,
die dieseAngabe nachgeprüft haben, gelungen,
die von Braconnot beschriebene Ausbeute bei genauer Be¬stimmung
zu erzielen.Erst 1883 hat E.
Flechsig2)
den Beweiserbracht,
daß der Zuckervon Braconnot in der Tat Glucose
ist,
und er hat in seinen besten Versuchen Zuckerausbeuten von95—98,6%3)
zuerzielengeglaubt.
DieBestimmungen geschahen
aber nur durch die Reduktion vonKupfer¬
lösung,
also nach einerMethode,
die bei derAnwendung
auf Zucker¬lösungen,
dielange
mit Säuregekocht
wordensind,
zu hohe Wertegibt.
C. G. Schwalbe und W.Schulz4)
haben dieRichtigkeit
derAusbeuteangaben
vonFlechsig
bestritten. VonWichtigkeit
sind da¬her die letzten
Untersuchungen
von H. Ost und L.Wilkening5),
worin die nach Braconnot erhaltenen
Zuckerlösungen
auf ihrDrehungs-
und ihrReduktionsvermögen
genauergeprüft
werden.Nach der
Bestimmung
mit der Reduktionsmethode finden Ost undWilkening
Glucose zwischen73,4%
und113,5%
vom Gewicht der Cellulose(theoretisch 111,1%).
Bei den vier besten Versuchen wurde dasspezifische Drehungsvermögen ermittelt,
und zwar:29,4—44,8°
anstatt
52,5°.
Die Ausbeute anGlucose
hat daher nur56—85%
derTheorie erreicht. Es
zeigt sich,
in welchem Maße hier diealleinige Bestimmung
durch Reduktion vonKupferlösung
irreführen würde.!) A. eh. 13, 172 (1819).
2) H. T, 523 (1883).
3) Aus derArbeit von Flechsig ist nicht zu entnehmen, ob seine Ausbeute in Prozenten der Cellulose oder der theoretischen
Glucosemenge angegeben
ist.Er verzeichnet: „In Zucker
umgewandelte
Menge Baumwolle."*) B. 43, 913 (1910).
«) Ch.-Z. 34, 461 (1910).
Ähnlich
hohe Reduktionswerte wie diese Autoren erhielt auchneuer¬dings
R.Oertel1), dagegen
fand er bei derVerzuckerung
vonOxy-
cellulose
niedrigere Kupferzahlen.
Acetolyse.
Eine andere
Richtung
derForschung
war das Studium des aceto-lytischen Abbaues,
das durch eine Arbeit von A. P. N. Franchi- monteingeleitet wurde2).
Durchacetylierende Reagenzien
inGegen¬
wart von
Hydrolysiermittel,
namentlichSchwefelsäure, Chlorzink, Halogen Wasserstoffe,
läßt sich die Cellulose bis zuGlucoseacetat3)
ab¬bauen;
dieAcetolyse
durchläuft alle Stufen vom hochmolekularenKohlenhydrat
bis zum letzten Baustein. Die erstenZwischenprodukte
bilden die technisch wertvollen
„Celluloseacetate",
die bereits Abkömm¬linge
einesmäßig angegriffenen
Zellstoffessind4);
dieumfangreiche
Literatur über diese Produkte ist beiCG.
Schwalbe6) zusammengestellt.
Die mittleren Produkte der
Acetolyse
sind in ihrenEigenschaften
von den Celluloseestern wesentlich
verschieden;
sie sinddextrinartig,
löslich in
organischen
Solvenzien und meistoptisch
aktiv. IhrAcetyl- gehalt
ist ein hoher.Gesetzmäßigkeiten
zwischen derMolekulargröße
und den
Eigenschaften
dieserZwischenprodukte
sind schon von Zd.H.
Skraup6),
E. v. Hardt-Stremayr7),
L.Maquenne
undW.
Goodwin8) gesucht worden,
aber erst W.Schliemann9)
undF.
Klein10)
bildeten die Methoden derquantitativen Darstellung
aus.Die
Charakterisierung
der Dextrinacetate besteht in derErmittlung
der
Acetylzahl,
derspezifischen Drehung,
desSchmelzpunktes
und desReduktionsvermögens
der freien Dextrine. DieUntersuchungen
sindnoch nicht so weit
gediehen,
daß die Einheitlichkeit deramorphen
Substanzen außer Zweifel stehen
würde;
wohl deshalb führten die bis¬herigen Angaben
zu keinem entscheidendenSchlußbezüglich
der Kon¬stitution des Zellstoffmoleküls.
Das
wichtigste
Resultat auf dem Gebiete derAcetolyse
war die!) Z. 26, 246 (1913). — Diss. Hannover
(1912).
2) B. 13, 1941 (1879); C. r. 93, 1053 (1881).
3) H. Ost, Ch.-Z. 36, 1099 (1912); A. 398, 313 (1913).
*) Schwalbe, Chemie der Cellulose, S. 328.
6) Z. 23, 433 (1910). — Siehe auch Anm. 4.
6) B. 33, 2413 (1899); M. 33, 1021 (1901); 36, 1467 (1905).
') M. 28, 63 (1907).
8) Bl. (3) 31, 854 (1904).
") A. 378, 366 (1910); Diss. Hannover (1910).
l0)
Z. 25, 1409 (1912).Entdeckung
eines neuenBausteines,
derCellobiose;
derkrystalli-
sierende Zucker wurde von
Skraup1) [wohl
schon von Franchi-mont2)]
bei dem Abbau des Zellstoffes mitAcetanhydrid-Schwefel-
säure in Form ihres schwerlöslichen Octaacetats erhalten. Die Biose wurde dann
Gegenstand
vongründlichen Untersuchungen3)
und istein Hilfsmittel für die
Charakterisierung
undUnterscheidung
vonCellu¬lose und ähnlichen Materialien
geworden4).
Ihre besondereWichtig¬
keit
geht
daraushervor,
daß nach Klein mindestens ein Drittel der GlucosemoleküledesZellstoffs in derCellobiosebindung vorliegen.
BeiderAufstellung
einer Strukturformel wird dieser Befundzuberücksichtigen
sein.
Die Konstitution der Cellulose
ist unbekannt. Es ist noch nicht
möglich,
eine Formelaufzustellen,
die allen Tatsachen
gerecht
wird. Als solche kommen das hohe Mole¬kulargewicht,
dieBeziehung
zum Traubenzucker und zurCellobiose,
die
optische Inaktivität,
das Fehlen vonCarbonylgruppen
und dieAnwesenheit freier
Hydroxyle
inBetracht;
auch soll die reichlicheBildung
vonco-Chlormethylfurfurol
beim Abbau nach H. J. H. Fenton und M.Gostling8)
erklärt werden.Vorschläge
für eine Celluloseformel mit offenen Kohlenstoffketten stammen von B.Tollens4),
eineRing¬
struktur ist vonC. F. Cross und E. J.
Bevan7)
angenommen worden.Neuerdings
wirdjedoch
dieFormel I vonA. G.Green8)
am meistenzitiert,
obzwar sie nichtrichtig
sein kann.CHOH-CH-CHOH 0—CH CHOH
o o
III
CHOH-CH-CH2 HOH2C-CH-CH
0i m
CHOH
*) Siehe Anm. 6, Seite 11.
*)
B. 18, 1941 (1879); C. r. 98, 1053 (1881).s)
G. Bertrand und M.Holderer,C. r. 149, 1385(1909).—E. Fischer undG.Zempl
en,A.365,1(1909);A.3T8,254(1910);
B.43,2536 (1910).—F.Klein, Z. 84, 1127(1911).
—H.Pringsheim,
H. T8, 266(1912).
—R. Oertel, Z. 86, 246 (1913); Diss. Hannover (1912). — Siehe auch die Anm. 6—10, Seite 11.*) E. Abderhalden und G.
Zemplén,
H. TS, 58(1911). — G.Zemplén,
H. 85, 173, 180 (1913).
")
Soc. T9, 361(1901).
•) Handbuch der
Kohlenhydrate
II, 252 (1895).7) Soc. T9, 366 (1901).
8) Z. Färb. Text. Ind. 3,97 (1904).—A.G.Green und A. G. Perkin,Soc.
89, 811 (1906).
Denn
abgesehen davon,
daß dieses Schema eine weitereVerkettung
beiBeibehaltung
derempirischen Zusammensetzung
nichtgestattet,
würde eine
Anhydridbildung
zwischenden beiden Enden des Trauben¬zuckermoleküls den
Erfahrungen widersprechen,
die E. Fischer in derZuckergruppe gesammelt
hat. Bei Verzicht auf dieDarstellung
eines hohen Moleküls würde daher die Formel II vorzuziehen sein.
Die
optische
Inaktivität istallerdings
auch mit diesem Schema nicht inEinklang.
II. Zur optischen Inaktivität der Cellulose.
A. Bêcham
p1)
hat diewichtige Entdeckung gemacht,
daß dieCellulose im
Gegensatz
zu Stärke in salzsaurerLösung
die Ebene despolarisierten
Lichtes nicht dreht. Nachdem dieseBeobachtung
vonA.
Levallois2)
mit Unrecht bestritten wordenist,
hatBéchamp dargetan,
daß sich ebenso wie die vermeintlich aktiveKupferoxyd- Ammoniak-Cellulose-Lösung jenes
Autors auch dieKupferoxyd-Am¬
moniak-Lösung
allein verhält und daß die unklarenBeobachtungen
von
Drehung
bei diesenKupferlösungen
indem benutzten Halbschatten¬apparat
nicht aufoptische
Aktivität schließen lassen. Die entscheidendeUntersuchung
vonBéchamp
scheint inVergessenheit geraten
zusein;
die referierende Literatur wird seinem Verdienste nicht
gerecht
undlange
Jahre hindurchgalt
dieFrage
als unentschieden.Die
einzige
Arbeit auf diesemGebiete,
dieAngaben
über die In¬aktivität der Cellulose
enthält,
stammt vonJ.König
undF.Huhn3),
sie bezieht sich aber auf ein anderes
Medium,
nämlich auf Chlorzink- Salzsäure. Es war dahererwünscht,
dieoptischen Eigenschaften
derBéchampschen Lösung
einerNachprüfung
zu unterziehen. MeineBeobachtung1) bestätigt
den Befund des Autors und somit ist die In¬aktivität der Cellulose bereits in 3 Medien
festgestellt.
Zur
Erklärung
des verschiedenenoptischen
Verhaltens derCellulose und der Stärke müßtemanerstentscheidenkönnen,
ob daserstgenannte Kohlenhydrat
absolut inaktiv ist oder ob es ein verschwindend kleinesDrehungsvermögen
dochbesitzt. Istesinaktiv,
somußmanannehmen,
daß sich die Glucosemoleküle innerhalb des Cellulosemolekülskompen-
l) C.r. 99, 1027(1884); 100,279,368(1885). Siehe auchC.r.43, 1210(1856);51, 255 (1860).
*) C. r. 98, 44, 732 (1883); 99, 1122 (1884).
3) Bestimmung
der Cellulosein Holzarten undGespinstfasern.
.Berlin(1912).4) Die ArbeitvonKönigund HuhnwarmirzurZeit der
Ausführung
meiner Versuche noch nicht bekannt.sieren und ihr
Drehungsvermögen
erst bei derAufspaltung
verraten.Trifft
dagegen
die zweite Annahme zu, so ist dieMöglichkeit
einer an¬deren
Erklärung gegeben.
Bei derVereinigung
zu Cellobiose büßen nämlich die zwei Moleküle Glucose einengroßen
Teil ihresDrehungs¬
vermögens ein,
während sie bei derBildung
der Maltose eine erhöhte Aktivität erhalten. Nimmt man an, daß auch bei derBildung
vonhöheren
Zwischenprodukten
derKohlenhydratsynthese
ähnliche Unter¬schiede
auftreten,
so wird[a]D
bei derfortgesetzten
Kondensation vonder Biose zur Cellulose zwar stets
fallen,
aber nicht verschwinden.Voneiner bestimmten
Molekulargröße
an wird dieDrehung
nichtmehrwahrnehmbar sein. Eine ähnliche
Überlegung
würde diehohe Aktivität der Stärke erklären.III. Hydrolyse der Cellulose mit starker Salzsäure.
Konzentrierte Salzsäure
wirkt,
wie A.Béchamp1)
im Jahre1856
gefunden hat,
auf Celluloselösend,
sie ist aber für diesen Zweck noch nicht nützlichgeworden,
weil die rauchende Säure des Handelsnur
langsam
undschwierig
einwirkt. NachBéchamp
verwandeln die konzentriertenSäuren,
wieChlorwasserstoffsäure,
die Baumwolle zu¬nächst in
breiartige
Massen undlösen sie dann. Meistens hatBéchamp,
namentlich in seinen
späteren Untersuchungen
über dieoptische
Aktivi¬tät der
Cellulose,
zum Lösen in Salzsäure dieFällung verwendet,
dieman ausder
Lösung
von Cellulose inKupferoxydammoniak
mitEssig¬
säure erhält.
Zum Verzuckern der Cellulose sind
Reagenzien gesucht worden,
z. B. von E.
Flechsig2),
dieLösungs-
undInvertierungsmittel
zugleicher
Zeitsind; Flechsig
nenntdieSalzsäure ein schlechtesLösungs¬
mittel. Unsere
heutige
Kenntnis hierüber wird von C. G. Schwalbe in der„Chemie
der Cellulose"folgendermaßen wiedergegeben3):
„Es
ist aus derLaboratoriumspraxis
zurGenüge bekannt,
daßFiltrierpapier,
alsoCellulose,
derWirkung
rauchender Salzsäure nichtlange widersteht,
sondern allmählich durch Zerfall der Fasern in Brei¬form
übergeht
und sich teilweise löst." Und ferner:„Bei
starker Salz¬säure ist der
Angriff
wohl noch viel beträchtlicher. Enthält die Salz¬säure
Chlorzink,
so findet reichlicheLösung
der Cellulose statt."*) A. eh.
(3)
48, 458 (1856); C. r. 48, 1210 (1856); 51, 255(1860).
*) H. 1, 523 (1883).
») S. 69.
Die
Beobachtung
vonBéchamp
ist also ohne Einflußgeblieben,
wahrscheinlich
infolge
des Fehlens genauerAngaben1).
Es
gelingt nicht,
mit der üblichen konzentrierten Salzsäure Cellulosezu lösen. Für die Anwendbarkeit der Säure ist es
entscheidend,
daßihre Konzentration höher sei als die der Handelssorten. Salzsäure von
37,6%
Chlorwasserstoff bewirktbeieintägiger Einwirkung
unterSchüt¬teln
Zerfaserung
undGelatinierung
der Cellulose. Ganz anders verhält sich Cellulose gegen Salzsäure von mehr als40%
Chlorwasser¬stoff, zweckmäßig
etwa41%.
Baumwolle löst sich darin reichlich und inwenigen
Sekunden auf und die Säure vermag auch dem Holze rasch diegesamte
Cellulose zu entziehen.Anfangs
läßt sich die Cellu¬lose aus der
Lösung vollständig
wiederausfällen;
allmählicherfolgt
ihre
Hydrolyse,
so daß immerweniger
Fällbares vorhandenist,
end¬lich enthält die
Flüssigkeit
nur noch Glucose.Die Salzsäure bildet
gegenüber
der viel benützten Schwefel¬säure einen
großen
Vorteil in ihrerAnwendung
zurHydrolyse.
DieSchwefelsäure verbindet sich mit den
Polyosen
zuEstersäuren,
die erst durch Kochen mit verdünnten Säuren oder mit Alkoholzerlegt
und dann in der Hitze weiter verzuckert werden
müssen;
dieser Prozeß läßt sichoptisch
nichtverfolgen.
DieHydrolyse
durch Salzsäure ver¬läuft in der Kälte
vollständig
und läßt sich vomAnfang
bis zum Endemit dem Polarimeter beobachten. Die Methode verdient wohl aus¬
gedehntere Anwendung
zurUntersuchung
der höherenKohlehydrate.
Die
Verzuckerung
der Baumwolle durch die Salzsäure in der Kälte erreicht bei1-prozentigen Lösungen
in 1—2Tagen
ihr Endeund
ergibt
eine Ausbeutevon106—107%
des GewichtsderBaumwolle,
also
95—96%
der Theorie anGlucose,
die sowohl durch Polarisation wie durch Reduktion vonFehlingscher Lösung
bestimmt wurde.Die
Aufgabe
derquantitativen Verzuckerung
von Cellulose(und
vonHolz)
ist dadurchgelöst,
nachdem man sie seit fast hundert Jahren l) DenAbhandlungen
vonBéchamp
ist nicht zuentnehmen,
wie er die CellulosemitSalzsäureinLösung gebracht
hat. Nuran einerviel späteren Stelle[C.
r. 100, 370(1885)]
findet sich bei ihm Salzsäurevom spez. Gewicht 1,2 er- wähnt. Wennmit dieserAngabe
dieDichte 1,200gemeintist(entsprechend39,1%
nach
Lunge
undMarchlewski),
dannwarseineSäurezumLösenvonCellulose nichtgutgeeignet.
Nichtohne weiteres verständlich istes,daß dieLösungen
vonBéchamp
nochnach6 Stunden inaktiv waren[C.
r. 100, 370(1885)],
während dieentsprechenden Lösungen (5-proz.)
desVerfassers schon in 1 Stunde erheb¬liche
Zuckerbildung zeigen.
Es istdaraus zuschließen,daß die Chlorwasserstoff- Konzentration in denVersuchenvonBéchamp
dochniedriger
war, wahrschein¬lich
infolge
von Filtrationen.durch die
Hydrolyse
mit Schwefelsäure in der Hitze zu lösen ver¬sucht hat.
Überraschend
istes, daß die Ausbeutean Glucose bei der Salzsäure¬methode nicht durch
Bildung
von Isomaltoseherabgedrückt
wird.Emil
Fischer1)
hatentdeckt,
daß aus Glucose in salzsaurerLösung
die Isomaltose
entsteht,
die erstesynthetisch
erhaltene Biose. IhreBildung erfolgt jedoch
nur in der von E. Fischerangewandten
kon¬zentrierten
Glucoselösung.
Diesezeigt
beim Stehen eine wesentliche Zunahme desDrehungs Vermögens,
während die verdünnteLösung
derGlucose in rauchender Salzsäure in ihrer
Drehung tagelang
konstantbleibt.
Den Verlauf der
Hydrolyse
von Cellulose in der salzsaurenLösung
habe ich im Polarimeter
verfolgt.
Die
Lösungen
sindanfangs inaktiv;
dieAblesungen hegen
inner¬halb der
Fehlergrenzen
derNullpunktsbestimmung.
Das Verhalten derCellulose,
welche durchKompensation
innerhalb ihres Moleküls inaktivist,
bedeutet einen wesentlichenUnterschied von der Stärke.1-prozen- tige Celluloselösungen (1
g in 100com salzsaurerLösung) beginnen
in1 Stunde Aktivität zu
zeigen,
dieje
nach der Stärke der Säure im Laufe von 24—48 Stunden bis zumDrehungsvermögen
der Glucoseansteigt.
DieLösung
enthält dann in der Tat nichts anderes als Glu¬cose, während
Béchamp2),
der ihre starkeRechtsdrehung
wahr¬genommen
hat,
angenommen zu habenscheint,
daß sie Stoffeenthalte,
welche sich in Glucose überführen lassen. Zur
vollständigen
Erkenntnisdes Sachverhalts ist
Béchamp
wahrscheinlich deshalb nichtgelangt,
weil die
Drehung
derGlucose,
wieuntenausgeführt ist,
mitder Konzen¬tration der Chlorwasserstoffsäure in außerordentlichem Maße
ansteigt;
[a]D
wurde wachsend von 53—180° ermittelt.Das
Ansteigen
desDrehungsvermögens
der Cellulose-Salzsäure ver¬läuft nicht
gleichmäßig,
sondern beijedem
Versuche war nacheinigen
Stunden für kurze Zeit ein Stillstehen zu
beobachten,
welches mit dem Auftreten einesZwischenprodukts
imZusammenhang
stehen wird.Die Aktivität in
irgendeinem Zeitpunkte
kannentwedervonhöherem Zuckermitbedingt
sein oder nur vonfertiger
Glucose herrühren. Der eine Fall ist in den ersten Stunden des Versuchsgegeben,
der zweiteim
späteren
Verlauf zu beobachten. In denAnfangsstunden ergibt
sichnämlich aus der
spezifischen Drehung
mehr Glucose als aus dem Re-x) B. 23, 3687 (1890); 28, 3024 (1895).
2) C. r. 99, 1028 (1884).
duktionsvermögen;
esist also einzusammengesetzter
Zucker inLösung.
Die noch
vorhandene,
durch Verdünnen fällbarePolyose
ist nämlichinaktiv1).
Trenntman diedextrinartigen
von denleicht löslichen Pro¬dukten ab und behandelt man die letzteren weiter mit
Salzsäure,
sosteigt
ihrespezifische Drehung infolge
derzu Endegehenden Hydrolyse
zu Glucose. Man kann so in
jedem Zeitpunkt
dieMenge
Glucose er¬mitteln,
die dengebildeten
wasserlöslichen Zuckernentspricht.
Imspäteren
Verlauf derCelluloseverzuckerung
wurde nach demDrehungs¬
vermögen
und derKupferzahl
dergleiche
Wert von Glucose ermittelt.Esscheint daraus
hervorzugehen,
daß imspäteren
Verlauf der Reaktion in der Zeiteinheitweniger Zwischenprodukt (z.
B.Cellobiose) entsteht,
als in Glucose weiter zu zerfallen vermag.
Die
optische Beobachtung
der Reaktion soll zurGrundlage
fürpräparative
Versuche über den Abbau der Cellulose dienen.IV. Acetolyse der Cellulose mit Acetylbromid.
Glucose
reagiert
bekanntlich nach W.Koenigs
und E.Knorr2) glatt
mitAcetylbromid,
indem einHydroxyl
durchHalogen
ersetztwird und die anderen
acetyliert
werden. Die so entstehende Aceto-bromglucose
ist außerordentlichreaktionsfähig
und dieKörper,
diedurch Ersatz des Broms bereitet werden
können, beständig
und schönkrystallinisch
;Pentaacetylglucose, Acetonitroglucose, Phenolglucosid, Naphtholglucosid
u. a. wurden bereits vonKoenigs
und Knorr auf diesemWege
gewonnen. Diemannigfaltigsten Verwendungen
vonAcetohalogenverbindungen
der Zucker zusynthetischen
Zwecken sindvon E. Fischer und seinen Mitarbeitern in zahlreichen
Abhandlungen3)
beschrieben
worden,
in welchen auchAcetohalogenverbindungen
vonmehreren
Biosen,
vonCellobiose4), Lactose,
Maltose charakterisiert sind.Derartige Abkömmlinge
vonPolysacchariden
sind noch nichtbekannt.Die Cellulose besitzt nach den herrschenden
Anschauungen
freies1) oder fast inaktiv.
*) B. 34, 957 (1901).
3) E. Fischer und E. F.
Armstrong,
B. 34, 2885(1901);
35, 833, 3144, 3153 (1902). —E. F. und K. Raske, B. 48, 1465 (1909); 43, 1750(1910).
—E. F. und K.
Delbrück,
B. 42, 1476 (1909). — E. F. und H. Fischer, B. 43, 2521 (1910). — E. F. und G.Zemplén,
B. 43, 2536 (1910). — E. Fischer, B. 44, 1898(1911).
—E. F. undK. Zach,B. 44,132(1911);
45, 3761(1912).
—E. F. und H. Strauß, B. 45, 2467, 3773 (1912).
4) Acetochlorcellobiose ist bereits von Zd. H.
Skraup
und J.König
er¬halten worden. M. %%, 1033
(1901).
2
Hydroxyl,
eswardaherzuerhoffen,
daß sichuntergelinden Bedingungen
AcetobromcellulosenundverwandteVerbindungen
bereitenlassen,
ohne daßgleichzeitig
eintiefgehender
Abbauerfolgt.
Der Austausch desHalogens
würde dann in eine neueKörperklasse führen,
die als„Cellu-
loside" bezeichnet werden könnte.Speziell
dieVerkupplung
mit aro¬matischenSubstanzen vom
Typ
des Vanillins würdeVerbindungen
er¬geben,
die zumVergleich
mit der Holzsubstanzgeeignet
wären.Beabsichtigt
war dieBereitung
dergewünschten Verbindungen
durch
Einwirkung
desAcetylbromids
auf Baumwolle, Die nicht auf¬gelöste
Cellulose verhält sich indessenträge
gegen dasReagens;
sienimmt in diesem Zustand weder Bromnoch
Acetyl
auf und dieHydroxyle
werden nur in dem Maße
reaktionsfähig,
als dasKohlenhydrat
in Lö¬sung
geht.
Mit demLösungsvorgang
ist aber der Abbau engverknüpft
und
gleichzeitig
mit derVeresterung
vorhandenerHydroxyle
werdenderen neue entschleiert. So konnte die Acetobromcellulose nicht er¬
halten werden und die Versuche führten zunächst zur
Untersuchung
des
acetolytischen
Abbaues. Das Studium dieses verwickelten Vor¬ganges war vorbereitet durch die Arbeiten von Zd. H,
Skraup
überdie
Einwirkung
vonAcetanhydrid
und Chlorwasserstoff(nascierendes Acetylchlorid)
auf Cellulose. Beijenen
Versuchen war also nicht nurdas Säurehaloid
wirksam,
und so waren die interessanten Beobach¬tungen,
die zurEntdeckung
der Acetochlorcellobioseführten,
noch nichtgeeignet,
den Mechanismus derAcetolyse
aufzuklären,1.
Lösung
der Cellulose inAcetylbromid;
Einfluß des Grades seinerHydrolyse
auf den Abbau.Läßtman die
Acetolyse
ingeschlossenem
Einschlußrohr vorsichgehen,
soerfolgt
die totaleAuflösung
in 1—2Tagen.
Der Abbau istdann weit
vorgeschritten;
man erhältProdukte,
derenBromgehalte
auf die Monosestufe hindeuten. Es entsteht dabei keine reine Aceto-
bromglucose
alsEndprodukt,
weil letzteres derEinwirkung
von HBrnicht widersteht. Die
lange
dauerndeEinwirkung
von Bromwasser¬stoff auf
Glucosepentaacetat
führtbekanntlich1)
über die Mono- zurAcetodibromverbindung
und zweifellos könnte man unter besonderenBedingungen
nochbromreichere, acetylärmere
Substanzengewinnen.
Bei den Versuchen mit Baumwolle wurden Bromzahlen bis zu
41%
Brbei mehrtägiger
Versuchsdauer ermittelt. Der Eintritt desHalogens
indas Molekül der Stärke
erfolgt langsamer,
trotzdem dieses Kohlen- l) E. Fischer und E. F.Armstrong,
B. 35, 833(1902).
hydrat
bereits in1/2—1 Tag glatt
inLösung geht,
also die erstenPhasen der Reaktion rascher durchläuft.Versuche in
geschlossenem
Rohre sind fürpräparative
Zwecke un¬geeignet,
weil der unter hohem Druck stehende BromWasserstoff den Abbau unerwürfschtbeschleunigt.
Bei dem Ersatz des Bombenrohres durch einoffenes,
vorFeuchtigkeit geschütztes Helmrohr,
dauerte derLösungsvorgang länger,
dasReaktionsprodukt
enthielt nach 5Tagen
nur
2072%
Br(Acetobromglucose 1972%)
und lieferte bei Austausch desHalogens
durchAcetyl
einfast reinesPräparat
von/î-Pentaacetyl- glucose.
Die Ausbeute an diesem Acetat war indessenklein,
weil da¬neben
Sirupe entstanden,
die wohl auch dasniedriger
schmelzende a-Acetatenthalten,
das bereitsvon H.Ost1)
durchAcetolyse
inGegen¬
wart von Schwefelsäure in sehr
guter
Ausbeute gewonnen wurde. DieIsolierung
beider Dextroseacetate mag im Hinblick auf dieKonfigura¬
tion der Cellulose von Interesse
sein,
wenn bei der Arbeitsweise vonOst keine
Umlagerung eintritt2).
Zur weiteren
Verfolgung
des Abbaues wurde unter Schütteln ge¬arbeitet,
wobei zunächst beträchtlicheSchwankungen
in derReaktions¬geschwindigkeit auftraten;
in dem Maßenämlich,
als dieOperationen
rascher wurden und auch der Abschluß von der
Luftfeuchtigkeit
ver¬bessert werden
konnte, zeigten
die Versuche einenträgeren
Verlauf.Die Ursache
lag
in der wechselndenQualität
desAcetylbromids.
Wieerwähnt,
wird unveränderte Cellulose nurlangsam angegriffen;
dieSpaltung
bis zu einerStufe,
die demReagens
nicht mehrwidersteht,
wird
hauptsächlich
von denVerunreinigungen
desBromids,
nämlichvon Bromwasserstoff und
Eisessig, besorgt.
KeinAcetylbromid
desHandels ist frei von sauren
Beimengungen,
weil dergeringste
Kontaktmit der
Luftfeuchtigkeit
einespurenweise Verseifung
bewirkt. DenBeweis über den Einfluß des
„Grades
derHydrolyse"
habe ich auf zweiWegen
erbracht.a)
DieEinwirkung
eines vollkommen reinenBromacetyls
auf die Cellulose wurde unterpeinlichem
Ausschluß derFeuchtigkeit
vor¬genommen. Nach
5-tägiger
Reaktionsdauerbegann
sich das Kohlen¬hydrat
erst eben zulösen,
während bei einemgleichzeitig angesetzten
Kontrollversuch mit käuflichem Bromid derLösungsvorgang
schon in472 Tagen
beendetwar. Daßspäter
schließlich doch eineLösung
ent¬steht,
wäre durch einespurenweise Acetylierung
undEinwirkung
des*) Ch.-Z. 36, 1099 (1912); A. 398, 313 (1913).
2)
Vgl.
Ph. Ch. 58, 97 (1902).2*
freigewordenen
Bromwasserstoffs zuerklären. BestimmbareMengen
anAcetyl
oderan Brom treten in dieungelöste
Cellulose nicht ein. Es istauffallend,
daß dieOH-Gruppen
einesKohlenhydrats
unter diesenBedingungen unangegriffen bleiben,
und dieAnsicht,
daß die intakte Cellulose in fester Form freiesHydroxyl enthält,
bedarf derexperi¬
mentellen
Nachprüfung.
b)
EinVergleich
von verschiedenhydrolysierten Acetylbromiden ergab
dasResultat,
daß dieweitgehender
verseiftenReagenzien
rascheraufdenZellstoff einwirken. Die Versuchsreihe wurde derart
ausgeführt,
daß der Zusatz der genau berechneten
Menge
an Wasser zum Bromidden
gewünschten Hydrolysiergrad
einstellte. DieAbhängigkeit
warnach
eintägiger
Reaktionsdauer diefolgende:
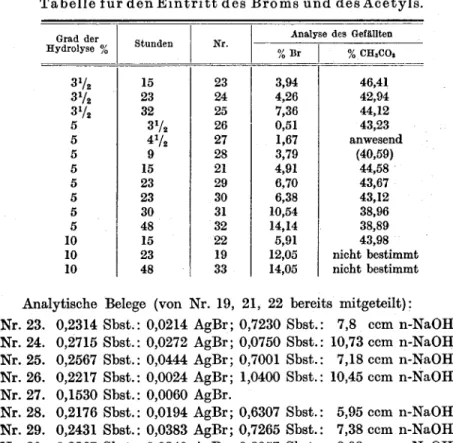
Grad derHydrolyse (%) Ungelöstes (%des Ausgangsmat.) %Br imF&llungsprodukt
0 75 1,4
5 17,5 6,0
10 10 12,0
2. Verlauf der
Acetolyse.
Zur
Aufklärung
derAcetolyse
ist esnötig,
bei einem Grad derHydrolyse
und untergleichen sonstigen Bedingungen
die Reaktions¬dauer zu variieren. Als Maß für den Grad des Abbaues in einem Zeit¬
punkt
dienenAnalysenzahlen
desReaktionsprodukts.
Nachdem hoch¬molekulare
Zwischenprodukte
überschrittensind,
wird dieAcetolyse
bis zur Monosaccharidstufe
ungefähr
denfolgenden Weg
durchlaufen:Ber. %Br %CH,CO Acetobrom-octasaccharid
CisHüAoACüsBr
3,29 44,30„ -hexasaccharid
C36H4203oAci9Br
4,32 44,14„ -tetrasaceharid
CüiH^OjäoAc^Br
6,27 43,85„ -trisaccharid
C18H21O15Ac10Br
8,09 43,58„ -disaccharid
C12H14O10Ac7
Br 11,43 43,07„ -monosaccharid C8
H7 Oa
Ac4Br 19,44 41,86 DieVersuchehaben in der Tatergeben,
daß derGang
der Reaktion diesem Schemaungefähr entspricht.
Stets tratenHalogen
undAcetyl
zusammen
auf,
das Verhältnis der beiden verschob sich aber bei fort¬schreitender
Acetolyse zugunsten
derBromzahlen,
die sich beträcht¬lich
ändern,
während dieAcetylzahl
nur eine kleineVerminderung
er¬fährt. Bei einem Grad der
Hydrolyse
von5%
enthielt das Reaktions¬produkt
nach372
Stunden etwa0,5%
Br und43% CH3CO,
nach2
Tagen 14%
Br und39% CH3CO.
Die Kurve
(Fig. 1) zeigt
dieAbhängigkeit
desHalogengehalts
vonder Zeit.
Die
Acetolyse
verläuft in derWeise,
daß freiwerdendeHydroxyl¬
gruppen in stets
größerem
Maße durch Bromwasserstoffangegriffen werden,
während sie in den ersten Phasen des Abbaues wesentlich eineAcetylierung
erfuhren. Durch Eintritt desAcetyls
wird der dazunötige
Bromwasserstofferzeugt,
der andererseits mehr und mehr auf dieeingetretenen Acetylgruppen
verseifend einwirkt. Neben dem all¬gemeinen Abbau,
der von höheren zuniedrigeren
Molekülenführt,
er¬folgt
also eineReaktion,
die derUmwandlung
von Zuckeracetaten inAcetobromverbindungen gleicht.
Von besonderem Interesse ist die kurze
Hemmung,
die dasAnsteigen
des
Halogengehalts
zu einer Zeiterfährt,
wo dieanalytischen
Datendes
Reaktionsprodukts
mit den für ein Acetobromtetrasaccharid be¬rechneten Zahlen übereinstimmen.
Vorläufige
Versucheergaben,
daßdas Produkt nicht einheitlich
ist;
zurendgültigen Entscheidung
derFrage,
ob sich aus dem Gemisch einZwischenprodukt
derAcetolyse
herausarbeiten
läßt,
muß derVersuchsmaßstabvergrößert
werden. DerUmstand,
daß dieAuflösung
des Zellstoffs allmählichstattfindet,
so¬mit verschiedene Anteile verschieden
lang
demspaltenden Agens
aus¬gesetzt sind,
schließt nicht aus, daß in bestimmtenZeitpunkten
be¬stimmte Reaktionsstufen vorwalten können.
B. Zur Kenntnis des Lignins.
I.
Über
die Natur der Holzsubstanz.1. Vorkommen und
Zusammensetzung.
Lignine
sind inHölzern,
Stroharten und verholzten Geweben all¬gemein
verbreitet und bilden einenHauptbestandteil
dieser Stoffe.Die Fichte enthält gegen
30% Lignin.
Doch ist zubemerken,
daß derGehaltanInkrusten eine Funktion des Alters
ist,
indem mit zunehmen¬dem Alter der Gehalt an
Lignin
raschersteigt,
als an Cellulose.Ältere Forscher1)
vermutetenimLignin
ein Isomeres desZellstoffs;
die scharfe
Unterscheidung
desKohlenhydrates
von den Inkrusten istPayens
Verdienst. Der NameLignin
stammtvonF. Schulze(1857).
Die
analytischen
Merkmale derVerholzung
lassen sich wiefolgt
zusammenfassen:
a)
der C-Gehaltsteigt
von etwa44,5
auf50%, b)
der»)
Vgl.
J. 1859, 529—542.H-Gehalt bleibt gegen
6%, c)
der O-Gehalt sinkt undd)
ein Gehaltan
Methoxyl
tritt auf.Von der
physiologischen
Rolle der Holzsubstanz scheint bisher nur dieErhöhung
der-mechanischenFestigkeit
undTragfähigkeit
bekanntzu sein und es ist nicht
aufgeklärt,
auf welche Weise dieLigninköfper
in die
Lebensprozesse
der Pflanzeeingreifen.
2. Aromatische Bestandteile. — Das aktive
Carbonyl.
Es muß betont
werden,
daß die Einheitlichkeit der Inkrustenkeineswegs
außer Zweifelsteht;
diegroße Mannigfaltigkeit
der Holz¬reaktionen und die Art der
Entstehung
der Holzsubstanz lassen dieMöglichkeit
zu, daß imLignin
eine ganze Reihe von Substanzen ent¬halten sind. Jedenfalls sind die
Analysenresultate
derverschiedenen Forscher1) schwankend;
um so willkommener war dieFeststellung
einiger
charakteristischer Merkmale.a)
DasLignin
enthält ein Benzolderivat. Diesewichtige
Erkenntnis ist leider durch das Fehlen vonquantitativen Angaben
in ihrerBedeutung herabgesetzt. Gelegentlich
zahlreicherUntersuchungen
wurden aromatische
Substanzen
inwinzigen
Ausbeuten aus dem Holzdargestellt
und zuweitgehenden Schlußfolgerungen
verwertet, obzwär dasLignin
einen sogroßen
Anteil desHolzgewichtes
ausmacht.Die ersten
präparativen
Versuche wurden im Wies nerschen Labora¬torium durch M.
Singer8) ausgeführt, gestützt
auf dieMeinung,
daßdie
„Holzsubstanz"
mit Vanillin identisch sei. DieBeweisführung
be¬stand in der
Feststellung
desvanillinartigen
Geruches von Extrakten.Für die Anwesenheit dieses
Aldehydes
im Holze traten dann unteranderen W.
Hoffmeister3),
J. B.Lindsey
und B.Tollens4),
ingewissem
Sinne auch E. 0. v.Lippmann5) ein,
während sichE.
Nickel6),
sowie Th.Seliwanoff7)
ablehnendäußerten. Die meisten Autorenbestätigten
die Anwesenheit von Vanillin in derHolzsubstanz.A.
Ihl8)
vermuteteallerdings
nichtVanillin,
sondernZimtaldehyd,
*) Biochem. Handlexikon II, 238.
s) Wiener
Sitzungsber.
86, I, 345 (1882). — Siehe auch F. Tiemann und W. Haarmann, B. 7, 608 (1874); 8, 1136 (1875).»)
Landw. Jahrb. IT, 260 (1888).*)
A. 26T, 341(1891).
») B. 13, 662
(1880);
18, 1335(1884).
«)
Ch. Z. 11, 1520(1887);
Bot. C. 38, 753(1889).
Farbenreaktioften derKohlenstoffverbindungen
S. 32 (1890).7)
Bot. C. 45, 279(1891).
B) Ch. Z. 13, 432, 560 (1899); 15, 201 (1901).
Eugenol, Safrol,
Anethol imLignin,
während F.Czapek1)
ein durchHydrolyse
mit Zinnchlorür erhaltenesProdukt,
sein„Hadromal",
alsden wesentlichenBestandteilderInkrusten
angesprochen
hat und ihm die Konstitution eines1, 3,
4-trisubstituierten Benzols zuschrieb.Eine teilweise
Aufklärung
der zahlreichenWidersprüche
schien eine ausführliche Arbeit von V.Gräfe*)
zubringen.
Er bewies die Un- einheitlichkeit des Hadromals undzeigte, „daß
die Holzsubstanz im wesentlichen einKonglomerat
vonVanillin, Methylfurfurol
und Brenz-catechin" darstellt. Wenn auch dieser
Ausspruch
zu ganz falschenVorstellungen
Anlaßgibt
und auf dasCzapeksche
Produkt be¬schränkt werden
muß,
so enthält die Arbeitnichtsdestoweniger
dieBestätigung
der Anwesenheit von aromatischen Produkten im Holze.Dieses
Hauptresultat
dergenannten Untersuchungen
erhieltgleich¬
zeitig
seitens C. F. Cross und E. J.Bevan3)
eineStütze,
die bei derChlorierung
vonJute unzweifelhaft aromatischeKörper
erhielten. End¬lich
sprechen
auch die neuen Arbeiten von P.Klason4) zugunsten
dieser
Anschauungsweise.
Klason nimmt zweiLignine
an, die er alshochmolekulare
Kondensationsprodukte
vonConiferyl-
undOxyconi- ferylalkoholen
bezeichnet und die sich nur durch eine Differenz von1
Methoxyl
unterscheiden sollen. Diesespezielle
Annahme istwenig wahrscheinlich,
sicher ist nur, daß Benzolderivate imLignin
vor¬kommen.
Klason betont auch die
große Ähnlichkeit
mit denGerbstoffen,
eineAnsicht,
die auch von C. G. Schwalbe erwogen wird.b)
DasLignin
enthält aktivesCarbonyl.
Es wirdallgemein
angenommen, daß im Nichtcelluloseanteil des Holzes ein
Aldehyd
ent¬halten
ist,
der sich durch Kondensationsreaktionen(mit primären
undsekundären
Aminen, Hydrazin-
undPhenylhydrazinchlorhydrat,
mitPhenolen und mit
fuchsinschwefliger Säure)
verrät. Als Beweise sind ferner dieIsolierung
von Vanillin und diealdehydische
Natur des„Hadromals"
zu betrachten.Über
dieMengen
dieseraldehydischen
Stoffe ist nichts Sicheresbekannt.
Methylzahlbestimmungen
brachten keineAufklärung;
so hatz. B. Gräfe unter der
Annahme,
daß Vanillin dereinzige Methyl
l) H. Vi, 141 (1899).
*) M. 25, 987
(1904).
3) Cellulose S. 101, 135(1903).—C. G.Schwalbe,DieChemiederCellulose S. 379 (1911).
) BeiträgezurKenntnisderchemischen
Zusammensetzung
desFichtenholzes.Berlin (1911).
liefernde Bestandteil des Holzes
sei, Vanillinmengen abgeleitet,
die denErfahrungen widersprechen.
Er schreibt:„Demnach
wäre, wenn man aus dengefundenen
Ziffern den Mittelwertnimmt,
dieMenge
des inderHolzsubstanz befindlichen Vanillins . . . mit
48%
der Holzsubstanz anzunehmen. DieMethylzahl
der Holzsubstanz(Menge
desabspalt¬
baren
Methyls ausgedrückt
inZehntelprozenten)
wäre demnach 48.Diese Zahl stimmt annähernd mit der von Benedikt und Bam¬
berger1)
. . . angenommenen Zahl52,9
überein." — Bezieht sich der Ausdruck„Holzsubstanz"
aufLignin,
so ist das Resultatunbrauchbar, .beziehen
sich dieMethylzahlen
aufHadromal,
sobesagen
sie nichtsüber die
Aldehydmengen
im Holze.Als zweiter
Beleg
seiangeführt,
daßKlason2) gelegentlich
derUntersuchung
derAblaugen
desSulfitkochprozesses methylreiche Körper isolierte,
die kein Kondensationsvermögen
gegen Amin- undHydrazingruppen zeigten.
Zusammenfassend ist zu
bemerken,
daß dieMengen
an aktivemCarbonyl
des Holzes meist überschätzt wurden und daß die Annahme einerProportionalität
zwischenCarbonyl-
undMethylzahlen
nicht stich¬haltig
ist. Dabei seibetont,
daß die kleinenMengen
deraldehydischen
Bestandteile fest
gebunden
und normale Bestandteile seinmüssen;
sie alsbeigemischte, niedrigmolekulare Aldehyde anzusprechen,
würde denLöslichkeitsverhältnissen nicht
gerecht
werden.3.
Beziehung
zwischen der Cellulose und demLignin.
Die zahlreichen theoretischen
Anschauungen
hierüber lassen sich in zweiGruppen
zusammenfassen. Man nimmt entweder an, daß der Zellstoffätherartig
an die Inkrustengebunden ist,
oder daß keine chemischeVerbindung,
sondern eingegenseitiges Adsorptionsgemenge vorliegt.
Die klareAussprache
der chemischenHypothese
stammtvon C. F. Cross und E. J. Be
van3);
ähnliche Ansichten wurden in denAbhandlungen
vonCzapek
und von Gräfegeäußert.
Der Be¬gründer
der kolloidenAnschauungsweise
ist H.Wislicenus4),
dessenAuffassung
auch von P.Klason5) geteilt
wird.*) Wiener
Sitzungsber.
1891, 292.2) 1. c. S. 27.
s) Cellulose. London (1903). Weitere Literaturstellen siehe Biochem. Hand¬
lexikon II, S. 233 und bei Klason, 1.c. S. 14.
4) H. Wislicenus und M. Kleinstück, Tharand. forstl. Jahrb. 60, 313
(1909);
C. 1909 II, 919. — Z. eh. ind. coli. 6, 1 (1910); C. 1910 I, 1623.5) 1.c. S. 39.