Vergleich von Methoden zur Bestimmung der minimalen Hemmkonzentration und Schlussfolgerungen zur
Weiterentwicklung der Methoden
Comparison of methods for suspectibility testing of pathogens to
antiinfective agents and conclusions concerning the further development of these methods
Abstract
The evaluation of microbial resistance is one of the most important and most often performed tests in clinical microbiology and infection control
Nils-Olaf Hübner
1Katharina Sciermoch
1laboratories. We show and compare our own approach to improved
Axel Kramer
1methods based on an overview on assets and drawbacks of established methods of resistance testing of pathogens to antimicrobial agents.
Keywords:supectibility testing, antimicrobial agents 1 Institut für Hygiene und Umweltmedizin der Ernst- Moritz-Arndt-Universität, Greifswald, Deutschland
Zusammenfassung
Die Bestimmung der mikrobiellen Resistenz gehört zu den wichtigsten und am häufigsten durchgeführten Untersuchungen im klinisch-mikro- biologischen und krankenhaushygienischen Labor. Ausgehend von einer Übersicht über Vor- und Nachteile der etablierten Methoden zur Emp- findlichkeitstestung mikrobieller Krankheitserreger gegen Chemothera- peutika zeigen die Autoren eigene Ansätze zur Verbesserung der Metho- dik und vergleichen diese mit den bestehenden Methoden.
Schlüsselwörter:Resistenztestung, Chemotherapeutika
Einleitung
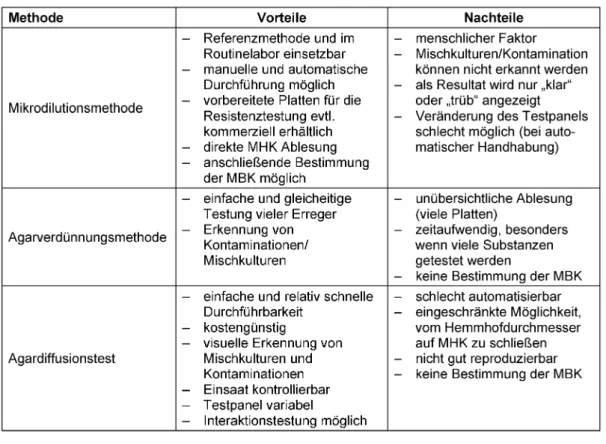
Die minimale Hemmkonzentration (MHK, engl. minimal inhibitory concentration, MIC) gegenüber Mikroorganis- men ist allgemein als die niedrigste Konzentration eines Antiinfektivums definiert, bei der das Wachstum eines mikrobiellen Erregers über eine bestimmte Zeit gerade noch gehemmt wird [1]. International existieren verschie- dene Standards zur Bestimmung der MHK. In Deutsch- land erfolgt die MHK-Bestimmung auf Grundlage der DIN 58940 „Empfindlichkeitsprüfung von mikrobiellen Krank- heitserregern gegen Chemotherapeutika“. In dieser wer- den drei Methoden, die Mikrodilutionsmetode (die Makro- bouillonmethode wurde ersatzlos zurückgezogen), die Agardiffusions- und die Agardilutionsmethode beschrie- ben.
Mikrodilutionsmethode
Die Mikrodilutionsmethode (DIN 58940-8 und Beiblätter) gilt als Referenzmethode. Sie beschreibt eine in Mikroti-
terplatten durchgeführte Bouillondilutionsmethode. Es handelt sich um einen Reihenverdünnungstest, in dem geometrische Verdünnungen des zu testenden Stoffs in Nährmedium mit dem zu testenden Erreger inokuliert werden. Nach erregerabhängiger Inkubationszeit (im all- gemeinen 18-24h) erfolgt die visuelle Auslesung und Bewertung gegen die mitgeführte Sterilitäts-(Negativ-) und Wachstums-(Positiv-)Kontrolle. Die Konzentration des Chemotherapeutikums, bei der gerade kein sichtba- res Wachstum (keine Trübung) erkennbar ist, gilt als mi- nimale Hemmkonzentration [2]. Die Vorteile der Methode liegen in der guten Standardisierbarkeit und der Eignung für das Routinelabor. Die Durchführung in Mikrotiterplat- ten erlaubt die effiziente und kostengünstige Testung vieler Isolate. Präparierte Mikrotiterplatten sind als Kits kommerziell erhältlich. Die Tests können teilweise oder komplett automatisiert werden. Die MHK kann direkt abgelesen werden, zudem ist die Bestimmung der mini- malen bakteriozidien Konzentration (MBK) im Anschluss unkompliziert möglich.
Neben diesen offensichtlichen Vorteilen existiert jedoch eine Reihe von Nachteilen. Hier ist zunächst die visuelle, nicht standardisierte Messung zu nennen (individueller Faktor). Obwohl die Norm auch die Messung mittels
Photometer ermöglicht, wird dadurch nicht das Hauptpro- blem, dass die diskrete, dichotome Entscheidung „Hem- mung vs. Wachstum“ auf Grundlage der Bewertung der kontinuierlichen Größe Trübung erfolgt, beseitigt. Zum anderen gestattet die Methode keine Unterscheidung von Mischkulturen. Grundvoraussetzung für eine Testung ist damit die absolute Reinheit des Inokulums, die, da es sich bei klinischen Isolaten üblicherweise um Mischkultu- ren handelt, mit einem substantiellen Arbeits- und Zeit- aufwand verbunden sein kann. Neben der Verzögerung der (ggf. therapiebestimmenden) Aussage kann es dabei auch zur Veränderung des Erregers unter Laborbedingun- gen kommen, so dass das getestete Inokulum für den ursprünglich isolierten und zu therapierenden Mikroorga- nismus nicht mehr repräsentativ ist. Auch eine Reinkultur schließt eine akzidentielle Kontamination, die nicht de- tektiert werden kann, nicht aus. Schließlich bieten kom- merzielle Testpanels und automatisierte Abläufe zwar logistische und ökonomische Vorteile, erschweren jedoch die Testung „ungewöhnlicher“ Substanzen [1], [2], [3], [4], [5], [6], [7].
Agardilutionsmethode
Die Agardilutionsmethode (DIN 58940-6) ist im Prinzip eine Variante der Bouillondilutionsmethode mit dem Un- terschied, dass als Verdünnungsmedium nicht Bouillon, sondern Agar dient, dem das Chemotherapeutikum, so- lange er flüssig ist, beigemischt wird. Der Agar wird an- schließend in Petrischalen gegossen. Nach Erstarren des Agars wird das Inokulum auf die Agar-Oberfläche aufge- tragen. Nach Inkubation wird das makroskopisch sichtba- re Wachstum abgelesen.
Die Vorteile dieser Methode liegen in der einfachen und seriellen Testung vieler Erreger und der Möglichkeit, Kontaminationen einfach zu erkennen. Die Nachteile liegen im zeitlichen Aufwand, der schlechteren Automati- sierbarkeit und der unübersichtlichen Ablesung insbeson- dere wenn eine große Anzahl verschiedener Substan- zen/Konzentrationen getestet werden soll. Zudem ist eine einfache Bestimmung der MBK wie bei der Bouillondilu- tion nicht möglich. Diese Methode eignet sich daher be- sonders zur Testung der Empfindlichkeit vieler Erreger gegen ein Chemotherapeutikum oder wenige Chemothe- rapeutika [1], [7], [8].
Agardiffusionsmethode
Im Gegensatz zu den Dilutionsmethoden (Bouillon- und Agardilutionsmethode) beruht der Agardiffusionstest (DIN 58940-3) auf einem anderen Prinzip. Hier wird ein Wirk- stoffträger (Testplättchen oder Teststreifen), der eine definierte Menge Chemotherapeutikum enthält, auf die Oberfläche einer zuvor homogen beimpften Agarplatte gelegt. Durch Diffusion des Wirkstoffs in den Agar entsteht ein nach außen hin abfallendender Konzentrationsgradi- ent mit der höchsten Konzentration am Wirkstoffträger.
Empfindliche Erreger wachsen unter Bildung eines Hemmhofs, dessen Durchmesser ein Maß für die Emp- findlichkeit des Erregers ist. Anhand der Hemmhofgröße lassen sich Rückschlüsse auf die MHK ziehen. Diese Methode ist die am wenigsten arbeitsintensive und technisch einfachste, da die kommerziell erhältlichen Wirkstoffträger mechanisch auf die Platte aufgestempelt werden. Sie wird daher häufig durchgeführt. Wie bei der Agardilutionsmethode können Kontaminationen und Mischkulturen einfach erkannt werden. Die Vielzahl der erhältlichen Wirkstoffträger ermöglicht die zu testenden Substanzen problemlos an die Fragestellung anzupassen.
Zudem können Interaktionen (z.B. Synergie zwischen Betalactam und Aminoglycosid) untersucht werden.
Hauptproblem der Methode ist wiederum die Bewertung einer kontinuierlichen Größe (Hemmhof) als Grundlage einer diskreten Entscheidung. Erschwerend kommen die visuelle Ablesung und teilweise unscharfe Hemmhofgren- zen hinzu. Das führt zu einer schlechten Reproduzierbar- keit der Ergebnisse. Der Hemmhofdurchmesser ist zudem kein direktes Maß der MHK, sondern steht mit diesem in einem nur durch Regressionsanalyse bestimmbaren Verhältnis [1], [7], [9].
In Tabelle 1 sind die Vor und Nachteile der drei Methoden zusammengefasst.
Aufbauend auf den beschriebenen Methoden haben wir Ansprüche für eine Ideal-Methode zur MHK-Bestimmung formuliert. Diese sollte die Vorteile der etablierten Metho- den bieten, ohne deren Nachteile zu besitzen. Die Diluti- onsmethoden ermöglichen eine direkte Ablesung der MHK und erscheinen daher besonders geeignet. Die im Folgenden vorgestellten Methoden basieren daher auf der Dilutionsmethode. Tabelle 2 fasst Vor- und Nachteile zusammen.
Mikroagargussmethode
Grundlage der Mikroagargussmethode ist die Idee, die Vorteile der Bouillondilutionsmethode zu nutzen, ohne deren Hauptnachteile, die fehlende Erkennbarkeit von Mischkulturen und das auf einer kontinuierlichen Skala zu messende Resultat (Trübung) in Kauf nehmen zu müssen. Sie ist eine Kombination der Koch’schen Guss- plattenmethode mit moderner Mikrotiterplattentechnik und nutzt die Reihenverdünnung des zu testenden Che- motherapeutikums. Eine Adaptation des Koch’schen Gussverfahrens auf ein Mikrotiterassay wurde erstmals 1998 von Nizet et al. [10] als semiquantitative Methode zur Keimzahlbestimmung bei Versuchen zur bakteriellen Invasion und Adhärenz beschrieben. Unseres Wissens sind wir die Ersten, die dieses Verfahren für die Empfind- lichkeitstestung von Krankheitserregern gegen Chemo- therapeutika weiterentwickelt und eingesetzt haben.
Wie bei der Mikrobouillonmethode werden geometrische Verdünnungen des zu testenden Chemotherapeutikums in Nährmedium mit dem zu testenden Erreger inokuliert.
Als Nährmedium dient jedoch nicht Bouillon, sondern Agar. Die Zumischung des Chemotherapeutikums und
Tabelle 1: Vor- und Nachteile der aktuell etablierten Methoden zur MHK Testung
Tabelle 2: Vergleich von Mikroagarguss- und Mikroagardilutionsmethode
des Inokulums erfolgen nach dem Koch’schen Verfahren, solange der Agar flüssig ist. Nach Erstarren resultiert eine annährend homogene Verteilung des Inokulums in der Kavität bzw. im Agar. Analog der Mikrobouillonmethode erfolgt nach erregerabhängiger Inkubationszeit die visu- elle Auslesung und Bewertung gegen die mitgeführte Sterilitäts-(Negativ-) und Wachstums-(Positiv-)Kontrolle.
Die Konzentration des Chemotherapeutikums, bei der gerade kein sichtbares Wachstum zu erkennen ist, ist die minimale Hemmkonzentration.
Die Hauptvorteile der Methode bestehen darin, dass sich sichtbares Wachstum nicht durch das rein qualitative Merkmal Trübung ausdrückt, sondern Einzelkolonien abgelesen werden, die erst bei hoher Koloniedichte ver- schwimmen (semiquantitativ). Das ermöglicht eine abge- stufte Bewertung sowie das Erkennen von Kontaminatio-
nen und Mischkulturen anhand der Koloniemorphologie.
Insbesondere im Umschlagbereich (Wachstum/kein Wachstum) ist die Methode sehr empfindlich. Die Zähl- barkeit von Einzelkolonien ist als diskreter Parameter einfach und logisch in eine dichotome Entscheidung (keine Kolonie = Hemmung, Kolonie(n) = keine Hemmung) übertragbar.
Mit der Mikrobouillonmethode hat sie die gute Standardi- sierbarkeit und Eignung für das Routinelabor gemeinsam.
Die Durchführung in Mikrotiterplatten erlaubt die effizien- te und kostengünstige Testung vieler Isolate. Vorpräpa- rierte Mikrotiterplatten und teilweise oder komplette Au- tomatisierung sind denkbar. Hauptnachteil ist die fehlen- de Möglichkeit zur Bestimmung der MBK im Anschluss.
Abbildung 1: Ausschnitte von Mikrotiterplatten
Mikroagardilutionsmethode
Unseres Wissens nach sind wir die Ersten, die diese Me- thode beschreiben. Die Mikroagardilutionsmethode ist eine miniaturisierte Version der Agardilutionsmethode.
Grundidee war, die Hauptvorteile (Erkennbarkeit von Kontaminationen/Mischkulturen, klare Aussage, hoher Durchsatz) der Agardilutionsmethode mit der Übersicht- lichkeit der Mirotitertechnik zu verbinden. Wie bei der Agardilutionsmethode wurde das Chemotherapeutikum dem Agar, solange er flüssig ist, beigemischt. Der Agar wird anschließend in die Kavitäten der Mikrotiterplatte gegossen. Nach Erstarren des Agars wird das Inokulum auf die Agar-Oberfläche aufgetragen. Nach Inkubation wird das makroskopisch sichtbare Wachstum abgelesen.
Der Vorteil dieser Methode liegt in der Möglichkeit, in ei- ner Mikrotiterplatte gleichzeitig mehrere Konzentratio- nen/Chemotherapeutika zu testen. Gleichzeitig bietet sie einen mit der Agardilutionsmethode vergleichbaren Durchsatz und die Erkennbarkeit von Mischkulturen. Das gilt umso mehr, als das die Präparation und Inokulation automatisiert werden können. Hauptnachteil der Methode ist, dass die Oberfläche des Agars, bedingt durch den kleinen Durchmesser der Kavität, gewölbt ist und dadurch das Inokulum im Zentrum zusammenlaufen kann. In dem Fall wachsen keine Einzelkolonien, sondern ein Erreger- rasen. Das erschwert die Auslesung und beschneidet den Bereich mit quantitativer Aussage. Eine Möglichkeit wäre die Verwendung von größeren Kavitäten, das würde je- doch den Materialeinsatz erhöhen und den Durchsatz vermindern.
In Tabelle 2 werden die Vor und Nachteile beider Metho- den verglichen.
In Abbildung 1 sind Ausschnitte von Mikrotiterplatten wiedergegeben. Dargestellt sind Reihen von Kavitäten, die mit je 105 KbE/ml Staphylococcus aureus beimpft wurden. Die Konzentration des Chemotherapeutikums nimmt von K1-K4geometrisch ab und ist für alle Methoden gleich. In zwei Kavitäten pro Methode wurde die gleiche Konzentration zugesetzt (Doppelbestimmung). Alle Platten wurden am Vortag wie beschrieben inokuliert und inku- biert. Deutlich wird, dass die Mikroagarguss- und Mikro- agardilutionsmethode sehr empfindlich sind. Während bei der Mikrobouillonmethode schon bei K2keine Trübung mehr auftritt, zeigt sich in der Mikroagarguss- und Mikro-
agardilutionsmethode noch deutliches Wachstum. Selbst bei K1sind noch Kolonien zählbar. Das deutet an, dass es nicht zu einer kompletten Hemmung gekommen, die MHK nicht erreicht ist. Damit ergibt sich eine wesentlich empfindlichere und differenzierte Aussage als bei der Mikrodilution.
Zusammenfassend ist zu sagen, dass keine der beschrie- benen Methoden allen gestellten Ansprüchen gerecht wird. Die von uns entwickelten und hier erstmals beschrie- benen Methoden bieten jedoch einige Vorteile gegenüber den etablierten Methoden. Weitere Untersuchungen sind nötig, um ihre Vorteile und Grenzen abschließend zu be- werten und Ihre Eignung für die Routine bzw. nationale und internationale Standardisierung zu gewährleisten.
Literatur
1. Wiedemann B. Bestimmung der Wirksamkeit von
Chemotherapeutika. In: Burkhardt F, editor. Mikrobiologische Diagnostik. Stuttgart: Thieme; 1992. p. 714-33.
2. Empfindlichkeitsprüfung von mikrobiellen Krankheitserregern gegen Chemotherapeutika Teil 8: Mikrodilution - Allgemeine methodenspezifische Anforderungen. 2002.
3. Empfindlichkeitsprüfung von mikrobiellen Krankheitserregern gegen Chemotherapeutika: Spezielle Anforderungen an die Testung von nicht anspruchvollen Bakterien. 2002.
4. Empfindlichkeitsprüfung von mikrobiellen Krankheitserregern gegen Chemotherapeutika Teil 8-2: Spezielle Anforderung an die Testung von anspruchsvollen Bakterien. 2002.
5. Empfindlichkeitsprüfung von mikrobiellen Krankheitserregern gegen Chemotherapeutika Teil 8-3: Spezielle Anforderung an die Testung von obligat anaeroben Bakterien. 2002.
6. Empfindlichkeitsprüfung von mikrobiellen Krankheitserregern gegen Chemotherapeutika Teil 8-4: Spezielle Anforderung an die Testung von Pilzen gegen Antimykotika. 2002.
7. Kolbert M, Shah P. Diffusion oder Dilution: Antimikrobielle Empfindlichkeitsprüfung im Routinelabor. LaboratoriumsMedizin.
2002;26(7-8):420-4.
8. Empfindlichkeitsprüfung von mikrobiellen Krankheitserregern gegen Chemotherapeutika Teil 6: Bestimmung der minimalen Hemmkonzentration (MHK) nach der Agar-Dilutionsmethode.
2003.
9. Empfindlichkeitsprüfung von mikrobiellen Krankheitserregern gegen Chemotherapeutika Teil 3: Agar-Diffusionstest. 2002.
10. Nizet V, Smith A, Sullam P, Rubens C. A simple microtiter plate screening assay for bacterial invasion or adherence. Methods Cell Sci. 1998;20(1-4):107-11.
Korrespondenzadresse:
Dr. med. Nils-Olaf Hübner
Institut für Hygiene und Umweltmedizin der Ernst-Moritz- Arndt-Universität, Greifswald, W.-Rathenaustr. 49a, 17489 Greifswald, Deutschland
nhuebner@uni-greifswald.de
Bitte zitieren als
Hübner NO, Sciermoch K, Kramer A. Vergleich von Methoden zur Bestimmung der minimalen Hemmkonzentration und
Schlussfolgerungen zur Weiterentwicklung der Methoden. GMS Krankenhaushyg Interdiszip. 2007;2(2):Doc34.
Artikel online frei zugänglich unter
http://www.egms.de/en/journals/dgkh/2007-2/dgkh000067.shtml
Copyright
©2007 Hübner et al. Dieser Artikel ist ein Open Access-Artikel und steht unter den Creative Commons Lizenzbedingungen
(http://creativecommons.org/licenses/by-nc-nd/3.0/deed.de). Er darf vervielfältigt, verbreitet und öffentlich zugänglich gemacht werden, vorausgesetzt dass Autor und Quelle genannt werden.