Bei dieser Datei handelt es sich um ein Protokoll, das einen Vortrag im Rahmen des Chemielehramtsstudiums an der Uni Marburg referiert. Zur besseren
Durchsuchbarkeit wurde zudem eine Texterkennung durchgeführt und hinter das eingescannte Bild gelegt, so dass Copy & Paste möglich ist – aber Vorsicht, die Texterkennung wurde nicht korrigiert und ist gerade bei schlecht leserlichen Dateien mit Fehlern behaftet.
Alle mehr als 700 Protokolle (Anfang 2007) können auf der Seite
http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html eingesehen und heruntergeladen werden.
Zudem stehen auf der Seite www.chids.de weitere Versuche, Lernzirkel und Staatsexamensarbeiten bereit.
Dr. Ph. Reiß, im Juli 2007
Protokoll zum Vortrag vom ] 3.06.1996
SS96
Struktur und Farbigkeit organischer Substanzen
Vortragender: Thomas Kremer
1.t Ein Farbstoff absorbiert seine Komplementärfarbe
2 STRUKTURELLE VORAUSSETZUNGEN FÜR FARBIGKEIT
2
3
3 EINFÜHRUNG VON ANTIAUXOCHROMEN UND AUXOCHROMEN GRUPPEN 4
3.1 Nltrosierung\'00 N..~-Dlmethylanilin
4 GRENZEN DES MESOMERIEMODELLS
~I Nitrophenole,Nitrophenolate
4.2 Titrati on \'OD4 - Nitrebrenzcatechln
5 EINE EINFÜHRUNG IN DAS MO-MODELL
5.t Synthese von Potyenalen 5.1 ,1 Reakuonsgleichung
5.1 .2 Verdeuthebung mittels MO - Modell 5.1.2.I Polvene
5.1.22 Polyenale
5.2 Lösungsmitteleffekte(Selvatocbromie)
6 UTERATUR
6
6
8 10
11
11
13
I~
15 16 17
19
1 Licht und Farbe
Absorbiert eine Verbindung einen bestimmten Bereich des sichtbaren Spektrums HOO - 800 nrn). so ist sie farbig.Vom menschlichen Auge wird der nicht absorbierte. gestreute und reflektierte Teildes Spektrums wahrgenommen. Er entspricht der Komplementärfarbe des ab- sorbierten Lichts.
1.1 Ein Farbstoff absorbiert seine Komplementärfarbe
fR uv
( 800
605
595 580 480 435 400nm
Abb.l:Spektrum des sichtbaren Lichts
Material:
optische Bank, Reuterlarnpe, Spalt, Sammellinse +5, Glasprisma. Sammellinse ,...20 o. +30.
Farbfilter
Versuchsaufbau
Abb 2:Versuchsaufbau
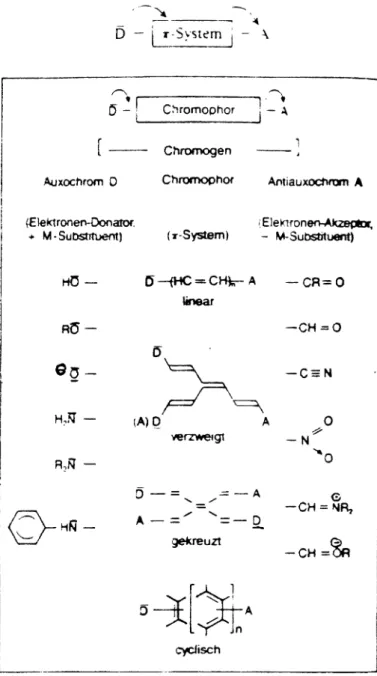
2 Strukturelle Voraussetzungen für Farbigkeit
Damit ein organisches Molekül farbig er- scheint, muß es leicht anregbare Elektronen besitzen Diessind meist1t - Elektronen.
- - -~ ~
i5 -
I
T-System J - -\Die Struktur einerfarbigen Substanz ge- horcht meist folgenden Merkmalen:
1. pi -System mitkonjugierten Dop- pelbindungen
Für eine bestimmte Verbindungsklasse gilt. Je ausgedehnter das n-System ist, desto langwelliger erfolgt die Absorpti- on.'
HÖ-
~-
-CR=O
-CH=O
2.. Elektronen - Donatoren, sog. ...\u- xochrome
3. Elektronen - Akzeptoren, sog. Anti-
-C=N
,yo -N
"0
cycfisch
Ö - = , /-=-A 0
=
-CH=~R,A - = / '=-Q.
~reun
e
-CH =OR
I
i
I L-. __
auxochrome
Sind an einkonjugiertes n-System Elektro- nendonatoren und /oder Elektronenakzep- toren angeschlossen, verschiebt sich die Absorption in den längerwelligen Bereich.
Außerdem können
• die Polarität des Lösungsmittels
• und stertsehe Effekte
die Absorptionsbande beeinflussen.
Abb. 3: Strukturprinzipien für Farbstoffe
roxos
DERC.HE.\USCHL~ I~DUSTR1E: _ Farbstoffe undPigmente". HcftJ). 19Y~.S.30=KABLOß. So. .Strukturprinzrpienfür Farbstoffe".
P(i'1-Ch..~/)8. Jg.1989. S 2
In der Schule wird der Einfluß.. den diese Faktoren auf die Farbigkeit einer Substanz haben, mit dem Mesomeriemodell verdeutlicht Insbesondere deshalb, weil sich einfache allgemein gültige Farbregeln fur dieverschiedenen FarbstotIkJassen licht formulieren lassen. Das Ziel dieses Vortrags besteht darin.. in Experimenten die Grenzen des Mesomeriemodells zu präsentieren und ein neues Verständnis der Phänomene mit einer vereinfachten Variantedes MO - Modells zu schaffen.
3 Einführung von antiauxochromen und auxochromen Gruppen
3.1 Nitrosierung
von
N,N • Dimethylanilin rv1aterial:Stativplatte, Schraubstange. 2 x Dopppelmuffe, 2 x Schraubklammer, Magnetrührer, Labor- ständer,2xR~TropftrichtermitDruckausgleich 50ml Übergangsstück, Zweihalskol- ben 1Oüml, Pasteurpipette, 2 x Demonstrationsreagenzglas, Wasserflasche. Kristallisationsscha- Je
Chern.ikMien.
• vorbereitete Lösungvon NJ'J - Dimethylanilin --) Zu ca. 10 Tropfen Dirnethylanilin gibt man 50 ml Eiswasser undfugt 10m1 konz. Salzsäure hinzu. R: 23/24/25-33 34-37 S:28.1- 37-45 2-26 T~C
• fast gesättigte Natriumnitritlosung (leicht gelblich gefärbt) R 8-25 S: 45 T
• konz. NaOH R. 35 S: 2-26-37/39 C
• Diethylether~ 12-19 S_ 9-16-29-33 F
• Eiswasser
Versuc.hsaufbau
DurchfuhruJ]~.
Die Natriumnitiritlösung wird langsam zur~'rN - Dimethylanilinlosung getropft, bis sich das Reaktionsgemisch dunkelorange färbt Es sollte nicht zu einer Niederschlagsbildung kommen.
Mit einer Pastourpipette wird die rote Lösung teilweise in ein Demonstrationsreagenzglas überfuhrt und nun mit konzentrierter Natronlauge bis zur Grünfärbung versetzt Anschließend wird das Reaktionsgemisch mit Diethylether überschichtet Das gebildete p - Nitrosodimethyl- anilin löst sich grün in der Etherphase.
(
Durch Einfuhrung der antiauxochrornen Nitrosegruppe. konnte das delokalisierte 1t - System ausgeweitet werden. Dadurch wurde die Absorptionin den längerwelligen Bereich verschoben.
Im sauren Milieu.
H
IN I
~
N - O - H +
Irn basischen Milieu
H - N - H H - N - H
+
H - N - H
IN
11
,,0/
IN
I
101
IN
I
101
6
4 Grenzen des 'lesomeriemodeJls
4.1 Nitrophenole, Nitrophenolate Material.
Reagenzglas6~ Reagenzglaständer
(
Chemikalien:
• 0 - Nitrophenol R: 22-36/38 S' 26-28.1 Xn
• m - Nitrophenol R+S n.bek. Xn
• P - Nitrophenol R 20/21/22-33 S28.1 Xn
• konz. NaOH R: 35 S: 2-26-37/39 C
Durchführung:
In jezwei Reagenzgläsern werden gleichkonzentrierte Lösungen der verschiedenen Nitrophe- nole hergestellt Jeweils eineProbe wird mit konzentrierter Natronlauge bis zur Farbänderung alkalischgemacht.
Reaktionszleichuncen
-K2"
+02N
OH..
~ +N OH-'0 -/
+ H+
1[-
H+ _I
-0
'" 0"
02N 01-
..-~+N
- /
~lO
OH
+
OH +
( ~
...
OH02N N---- 1
+
1[- H+ / + 0_
+H _fOl
N --- ~ + ---
Ol-
I -
_JOI
Erläuterung
Durch die Phenolatbildungbeteiligt sich der Sauerstoffals Elektronendonator am farbgebenden System. Dadurch wird das längstwellige Absorptionsmaximum bei allen drei Verbindungen um ca. 60-80 nm langwellig in den Bereich des sichtbaren Lichtes verschoben. Die Farbgebung der Nitrophenolate ist also weitgehend unabhängig vonder Stellung der Substituenten.
.Anders die Saurestarken Diese wirdbestimmt durch die mesomeren Wechselwirkung-en der Substituenten mit dem rr-Svstern Die0- und p- Verbindung sind infolge der mesorneren Stabi- lisierung des Saureanions deutlicher acider als die m- Verbindung. Die Dissoziationsphänome- ne der drei Isomeren lassen sich also durch das \ tesomeriemodell korrekt deuten.
(
8
Nitrophenol ortho meta para
pKs 7.22 8.39 7.15
---.
Tab. I:Säurestärken von Nitrophenolen
Die FarbetTekte lassen sich dagegen nicht aufmesomere Wechselwirkungen zwischen den Substituentenzurückfuhren. Die mesomeren Grenzformeln beschreiben das Molekül nicht im angeregtenZustand".
Diestarken, durchrn-ständige Substituenten hervorgerufenen Farvertiefungen, lassen sichbe- sonders eindrucksvoll am Beispiel von Dihydroxynitrobenzolen demonstrieren. Hier werden 4- Nitrobrenzcatechin und 2 - Nitroresorcin verwendet. Letztere Verbindung zeigt zusätzlich, daß symetriebedingte Farbveränderungen vom MesomeriemodelJ nicht erfaßt werden,
4.2 Titration von 4 -Nitrobrenzcatechin5
Material:
250ml Becherglas hohe Form, Rührfisch3-4c~ Magnetrührer, Bürette, pH - Meter
Chemikalien:
• HelO~l rnolll
• NaOH 0, 1 molll
• 4 - Nitrobrenzcatechin R+S n.bek
Durchfuhrung:
In einem 250ml Becherglashoher Form werden SOml Wasser vorgelegt. Man gibt eine Mi- krospatelspitze 4 - Nitrobrenzcatechin zu und säuert mit 10 Tropfen Olm Salzsäure an
~ STRElT\ViESER..HE~THCOCK_ kOSO\CR. .Orgaruschc Chcnue". ~__Aufl..\·CH.-19()~. S.lU~~
-1 K.~8L1ß, S."'Dle ncfcFarbe des m-Nnrophcnolats und analoger Phcnoldcnvarc. Praxis der Naturwissen- schaften Chemie,3/.+3_ 1994.S. 18-21
, KABUß. S.: "DieliefeFarbedesm-Nitrophcnolats und analoger Phenoldemate. PraxisderNaturwissen- schaften Chemie. )/41. 199~ S.18-28
(pH ca.3.5). Die Lösungist hellgelb gefärbt Nun wirdgegen 0.1 m~atronlauge titriert.Nach Zugabe von Natronlauge (pH ca,6.2)'1 verfärbt sich dieLösung nach Orangegelb. Bei weiterer Zugabe von Natronlauge, trittbei pH ca. 10.2 eine Violettfärbungauf.
NOZ
OH
OH
+ OH--
-H1.0 ...101 - -
OH
-- 101
H
( Anschließend deprotoniert die OH - Gruppe in m- Stellung zur Nitrogruppe. Das entstehende Sauerstoffanion wirkt stark farbvertiefend.
-iQ' n'-
N02 <<r.:»
N02 N
p~1{}
+OH-
- H1.0~ -... ..
cs- ,-
H
"",I ~,101 - - IQJ _ 'P/
Erläuterung,
Die Dissoziation der ersten, zur Nitrogruppe p-ständigen Hydroxylgruppe, die wegen des me- someren Effektes stärker sauer istals die rn-ständige Gruppe, erfolgt bereits im neutralen pH- Bereich, Erst die zweite Dissoziationderschwächer sauren rn-ständigen Hydroxylgruppe er- gibt eine starke \1erschiebung nach einer längerwelligen Absorption. Es wird deutlich, daß sich die chemischen Eigenschaftenmit dem Mesomeriemodell deuten lassen,dasPhänomen der Farbvertiefung dagegen nicht Das Mesomeriemodell symbolisiert die Elektronenverteilung der
\Terbindung inihrem Grundzustand. Diedavon abweichende Elektronenverteilung im angereg- ten Zustand wird nicht erfaßt
10
4.3 Titration von 2 •Nitroresorcin'
Material:
250 ml Becherglas hohe Form, Rührfisch3-4cm~ Magnetrührer, Bürette, pH - Meter
Chemikalien:
• Hel 0., 1moll1
• NaOH O~1 molJl
• 2 - Nitroresorcin R-rS.n.bek.
Durchführung:
( In einem 250ml Becherglas hoher Form werden 50ml Wasser vorgelegt. Mangibt eine Mi- krospatelspitze 2- Nitroresorcin zu und säuert mit10 TropfenO.lm Salzsäure an (pH ca. 3.5).
Die Lösung ist hellgelbgefärbt. Nun wird gegen O.lm Natronlaugetitriert.Nach Zugabe von Sml beobachtet man bei pH ca. 7.3 eine Orangefärbung. Nach weiteren 5ml Zugabe (pH ca.
10.]), schlägt die Farbenach Hellgelbum.
Reaktionsgleichungen.
....--
\0 OH
...
H +OH-
tO OH
313 nm 425 nm
OH
+OH-
-"/0' ""-O~-
" ' - . + / /
N
392
nm
Erläuterung:
Bei 2-Nitroresorcin tritt nachder zweiten Dissoziation - entgegen der Erwartung - eine Far- oaufhetlungein.Das Dianionabsorbiert also kürzerwelligals das Monoanion.Diese besonders kurzwellige Absorption kann auf die zusätzliche vertikale Spiegelebene zurückgeführt werden.
Verbindungen, mit zwei oder drei am Benzolring symetrisch angeordnet en Substituenten, zeichnen sich allgemein durch besonders kurzweilige Absorption aus.Mitdem Mesomeriemo- dell können Symetrieffekte nicht erklärt werden.
5 Eine Einführung in das MO-Modell
( 5.1 Synthese von PolyenaJen'
Material:
Petrischale Sem, Spritze Sm! mit Kanüle
Chemikalien:
• Crotonaldehyd ~ 11-23-36/37/38 S:29-33-45 T, F
• Zimtaldehyd R:21-38-43 S:28.1 Xn
• Piperidiniumacetat R.: 24/25 S:44
Durchfuhrung.
In die Petrischale werden 0.7g Crotonaldehyd und 0.65 g.Zimtaldehyd pipettiert. Anschlie- ßend beschickt man die Spritze mit einer Lösung von drei Mikrospatelspitzen Piperidiniu- macetat in 1,5ml70%igern Ethanol. Die Piperidiniumacetatlösung wird zu dem Reaktions- gemisch gegeben.Nach ca.funfMinuten hat sich die Lösung über Orange nach Rot ver- färbt.
~ siehe auch:SOLLBACH. Werncr:..EinführungIndie Farbigkeit organischer Verbindungen am Beispiel von Polycnalcn".Hrsg Pädagogisches Zentrum Berlin.198:<. 100 S
13 5.1.1 Reaktionsgleichung
Katalysator:
!
CH3 -CH =CH-C ~/ + OAC - :;: ....
=~.... HOAC +
(
'H
- ~/ -0
ICH2 -CH =CH-C
'H
/0"
CH2 -=CH - CH=C/ I"
'H
H, 0
/C-CH =CH- CH21- +fi-CH=CH-C~ / H+ ..
/~
~~" H -
,bi H
©-CH=CH-~-CH2 -CH
=CH-C~/ - H2~
~ 'H -
f i -
~CH=CH-C=CH-CH
=CH-C ;0/ ~
~ 'H
+ n CH3CHCHCHO
- n H20
IQ\- \.\!r(-CH=CH-)-C~ ;GI
n 'H n = 3,5,7...
(
Die zunehmende Farbvertiefung weist darauf hin, daß mit zunehmender Länge des konjugier- ten 7t - Systems die Anregungsenergiefürein Elektron sinkt.Dies wird so erklärt, daß die Energiedifferenz von HOMO und LUMO durch die Konjugation kleiner wird.
5.1.2 Verdeutlichung mittels MO - Modell
Nomenklatur auf vereinfachter MO-Basis:
- f ----J...- - - - lr"
- - - ' - -- - -- - 11
Abb 5:Molekülorbitaleund Elektronenübergänge
Eine Klassifizierung der Elektronenübergängeläßtsich mit Hilfe der beteiligten Molekülorbita- le (\10) treffen.Aus besetzten bindenden o -oder 7t - Orbitalen oder aus den nichtbinden- den n-OrbitaIen (einsame Elektronenpaare) kannein Elektron in die leeren... antibindenden
7t* - oder cr*- Orbitale aigehoben werden.Entsprechend werden die Elektronenübergänge kurz mit(j-xJ*,::I~7t*_ n~Jr*_ll----xJ* usw. bezeichner. Veranrwonlichfürdie Farbigkeit ei- ner Verbindungsind immerit~7t* . oder/ und n~rr" Übergange.
HESSE ~1EIERZEEH :"Spck1rOskOPISChe Methodeninocr organischenChemie".-l.Aufl..Georg Thierne Verlag. 199I. SA
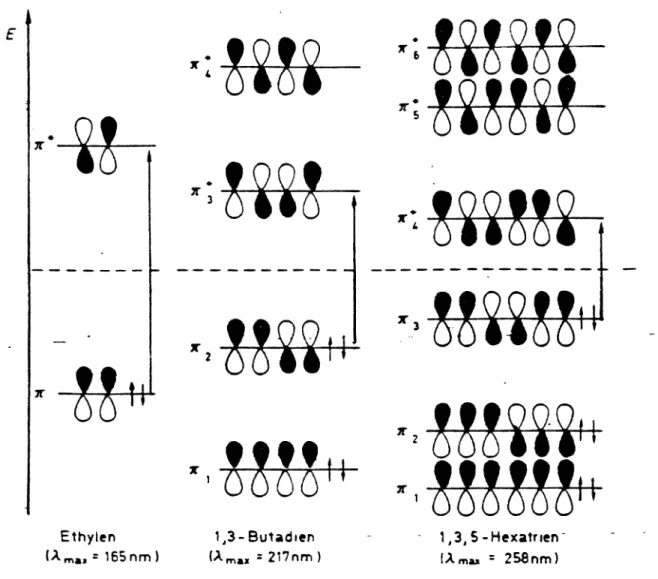
15 5.1.2./ Po~rene
7(•~ ...---11(---111--....-...- -
X'•
4
1r 3
.
---t...-...-~--E
(
7C
Jr2
7C'2
'1r1
Ethylen
(Am a J=1SSnm)
, .. 3- Butadten
(Am a x =217nm )
, I3I 5 -Hexatrlen - fAma. = 2S8nm)
Abb. 6: HOMO - LUMO - Übergänge in Ethylen, 1.3-Butadien undJ.3..5-lIexatrien
Der1t - x* - Übergang des Ethylens liegtim Vakuum - lJVbei ~ == 165nm. Die Einfuhrung von Alkylgruppen bewirkt offensichtlich eine langweilige Verschiebung der n:-1t*- Absorption.
Zur Erklärung wird dafur die Hyperkonjugation herangezogen.
Bei der Konjugation zweier oder mehrererolefiniseherDoppelbindungensinkt zwarder Schwerpunkt der1t - OrbitaJe infolge der Mesomerie ab, aber dieEnergjedifferellzzwischen HOMO und LUMO wird wie Abb.ö zeigt, mit zunehmender Kettenlänge kleiner".
~ HESSE \.1ElER. ZEEH "'Spektroskopische Methoden inder organischen Chemie". -l.Aufl..Georg Thieme Verlag, ] 991. S.11
5.1.2.2 Polyenale
Bei den hergestellten Polyenalen fuhrtder elek-tronenreiche Benzenring und die Carbonyl- gruppe zusätzlich zu einer bathochromen Verschiebung: Durch die Konjugation der Carbonyl- gruppemiteiner C=C - Bindung, werdendie 1t - Niveaus stark verschoben. Das n-Orbital bleibt in erster Näherung unbeeinflußt. Mit zunehmender Länge der konjugierten Kette ver- schiebt sich der längstwellige1t~Jt* Übergangimmer stärker langwellig. holt dien~1t* Bande ein undverdeckt siewegen seinerwesentlichgrößeren undmitderKonjugation ebenfalls stark ansteigenden Intensität".
n
'Ir
*
".
" "
""
~tT---~
n3
:I:::---...-...-
"2 "" , "...
'"
"
"
"_ ... _-" ,
<," "
/" , - - - _ /
/ /~
..
---~7r
(
\ /
/
C=C
\" C=C-C=o -
/ 1 -
\
-
. C=O I -
Abb. 7' Energiediagramm zudenElektronenübergängeninkonjugierten Enonen imVergleich zu Alkenen und gesättigten Carbonylv erbindungen"
~ HESSE. ~1ElER.ZEEH .Spektroskopischc Methoden Lnder organischen Chemie".~.ßu1fl..Georg Thierne Verlag. 1tJ91.S.17
17
5.2 Lösungsmitteleffekte (Solvatochromie)
Geräte:
Reagenzglas 6x, Reagenzglasständer.Stopfen 6x
Chemikalien:
• Betain(l) R+S n.bek.
• Methanol R: 11-23/25 S: 7-16-24-25 T, F .. Ethanol R: II S: 7-16 F
• l-Propanol R: 11 S: 7-16 F
• i-Butanol R: 22 Xn ( • Aceton R: I 1 S: 7- 16 F
• Butanon(2)R: 11 S:9-16-21-33 F
Durchfuhrung:
In jedem Lösungsmittel wirdeineMikrospatelspitze Betain( 1) gelöst. Je nach Dipolmoment des Lösungsmittels, erscheint der Farbstoff in einem anderen Farbton. Dieser resultiert aus den unterschiedlichen AnregungsenergienderElektronenin den verschiedenenLösungsmitteln:
Lösungsmittel Methanol Ethanol l-Propanol I-Butanol Aceton Butanon
M: 55,4 51~9 50,7 49,7 42,2 4],3
[kcal/mol]
."
Tab.2: An~~gieenfurHOMO -LlJMO - Übergänge von Betain(1)in verschiedenen Lösungsrrutteln. 0
Erläuterung:
Beiden bisher betrachteten Farbstoffmolekülen. hängt die Lage des Absorptionsmaximums nicht (oder nur minimal) davon ab, in welchemLösungsmittelder Farbstoff gelöst ist. Das liegt daran,daß sich die Wechselwirkungen zwischen den Lösungsmittelmolekülen und den Farb- stoffmolekülen im Grundzustand und im angeregten Zustand praktisch gleich auswirken Bei Farbstoffmolekulen, die ein großes Dipolmomentbesitzen und bei denen sichdas Dipolmoment
' l iREIClLAgDT.C.: _Solvatochromic Dyes as Solvent Polarity Indicators Chenucal Reviews. 1994. \'01. 94.
Ne.8. S. 2339 - 2337
)
)
bei der Anregung stark verändert, erwartet man dageg.en eine Abhängigkeit des Absorptions- spektrums vonder Art des Lösungsmittels Ein Beispiel dafur ist das sog. Betain( 1) Dieser Farbstoffträgt eine positive Ladung am Stickstoff und eine negative am Sauerstoff Daraus ergibt sich eingroßes Dipolmoment im Grundzustand Bei der Anregung wird negative Ladung zum Pyridiniumringhinverschoben, und dasDipolmoment geht zurück. In einem polaren Lö- sungsmittel wird der Farbstoff stabilisiert, weil sich die Lösungsmittelmoleküle im Dipolfeld orientieren und damit Coulombsehe Energie frei wird. Dadurch wird die Energie des Grund- zustandes stark erniedrigt.
Bei der Absorption von Licht nimmt das Dipolmomentab"dieser Vorgang erfolgt außeror- dentlich schnell. Das Farbstoffinolekül besitzt unmittelbar nach der Lichtabsorption noch die gleiche Lösungsmittelumgebung wie im Grundzustand. Da das Dipolmoment kleiner geworden ist, wird der angeregte Zustand weniger gut stabilisiert als der Grundzustand. Die Folge ist, daß die Anregungsenergie des Farbstoffsvon seiner Lösungsmittelumgebungabhängigsein
kann, Man bezeichnet diese Erscheinung als Solvatochromie!'.
Man könnte zu der Annahme geneigt sein, mit der elektronischen Anregung der Elektronen in einem Molekülundder Neuverteilung der elektrischen Ladungändere sich sofortauch die Ori- entierung der LösungsmittelmoJeküle. Wegen der sehr viel größeren Masse der Kerne, erfolgt der elektronische Übergang.eines Elektrons schneller~als dieKerne darauf reagieren können.
Dasheißt, daß die Lösungsmittelmoleküle keine Chancehaben,sich der neuen Elektronenver- teilung rechtzeitig anzupassen.
1\ RElCHARDT. C.~ .Solvatochromism,Tbermochromism, Piezochromism, Halochromism and Chiro- Solvatochrornisrn of Pyridinrum N-PhenoxideBetaineDyes"~ Chern. Soc. Rev..1992. 21. 147-153 FöRSERLL.~G. KUHN~ ... PraxisderPhysikalischen Chemie". Dritte ergänzteAufl. .VCH.. 199L 286-287
19
Ph
Solvent PoJarity
-
.-~~
••
••
••
--~_.
Ph 101•
t-
Er{30}= hcVN
A=
molarTransitic EnergyPolar
Ä=453nm i1Hz{)
••
•••
••
. _----
Non-polar '
Sc/vent
).. =
810nmin p~O
Ph
A
Ph.A.:.Jl
Ph N Ph
Ph
J1g.150
Abb.S:Einfluß des Lösungsmittels auf HOMO - LUMO - Übergänge bei BetaJ.n( 1)
(
6 Literatur
Außer der inden Fußnoten angegebenen Literatur, sind folgende Publikationen verwendet worden:
) BECKER,aG.o.:.Einführungindie Photochemie"2.Aufl.,Georg Thieme Verlag, 1983, S.51-63
2) FABlANJ.~ HARTMA1'lN H.:"Reactivity and Structure Concepts inOrganic Chemistry' daraus:Volume12:''Light Absorption ofOrganic Colorants, Theoretical Treatment and Empirical Rules", Springer - Verlag 1980,245 S
3) KLESSINGER, Martin:.Konstitution und Lichtabsorption organischer Farbstoffe" in Chemie in unserer Zeit?12.Jahrg. 1978, Nr.I. Verlag Chemie GmbH., S.1-11