Bei dieser Datei handelt es sich um ein Protokoll, das einen Vortrag im Rahmen des Chemielehramtsstudiums an der Uni Marburg referiert. Zur besseren
Durchsuchbarkeit wurde zudem eine Texterkennung durchgeführt und hinter das eingescannte Bild gelegt, so dass Copy & Paste möglich ist – aber Vorsicht, die Texterkennung wurde nicht korrigiert und ist gerade bei schlecht leserlichen Dateien mit Fehlern behaftet.
Alle mehr als 700 Protokolle (Anfang 2007) können auf der Seite
http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html eingesehen und heruntergeladen werden.
Zudem stehen auf der Seite www.chids.de weitere Versuche, Lernzirkel und Staatsexamensarbeiten bereit.
Dr. Ph. Reiß, im Juli 2007
Fachbereich Chemie
Protokoll
des Experimentalvortrags zum Thema:
Charge-Transfer-Komplexe im Sommersemester 1997
.,
,
vorgelegt von Kilian Berns Bunsenstr. 9 35037 Marburg
Inhaltsverzeichnis
1GESCHICHTEUNDDE FINITION•••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••4
1.1DEFINITIO N:CHARGE-TRANSFER-KoMPLEXE 7
1.2SPEKTROSKOPISCHEEIGENSCHAFTENUND FARBIGKEIT 12
2EINTEILUNG VON CHARGE-TRANSFER-KOMPLEXEN 14
2.1 METALLISCHECHARGE-TRANSFER-KOl\IPLEXE 14
2.1.1 Metall Ligand-Charge-Transfer (MLCT) 15
2.1. 2Ligand Metall-Charge-Transf er (lMCT) 16
2.1.3 Metall Metall-Charge-Transfer(MMCT) 16
2.1.4Ligand Ligand- Charge-Transfer (LLCT) 17
2.2ORGANISCHECHARGE-TRANSFER-KOMPLEXE 22
2.3EINTEILUNG NACH ST RUKTURELLENGESICHTSPUNKTEN 27
3 EIGENSCHAFfEN VON CHARGE-TRANSFER-KOMPLEXEN 27
3.1KOMPLEXCHEMIE/CHEMISCHESGLEICHGEWICHT 28
3.2 SOLVATOCHROMI E 33
3.3KONKURRENZREAKTION 38
4 LITERATUR: 40
ABBILDUNGSVERZEICHNIS:
ABBILDUNG1:THEORIE ZURERKLÄRUNG DERKOMPLEXST.-\BILITÄTVON CHINHYDR ON DURCH STf\;'\'DIGEN WECHSELDEROXIDATTO NSSTIJFENlINDWASSERSTOFFBRÜCKENBI]\'D UNG ..+
ABBILDU1\G2:HEXAMETH YLß ENZO L-CHI.ORA,'\'IL 5
ABBILDUNG3:ERHÖHl~GDERKOMPLEXSTABl LITATDlJRCHCT-WECHSELWIRKUNG 5
ABBILDUNG4:ERHÖHUNG DERKOMPLEXSTABlLlT.Ü DURCH"ELEKTRO"''E~DR OCKEl'.DE''St."BST ITUE!\'TEN
(BENZOIDEKOlvIPONEl'.'TE) 6
Ä.BI3ILDUNG5:ERll ÖHlT;\GDERKOl\IPLEXSTABIUT.4.TDURCH..ELEKTRONENZ IEHENDE" SliBSTITUENTEN
(CHINOIDEKOMPONENT E) 6
ABBILDUNG6:CHARGE- TRANSFER(LADUNGSCBERFÜ\{Rl~GEINESELEKTRONSAUSDEM H(XH ST BESETZTEN BlNDE"-'DENMOLEKC'LORBITALDESDONATORSINDAS TIEFSTEUNBESETZTEAN·l lBINDE:'-.l)E MOLE-
KÜLORßl T.-\L DESAKZEPTORS 8
ABBILDUNG7:DIE VONMU LLIKEN POSTULIERTEN ZWEIZtISTANDE BEICT-KOMPIEX!'N <)
,r-..
ABBILDUNG 8:VEREINFACHTESE1\'ERGIENlVEAUDlAGRAMMNACHMULUKEN 10
ABBILDUNG9:DARSTELLUNG VON SE\IJCHINON 11
ABBILDUNG10:NÄCHSTESEITE 14
ABBILDUNG 11:MLCT 15
ABBILDUNG 12:LM C T 16
ABBILDUNG13:MNICT 17
ABBILDUNG14 : LLCT 17
ABBILDUNG 15: KALIBRIERGERADE FCR PHOTOMETRISCHE BESTIMMUNGVON EISEN 20
ABBILDUNG 16: AUFBAU DES TRIS(2.2'-BIPYRIDlL)-EISEN(II) 22
ABBILDUNG17 : INDIGO 27
ABBILDUNG 18:AUFBAUUND STRUKTURORGANISCHERCT-KOMPLEXE 27
ABBILDUNG19:SYNTHESEVONANTHitACENPIKRAT 28
ABBILDUNG 20:AUSBEUTEANAP(A:B=1:1) MITZUNEHMENDER VERDüNNUNG(K= 6,4;9 = 25°C) 29 ABBILDUNG 21: DARSTELLUNG DESAzOFARBSTOFFES BENZOLAZO-ß-NAPHTHOL.. 32 ABBILDUNG 22:"REICHARDTSCHERDIPHENYL-BETAINEr30FARBSTOFF 33 ABBILDUNG 23: MESOMEREGRENZFORMELNDES REICHARDTSCHENDIPHENYL- BETAIN-FARBSTOFFES 34 ABBILDUNG 24:ÄNDERUNG DERPOLARITÄT DES DIPHENYLBETAINFARBSTOFFES BEIMÜBERGANGP.\DEN
ANGEREGTENZUSTAND 35
ABBILDUNG25 :DER ÜBERGANG EI:\'ES ELEKTRONS VERLÄUFT WESENTLICH SCHNELLER,ALS DIEÄ'UERUNGDER
AUSRICHTUNG DER L6SUNGSMITTELMOLEKÜLE 36
ABBILDUNG26: ANREGUNGSENEHGIE~VON CT-KOMPLEXENMITNEGATIVER SOLVATOCHROMIE 37 ABBILDUNG 27:KONKURRENZREi\KTIO~ZWISCHEN CT-K OMPLEX'BILDUNGSGLEICHGEWICHT UNDEI;"cRDIELS-
ALDER REAKTION 39
Charge-Transfer-Komplexe
1 Geschichte und Definition
1844 erhielt Friedrich Wöhler durch Zusammengeben äquimolarer Lösungen von Hydrochino- lin und p-Benzochinon zunächst eine rote Lösung, dann einen tiefgrünen kristallinen Farb- komplex, das seitdem bekannte Chinhydron. Der Name setzt sich aus den Anfangs-undEnd- silben seiner Edukte zusammen. (p-Benzochinon+Hydrochinolin==Chinhydron)
Versuch 1 a: Darstellung von Chinhydron Versuchsautbau und Geräte:
Magnetrührer + Rührfisch, Erlenmeyerkolben, Wasserbad
Chemikalien:
wässrige Lösungen von Hydrochinon(Xn, R: 20/22 S: 2-24/25-39) und p- Benzochinon(T, R: 23/25-36/37/38 S: 26-28-44)
Durchführung:
Ungefähr halbverdünnte gesättigte Lösungen von Hydrochinon und p- Benzochinon werden vereinigt. Esentsteht eine rote Lösung, aus der sich bald ein Feststoff ausscheidet, der im warmen Wasserbad löslich ist.
r>,
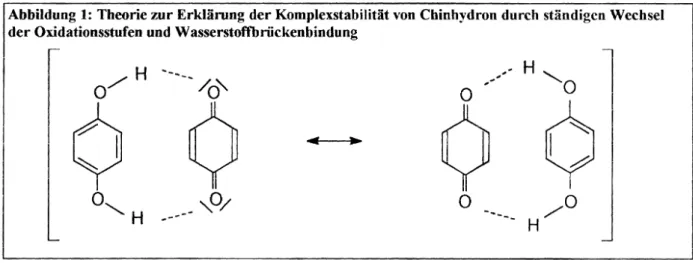
Abbildung 1: Theorie zur Erklärung der Komplexstabilität von Cbinhydron durch ständigen Wechsel der Oxidationsstufen und Wasserstoftbriickenbindung
/ H ' - ' - , ~ ~ ,....,,0#
H,
0l
0 0 0
I
I ... • I
I l
_,,0/I 011
Zur Deutung der Komplexstabilität nahm man lange Zeit eine Wasserstoffbrückenbindung zwi- schen Hydroxyl- und Carbonylgruppen an unddie tiefe Färbung erklärte man sich durch stän- digen Wechsel der Oxidationsstufen zwischen benzoider und chinoider Komponente.
Cl Cl
101 Ii 101
Cl Cl nente konnte jedoch nachgewiesen
werden, daß ein solcher Wechsel der Oxidationsstufen nicht erfolgt. Ohne wesentliche
v
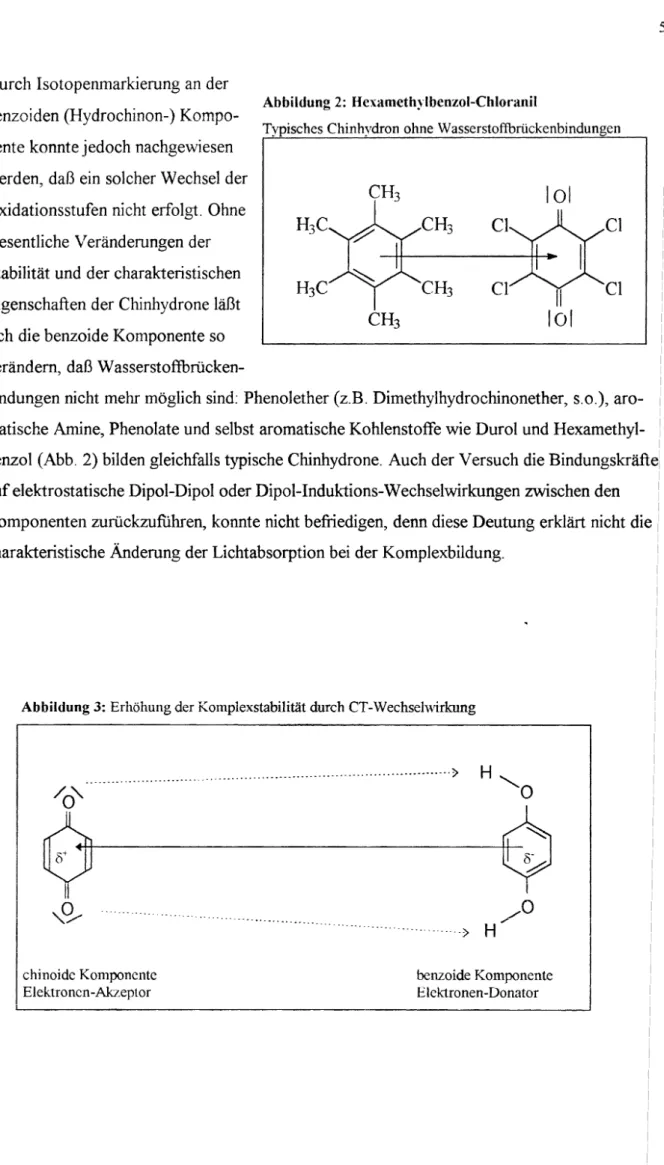
eränderungen der Stabilität und der charakteristischen Eigenschaften der Chinhydrone läßt sich die benzoide Komponente so verändern, daß Wasserstoffbrücken-bindungen nicht mehr möglich sind: Phenolether (z.B. Dimethylhydrochinonether, s.o.), aro- matische Amine, Phenolate und selbst aromatische Kohlenstoffe wie Durol und Hexamethyl- benzol (Abb. 2) bilden gleichfalls typische Chinhydrone. Auch der Versuch dieA.J.I. ....L~'-4.L...,..,o..J'...~.I."'~L"'1
auf elektrostatische Dipol-Dipol oder Dipol-Induktions-Wechselwirkungen zwischen den Komponenten zurückzuführen, konnte nicht befriedigen, denn diese Deutung erklärt nicht die charakteristische Änderung der Lichtabsorption bei der Komplexbildung.
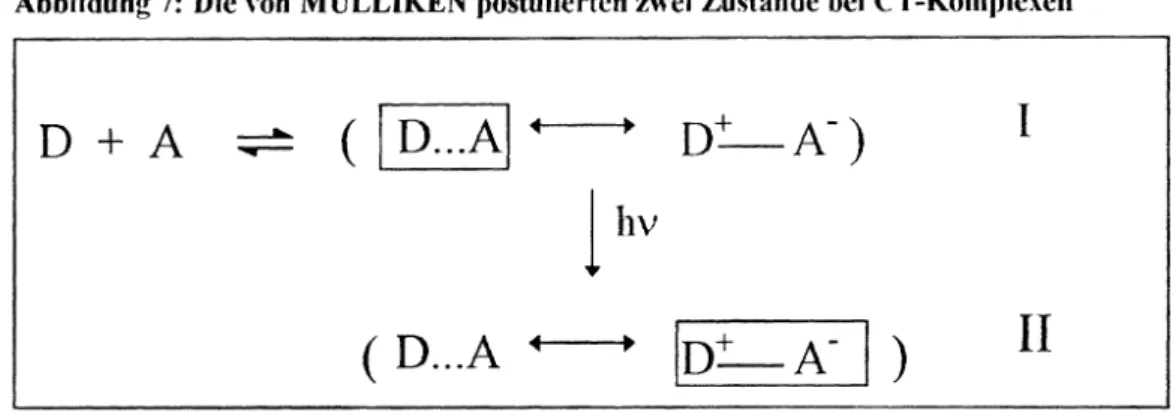
Abbildung 3: Erhöhung der Komplexstabilität durch CT-Wechsehvirkung
-- ... _- .. -..._) H
/ 0
....__ ---_ )
. . . ._'" _•• '"~4
H,
o
chinoide Komponente Elektronen-Akzeptor
benzoide Komponente Elektronen-Donator
R R
R
Abbildung 4: Erhöhung der Komplexstabilität durch
"elektronendrückende"Su bsti- tuenten (benzoide Komponen- te)
Abbildung 5: Erhöhung der Komplexstabilität durch
"elektronenziehende" Substituen- ten (chinoide Komponente) Einen weitgehenden Einblick in die Bindungsverhältnisse der
Chinhydron-Komplexe erhält man durch Variation der Kornpo- nenten. Man stellt fest, daß in Chinhydron als benzoider Kom- ponenten nur Verbindungen mit abgeschlossenem TC-
Elektronensystem (Benzol, Heteroaromaten) treten können, und daß Substituenten, welche die Elektronendichte im Kern erhöhen (R:.
eH
3, O~ NRz)die Stabilität der Verbindung ver- bessern (Abb.4).Für die chinoide Komponente der Chinhydrone gilt, daß ein Dop- pelbindungssystem mit elektronenziehenden Gruppen(R: 0==, N02, CN, Halogene) vorliegen sollte, und daß stark elektronegati- ve Substituenten die Stabilität erhöhen, während zusätzliche Al- kylgruppen dieselbe verringern (Abb. 5). Der Substituent beein- flußt folglich sowohl in der benzoiden, wie auch in der chinoiden Komponente die Beständigkeit und die damit zusammenhängende Farbtiefe der Chinhydrone genau entgegengesetzt.
Aromatische Molekülkomplexe vom Typ der Chinhydrone kön-
nen offenbar immer dann entstehen, wenn die benzoide Kompo- R nente ein -Elektronensystem mit einer niedrigen Ionisierungse- R
nergie hat und wenn das Elektronensystem der chinoiden Kom-
ponente eine große Elektronenaffinität besitzt. Verbindungen mit einer niedrigen Ionisierungs- energie geben leicht Elektronen ab, sie wirken alsElektronen-Donatoren;Verbindungen mit einer hohen Elektronenaffinität haben eine große Tendenz zur Aufnahme von Elektronen und wirken deshalb als Elektronen-Akzeptoren. Eine Verbindung von beiden wird allgemeinals Elektrol1el1-Donator-Akzeptor-Konlplex(EDA-Komplex) oderCharge-Transfer»
(Ladungsüberfuhrungs- }Konlplex bezeichnet. Die meisten Literaturstellen schreiben beiden Ausdrücken (EDA- und CT -Komplex) die gleiche Bedeutung zu, andere schränken den Begriff des CT -Komplexes ein, da er LadungstranspoI1 impliziere und somit ein Spezialfall der EDA- Komplexe sei.
1.1 Definition: Charge-Transfer-Komplexe
(Cl-Komplexe). Hierunter versteht man den nicht durch chem. Bindungen bewirkten lockeren Zusammenschluß von Molekülen verschie- dener (seltener der gleichen) Art, bei dem eines der Moleküle elektronenarm (Elektronenakzeptor), das andere elektronen- reich (Elektronendonator od. -donor) ist. Bei der Bildung dieser Elektronen-Don(at)or-Akzeptor-Komplexe gehen negative elektrische Ladungen reversibel vom Donator-Molekül zum Ak- zeptor-Molekül über. Dabei tritt nicht selten eine Färbung auf, die sich von den Einzelkomponenten charakteristisch unter-
r:
scheidet.Zum Vergleich möchte ich an dieser Stelle die Definition für Elektronen-Don(at)or-Akzeptor- Komplexe vorstellen, umzu zeigen wie schwierig eine genaue Trennung dieser beiden Begriffe ist.
(EDA-Komplexe). EDA-K. setzen sich aus einem Elektronendonator u. einem Elektronenakzeptor zusammen. Oft findet man für EDA-K. die von der IUPAC empfohlene Bezeichnung Charge-Transfer- Komplex, doch ist diese Terminologie nicht für alle EDA-K. zu- lässig, da sie Ladungstransfer impliziert Das Donormolekül in
f einem EDA-K. kann entweder ein freies Elektronenpaar (n- Donor) oder ein p-Elektronenpaar aus einer Doppelbindunq od.
einem aromatischen System (p-Donor) zur Verfügung stellen.
Viele EDA-K. sind farbig, einige instabil u. nur in Lsg. im Gleich- gewicht mit den Ausgangskomponenten existenzfähig, andere wiederum sind stabile kristalJine Feststoffe. Die EDA-K. liegen oft in stöchiometrischer Zusammensetzung vor (meist 1:1); es sind aber auch nicht stöchiometrisch zusammengesetzte Kom- plexe bekannt.
Quelle: CD Römpp Chemie Lexikon - Version 1.0. Stuttgart/New York: Georg Thieme Verlag 1995
Quantenmechanische Deutung
Abbildung 6: Charge-Transfer(Ladungsiiberführungeines Elektrons aus dem höchstbesetzten binden- den Molekülorbital des Donators in das tiefste unbesetzte antibindendeMolekülorbital des Akzeptors
Donator
I I
AkzeptorI HOMO I
bindende MO antibindende MO
o o o
o o
o I
LUMOI
..._···7·..····..·..·..·..·..··..·..·..·· .
e . @
@
@
Unter einem "Charge-Transfer-Übergang" versteht mani.A. den Übergang eines Elektrons von einem HOMO (highest occupied molecular orbital) des Donators in ein LUMO (lowest unoccupied molecular orbital) des Akzeptors.
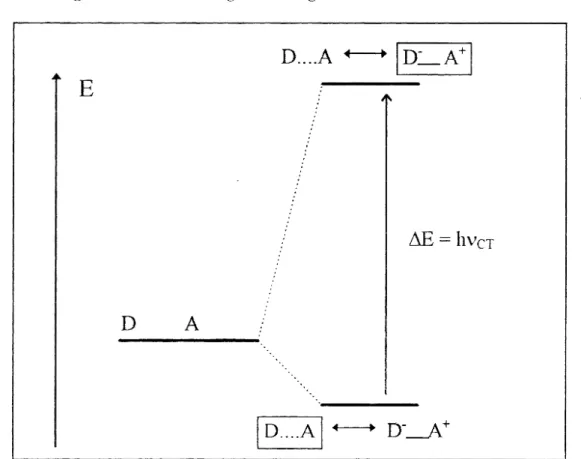
Eine quantenmechanische und gleichzeitig für meine Zwecke die geeignetste Deutung aller experimentellen Eigenschaften der CT -Komplexe stammt von ~1lJLLIKENund DEWAR (1952). Sie geht von der Annahme einer "intermolekularen Mesomerie" aus. Danach läßt sich der Bindungszustand durch eine Überlagerung zweier mesomerer Strukturen beschreiben:
Abbildung 7: Die von MULLIKEN postulierten zwei Zustände beiCf-Komplexen
D+A
--....~ ( ID...AI ~ • O+-A-)
1 hv
(D...A
~ ..ID+-A- I)
I
11
MULLIKEN postuliert für einen CT-Komplex das Vorliegen zweier Zustände? einen Grund- (I) und einen angeregten Zustand(11), die durch Energie oftmals in Form von sichtbarem Licht
r-- ineinander überführt werden können (Abb. 7). Beide bestehen aus einer antibindenden Struk- tur, bei der lediglich unspezifische intramolekulare Wechselwirkungen zwischen den Kompo- nenten vorliegen und einer ionischen bindenden Struktur.
Im Grundzustand (I)? so MULLIKEN, ist die antibindende Struktur häufiger vertreten und im angeregten Zustand die bindende Struktur.
Genauer gesagt? drückt sich Mulliken folgendermaßen aus:
Bei der Näherung von D und A auf den CT-Gleichgewichtsabstand von320 bis 350 pm wird die intermolekulare BindungsenergieL\Hfrei und ein Grundzustand erreicht, in dem die nicht- bindende Struktur1überwiegt.
Dieser Grundzustand wird durch eine Wellenfunktion beschrieben, die sich aus der überlage- rung zweier Wellen, einer nichtbindenden \Va und einer bindenden \VI ergibt.
'VGrundzustand== a\V0(D ...A) +
b
\V1(D(+)-A(-))Dabei drücken a und b die Anteiligkeiten der beiden Wellenfunktionen aus. Im Grundzustand ist a» b. Durch Zufuhr von Elektronenüberführungsenergie - oder besser gesagt: Charge- Transfer-Energie - hv cr wird ein angeregter Zustand erreicht, bei dem die Struktur11 über- wiegt und dessen Wellenfunktion nunmehr folgendermaßen lautet:
\jfangeregter Zustand = b
411 (D(
+l_A(-)) - a\V
0 (D...A)
Diesmal istb» a.Die Energie im angeregten Zustand setzt sichzusarnmenaus der Differenz zwischen Ionisierungspotential des Donators 1POonator(D ~ D(+)+e) und der frei werden- den Elektronenaffinität des AkzeptorsEAAkzeptor(A + e- ~ A(-) abzuglieh eines Teilbetrags X, der sich ebenfalls aus der Differenz zwischen Coulombscher Energie und Resonanzenergie ergibt.
E== IPDonator - EAAkzeptor -
X
Für die folgenden Betrachtungen meines Vortrags, ist es aus Gründen der Übersichtlichkeit sinnvoll eine Vereinfachung dieser energetischen Aspekte vorzunehmen.
Abbildung 8: Vereinfachtes Energieniveaudiagramm nach MULLIKEN
E
~ ==I1vcT
D A
Versuch 1 b: Darstellungvon Semichinon
Chemikalien: HCI aq (Xi, R: 36/38 S: 2-28), NaOH aq
rc,
R: 35 S: 2-26-37/39) Durchfiihrung:Das im heißem Wasserbad gelöste Chinhydron wird mit etwas Natronlauge (c =
1mol/l) versetzt. Es entsteht eine braune Lösung, die nach Zugabe von Salzsäu- relösung (c == 1mol/I) wieder in die vormals rote Lösung übergeht.
1.2 Spektroskopische Eigenschaften und Farbigkeit
Die Charge-Transfer-Energie/Ali-s) ist abhängig vom Ionisierungspotential des Dona- tors(IPDonatOI) und der Elektronenaffinität des Akzeptors(EAAkzeptor):
AE
CT ==I1VCT== IPDon~tor-(EAAkzeptor+ X) + MI
Diese entspricht dem für den Molekülkomplex charakteristischen Absorptionsmaximum, das eine andere spektrale Lage hat als die Maxima der beiden Einzelkomponenten. Liegt das Ma- ximum im sichtbaren Bereich des elektromagnetischenspektrums und haben die Komponenten dort keine Eigenabsorption, so tritt bei der Komplexbildung eine typische Färbung auf, die .
r-
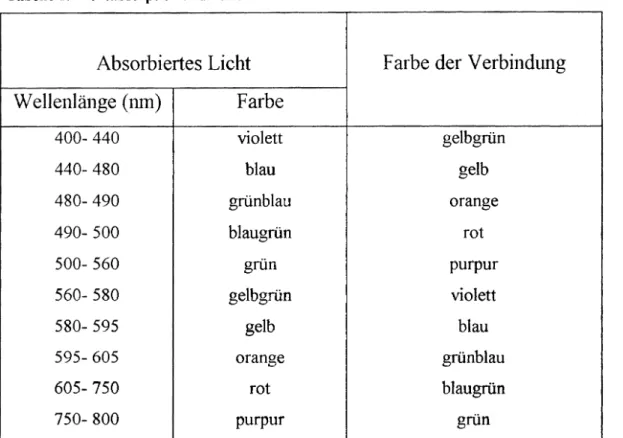
besonders dann als Nachweis des CT-Komplexes dient, wenn dieser im festen Zustand nicht isoliert werden kann.Die Farbigkeit eines Komplexes entsteht dann, wenn dieser aus dem sichtbaren Teil des Spek- trums (400- 800 nm) einen gewissen Wellenbereich selektiv zu absorbieren vermag. Die von unserem Auge wahrgenommene Farbe der Verbindung entspricht der jeweiligen Komplemen- tärfarbe des absorbierten Spektralbereiches, die auf den Rest des sichtbaren Teil des Spektrums zwischen 400 und 800 nrn zurückzuführen ist.
Bei Näherung von Donator und Akzeptor wird intermolekulare Bindungsenergie frei. Der Grundzustand liegt demnach energetisch betrachtet etwas niedriger. Durch Aufnahme von CT- Energie, die häufig imBereich von sichtbarem,oftmals aber auchimUV-Bereich liegt, wird der angeregte Zustand erreicht, dessen Energieniveau um genau diesen Betrag höher liegt.
(Abb.8)
Andieser Stelle möchte ich noch einmal zum Chinhydron zurückkommen. Versucht man die von Mulliken geforderte, durch Elektronenübergang entstandene ionische Struktur für diesen Komplex herzustellen, gelangt man zu einer Struktur, die dem Semichinon ähnlich sein müßte.
(~ Abbildung 9: Darstellung von Semichinon.
O-H ---
Chinhydron
+ 2 OH8, - 2 H20
laie .
101 1018
r>
~
2
.. .. .- ...
~
101
,
laie 101
Semichinon
Dieses entsteht im Falle des Chinhydron aber nicht. Deswegen bezeichnete man es heute auch nicht als ."echten" CT -Komplex, sondern bestenfalls als EDA (Elektronen-Donator-Akzeptor)- Komplex.
Tabelle 1: Lichtabsorption und Farbe
Absorbiertes Licht Farbe der Verbindung
Wellenlänge (nm)
Farbe400- 440 violett gelbgrün
440- 480 blau gelb
480- 490 grünblau orange
490- 500 blaugrün rot
500- 560 grün purpur
560- 580 gelbgrün violett
580- 595 gelb blau
595- 605 orange grünblau
605- 750 rot blaugrün
750- 800 purpur grün
Die CT-Absorptionsbanden sind breit und unsymmetrisch, wobei sie auf der kurzwelligen Seite flacher abfallen, als auf der langweIligen, d. h. der Abstand Amax- AList größer als AR -Amax;
dabei sollen ALund ARdie Halbwertswellenlängen links und rechts des Absorptionsmaximums bedeuten, bei denenE = 1;2Emaxist.
In einer Reihe von Komplexen, bei denen ALund AR
r> ermittelt wurden, konnte näherungsweise
~ 1 2
,
gefunden werden. Lage und Extinktion der Maxima sind in der Regel lösungsmittel- und tem- peraturabhängig.
Für den Fall des Chinhydrons habe ich im Vorfeld des Vortrags eine UV-VIS-Aufnahme gefah- ren (Abb. 10). Man erkennt die breite Absorptionsbande, deren Halbwertsmittel
(304 nm - 279 nm)
1,136
~1,2 2 (304 nm - 293 um)
beträgt.
Abbildung 10: Nächste Seite UV-VIS-Aufnahme von Chinhydron
2 Einteilung von Charge-Transfer-Komplexen
Eine sinnvolle Einteilung von Charge- Transfer-Komplexen scheint für meinen Vortrag diezwi- schen
• Metall-Charge-Transfer-Komplexen und
• reinen organischen Komplexen zu sein.
Da mein Vortrag ein eher organischer sein soll, werde ich mich im folgenden vorwiegend mit organischen CT -Komplexen befassen. Der Vollständigkeit halber und der Klärung von Irrita- tionen bezüglich meines Themas im Vorfeld wegen, müssen auch anorganische Aspekte Be- rücksichtigung finden.
- metallische CT-Komplexe CT-Komplexe -
- organische CT-Komplexe
2.1 Metallische Charge- Transfer-Komplexe
Auch metallische Charge-Transfer-Elektronenübergänge unterscheiden sich von den meist nur schwachen Absorptionen "normaler" Übergangsmetall-Komplexe, die ihre Farbe verbotenen Elektronenübergängen zwischen zwei Orbitalen am selben Metallzentrum , z.B. durch das Li- gandenfeld aufgespaltenen d-Orbitalen, verdanken, durch eine ausgeprägte CT -Bande im Be- reich von 400 - 700 nm im Bereich des elektromagnetischen Spektrums. Sie können folgen- derweise klassifiziert werden:
Scr G SC,l" T,m ~hrs ""n Mo l1u l.lI,onFre Q.Jel'lcy Hz To mp~f a t Llrt! "C GHz
M,cro v.Jvp.Freq ueocy Dale Rern;H1I.S
r-I II-r--IT I I I I I , I I I I , I I I i I I I I I I I i , i I I I i i I I ' I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I
'l l
I I I I I I I I I I I I I.-.:.__ 1-._ .
tI
I
,1-5.3 \'\.iM.:
-- -.__...:...•.•I f\
I 1 I I
~
. 1I
.-- . --_..---_.-----_ ..
_ . . :~-~~~" ~~~~+- . .~ .. ;--~ '.=:':=~'.~~ ~ :-.:~ '~~-, ,
I'"'"
~,-.;
.. :. ... i
dd-
t -
... :_ _1-· _ 1 _
i-- -;- j---! -I__ .
, :,
---- -1 ; 'I·
. _-;- - - _
.... ..__..._-- _
....... +..._- .__.~_... -_.. _. - ;...:•
- T
! I .: :
- -_ .: - '-- - f - h -
1,- '- ' ---i---'"-:-- ;- : ....,.( ~-
... - : .. . - .~-- +- -_ . ;. .. ~ i- - -- - -i- i ·· · " 1-- - r"'"
1 _~ . .. + _ . . _ P t·- ' -- - " '~--i " :-- ._.. .- .
i
! ... ,-
j :I . . : i
! .
I . ..
~.. _ .. - '- .
T"---r-:-:.--:-- ,....-.-- ..._ - ,- I :;' I '
I
.'. ..: - ..-i ..- : '.:: .... -- ! --i":':_.. '1' .. ...
! ,I
I .
.1 _
' 1-_ .__...! ,
..-.1_... .. _.
I
-1I
:~ r~" I ~~
!
. ..- -1
II
j ...
I
1,136 R: 1,2
= (304nm ..279nm) 2 (304nm -293nm) (t"R - Ad
2(AR - Ama,,J j
T-
' -f ' .. . -
. .
- ..
- -- :
. . . t ..__.._.._
"'::_:r'--"'- ",--- _...
1 ,
..:-, -"-1---I ...-
: . I
.L
'i t---
.- ;
I:
I I, _.1! ,
..,.' ''- 'j
i....~-_ ; .
-- -;--'I :1-"':' "'_,'_,L :" + i ~_~Ld_ -: , ~. ,~ ' ,~=_ ..- ,~ I= ... ' _L t=-
~_.-
_!-.. _ ~~I l-C
_ _'.
._. ..,
.'
- . ._,
.... y ,.!....".
!"L ~:
,_ ....-.. I1
i _.-J,.
I
---~-_..•-.._--_.-_. _ - , . -I
: . H
.'_.._--... ---!. _.
_ . _ _
...I'_
..._-_.'.--_._ ._.._-__..__- ... . ._ _t ---···-·1...~ ._....•.__. ..~_ . _.
.'1
!
; ~
:'5
I I I r I I I I I 1 I I I I ! I I ! I r I
,c.,..", vwc-._ _.., ,.._ .
I , I , I
,lt~i
o
oo ,
iQ '?
,,-...;..)
I ,\
Je-Lr
I I
,
' I I,
, ,'I
5
4 25
I , , t
I .,>co
2.1.1 Metall - + Ligand-Charge-Transfer (MLCT)
Bei diesem Komplextyp wird durch Photonenabsorbtion ein Elektron von einem MetalIzentrum auf einen Liganden übertragen.In der Molekülorbital(MO)-Theorie entspricht dies der Anhe- bung eines Elektrons aus einem am Metall lokalisierten,besetzten Orbital, z.B.einem gefilllten d-Niveau, in ein eher ligandenzentriertes,unbesetztes MO-Orbital,etwa einem n*-Orbital glei- cher Symmetrie.
Ein Beispiel für diesen Typus ist der Tris(2,2'-bipyridil)eisen(II)-Komplex.Bei diesem wird durch Anregung eines Elektrons aus einem besetzten d-Niveau des zweiwertigen Eisens (d6_
Konfiguration) in das niedrig liegende, unbesetzte n*-Orbital eines2,2'-Bipyridin-Liganden Licht der Wellenlänge A == 500 nm absorbiert.Da blaugrünes Licht aus dem Bereich des sicht- baren Spektrums absorbiert wird, erscheint die Lösung in der Komplementärfarbe Rot.
Der durch intramolekulare Ladungsübertragung erhaltene kurzlebige und energiereiche ,,MLCT-angeregte" Zustand dieses Komplexes läßt sich näherungsweise so beschreiben, als hätten Eisenzentrum und ein Ligand ein Elektron ausgetauscht; aus Fe(II) wird Fe(III) und aus 2,2'-Bipyridin (bpy) wird die reduzierte Form, das Radikalanion bpy(-x,) des Liganden.
In diesem elektronisch angeregten Zustand ist der Komplex sehr reaktiv, die durch Photonen- absorption aufgenommene Energie kann in Wärme,Lichtemission (',Lumineszenz") oder auch in chemisch nutzbare Reaktivität umgewandelt werden (Photochemie, Photokatalyse).
Abbildung 11: MLCT
Donororbitale sindschraffiert, Akzeptororbitale weiß angedeutet
L
Metall Metall
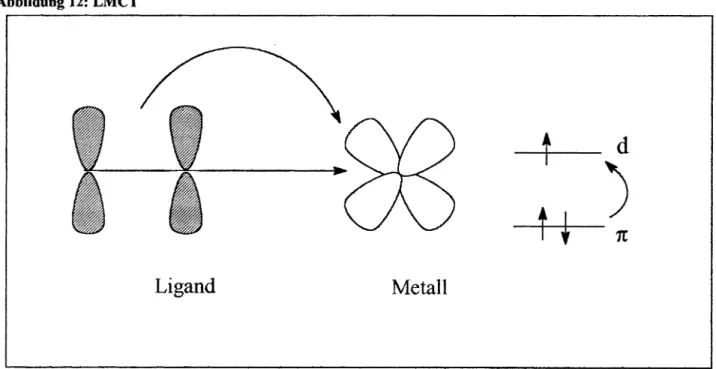
2.1.2 Ligand - + Metall-Charge-Transfer (LMCT)
Wird ein Elektron aus einem besetztenMOeines Liganden in ein niedrig liegendes unbesetztes oder nur teilweise besetztes MOamMetallzentrurn angeregt,sobezeichnetmandies als Li- gand to Metall-Charge-Transfer.
Ein typisches Beispielsind die Thiocyanatokomplexe des dreiwertigen Eisens. Hierläßt sich der CT-angeregteZustand in erster Näherung so beschreiben, alswäreFem(d5) zu Fen(d6) re- duziert und ein NCS<-)-Ligand zu einem Radikal, NCS('), oxidiert worden.
Abbildung 12: LMCT
, , --+- d
I a ~ -+t-~
~
Ligand Metall
2.1.3 Metall --+ Metall-Charge-Transfer(MMCT)
Komplexe, die zwei oder mehrere Metallatome in unterschiedlichen Oxidationsstufen enthal- ten, werden als ,,gemischtvalente" Verbindungen bezeichnet und können ebenfalls durch
Lichtabsorption zu einemintramolekularenElektronenübergang zwischen diesen Zentren ange- regt werden. das wohl bekanntesteBeispiel dafür ist das "Berliner Blau"(Fern4[Fen(CN)6]3-16
H20), dessen tiefblaue Farbe daher rührt, daß schon die Energie des langweiligen gelben Lichts dazu ausreicht, den Elektronenübergang von Fe(II) zu Fe(III) anzuregen.
Abbildung 13: MMCT
L
-ij-<~+ >:::;+- d'
Metall Metall
2.1.4 Ligand ~ Ligand-Charge-Transfer (LLCT)
Als letzte Möglichkeit sei hier der (Donator)-Ligand to (Akzeptorj-Ligand-Charge-Transfer erwähnt,der in Komplexen mit gut wechselwirkenden, elektronisch jedoch sehr verschiedenen Liganden vorkommen kann.
Abbildung 14: LLCT
}t--- ""*-- - - - .
M
-+-
11:'*-+t-)
Ligand
11:Versuche zu metallischen CT-Komplexen
Versuch 2 a: Nachweis von Eisen als "Berliner Blau" (MMCT)
Versuch 2 b: Nachweis von Eisen als Thiocyanat Aufbau und Geräte:
2 Filterpapiere, 2 Klammern, Stativgerüst Chemikalien:
Fe(III)-salzlösung (pH<7), K4[Fe(CN)6], NI-I4SCN Durchfuhrung:
Zwei Filterpapiere werden mit einer Eisen(III)-salzlösung beträufelt. Das eine erhält zusätzlich einen Tropfen einer Lösung von gelben Blutlaugensalz und das andere einen Tropfen einer Thiocyanatlösung. Dievereinigten Phasen auf dem Filterpapier werden blau bzw. rot.
Berliner Blau:
+11
4Fe3+ + 3 [Fe(CN)6]4-
Thiocyanat:
Fe3+ + 3 SCN-
+111 +11
• Fe4[Fe(CN) 6]3
- - - - . Fe(SCN)3
(blau)
(rot)
Versuch 2 c: Photometrische Bestimmung des Gehaltes von Eisen im Kakao mit 2,2'-Bip)Tridin
Geräte: 8 Meßkolben 100 ml 1Vollpipette 20 mI/ 10 ml I Bürette 25 ml
1 Meßzylinder 25 ml 2 Meßpipetten 10m]
Tiegel, Trichter
Chemikalien:
Eisen-Eichläsung (Fixanal) (1 ml= 25 ug) Schwefelsäure, c(H2S0~) ==0,05 molll Natriumsulfitlsg., w (Na2S03)==2 % 2,2'-Bipyridin-Lösung, w(Stofl)==0,25 0/0
C, R:36/38 S: 2-26
·r
Prinzip:
Eisen(II)-Ionen bilden mit 2,2'-Bipyridin einen wasserlöslichen, roten Komplex, dessen Farbintensität bei 522nm im Photometer gemessen werden kann.
Aufarbeitung des Kakaos:
Ca. 8 g Kakao werden in einem Tiegel erst gelinde erhitzt, dann durch Zünden des Inhalts verascht, bis der gesamte Rückstand farblos ist. Die Asche wird mit konzentrierter Salzsäure aufgenommen und wieder eingedampft. Nach wiederholter Aufnahme mit Wasser wird die Lösung filtriert und in einen 100ml Meßkolben gefüllt.
Arbeitsanweisung zur Bestimmung des Fe-Gehaltes
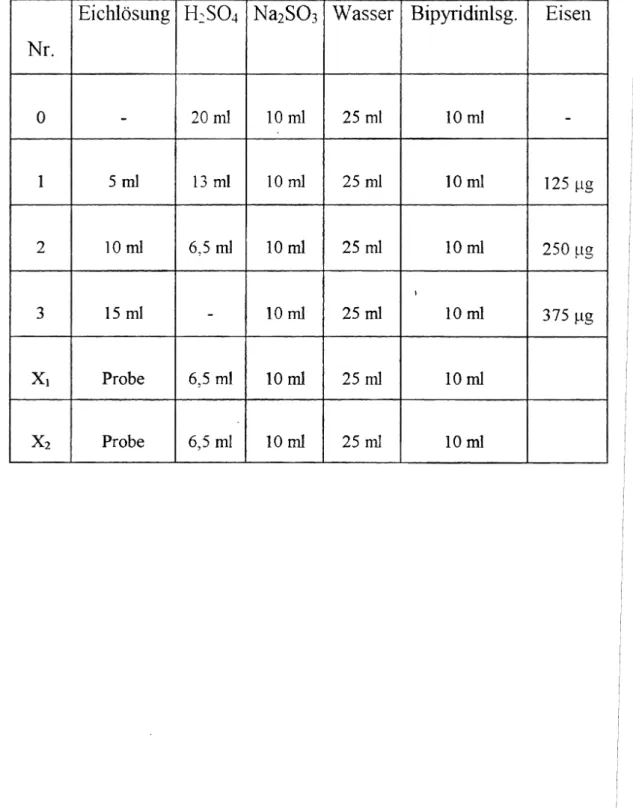
Die im 100mlMeßkolben erhaltene Eisensalzlösung wird aufgefiillt und gemischt. Von der aufgefullten Lsg. werden jeweils20 ml(Analysenlsg. Xi, X2) zur Bestimmung ein- gesetzt. Hintereinander werden die in der Tabelle aufgeführten Portionen der einzelnen Lösungen in je einen 100ml Meßkolben gegeben und nach jeder Zugabe gemischt. Es wird empfohlen, dieEichlösungen(besser: Kalibrierlösungen) mit einer Bürette, die Schwefelsäure und dieNatriumsulfitlösungmit je einer Meßpipette, das Wassermitei- nem Meßzylinder und die 2,2'-Bipyridin-Lsg. mit einer 10mlVollpipette abzumessen.
Anschließend werden die Kolben mit dest. Wasser aufgefüllt und gemischt. Nach frü- hestens 15min werden die Extinktionen der aufgefüllten Lösungen gegen die Reagen- zienblindlösung gemessen.
Tabelle 2: Arbeitsanweisung für diephotometrische Messungmit Bipyridn
EiclllösUllg H
2S04 Na2S0
3 Wasser Bipyridinlsg, Eisetl Nr.0
-
20ml 10rnl 25 ml 10ml-
1 5 ml 13 ml 10ml 25 ml 10m1 125 ug
2 10ml 6,5 ml 10ml 25 ml 10ml 250 ug
I
3 15 mI - 10ml 25 ml 10ml 375 ug
Xl Probe 6,5 ml 10ml 25 ml 10m1
X
2 Probe 6,5 ml 10m1 25 m1 10mlAbbildung 15: Kalibriergerade für photometrische Bestimmung von Eisen (Siehe nächste Seite)
...
......
'".~. . M· ••_ :-.' •
··:~yi::~:=:~~~~~~~~ ~~~~~~ !~~c::.:~}~::/~ ~7 -
. .
-:~~~?:~~;~;~~.~ :~=~-~:=:~:.:~~--_.=~::=~'-:~~_.--..;
00Q
-.=~--
(l"")
..c:- o
O
•••..
~
•..': ~ .:
.•: ~-
_·.~
•..~
•...:-~. :
.•.•.~ .i::~. :
...•:::·...~.,.· .·.- .;=-~· . ~
..~,: _
..::....:~:
.....••:. ·-~~::~~l~---. -
· ::=:·:··::::::=~t.:c~:.:~.:.-.' ---.-
~=~~~F::~:::·::·:::- . . --. . --..
::::::.----.
::::':'·.:.c::::.:~>~~~ :.;=:.:.:~~;::-::.:::~.
::.:~.==--=--.:
._- -
..- 1 _.-
_.C.:.j= =::-':'
~.~:~~~.
::.: r ..
-
()~
.- . '"--s: :-
L ~oI -:
.-- - _.-
""
v;C>''):7
r:': ~ ~
""
.e- f
0 l "
"):G
~
.r-
()";
0
~
J1 ~
ß - 0
D f
---
.0$ 1'0:::"
Beim Tris(2,2'-bipyridil)eisen(II) ist das Zentralion (Fe2+)oktaedrisch von drei Bipyridinligan- den umgeben.
Abbildung 16:Aufbau desTris(2,2'- bipyridil)-ei sen(Il)
2, 2' - Bipyridin (bpy)
2+
r~-
..,
N N
\ I\ I
\ ,
\
.
,IIm angeregter Zustand wird vorn Eisen(II) ein Elektron auf einen Bipyridilliganden übertragen:
hv
-)2
:L
nm2.2 Organische Charge- Transfer-Komplexe
Je nach ihrem Charakter unterscheidet man sowohl 7(-, er- und n-Donatoren als auch 7(-, c- Akzeptoren.Entsprechend dieser Einteilung sind mehrere Kombinationen möglich, die wieder- um zu unterschiedlichen C'T-Komplexen fuhren.
Tabelle 3: Einteilung von Donatortypen
Donatortyp Herkunft des Donatore- Verbindungsklasse lektrons
abgeschlossenes und leicht Benzol, Polycyclen, Polyphenyle, deren Alkyl- x-Donator ionisierbares1t- derivate, Olefine, aromatische Amine, und He-
Elektronensystem teroaromaten
o-Bindung eines Neutral-
o-Donator moleküls offenkettige und cyklische Kohlenwasserstoffe
nichtbindendes Elektronen- aliphatische und aromatische Amine, aromati- n-Donator paar sche N- Verbindungen, Alkohole, Ether, Ketone,
Iodide, Sulfoxide, Schwefel, Sauerstoff o- und 7[- heterocyclische Aromaten wie Pyridin und
Donor-Orbitale Chinolin
Tabelle 4: Einteilung von Akzeptortypen
Akzeptortyp Akzeptorart Beispiel
organische Verbindungen mit elek- Neutrale Moleküle mit abgeschlosse- trophilen Gruppen(N02, CN, Halo- n-Akzeptor nem n-Elektronensystem und relativ gene), Säureanhydride, Säurechlori- großer Elektronenaffinität de, Chinone, Schwefeldioxid, Sauer-
stoff ...
Halogene,Pseudohalogene, Hydro- o-Akzeptor Neutrale Moleküle mit (J-Bindung chloride, halogenierte Paraffine, Me-
tallhalogenide (Fee13 , Alel.,)
Tabelle 5: Kombinationen von unterschiedlichen Donator- bzw. Akzebtortypen zu CT-Knrnplexen
Komplextyp Beispiel
Hydrochinon - Benzochinon Hexamethylbenzol - Chloranil
N,N,N',N'-Tetramethyl-p-phenylendiamin - Chloranil Azulen - Trinitrobenzol
Indol - Trinitrobenzol 1t, 1[-Komplexe Phenothiazine - Trinitrobenzol
Chlorophyll - Polyaromaten Salicylsäure - Menadion
1t, o-Komplexe Pyridin - Iod
Alkaloide - Iod
0", n-Komplexe Cyclohexan - Polyaromaten
o, o-Komplexe Cyclohexan - Iod
Methylanilin - Pikrinsäure
n, 1[-Komplexe Aminosäuren - Chloranil Aminosäuren - Teracyanoethylen
Aminosäuren - Riboflavin
Chloranilin - Dinitrobenzoesäure Toluidin - Dinitrobenzoesäure Benzocain - Trinitrobenzol
Procain - Trinitrobenzol Arnolds-Reagenz - 1, 3-Dintrobenzol
Methanol - Iod Trimethylamin - Iod
Aminosäuren - Iod Alkaloide - Iod 11,o-Komplexe
Ethambutol-Iod Aceton - BrOITI Dioxan - Brom Pyridin - IBr/ ICI Chinolin - Iodoform
Versuch: Darstellung einiger organischer CT-Komplexe Chemikalien:
Hexamethylbenzol Chloranil
Ether Dioxan Brom Cyclohexan Trinitrobenzol Pyridin
Iod Durchfuhrung:
Xn Xi F F, Xi C F E!, T F, Xn Xn
R~ 12-19 S: 9-]6-29-33 R: 11-19-20 S: 9-16-33 R: 26-35 S: 7/9-26 R: 11 S: 9-16-33 R: 11-20/21/22 S:26-28 R: 20/21 S: 23-25
Die CT-Komponenten werden soweit es sich um zwei Feststoffe handelt gelöst und vereinigt (Hexamethylbenzol und Chloranil in Ether), ansonsten werden sie einfach nur vereinigt.
Tabelle 6: Beispiele für organische C'f-Komplextypen
Komplextyp Beispiel
CH]
101
Hexamethylbenzol - Chloranil
H3C CH] Cl Cl1t,
n-Komplex
H3C CH] CI CI
CH] 101
r
n,cr-Komplex
Pyridin - Iod
o.x-Komplex
Cyclohexan - Polynitroaromaten
r--
o.o-Kornplex
Cyclohexan - Iod
n.o- Komplex
Dioxan - Brom2.3 Einteilung nach strukturellen Gesichtspunkten
Abbildung17: Indigo
Eine weitere Möglichkeit derEinteilungvon CT-Komplexen könnte durch strukturelle Merkmale der Komplexe erfolgen,wie etwa durch Kristallstrukturen,stöchiometrische Zusammensetzun- gen usw..
zwe{,ominenteBeispiele für intramolekularen CT-Komplexe sind Indigo und der später nochzu behandelnde Indikator fürLö- sungsrnittelpolaritäten,das sogenannteEn o-Betain.
Die Farbe des Indigos beruht ebenfalls auf einem CT-Übergang.Dieser findet zwischen den elektronenreichen Aminstickstoffzentren und den elektronenarmen Cabonylfunktionen statt.
Dieses organische zentrosymetrische Farbstoffmolekül zeigt wie das ET30-Betain deutlich sol- vatochrome Eigenschaften. Im Unterschied zum letztgenannten sind diese allerdings positiv.
Typische I:I-Komplexe sind die Chinhydrone oder das anschließend zu benutzende Athracen- pikrat. Dioxan und Brom bilden eine Ketten.
r -·
Abbildung 18: Aufbau und Struktur organischer CT-Komplexe
(~
- .
3 Eigenschaften von Charge-Transfer-Komplexen
3.1 KomplexchemielChemisches Gleichgewicht
Daß organische CT -Komplexe ganz normale Komplexe sind, die dem Gesetz des chemischen Gleichgewichts und Massenwirkungesetzes unterstehen, soll am Beispiel des Anthracenpikrats gezeigt werden.
Versuch 3:Das chemische Gleichgewicht am Beispiel des Anthracenpikrats
Abbildung 19:Synthese von Anthracenpikrat
+
Anthracen (A)
OH
(f) OHPikrinsäure(P)
OH
Anthracenpikrat(AP) N02
Infolge des -1- und des -M-Effektes der Nitrogruppen ist die Pikrinsäure stark an Elektronen verarmt. Dieser Elektronenmangel kann durch Wechselwirkung mit anderen geeigneten1(- Elektronensystemen ausgeglichen werden. So wirkt in diesem CT -Komplex Anthracen als Do- nator und Pikrinsäure als Akzeptor.
Das chemische Gleichgewicht für die Reaktion A + P
---- -
AP lautet=K
fAl fPl
, wobei K bei 24°C in Chloroform 6,4beträgt.
Abbildung 20: Ausbeute an AP (a:b=1:1) mit zunehmender Verdünnung (K=6,4; 9 =25°C)
I• .,"
Ausb.•,.
100
50
50 100
5 '6
VoJ.(l)
I Versuch 3. a: Synthese und Dissoziation von Anthracenpikrat (PA)
Beim diesem chemischen Gleichgewicht reagieren also A + P ~ AP. Diese Gleichung sagt aus,daß sich aus den Stoffen A und P ein neuer Stoff AP bildet
(Synthese),oder - von rechts nach links gelesen - daß AP in die beiden Stoffe A und P zerfällt (Dissoziation). Im Gleichgewicht existieren alle drei Stoffe nebeneinander,wobei ihre Konzen- tration in gesetzmäßiger Weisevon bestimmten Bedingungen abhängen.
Geräte und Chemikalien:
Anthracen
Pikrinsäure Chloroform
Xn T Xn
R: 1-4-24/25 S: 28-35-37-44 R:20 S:24/25-26 2 Standzylinder mit Schliff
2 Tropftrichter mit Druckausgleich Magnetrührer+Rührfisch
Durchführung:
50 ml jeweils 0,1 molare Anthracen- und Pikrinsäurelösung werden vereinigt.
Zum Vergleich dazu versetzt man 2,035 g Anthracenpikrat (dies entspricht der gleichen molaren Masse von Anthracen und Pikrinsäure) mit 100 ml Chloro- form. Beide Lösungen haben die gleich intensive rote Farbe.
Auswertung:
Sowohl durch Synthese, wie auch durch Dissoziation gelangt man zur gleichen GIeichgewichtseinstellung.
Versuch 3. b: Ansteigen der Dissoziation durch Verdünnung
Das System antwortet auf die Störung seiner Gleichgewichtslage durch Volumenvergrößerung mit vermehrter Dissoziation.
Geräte und zusätzliche Chemikalien:
Benzolazo-ß-Naphthol
4 Standzylinder mit Glasdeckel Spiegel
Reagenzglasaufsatz für Overhead-Proj ektor Durchführung:
Jeweils 10 ml einer AP- und einer exakt gleich gefärbten Benzolazo-ß-
Naphthol-Lösung werden in vier Standzylinder gegeben. Jeweils eine der beiden Lösungen wird mit 20mlChloroform verdünnt, die andere als Vergleichssub- stanz daneben belassen.
nach der Verdünnung sieht man von der Seite eine Aufhellung beider Farbstoffe, allerdings vielmehr vom AP. Ein Blick in den Spiegel, um die Zylinder von oben durchschauen zu können, zeigt drei gleichgefärbte Lösungen und eine hellere.
Dies ist die verdünnte AP-Lösung. Der nicht-dissoziierte Azofarbstoff Benzola- zo-ß-Naphthol zeigte lediglich einen Verdünnungseffekt, während die i\P- Lösung vermehrt dissoziiert ist.
Gut beobachtbar ist dieser Effekt auch durch einen Reagenzglashalterautbau über einem Overhead-Projektor. Dabei werden wiederum zwei Reagenzgläser mit wenig AP-Lösung und zwei weitere mit wenig Benzolazo-ß-Naphthol-
gleich hoch aufgefullt. Beim Azofarbstoff sieht man den Verdünnungseffekt, beim CT -Komplex den Dissoziationseffekt.
Versuch 3. c: Verschiebung des Gleichgewichts durch Änderung der Temperatur Thermochromie
Dieser interessante Effekt ist am Beispiel des Anthracenpikrats sehr gut zu verfolgen. Außer- dem leitet er nahtlos zum nächsten Thema, der Solvatochromie über.
Geräte:
2 100 ml Einhalskolben Rückflußkühler
Wasserbad Eisbad Durchführung:
Die 0, I molare AP-Lösungen wird auf etwa das vierfache verdünnt. Indie bei- den Kolben werden gleiche Volumina AP-Läsung gefullt. Einen dieser Kolben versenkt man dann in ein Eisbad, während der andere mit Rückflußkühler in ein heißes Wasserbad getaucht wird. Nach kurzer Zeit hat die heiße AP-Läsung ei- ne viel hellere Färbung als die kältere. Die heißere ist also zunehmend dissozi- iert. Temperaturerhöhung verschiebt das Gleichgewicht durch Abnahme von K nach links, Temperaturerniedrigung durch Vergrößerung von K nach rechts. Die Bildung von AP ist eine exotherme Reaktion, sie liefert also Wärme, umgekehrt muß für den Zerfall von AP Wärme zugefuhrt werden. das System reagiert auf die Erhöhung der Temperatur 'von außen durch vermehrte Dissoziation.
Abbildung 21: Darstellung des Azofarbstoffes Benzolazo-ß-Naphthol
Diazotierung:
Anilin
+2 Hel,+NaNÜ2
...
- NaCI, - 2 H20
Diazoniumchlorid Cl
e
Kupplung:
+
OH
- Hel
ß-Naphthol
HO
Die Darstellung des Azofarbstoffes gelingt über die Diazotierung des Anilin zum Diazonium- chloridundanschließendem Kuppeln inI-Stellung am ß-Naphthol.
3.2 Solvatochromie
Lrsache für die oftmals stark ausgeprägte Solvatochromie ist die unterschiedliche Wechselwir- kung zwischen den verschiedenen Zuständen einer gelösten Verbindung und den Lösungsmit- telmolekülen, wobei Kräfte zwischen Ionen, Dipolen und induzierten Dipolen wirksam sein können. Negative Solvatochromie (geringere Übergangse-
Abbildung 22: "Reicbardtscber nergie, die Absorption wird mit zunehmender Polarität des Diphenyl-betain ET-30Farbstoff Lösungsmittels zu kürzeren Wellenlängen verschoben) wird
dann beobachtet, wenn die energetische Stabilisierung im Grundzustand größer ist, als im elektronisch angeregten Zustand und so bei ansteigender Polarität des Lösungsmit- tels zu einer Vergrößerung der Anregungsenergiefuhrt.
..~ Den umgekehrten Fall nennt man positive Solvatochromie.
So weisen eine Reihe von CT-Komplexen ausgeprägte 501-
vatochrome Eigenschaften auf Aus dieser Tatsache kann geschlossen werden, daß beisolchen Wechselwirkungen, die durch das Lösungsmittel induzierten Dipolmomente eine große Rolle spielen müssen.
Das solvatochrome Verhalten des Diphenylbetains
Der von Reichardt und Dimroth entwickelte Indikator für Lösungsmittelpolaritäten, das sog.
Diphenyl-betain Er-30ist ein CT -Komplex, der aufgrund dieser Eigenschaften Berühmtheit
/> erlangt hat. Die mesomeren Grenzformeln (Abb. 23) des Farbstoffes zeigen, daß die positive
Ladung am Stickstoff-Atom des Pyridinium-Ringes gleichmäßig von negativer Ladung umringt ist. Es ist im Grundzustand eine ausgesprochen polare Verbindung.
Abbildung 23: Mesomere Grenzformeln des Reichardtschen Diphenyl-betain-Farbstoffes
I
e I
Die Erklärung für die SoIvatochromie des Farbstoffes liefert der Vergleich der Dipolmomente im Grundzustand und im angeregten Zustand. Moleküle mit polarem zwitterionischen Grund- zustand werden in polaren Lösungsmitteln gut solvatisiert, die Polarität wird dabei noch grö- ßer, d.h. der Anteil der polaren Grenzform am Mesomerie-Hybrid nimmt weiter zu. Dadurch wird der Grundzustand energetisch abgesenkt. Hingegen wird der Energieinhalt des - in diesem Falle weitgehend weniger polaren - angeregten Zustands durch das Lösungsmittel nur wenig
Abbildung 24: Änderung der Polarität des Dipbenylbetainfarbstoffes beim Übergang in den angeregten Zustand
Polarität
Polarität
t
"DiPheny1-betain"
E
T-30•
r:-.
Abb. 24 zeigt, daß sich die Polarität des Diphenylbetains beim Übergang in den angeregten Zustand ändert. Der gesamte Polaritätsgradient wird schwächer und auch der Ort der Polarität ändert sich. Elektronenübergänge verlaufen wesentlich schneller, als die Ausrichtung von Lö- sungsmittelmolekülen. Beim Diphenylbetain hat diese Tatsache die Folge, daß der Grundzu- stand energetisch wesentlich günstiger solvatisiert werden kann je polarer das Lösungsmittel ist,
und umgekehrt, daß bei der Solvatisation des angeregten Zustands nur wenig Solvatisierungs- enthalpie freigesetzt wird.
Abbildung 25 : Der Übergang eines Elektrons verläuft wesentlich schneller, als die Ände- rung der Ausrichtung der Lösungsmittelmoleküle
()
hv
Je:) ---.
~r>
~ r:J
0 D8-t= A 8 - 0
tJ ~
Somit kommt es bei zunehmender Polarität des Lösungsmittels zu einer Vergrößerung des Abstandes zwischen Grund- und Anregungszustand, d. h. zu einer Erhöhung der Anregungse- nergie und damit zu einer hypsochromer Verschiebung der Absorption.
Abbildung 26: Anregungsenergien von CT-Komplexen mit negativer Solvatochromie
E
N E
R G I E_.- ... -
CI-angeregter Zustand
Grundzustand
Lösungsmittelpolarität
Den umgekehrte Fall, die sog. positive Solvatochromie beobachtet man z.B. bei Verbindungen, dieimGrundzustand wenig, dafur im angeregten Zustandmehrpolar sind. Diesmal ist der an- geregte Zustand im polaren Lösungsmittel gut stabilisiert. Beim Übergang inden Grundzu- stand können sich die Lösungsmittelmoleküle wieder nicht schnell genug den veränderten Be- dingungen anpassen und diesmal wird dieser weniger gut stabilisiert. Mitzunehmender Polari- tät des Lösungsmittels wird die Absorption zu größeren Wellenlängen verschoben.
Versuch 4. 1
Chemikalien und Geräte Diphenylbetain Methanol Ethanol
I-Propanol
R: , S: nicht bekannt F, T, R: 11-23/25
F R: 11
F R: 11
S: 2-7-16-24 S. 7-16 S: 7-16
S: 16 S: 24/25-26 R: 10-20
R: 20 R: 10 Xn
Xn I-Butanol
Chloroform
Anisol (Methoxybenzol) Glasflaschen (hell) mit Schliff
Demonstrationsreagenzglas mit 2-fach durchbohrtem Stopfen 2 Kanülen
1 Spritze komplett
I Spritze gefüllt mit Aktivkohle Durchführung:
Eine Mikrospatelspitze des Farbstoffes wird in verschiedenen Lösungsmitteln gelöst. Die Lösungen erhalten je nach Polarität verschiedene Färbungen:
Tabelle 7: Farben des Diphenylbetainfarbstoffes in verschiedenen Lö- sungsmitteln
Methanol rot Ethanol violett Propanol blau
Butanol grünblau Chloroform grün
Anisol hellgrün
Eine weitere Möglichkeit sämtliche in Tabelle aufge- fuhrten Farben zu erhalten, besteht darin ein Rea- genzglas mit dem in Anisol gelösten Farbstoff~~ zu fullen und dann wenige Tropfen einer Farbstoff- Methanollösung daraufzuspritzen. An der Grenz- schicht zeigen sich die Farben mit zunehmender bzw.
abnehmender Lösungsmittelpolarität.
Hinweis:
Die Lösungsmittel sollten vor Gebrauch gut getrocknet werden, da der Farb- stoff sehr Wasser empfindlich ist.
3.3 Konkurrenzreaktion
Weitere interessante CT-Komplexe bildet das Tetracyanoethylen (TCNE). Es wird vor allem in der pharmazeutischen Analyse zur Detektion von Alkaloiden benutzt. Seine Eigenschaften be- schränken sich allerdings nicht nur darauf, ein guter Elektronenakzeptor zu sein, sondern es zeichnet sich gleichzeitig als hervorragendes Dienophil bei Diels-Alder-Reaktionen aus.
Abbildung 27: Konkurrenzreaktion zwischen CT-Komillexbildungsgleichgewicht und einer Diels-Alder Reaktion
Anthracen
NC ,
/CN
+ CI1
NC
/C,CN
TCNE
Diels-Alder
NC ,
/CN
C
/c,
11Ne CN
CT-Komplex
Chemikalien und Geräte:
Dichlormethan (Methylenchlorid) Anthracen
Xn Xn
R: 20 S: 24
Tetracyanoethylen T
Magnetrührer mit Rührfisch 250 mI Einhalskolben
Tropftrichter mit Druckausgleich Durchführung:
R: 23/24/25 S: 44
Nach Vereinigung zweier gesättigter Lösungen von Anthracen und Tetracya- noethylen in Dichlormethan verfärbt sich die Lösung zunächst grün, nach kurzer zeit wird sie dann farblos.
Zunächst ist der grüne CT-Komplexentstanden, dessen Farbigkeit wahrschein- lich auf das Tetracyanoethylenradikalanion (also: ein echter CT-Komplex") zu- rückzuführen ist. in einer irreversiblen Konkurrenzreaktion reagieren die Edukte
r:
gleichzeitig in einer Diels-Alder-Reaktion zu einem weiteren Produkt. Dadurch werden die Edukte aus dem Gleichgewicht entfernt und die Gleichgewichtsre- aktion kommt nach kurzer Zeit zum Erliegen.
4 Literatur:
[1]Kovar und Mayer, ,,Elektronen-Donator-Acceptor-Komplexe", Pharmazie in unserer Zeit / . 8.Jahrg. 1979 / Nr. 2, S.46- 53
[2]Kaim ,Ernst, Kohlmann, ,,Farbige Komplexe: das Charge-Transfer-Phänomen", Chemiein unserer ZeitI 21. Jahrg. 1987 / Nr. 2, S. 51- 58
[3]Dimroth, K, ,,Das Experiment: Chemisches Gleichgewicht", Chemie in unserer Zeit / S. 28- 30
[4]CDRömppChemie Lexikon, Thieme Verlag Stuttgart und :\ew York, 9. erweiterte Aufla- ge, 1995
[S[Auterhoff H., "Versuch einer Klassifizierung der pharmazeutisch gebräuchlichen Farbreak- tionen", Deutsche Apothekerzeitung / 118. Jahrg. Nr. 41I 12.10.78, S. 1522- 1524
[6]Turro, N J., ,,Molekulare Photochemie", Chemie in unserer Zeit / 6. Jahrg. 1972, S. 135
[7]Perlstei~ Jerome, "Organische Metalle"- Die intermolekulare Wanderung der Aromatizität, Angew. Chemie 89 (1977), 534-549
[8]Klessinger, Martin, Konstitution und Lichtabsorption organischer Farbstoffe, Chemie in unserer Zeit 12. Jahrg. 1978/ Nr.I.
[9]Porath, Jerker. "Charge-Transfer-Adsorption In Aqueous Media", Pure And Appl. Chern., Vo1.51, pp. 1549-1559
[10]Taha,A. und Rücker, G., Utility of -Acceptors in Alkaloid Assay,Arch. Pharm.(Weinheim) 310, 485-495 (1977)
[I 1]Reichardt, Christian, Der Lösungsmitteleinfluß auf chemische Reationen, Chemie in unse- rer Zeit/ 15. Jahrg. 1981/ Nr.5
[12]Gilbert, G.L., Tested demonstrations, J. ehern. Educ., 199-+, 71, 517
[13]Osterby, Bund Mc Kelvey, R.D., Convergent Synthesis ofBetaine-30, a Solvatochromic Dye, J.Chern., Educ., 1996,73, 260-261; 737
[14 ]Ausbildungspraktikum für Chernielaboranten im Institut Chemie der Phillipps-Universität Marburg, Analyse: Photometrische Bestimmung von Eisen mit 2,2' -Bipyridin
[15]Gerstner, E., Scriptum zum Anorganisch-Chemischen Praktikum, Vorschrift 61 , Quanti- tative Bestimmung von Eisen in Lebensmitteln, 3. Auflage Marburg 1989
[16]Kabuß, S. "Strukturprinzipien für Farbstoffe, PDN-Ch. 4/~SIJg. 1989 [17]Reichardt, Chr., Solvent etfects in organic chemistry
[18]Beyer, Walter Lehrbuch der Organischen Chemie, S. Hirzel Verlag Stuttgart, 21. Auflage, 1988