Schönheitspflege chemisch betrachtet: Katja Reinl
Hinweis
Bei dieser Datei handelt es sich um eine Wissenschaftliche Hausarbeit (1. Staatsexamensarbeit), die am Fachbereich Chemie der Philipps-Universität Marburg angefertigt wurde.
Weitere Wissenschaftliche Hausarbeiten können auf der Seite http://www.chids.de/veranstaltungen/wiss_hausarbeit.html eingesehen und heruntergeladen werden.
Zudem stehen auf der Seite www.chids.de weitere Versuche, Lernzirkel und Experimentalvortäge bereit.
Dr. Ph. Reiß, im Juli 2007
im Fach Chemie
vorgelegt von Katja Reinl
Thema: Schönheitspflege chemisch betrachtet
Gutachter: Dr. Philipp Reiß
Marburg, den 24.05.2007
Inhaltsverzeichnis ii
Inhaltsverzeichnis
Seite
I Einleitung
...1
II Theoretischer Hintergrund
...2
1. Aufbau und Funktion der Haut
...3
1.1 Epidermis
...3
1.2 Dermis
...6
1.3 Subkutis
...7
1.4 Haare
...8
2. Die Chemie der Haut
...11
2.1 Pigmente
...11
2.2 Proteine
...13
2.2.1 Grundlagen zur Chemie der Proteine ...
13
2.2.2 Keratin ...
25
2.2.3 Kollagen ...
29
2.2.4 Elastin ...
35
2.2.5 Filaggrin und Profilaggrin ...
36
2.2.6 Proteine der Hornhülle ...
37
2.2.7 Adhäsionsproteine ...
39
2.3 Polysaccharide und Glycokonjugate
...40
2.3.1 Glycosaminoglycane ...
40
2.3.2 Proteoglycane ...
43
2.4 Lipide
...44
2.4.1 Fettsäuren – ein chemischer Baustein der Lipide ...
44
2.4.2 Glycerophospholipide ...
47
2.4.3 Sphingolipide ...
48
2.4.4 Sterole ...
49
2.4.5 Lipide als Bestandteil von biologischen Membranen ...
50
2.4.6 Triacylglycerine ...
52
2.4.7 Wachse ...
54
2.5 Chemie der Hautoberfläche
...55
2.5.1 Säureschutzmantel ...
55
2.5.2 Lipidschutzfilm ...
56
III Didaktische Betrachtung des Themas „Schönheitspflege“
...57
1. Das Unterrichtsfach Chemie
...57
2. Die Einordnung des Themas in den Lehrplan des Faches Chemie
...58 3. Orientierung an den Bildungsstandards
...58
4. Zur Umsetzung des Themas „Schönheitspflege“ im Unterricht
...62
IV Versuchsteil
...64
1. Kosmetische Produkte für die Haut und ihre Wirkung
...64
1.1 Lipide und grenzflächenaktive Substanzen
...65
1.1.1 Theoretische Voraussetzungen für die Versuche ...
65
1.1.2 Versuche ...
65
Versuch 1: Herstellen einer Hautcreme ...
65
Inhaltsverzeichnis iv
Seite
Versuch 2: Herstellen einer Toilettenseife ...
68
Versuch 3: Funktion von Emulgatoren ...
73
Versuch 4: Vergleich der Eigenschaften von Toilettenseife und synthetischer Seife ...
77
1.1.3 Didaktische Hinweise zu den Versuchen 1-4 ...
79
1.2 Naturstoffe ..
...82
1.2.1 Theoretische Voraussetzungen für die Versuche ...
82
1.2.2 Versuche ...
82
Versuch 5: Herstellen einer Vitamin E-Hautcreme ...
82
Versuch 6: Vitamin E als Radikalfänger ...
85
1.2.3 Didaktische Hinweise zu den Versuchen 5-6 ...
89
1.3 „Farbstoffe“ und Pigmente
...90
1.3.1 Theoretische Voraussetzungen für die Versuche ...
90
1.3.2 Versuche ...
91
Versuch 7: Herstellen einer Titandioxid-haltigen Sonnenschutzcreme ...
91
Versuch 8: Modellversuch - Wirkung von Sonnenschutzmitteln ...
95
1.3.3 Didaktische Hinweise zu den Versuchen 7-8 ...
98
1.4 Kohlenhydrate und Aminosäuren
...99
1.4.1 Theoretische Voraussetzungen für die Versuche ...
99
1.4.2 Versuche...
100
Versuch 9: Hyaluronsäure als Wasserspeicher ...
100
Versuch 10: Hyaluronsäure als Radikalfänger ...
102
Versuch 11: Herstellen einer Bräunungscreme ...
107
Versuch 12: Modellversuch – Reaktion der Bräunungscreme mit der Haut ...
110
Versuch 13: Aromastoffe als Nebenprodukt der Bräunungsreaktion ...
114
1.4.3 Didaktische Hinweise zu den Versuchen 9-13 ...
118
2. Kosmetische Produkte für die Haare und ihre Wirkung .... 120
2.1 Redoxreaktionen und Komplexchemie
...120
2.1.1 Theoretische Voraussetzungen für die Versuche ...
120
2.1.2 Versuche ...
120
Versuch 14: Wirkung von Blondierungsmitteln ...
120
Versuch 15: Grüne Gefahr für blondierte Haare ...
125
2.1.3 Didaktische Hinweise zu den Versuchen 14-15 ...
128
2.2 Aminosäuren, Peptide, Polypeptide
...129
2.2.1 Theoretische Voraussetzungen für die Versuche ...
129
2.2.2 Versuche ...
129
Versuch 16: Dauerwelle vs. Wasserwelle ...
129
Versuch 17: Modellversuch – Die chemische Wirkung des Wellmittels ...
133
Versuch 18: Nachweis von Aminosäuren des Haares ...
137
2.2.3 Didaktische Hinweise zu den Versuchen 16-18 ...
143
3. Vorprodukte
...145
Zu Versuch 10: Herstellen der Fehling-Reagenzien ...
145
Zu Versuch 12: Herstellen von Nylon ...
147
V Zusammenfassung
...149
VI Literaturverzeichnis ..
...150
VII Abbildungsverzeichnis
...155
VIII Anhang
...162
IX Versicherung
...190
I Einleitung 1
I Einleitung
„Staunen und Wunder sind die beste Motivation zu Lernen und Weiterfragen.
Staunen entsteht aber nur im Erleben und Erfahren. Im Staunen wird der Mensch offen für die größere Wirklichkeit. Er ist betroffen und bekommt das Eigentliche in den Blick“ Diese prägnanten Sätze formulierte der Münchner Schulpädagoge Helmut Zöpfl ([1] S. XIV).
Genau das ist es, was den naturwissenschaftlichen Unterricht und damit auch den der Chemie ausmacht. Durch das Experimentieren in alltagsnahem Bezug erhalten Schülerinnen und Schüler die Möglichkeit, die „trockenen“ theoretischen Fach- inhalte durch das Ansprechen der Sinne – wie Farbe und Geruch – zu verstehen.
Der Unterricht wird dadurch interessanter gestaltet und chemische Fachinhalte werden nachhaltiger vermittelt.
Bei der Wahl des Themas dieser wissenschaftlichen Hausarbeit „Schönheitspflege chemisch betrachtet“ wurde dieser Aspekt besonders berücksichtigt, denn die Chemie mit Haut und Haaren hat einen sehr hohen Alltagsbezug:
Die Haut ist das größte Sinnesorgan des Menschen (ca. 1,8 m2 [7]) und übernimmt wichtige Schutz- und Barrierefunktionen für unseren Körper. Jeder beschäftigt sich täglich mit seiner Haut und den Haaren, sei es das Schminken der Mädchen und Frauen oder das morgendliche Rasieren der Jungen und Männer. Damit hat das Thema einen hohen Motivationsgrad für Schülerinnen und Schüler1, fast alle Versuche sind daher auch so gestaltet, dass Schüler sie selbst durchführen können.
Die Arbeit hat ihren Schwerpunkt im Versuchsteil. Dieser ist in die Themen- bereiche „Kosmetische Produkte für die Haut und ihre Wirkung“ und „Kosme- tische Produkte für die Haare und ihre Wirkung“ unterteilt. Die chemischen Grundlagen von Haut und Haar sind sich zwar sehr ähnlich, aber, da die Haare
„tote“ Anhangsgebilde der Haut sind, werden sie kosmetisch gesehen anders behandelt. Die einzelnen Experimente sind innerhalb der beiden genannten Bereiche nach ihrer Einordnung in den hessischen Lehrplan einsortiert. So können die Versuche bzw. Versuchsreihen abhängig vom jeweiligen Unterrichtsstoff passend ausgewählt werden. Für einen besseren Überblick wird im Versuchsteil auf die jeweiligen Kapitel im vorangestellten Theorieteil verwiesen. Zusätzlich folgen in einigen Versuchen nach der Auswertung weitere spezielle Informatio- nen.
Es ist mir ein Anliegen, den fachwissenschaftlichen Inhalt zu diesem Thema ausführlich darzustellen. So ist es dem Lehrer möglich, je nach Jahrgangsstufe und Leistungsstand der Schüler die erforderliche didaktische Reduktion selbst vorzunehmen. Im Theorieteil werden zuerst der Aufbau und die Funktion der Haut aus biologischer und anatomischer Sicht betrachtet, danach folgt ein ausführliches Kapitel zur Chemie der Haut
An den theoretischen Hintergrund schließt sich ein kurzer didaktischer Teil an, in dem erst allgemein auf die Bildungsstandards und den fächerübergreifenden bzw.
fächerverbindenden Unterricht eingegangen wird, bevor die Bedeutung dieser Aspekte insbesondere für den Chemieunterricht und der Einsatz von „Schönheits- pflege als Unterrichtsinhalt“ betrachtet werden.
1 Im Folgenden wird der Einfachheit halber auf die Unterscheidung zwischen femininer und maskuliner Form von z.B. Lehrerinnen und Lehrern bzw. Schülerinnen und Schülern verzichtet und nur die männliche Form verwendet.
II Theoretischer Hintergrund
In diesem Kapitel werden Aufbau und Funktion der Haut betrachtet und anschließend in einem gesonderten Teil die chemischen Grundlagen ihrer moleku- laren und strukturellen Zusammensetzung aufgezeigt. Der Übersicht halber werden also biologische und chemische Sachverhalte getrennt dargestellt. Es soll damit dem Leser die für den Unterricht erforderliche didaktische Reduktion erleichtert werden.
1. Aufbau und Funktion der Haut
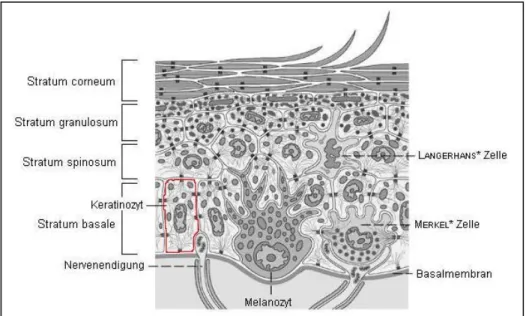
Die menschliche Haut ist aus drei Gewebeschichten aufgebaut, der Epidermis, der Dermis und der Subcutis (s. Abb. 1). Die oberste Schicht, die Epidermis (Ober- haut), besteht hauptsächlich aus Epithelgewebe, ist also ein „Grenzgewebe, das die Oberfläche des Körpers bedeckt und seine inneren Hohlräume und
Abb. 1 Schematischer Aufbau der Haut
II Theoretischer Hintergrund – 1.1 Epidermis 3
Gangsysteme auskleidet“ ([2] S. 94). Sie ist fest mit der mittleren Schicht, der Dermis (Lederhaut) verzahnt. Die Dermis setzt sich aus straffem, gefäß- und faserreichem Bindegewebe zusammen und der Übergang zur Subcutis (Unter- hautfettgewebe) ist fließend. Die Subcutis besteht aus lockerem, mit makros- kopisch sichtbaren Nerven und Gefäßen durchsetztem Binde- und Fettgewebe ([3]
S.776). Die Blutgefäße der Haut versorgen die gefäßlose Epidermis über dünne Kapillaren der papillären Dermis (s. S. 9). Im fließenden Übergangsbereich von Dermis und Subcutis sind die tiefer sitzenden größeren Venen und Arterien zu finden ([4] S. 12). Im unteren Bereich der Dermis und im oberen Teil der Subcutis sitzen verschiedene Drüsen wie beispielsweise die Talgdrüsen, die meistens mit Haarfollikeln zusammenhängen, sowie die Schweißdrüsen, die am Ende geknäuelt sind und einen langen Ausführgang besitzen. Auch weist die Haut Nervenrezeptoren auf. Die Meissner-Körperchen in der Dermis von unbehaarten Hautflächen (z.B. Fingerspitzen) reagieren auf Berührung und die Vater-Pacini- Körperchen in der Subcutis von z.B. Handinnenflächen und Fußsohlen sprechen auf Vibrationen an ([5] S. 32).
1.1 Epidermis (Oberhaut)
Zellulärer Aufbau
Die Epidermis als äußere Hülle der Haut bildet den Schutzmantel. Ihre Aufgabe ist es, eine „chemisch und mechanisch widerstandsfähige“ und beinahe wasser- undurchlässige Hautoberfläche zu bilden ([3] S. 777). Sie ist durchschnittlich et- wa 0,1 mm dick, je nach Körperregion variiert sie aber zwischen 30 µm und 4 mm, wobei ein Fünftel die Hornschicht (Stratum corneum) einnimmt. Diese ist auf den Handinnenflächen und den Fußsohlen (Leistenhaut) am stärksten ausge- bildet ([5] S. 28). Die Oberhaut ist hauptsächlich aus einem Zelltyp aufgebaut, den Keratinozyten. In ihnen wird das für den Aufbau der Hornhaut nötige Protein Keratin gebildet. Die Keratinozyten sind in einem mehrschichtigen verhornten Plattenepithel angeordnet (s. Abb. 2). Neben der Hornschicht bilden noch drei weitere Schichten die Epidermis. Diese sind von oben nach unten: Stratum granulosum (Körnerzellschicht), Stratum spinosum (Stachelzellschicht) und Stratum basale (Basalzellschicht) (s. Abb. 2). An dickeren Stellen der Hornhaut,
wie den Handinnenflächen und den Fußsohlen, befindet sich zwischen Stratum granulosum und Stratum corneum eine weitere Schicht, das Stratum lucidum, die Leucht- oder Glanzschicht. ([2] S.778)
Alle Zellen der Epidermis sind miteinander in der Ebene und mit den Zellen darüber über Desmosomen (griech.: desmos, Bindung; griech.: soma, Körperchen ([3] S.26)), also interzelluläre Haftstellen, und Adhäsionsproteine (s. Kap. 2.2.7), wie Fibronectine und Integrine, eng verbunden. Desmosomen sind Fortsätze des Zellskeletts und bestehen hauptsächlich aus Proteinen der Keratinozyten ([4] S.
13) ([5] S. 30).
Weitere, aber seltener vorkommende Zellarten in der Basalzellschicht sind:
1. die Melanozyten (Pigmentzellen, 8-25 % der Basalzellen), die mit Hilfe des durch UV-Strahlen ausgelösten Enzyms Tyrosinase den braunen Hautfarbstoff Melanin produzieren (s. Kap. 2.1),
2. die Merkel-Zellen, die mit den Nervenfasern der Dermis zusammenhängen und als Druckrezeptoren fungieren, sowie
3. die in der Stachelzellschicht zu findenden Langerhans-Zellen, die Bestandteil des Immunsystems sind.
Freie Nervenendigungen aus der Dermis, die auf Druck- und Schmerzreize reagieren, reichen bis in die Basalzellschicht, welche durch die Basalmembran von dieser abgegrenzt ist. ([4] S. 12) ([18])
Abb. 2 Schematische Darstellung der Epidermis
II Theoretischer Hintergrund – 1.1 Epidermis 5
Bildung der Hornschicht
Die Differenzierung der Keratinozyten ist ein Prozess, der als programmierter Zelltod (Apoptose) einzuordnen ist. In jeder Schicht der Epidermis befinden sich die Keratinozyten in verschiedenen Funktionszuständen und durchlaufen eine mehrstufige Umwandlung (Differenzierung) vom Stratum basale bis zum Stratum corneum. Zwischen Neuentstehung eines Keratinozyten in der Basalzellschicht und letztendlicher Desquamation (Abschilferung) als Korneozyt in der äußeren Hornhaut liegen etwa vier Wochen. Zwei Wochen davon verbringt der endgültig differenzierte Keratinozyt im Stratum corneum.
An der Keratinisierung (Verhornung) sind unter anderem Enzyme wie die Transglutaminasen (s. Kap. 2.2.6) beteiligt, die von den Keratinozyten selbst gebildet werden, sich aber im Anfangsstadium der Zellen in Vesikeln (lat.:
vesicula, Bläschen) in der Zelle oder in der Zellmembran befinden und erst später aktiv werden ([4] S. 25).
Die Differenzierung der Keratinozyten wird in der untersten Schicht, in den Basalzellen initiiert. Diese bilden durch Mitose ständig neue Tochterzellen, die nach oben abwandern und so erst das Stratum spinosum und das Stratum granulosum bilden, bis sie schließlich ihre Teilungsfähigkeit verlieren und als stoffwechselinaktive Hornschuppen (Korneozyten) im Stratum corneum vorliegen. Dabei verlieren sie Wasser, nehmen immer mehr Keratin auf und werden flacher. Als ersten Hinweis auf die Verhornung treten im Stratum granulosum Keratohyalinkörper (-granula) auf, die Keratohyalin – eine Mischung aus verschiedenen Proteinen – enthalten. Allgemein existieren zwei Typen von Keratohyalingranula, die „schwefelreichen“ Granula, die vor allem das Protein Loricrin enthalten und die „phosphatreichen“ Granula, die insbesondere Profilaggrin beinhalten ([4] S. 23). Die Keratohyalingranula lösen sich in der Übergangszone des Stratum granulosum zum Stratum corneum auf und geben ihren Inhalt in das Zellinnere frei. Nun werden die Transglutaminasen aktiviert, die die Quervernetzung von Proteinen katalysieren. Die Hornhülle wird aufgebaut ([2] S. 97). Die Korneozyten als ausdifferenzierte Keratinozyten besitzen keinen Zellkern mehr und sind aus dicht gepackten Keratinfasern und Filaggrinen aufgebaut, die von einer unlöslichen dünnen Hornhülle eingefasst werden – sie enthalten aber noch 50 % an Protein gebundenes Wasser. Die Hornhülle besteht
Abb. 4 Schema- tische Darstellung eines Lamellar- körpers
vor allem aus den quervernetzten Proteinen Loricrin, Involucrin und Keratolinin (s. Kap. 2.2.6) und ersetzt zusammen mit dem Lipidsystem die Zellmembran.
Die entstandene Horn- haut besteht aus einem Verbundsystem von Korneozyten und Lipid- system (Hornfett) (s. Abb. 3). Die Kor- neozyten sind dabei normalerweise in 15 bis
20 Schichten wabenförmig übereinander geordnet und in den Zwischenräumen befindet sich das Hornfett. Die Hornschicht ist im Ganzen nur 10 - 50 µm dick und besteht zu 40 % aus Protein, zu 40 % aus Wasser und zu 20 % aus Lipiden.
Die Lipide der Hornhaut werden in den Keratinozyten des oberen Stratum spinosum synthetisiert und in bestimmten Vesikeln, den Lamellarkörpern (Keratosomen) aufbewahrt (s. Abb. 4). Lamellarkörper enthalten dicht geschichtete scheibenförmige Liposomen (s. Kap. 2.4.5), die im Falle der Haut hauptsächlich aus Ceramiden (ca. 30 %), freien Fettsäuren (ca. 30 %) und Cholesterin und dessen Derivate (s. Kap. 2.4.4) bestehen. Im Endverlauf der Keratinisierung, zum Zeitpunkt der Hornhüllenbildung, lösen sich die Lamellarkörper auf und die Lipide werden in den
interzellulären Raum abgegeben (Exozytose), ersetzen die Phospholipide der Plasmamembran und erzeugen eine mehrschichtige, durchgängige Lipidmembran (s. Kap. 2.4.5) („Lipidverschluss“). Diese ist größtenteils kovalent an Seitenketten an der Oberfläche der Korneozyten gebunden und kann deswegen durch Waschen mit Lösungsmitteln und Detergenzien nicht entfernt werden. Vor allem bestimmte Ceramide (s. Kap. 2.4.3) sind dafür verantwortlich, dass die Haut für Wasser und lipophile Substanzen geradezu undurchlässig ist (Diffusionsbarriere für hydrophile Moleküle). Die Phospholipide der Plasmamembranen sind allerdings nicht am Aufbau des Lipidsystems beteiligt. Sie zersetzen sich wegen des knappen Vorkommens von Phosphat in der Natur als Nährstoff in ihre
Abb. 3 Verbundsystem Korneozyten und Lipidsystem
II Theoretischer Hintergrund – 1.2 Dermis 7
Bestandteile und werden in tiefliegendere Schichten der Epidermis wieder aufgenommen.
([4] S. 37 f.) ([3] S. 779 f.)
Desquamation
Bevor die Hornschuppen abschilfern, werden die interzellulären Haftstellen, die Desmosomen, durch proteinspaltende Enzyme gelockert. Die einzelnen Hornschuppen sind mit bloßem Auge nicht zu erkennen. Die sichtbaren Schuppen sind Aggregate von Hornzellen. Pro Tag verliert ein Erwachsener etwa 10 g Hornschuppen ([4] S. 13) ([3] S. 780).
1.2 Dermis (Lederhaut)
Als feste Begrenzung zwischen Epidermis und Dermis dient die Basalmembran (Basallamina), die über Ankerfibrillen (Kollagen VII) an die Kollagenfibrillen der papillären Dermis (lat.: papilla, Warze, Knospe) geheftet ist. Die Grundstruktur der Basallamina bilden feine Kollagennetzwerke des Typs IV (s. Kap. 2.2.3).
Die Dermis baut sich aus dem Stratum papillare, und dem Stratum reticulare auf ([3] S. 782). Das Grundgerüst der Dermis sind netzwerkartige Kollagenfasern, welche durch einen kleinen Anteil von elastischen Fasern ergänzt werden. Die Lücken zwischen den Fasern werden hauptsächlich von gallertartigen, stark wasserhaltigen Proteoglycanen eingenommen, die für den Hautturgor (Gewebe- innendruck) verantwortlich sind (s. Kap. 2.3) ([4] S. 33) Über Fibronectine (s. Kap. 2.2.7) sind die Proteoglycane an das Kollagennetzwerk gebunden. ([4] S.
33) Dieses makromolekulare Netzwerk aus Proteinen und Proteoglykanen, die so genannte extrazelluläre Matrix ([5] S. 34), ist unter anderem für eine straffe, glatte Haut zuständig ([4] S. 33).
Die papilläre Dermis besitzt viele Zellen, dünne Kollagenfasern – hauptsächlich Typ III (s. Kap. 2.2.3) – und ein dichtes Netz aus zarten elastischen Fasern. Die zellarme retikuläre Dermis ist dagegen von einem breiten Maschengitter aus dicken, wellig verlaufenden Kollagenfasern (hauptsächlich Typ-1-Kollagen) und begleitenden dicken elastischen Fasern durchzogen. Das Stratum reticulare
bewirkt, dass die Haut reversibel dehnbar und dennoch reißfest ist. Durch Entwellung und anschließende parallele Ausrichtung des Kollagennetzwerkes kann die Haut zu einem bestimmten Maße gedehnt werden. Bevor die Kollagenfasern überdehnt werden und es zu irreversiblen Rissen kommt, greifen die elastischen Fasern ein und der Ausgangszustand wird wieder hergestellt ([3] S.
782 f.).
Die Hauptzellen des Bindegewebes (hauptsächlich Bestandteil des Stratum papillare) sind beim Erwachsenen die Fibroblasten (Faserbildner; lat.: fibra, Faser). In ihnen werden die für den Aufbau der extrazellulären Matrix benötigten Bestandteile synthetisiert, sie sind für den Abbau und Umbau des Hautgerüstes (z.B. Wundheilung) zuständig. Die Kollagenmoleküle der Matrix werden extrazellulär aus den in Fibroblasten hergestellten Tropokollagenmolekülen gebildet (s. Kap. 2.2.3) ([2] S. 108 ff.).
Neben den Fibroblasten sind weitere Zelltypen des Bindegewebes noch die Makrophagen (Zellen des Immunsystems) und die Mastzellen, welche für
„typische Zeichen akuter Entzündungsreaktionen der Haut verantwortlich sind“
([3] S.783), zu nennen. Auch können hier schon einige Fettzellen auftreten ([4] S.
14).
1.3 Die Subcutis (Unterhautfettgewebe)
Das Fettgewebe der Unterhaut ist von Bindegewebsfasern durchzogen, welche die Haut an der Unterlage (z.B. Knochen, Muskeln, Organe etc. ([5] S. 36)) fixiert ([3] S.782). Die Stärke der Subcutis ist lokal und geschlechtsspezifisch schwan- kend und wird hormonell gesteuert. [6]
Die Fettzellen (Adipozyten) des subcutanen Fettgewebes liegen nicht als einzelne Zellen vor, sondern ballen sich zu dichten Zellhaufen, die von Blutkapillaren durchzogen werden (s. Abb. 1) ([4] S. 12). Die Adipozyten enthalten ein Fett- tröpfchen, das fast die ganze Zelle ausfüllt, die Zellorganellen sind an den Rand der Zelle gedrängt (s. Kap.2.4.6) ([3] S.126).
Das Fettgewebe der Subcutis übernimmt verschiedene Aufgaben im Körper (s. Kap. 2.4.6):
Es ist zuständig für die Speicherung von Energie liefernden Nährstoffen wie Kohlenhydrate, Fette und Proteine, aber auch für die Freisetzung von Fettsäuren
II Theoretischer Hintergrund – 1.4 Haare 9
wenn der Körper Energie benötigt. Weiterhin dient es als Polster bei Stoßeinwirkung und als Wärmeisolator für den Organismus.
1.4 Haare
Haare sind fast überall auf der Haut des Menschen zu finden. Nur an Stellen wie Fußsohlen und Handinnenflächen fehlen sie völlig. Etwa 90 000 bis 150 000 Haupthaare hat der Mensch, das entspricht einer Haardichte von ca. 200 Haaren pro Quadratzentimeter. Die Anzahl ist abhängig von der Haarfarbe: Blonde und Brünette besitzen mehr Haare als Rothaarige. Man unterscheidet zwischen kurzen, dünnen und wenig pigmentierten Flaumhaaren, z.B. Behaarung im Gesicht oder auf den Armen, und Terminalhaaren, z.B. Haupthaare, Wimpern und Augenbrauen, die dicker und pigmentiert sind. Die Anlagen der Haare werden schon während der Fetalzeit Geburt angelegt ([7] S. 203 f.) ([3] S. 784 f.). Das Haar (Pilus) zählt wie der Nagel zu den Anhangsgebilden der Haut. Die Haare sind Verhornungsprodukte der Epidermis und entstehen in tiefen, röhrenförmigen Epidermiseinstülpungen, den Haarfollikeln. Die Follikel der Flaumhaare reichen nur in die Dermis und sind dort verankert, während die Follikel der Terminalhaare erst in der Subcutis enden und dort verankert sind ([4] S. 14 f.) ([3] S. 784 f.).
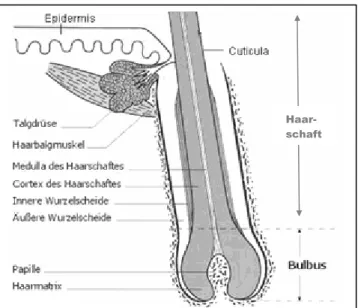
Aufbau eines Haarfollikels und eines Haares
Ein Haarfollikel hat eine zylindrische Form und steckt schräg in der Haut. Er besteht aus der unver- hornten Haarwurzel und dem vollständig verhornten Haarschaft, der sich aus dieser entwickelt. Haar- wurzel und Haarschaft sind im Follikel von einer in- neren und einer äußeren
Abb. 5 Schematischer Aufbau des Haarfollikels
Haar- schaft
Wurzelscheide aus Epithelzellen umgeben (s. Abb. 5). Der längste Teil des Haarschaftes befindet sich allerdings außerhalb der Haut und wird herkömmlich als „Haar“ bezeichnet. Der Haarschaft baut sich zum größten Teil aus der Rinde (Cortex) auf, die aus dichten, parallelen Haarzellen (Trychozyten) (s. Kap. 2.2.2) mit eingeschlossenen Melanosomen (s. Kap. 2.1) besteht. Außen ist sie von dachziegelartigen Hornzellen, der Cuticula, bedeckt. Bei Terminalhaaren befindet sich im Inneren des Haares das stellenweise unterbrochene dünne Mark (Medulla), das aus einer porösen Packung von Trichozyten und Luft besteht.
Wie bereits erwähnt, ist das Haar zwar ein Produkt der Epidermis, die jedoch nur bis zur Talgdrüse reicht, deren Ausgang sich zum Haar hin öffnet. Der Teil des Follikels, der sich in der Dermis befindet, wird von einer bindegewebigen Wurzelscheide aus zirkulären und längsgerichteten Kollagenfasern umgeben, die durch eine dicke Basalmembran (Glashaut) von der epithelialen Wurzelscheide abgetrennt ist. Unter der Talgdrüse befindet sich ein Muskel, der das Haar aufstellen kann (Musculus arrector pili). Er ist über Kollagenfasern der bindegewebigen Wurzelscheide mit dem Haar verbunden. Auch die Versorgung des Haares mit Nährstoffen wird über die Dermis geregelt ([4] S. 14 f.) ([3] S.
785).
Bildung des Haares
Das Haar bildet sich aus den Matrixzellen in der Haarzwiebel (Bulbus). Die Matrixzellen sind mitotisch aktive basale Epithelzellen, die das Wachstum des Haares regeln und die über eine Blutkapillare in der dermalen Papille, eine zapfenförmige Einstülpung der Dermis in den Bulbus, versorgt werden (s. Abb. 5). In der Übergangszone zwischen Haarwurzel und Haarschaft, der keratogenen Zone, beginnt die Verhornung der Matrixzellen, im Gegensatz zur Epidermis ohne Keratohyalinkörper. Dabei aggregieren die Cytokeratinfilamente mit kleineren Proteinen zu Makrofibrillen und verhornen immer stärker, je weiter die Zellen nach oben wandern. Schließlich bilden sich die Trichozyten (s. Kap. 2.2.2). Zwischen den Matrixzellen in der Haarzwiebel liegen die Melanozyten (s. Kap. 2.1) ([3] S. 785)
II Theoretischer Hintergrund – 2.1 Pigmente 11
Haarzyklus
Täglich wächst das Kopfhaar eines Menschen etwa 0,35 mm. Allerdings befinden sich nicht alle Haare im selben Stadium. Das bedeutet, dass das Wachstum des Haares einem Zyklus unterliegt, der mit der Wachstumsphase beginnt, dann in die Rückbildungsphase übergeht und schließlich mit der Ruhephase endet. Mit der Ruhephase fallen die Haare aus. Täglich verliert ein gesunder Mensch etwa 50- 100 Haupthaare. Beim Ausfallen gehen jedoch nicht die Haaranlagen verloren, sodass sich ein neues Haar nachbilden kann. Die Länge eines Zyklus ist von der Art und dem Ort des Haarwuchses abhängig. Wimpern beispielsweise erreichen die Rückbildungsphase schon nach 100 bis 150 Tagen, während Kopfhaare sich drei bis acht Jahre in der Wachstumsphase befinden ([3] S. 787)
2. Die Chemie der Haut
Für die vielfältigen Beziehungen zwischen Bau und Funktion der Haut ist ihr chemischer Aufbau ganz wesentlich von Bedeutung. Neben Wasser, dem Hauptbestandteil der Haut - auf den im Rahmen dieser Arbeit nicht gesondert eingegangen wird - spielen die Stoffgruppen Proteine, Lipide, Polysaccharide, Glycoproteine und Pigmente eine wichtige Rolle.
2.1 Pigmente
Für Haut- und Haarfarbe im menschlichen Körper ist das Pigment Melanin verantwortlich. Man unterscheidet zwei Melaninarten: das dunkelbraun bis schwarze Eumelanin und das gelb bis rötlich-braune Phäomelanin, welches in Sommersprossen und roten Haaren überwiegt. Eumelanin ist ein chemisch relativ beständiges Polymer, während Phäomelanin sich in Laugen löst. Allerdings können beide Melaninarten durch Oxidationsmittel oxidiert und damit zerstört werden (s. Versuch 14: Wirkung von Blondierungsmitteln) ([8] S. 14). Auch ist das Melanin dazu in der Lage, ein gewisses Maß an UV-Strahlen zu absorbieren und fungiert so als natürlicher Schutz gegen Sonnenbrand und Hautkrebs ([2] S.
69).
Melanin wird in den Melanosomen (Pigmentgranula) der Melanozyten gebildet.
Sie sitzen in der Basalzellschicht der Epidermis und zwischen den Matrixzellen im Haarfollikel. Bei der Ausbildung der Hautfarbe werden die Melanosomen aus der Zelle ausgeschieden, durchwandern die Schichten der Epidermis und verteilen sich mit den Korneozyten in der Hornschicht. Die Haarfarbe entsteht durch zwischen Trychozyten eingeschlossene Melanosomen in der Cortex des Haar- schaftes ([9] S. 10).
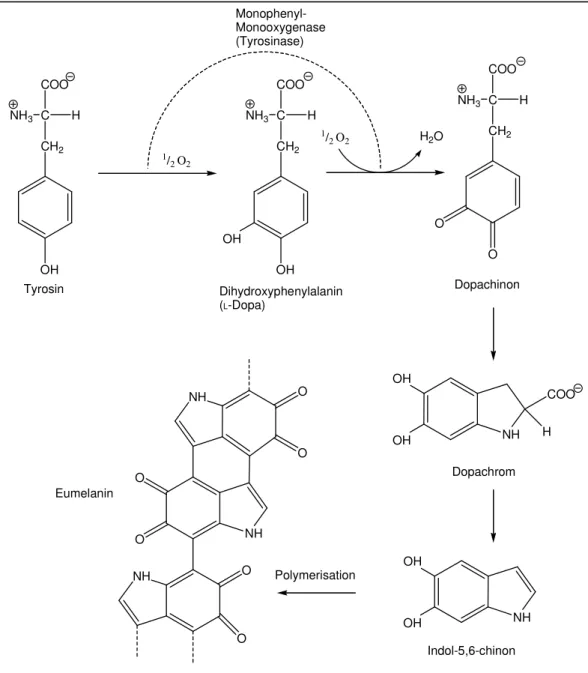
Reaktionsschema der Melaninsynthese am Beispiel von Eumelanin (s. Abb. 6)
Abb. 6 Reaktionsschema zur Bildung von Eumelanin NH3 C H
CH2
OH COO
Monophenyl- Monooxygenase (Tyrosinase)
Tyrosin
NH3 C H CH2
OH COO
OH
Dihydroxyphenylalanin (L-Dopa)
H2O
NH3 C H CH2
O COO
O
Dopachinon
OH OH
NH
COO H Dopachrom
OH OH
NH Indol-5,6-chinon O
O NH
NH O
O
O
O NH
Eumelanin
Polymerisation
1/2 O2
1/2 O2
II Theoretischer Hintergrund – 2.2 Proteine 13
Abb. 7 Allgemeine Struktur einer α-Amino- säure
H2N C H R COOH
α
Katalysiert wird die Synthese der Melanine durch das Enzym Tyrosinase (Monophenyl-Monooxygenase). In den ersten beiden Reaktionsschritten erfolgt die Hydroxylierung von Tyrosin zu Dopachinon. Dabei entsteht L-Dopa im ersten Schritt und wird dann oxidiert. Die nächsten Schritte verlaufen ohne Katalyse: erst bildet sich durch einen Ringschluss (Addition an das chinoide System) Dopachrom und unter Kohlenstoffdioxidabspaltung Indol-5,6-chinon, dann polymerisiert dieses zum Eumelanin.
Phäomelanin ist ein schwefelhaltiges Mischpolymer aus Indol-5,6-chinon und Dopachinon. Es bildet sich, wenn Dopachinon an Cystein addiert und danach ebenfalls zum Chinon oxidiert wird, anschließend zyklisiert und zuletzt mit Indol- 5,6-chinon polymerisiert ([10] S. 183 f.).
2.2 Proteine
2.2.1 Grundlagen zur Chemie der Proteine
Die strukturgebenden Bestandteile von Haut und Haaren sind die Proteine Keratin und Kollagen. Die Bausteine aller Proteine sind Aminosäuren. Deren Eigen- schaften sind maßgeblich für die Funktion von Proteinen. Aus diesem Grund wird nun ein kurzer Überblick über die 20 proteinogenen Aminosäuren und deren Klassifizierung gegeben, bevor näher auf die Struktur von Proteinen eingegangen wird.
Proteinogene Aminosäuren
Die 20 proteinogenen Aminosäuren sind chirale Moleküle (Ausnahme: Glycin) und bis auf Prolin (eine zyklische Aminosäure) α-Aminosäuren, d.h. sie besitzen eine primäre Aminogruppe (-NH2) und eine Carboxylgruppe (-COOH) am selben Kohlenstoffatom (α-C-Atom). (s. Abb. 7). Sie unterscheiden sich durch ihre Seitenketten (-R), die unter anderem verantwortlich für Größe, Gestalt und das Löseverhalten der Aminosäuren in Wasser sind. In wässriger Lösung und bei einem physiologischen pH-Wert von etwa 7,4 liegen
die Aminosäuren als dipolare Ionen (= Zwitterionen) vor (s. Abb. 8) (Ausnahme: Histidin) ([11] S. 84f.).
Moleküle, die ein Chiralitätszentrum besitzen, sind optisch aktiv - d.h. sie drehen die Ebene von polarisiertem Licht - und sind asymmetrisch. Dies bedeutet, dass das Molekül mit seinem Spiegelbild nicht zur Deckung gebracht werden kann.
Bild und Spiegelbild werden als Enantiomere bezeichnet. Die absolute Konfiguration (räumliche Anordnung) der Enantiomere kann mit Hilfe der Fischer-Konfiguration, dem D,L-System beschreiben werden (s. Abb. 9). Proteine bestehen nur aus den L-Amino-
säuren. Der Grund liegt darin, dass die Zellen lebender Systeme stereospezifische Erzeugnisse produzieren, da die aktiven Zentren der an der Synthese beteiligten Enzyme auch asymmetrisch sind.
Für die Stabilität von Proteinen ist die Zugehörigkeit der Amino-
säurenbausteine zur gleichen stereochemischen Reihe sehr wichtig ([12] S.122 ff.). Neben der Fischer-Konvention existiert auch noch ein neueres und eindeutigeres Benennungssystem, das R,S-System nach Cahn-Ingold-Prelog.
Danach sind alle L-Aminosäuren der Proteine (S)-Aminosäuren. Einzige Aus- nahme ist Cystein, bei dem sich durch das Schwefelatom in der Seitenkette die Prioritäten der Substituenten ändern ([11] S. 95).
Die physikalischen und chemischen Eigenschaften der freien und der in Proteinen gebundenen Aminosäuren werden, wie schon erwähnt, durch die Eigenschaften der Seitenketten (Reste -R) bestimt und anhand dieser werden sie in insgesamt vier Gruppen eingeteilt ([12] S.124 ff.):
Abb. 8 Zwitterionische Aminosäure
H3N C H
R COO-
Abb. 9 Enantiomere der α-Aminosäuren Spiegelebene
C
COO R H
H3N C
COO R NH3 H
L-α-Aminosäure D-α-Aminosäure
II Theoretischer Hintergrund – 2.2 Proteine 15
1. Unpolare Aminosäuren (s. Abb. 10)
Die Aminosäuren Glycin, Alanin, Valin, Leucin, Isoleucin und Methionin sind durch ihre einfachen Kohlenwasserstoffreste hydrophob. Die unpolaren und hydrophoben Eigenschaften steigen mit der Seitenkettenlänge vom Glycin, das als unpolaren Rest lediglich ein Wasserstoffatom besitzt bis hin zum Methionin, das eine unpolare Thioethergruppe eingeschlossen hat ([12] S.124).
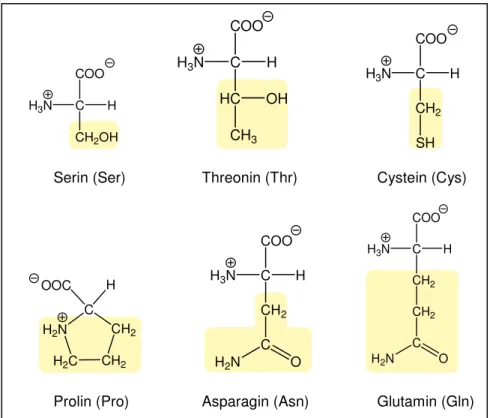
2. Polare Aminosäuren (s. Abb. 11)
Serin und Threonin besitzen im Vergleich zu Alanin und Valin je eine polare Hydroxid-Gruppe und sind somit um ein vielfaches hydrophiler. Asparagin und Glutamin besitzen jeweils eine polare Amidgruppe.
Prolin hingegen ist nur wenig polar und besitzt fast keine strukturelle Flexibilität in Proteinen, was durch die cyclische Pyrrolidinstruktur, bei der die Iminogruppe (sekundäre Aminogruppe) starr eingebunden ist, bedingt wird.
H3N C COO
H H
H3N C COO
CH3 H
H3N C COO
CH H
H3C CH3 Glycin (Gly) Alanin (Ala) Valin (Val)
H3N C COO
CH2 H
CH H3C CH3
H3N C COO
HC H
CH2 CH3
CH3
H3N C COO
CH2 H
CH2 S CH3 Leucin (Leu) Isoleucin (Ile) Methionin (Met) Abb. 10 Unpolare Aminosäuren
Cystein besitzt eine end- ständige Thiolgruppe und ist daher polar. Cystein ist sehr reaktiv ist und lässt sich mit einem weiteren Cystein(-Rest) leicht zu Cystin oxidieren (s. Abb. 12) ([12] S. 125) ([11]
S. 88).
3. Aromatische Aminosäuern (s. Abb. 13)
Aromatische Aminosäuren besitzen als Seitenketten aromatische Reste. Tyrosin ist unter den aromatischen Aminosäuren durch die Hydroxid-Gruppe die einzige mit polarem Charakter und damit fähig, Wasserstoffbrückenbindungen auszubilden. Die Eigenschaften der drei aromatischen Aminosäuren sind durch die Größe und die Aromatizität gegeben. Durch das delokalisierte π-Elektro-
Abb. 11 Polare Aminosäuren H3N C
COO
CH2OH H
H3N C COO
HC H OH CH3
H3N C COO
CH2 H
SH Serin (Ser) Threonin (Thr) Cystein (Cys)
H2N C OOC
CH2 H
CH2 H2C
H3N C CH2 C COO
H
O H2N
H3N C CH2 COO
H
C O H2N
CH2
Prolin (Pro) Asparagin (Asn) Glutamin (Gln)
Abb. 12 Reversible Disulfidbrückenbildung
H3N C COO
CH2 H
SH
NH3 C COO CH2 H
SH
H3N C COO
CH2 H
S
NH3 C COO CH2 H
S 2H+ + 2e-
2H+ + 2e- Cystein
Cystein
Cystin
II Theoretischer Hintergrund – 2.2 Proteine 17
nensystem können vor allem Tryptophan und Tyrosin ultraviolettes Licht absor- bieren. Sie prägen dadurch die charakteristische Lichtabsorption von Proteinen bei einer Wellenlänge von 280 nm ([12] S. 124).
4. Saure und basische Aminosäuren (s. Abb. 14 und 15)
Die hydrophilsten proteinogenen Aminosäuren sind die, deren Seiten- kette eine positiv oder negativ gela- dene Gruppe enthält, und das Histidin, dessen Seitenkette bei einem physio- logischem pH-Wert leicht ionisierbar ist und so als Protonenakzeptor fungiert.
Lysin, Arginin und Histidin sind basische Aminosäuren und ent- halten positiv geladene Seitenketten ([12] S.
125 f.).
Aspartat und Glutamat liegen in wässriger Lö- sung bei einem pH- Wert größer 3 als saure
Abb. 13 Aromatische Aminosäuren
Abb. 14 Saure Aminosäuren
H3N C H CH2
COO-
COO- H3N C H
CH2 CH2 COO-
COO-
Aspartat (Asp) Glutamat (Glu)
Abb. 15 Basische Aminosäuren
H3N C H CH2
CH2 COO
CH2
CH2
NH3
H3N C H CH2
CH2
COO
CH2
NH C NH2
NH2
H3N C H CH2
N NH COO
Lysin (Lys) Arginin (Arg) Histidin (His) H3N C
COO
CH2 H
H3N C COO
CH2 H
OH
H3N C H CH2
HN COO
Phenylalanin (Phe) Tyrosin (Tyr) Tryptophan (Trp)
Anionen vor. Die Säuren der beiden Salze sind die Asparaginsäure und die Glutaminsäure ([11] S. 90).
Peptidbindung: Polypeptide und Proteine
Eine Peptidbindung entsteht durch Kondensation (Eliminierung von Wasser) von zwei Aminosäuren (s. Abb. 16)
([11] S.85)
Die Peptidbindung ist mesomeriestabisiliert, besitzt somit partiellen Doppel- bindungscharakter und ist nicht frei drehbar. Folglich liegen alle vier an der Peptidbindung beteiligten Atome in einer Ebene und bilden das Rückgrat des Proteins. Das Sauerstoffatom der Carbonylgrupe und das Wasserstoffatom der Amidgruppe sind trans-ständig (s. Abb. 17).
Rotationen sind nur über die N-Cα- Bindung um den Winkel Φ und über die C-Cα- Bindung um den Winkel Ψ möglich (s. Abb. 18) ([12] S. 168). Der Aminosäure- Rest, der sich am linken Ende des Peptids befindet, wird Amino-Terminus oder N-Terminus und der Rest am rechten Ende des Peptids wird Carboxy-Terminus oder C-Terminus genannt (s. Abb. 16) ([11] S. 85). Je nach Anzahl der Amino- säure-Reste bilden sich bei der Polymerisation Di-, Tri-, Oligo- und Polypeptide.
Abb. 16 Kondensationsreaktion von zwei Aminosäuren zu einem Dipeptid
H3N C C CH3 O
O + R1
N C C
CH3 O R2 O
H H H
H2O
H3N C C CH3
O R1
N C C
CH3 O R2 O
H
a a
Abb. 17 Mesomeriestabilisierung der Peptidbindung
C C O
N H
C α α
C C O
N H
C
α δ α
δ
C C O
N H
C α α
II Theoretischer Hintergrund – 2.2 Proteine 19
Der Übergang von einem (Poly-)Peptid zu einem Protein ist fließend. Proteine bestehen im Allgemeinen aus mindestens 40 Aminosäureresten und setzen sich aus einer oder mehreren Polypeptidketten zusammen ([11] S. 85 und 103).
Das Protein mit der längsten bekannten Polypeptidkette in der Natur ist das Titin mit ca.
27 000 Aminosäure(-Resten) und einem Moleku- largewicht von fast 3.000.000 Da. Die meisten in der Natur vorkommenden Proteine enthalten jedoch zwischen 100 und 1000 Reste ([11] S. 103). Proteine, die mehr als eine identische und/oder unterschiedliche Polypeptidkette enthalten, werden oligomere Proteine genannt. Sind die Polypeptidketten nicht kovalent, sondern z.B. nur über Wasserstoffbrücken gebunden, werden sie als Untereinheiten bezeichnet.
Identische Untereinheiten heißen Protomere ([12] S.133 f.) ([11] S. 159).
Nicht alle zwanzig Aminosäuren kommen gleich oft in Proteinen vor, aber jedes Protein besitzt eine charakteristische Mischung aus den im Molekül auftretenden Aminosäuren. Entsprechend beeinflussen chemische und physikalische Eigenschaften der Aminosäuren Funktion und Struktur des Proteins. Allerdings ist dafür nicht nur wichtig, welche Aminosäuren im Molekül vorkommen, sondern auch wie deren Reihenfolge dort ist (s. Primärstruktur). Die am häufigsten in Proteinen zu findenden Aminosäuren sind Leucin, Alanin Glycin, Serin, Valin und Glutaminsäure, die seltensten sind Tryptophan, Cystein, Methionin und Histidin ([11] S.104).
Abb. 18 Rotationswinkel eines Polypeptidrückgrates
Stereochemie der Proteine
Die Struktur von Proteinen lässt sich wie bei anderen Polymeren über mehrere abgestufte „Komplexitätsebenen“ beschreiben (s. Abb. 19) ([12] S.135):
1. Primärstruktur:
Als Primärstruktur bezeichnet man die lineare Aminosäuresequenz der Peptidketten. Sie beschreibt die bestimmte Aufeinanderfolge von Aminosäuren, die durch Peptidbindungen miteinander verbunden sind ([11] S. 102). Die Primärstruktur lenkt die Faltung in die dreidimensionale Gestalt (Sekundär-, Tertiär- und Quartärstruktur) und bestimmt somit die Funktion des Proteins (s. Abb. 19 links oben) ([12] S. 120).
2. Sekundärstruktur:
Die räumliche relative Anordnung der Aminosäuren zueinander ohne Berücksichtigung der Konformation ihrer Seitenketten gibt die Sekundärstruktur
Abb. 19 Komplexitätsebenen von Proteinen
II Theoretischer Hintergrund – 2.2 Proteine 21
an. Beispiele für Faltungsmuster sind Helices, die durch Wasserstoffbrücken innerhalb der Kette stabilisiert werden, Faltblattstrukturen, bei denen benachbarte Polypeptidketten parallel oder antiparallel durch Wasserstoffbrücken verbunden sind und Schleifen, die oft bei globulären Proteinen mit kompakt gefalteter Struktur auftreten ([11] S.134 f.) ([12] S. 174). Besonders häufig kommen in Proteinen die α-Helix, das β-Faltblatt und die β-Schleifen vor ([12] S.169).
Als Beispiel für eine Sekundärstruktur wird nun die α-Helix beschrieben, da sie die vorherrschende Struktur im Keratin von Haut und Haar ist (s. Abb. 20):
Die helicale Struktur der α-Helix ist die einfachste räum- liche Anordnung einer Polypeptidkette mit starren Pep- tidbindungen. Die Rotation um andere Einfachbindungen ist dennoch möglich (s. Kap. 2.2.1). Die α-Helix ist asymmetrisch, optisch aktiv, die Drehrichtung ist bei fast allen Proteinen rechtsgängig. Pro Windungseinheit hat sie eine Ganghöhe von 0,54 nm und 3,6 Amino- säurereste. Die durchschnittliche Länge in Proteinen beträgt ca. 1,8 nm, was ca. zwölf Resten und drei Windungen gleichkommt. Die α-Helix wird durch eine maximale Ausnutzung von internen Wasserstoff- brückenbindungen stabilisiert
(s. Abb. 21). Dabei sind diese so angeordnet, dass die Wasserstoffbrücke zwischen dem Wasserstoffatom an einem Stickstoffatom einer Peptidbindung mit dem Carbonyl-Sauerstoffatom der
4. Aminosäure in Windungsrichtung der Helix besteht. Außer an den beiden Enden ist jede Peptidbindung an solch einer Wasserstoffbrücke beteiligt. Die Seitenketten stehen nach außen und nach unten aus der Helixrichtung hervor. Im Inneren der Helix herrschen durch die dichte Packung der Atome van der Waals- Kräfte, die zusätzlich stabilisieren ([12] S. 169 f.) ([11] S.138).
Jede Aminosäure einer Polypeptidkette muss dieselbe Konformation besitzen, sonst ist der Aufbau einer regelmäßigen α-Helix nicht möglich. Auch ist nicht jeder Abschnitt einer Polypeptidkette dazu fähig, stabile α-Helices zu bilden, denn es hängt von der Art der Aminosäuren und der Aminosäuresequenz im jeweiligen Abschnitt ab. Prolin- und Glycinreste z.B. verhindern die Faltung zur α-Helix. Die
Abb. 20 Die α-Helix
H N
O C
Abb. 21
Wasserstoffbrücken- bindung
sekundäre Aminogruppe beim Prolin ist Teil eines starren Ringes (s. Abb. 11), somit ist eine Rotation um die N-Cα-Bindung nicht möglich, und sie besitzt keinen Wasserstoffsubstituenten, der zur Ausbildung einer stabilisierenden Wasserstoff- brücke nötig wäre. Glycinpolymere besitzen durch die kurze Seitenkette des Glycins (ein Wasserstoffatom) eigene charakteristische Konformationen, die sich von einer α-Helix unterscheiden. Auch das gehäufte Vorkommen von Aminosäuren wie Glutamat, Lysin oder Arginin verhindert durch elektrostatische Wechselwirkungen ihrer Seitenketten die Verdrillung zur Helix. Andere Amino- säuren wie Asparagin, Serin, Threonin und Cystein können bei zu großer Nähe in der Polypeptidkette durch ihre Größe und Form diese destabilisieren. Die eben schon erwähnten van der Waals-Kräfte (s. auch unten) im Inneren der Helix bewirken, dass sich über die gesamten Länge ein einziger gerichteter Dipol ausbildet, mit der positiven Teilladung (δ+) am N-terminalen Ende und mit der negativen Teilladung (δ-) am C-terminalen Ende. Somit finden sich stabilisierende negativ geladene Aminosäuren am Amino-Terminus, während positiv geladene Aminosäuren das Gegenteil bewirken würden ([12] S. 171 f.).
3. Tertiär- und Quartärstruktur:
Die gesamte dreidimensionale Struktur der Atome im Polypeptid beschreibt die Tertiärstruktur. Dabei werden Aspekte, die über einen größeren Abstand wirken, miteinbezogen. Zu nennen sind schwache Wechselwirkungen wie Wasser- stoffbrückenbindungen und starke kovalente Bindungen wie Disulfidbrücken zwischen Aminosäuren, die in der Proteinsequenz zwar weit voneinander entfernt sind, sich in der vollständig gefalteten Struktur aber nahe kommen.
Besteht ein Protein aus mehreren Untereinheiten oder separaten Polypeptidketten wird deren räumliche Anordnung durch die Quartärstruktur erklärt (s. Abb. 19 unten).
([12] S. 175 f.)
II Theoretischer Hintergrund – 2.2 Proteine 23
Die stabilisierenden Wechselwirkungen der Sekundär-, Tertiär- und Quartär- struktur werden durch verschiedene Arten von Bindungskräften stabilisiert:
Kovalente Kräfte:
• Disulfidbrücken sind chemische Quervernetzungen z.B. von zwei Cystein- Resten (s. Abb. 12) innerhalb einer und zwischen verschiedenen Polypeptid- ketten. Sie treten gehäuft in funktionalen, gefalteten Proteinen (native Proteine) auf und kommen besonders in der extrazellulären Umgebung vor, da diese oxidierend wirkt.
• Säureamidbindungen (s. Kap. 2.1.6) sind Quervernetzungen zwischen den Seitenketten der Aminosäuren benachbarten Proteinen oder Proteinunterein- heiten. Die Bildung kann durch Enzyme wie die Transglutaminase katalysiert werden.
Nicht-kovalente Kräfte:
• Wasserstoffbrückenbindungen spielen vor allem bei der Sekundär- und der Tertiärstruktur von nativen Proteinen eine wichtige Rolle zur Stabilisierung.
• Hydrophobe Kräfte haben den größten Einfluss auf die Struktur eines Proteins.
Sie sind wichtig für die Faltung eines Proteins, denn durch den hydrophoben Effekt (kleinstmöglicher Kontakt von unpolaren Substanzen zu Wasser) ordnen sich die hydrophoben Reste im Inneren des Proteins an. Die treibende Kraft der hydrophoben Kräfte ist die Entropie.
• Salzbrücken sind starke elektrostatische Anziehungen zwischen zwei ionischen Proteingruppen mit entgegengesetzter Ladung. Die Ionenpaare sind meist an der Oberfläche des Proteins lokalisiert. Ihr Beitrag zur Stabilisierung ist jedoch gering, da sie solvatisiert werden müssen und die Solvatationsenergie und der hinzukommende Entropieverlust größer ist als die freie Enthalpie der Ionenbindung.
• Van der Waals-Kräfte sind schwache, nur über kurze Entfernung wirkende Dipol-Dipol-Wechselwirkungen. Jede Peptidbindung enthält jedoch einen schwachen elektrostatischen Dipol, der im Inneren eines Proteins stabilisierend wirkt (s. Abb. 17).
([11] S.161 f.)
Einteilung der Proteine
Proteine können nach ihrer strukturellen Eigenschaft in zwei Hauptgruppen eingeteilt werden:
1. Faserproteine (fibrilläre Proteine):
Faserproteine sind Strukturproteine mit oft protektiver, verbindender oder stützender Funktion. Ihr sich wiederholender Grundbaustein sind meistens einfache aus einer Sekundärstruktur aufgebaute Abschnitte und lange Polypeptid- ketten, die Stränge und Schichten bilden.
Sie sind durch einen hohen Anteil an hydrophoben Aminosäureresten im Protein bzw. an der Oberfläche des Proteins in Wasser unlöslich.
Gut charakterisierte Beispiele sind Keratin, Seidenfibroin und Kollagen.
2. Globuläre Proteine:
Globuläre Proteine bestehen aus kugelförmig gefalteten Polypeptidketten. Sie enthalten verschiedene Arten von Sekundärstrukturen und können Bereiche ohne besondere Struktureigenschaft haben.
Beispiele sind Enzyme und regulatorische Proteine mit ihrer strukturellen und funktionellen Vielfalt.
Die meisten Proteine sind globuläre Proteine, die fibrilläre Bereiche enthalten können. In der Haut nehmen jedoch die Faserproteine als stützendes Grundgerüst den Hauptanteil ein.
([12] S. 177) ([11] S. 141, 148)
II Theoretischer Hintergrund – 2.2 Proteine 25
2.2.2 Keratin
Das Faserprotein Keratin (griech.: keras, Horn) ist das Protein mit dem größten Anteil in Haut und Haaren. Es gehört zu den IF-Proteinen - von Intermediär- filament: Intermediäre Filamente sind bevorzugt in Bündeln angeordnete Protein- einheiten mit einem Durchmesser von 8 - 10 nm ([12] S. 44) - und zeichnet sich durch seine mechanische Beständigkeit und chemische Stabilität (z.B. wasser- unlöslich) aus. Keratine lassen sich in zwei Klassen unterteilen: α- und β-Kera- tine. α-Keratine kommen bei Säugetieren in Hornhaut, Haaren und Nägel, Krallen Hufen, Hörnern, Wolle und vielem mehr vor, β-Keratine findet man bei Vögeln (Federn) und Reptilien (Haut, Krallen) ([12] S. 177) ([11] S. 141).
Die molekulare Struktur von Keratin
Die Sekundärstruktur von α-Keratin ist eine rechts- gängige α-Helix, die durch Disulfidbrücken vernetzt ist ([12] S.177). Zwei dieser α-Keratine winden sich parallel (C- und N-Termini befinden sich jeweils am selben Ende) in Form einer linksgängigen Spirale umeinander. Diese Struktur wird superspiralisierte Helix (Superhelix; engl.
coiled coil) genannt (s. Abb. 22). Im Vergleich zu einer vergleichbaren normalen α-Helix haben die α-Keratine in der Superhelix eine Ganghöhe von 0,51 nm statt 0,54 nm.
Auch setzt sich eine Windung statt aus 3,6 nur aus 3,5 Aminosäure-Resten zusammen. ([11] S. 142). Dies wird durch die Primärstruktur der α-Keratinsuperhelix bestimmt: Die Aminosäurensequenz beinhaltet etwa 310 Aminosäuren-Reste mit einem hohen Anteil an hydrophoben Resten wie Alanin, Valin, Leucin, Isoleucin, Methionin und
Phenylalanin ([12] S. 178) ([11] S. 142).
Diese hydrophoben Reste sind so angeord- net, dass sie sich vor allem dort an der Oberfläche befinden, an denen sich die beiden α-Helices berühren (s. Abb. 23).
Abb. 22 Superhelix
Abb. 23 Anordnung der unpolaren Reste a, d, a’, d’ - Ansicht entlang der beiden Helixachsen
Dadurch haben die Seitenketten die Möglichkeit, miteinander zu verzahnen und so eine stabilisierte Superhelix zu bilden. Die Quartärstruktur von α-Keratin kann sehr komplex sein, ein Beispiel ist die Zusammenlagerung der Helices zu einem Intermediärfilament des Haares (s. S. 23 f.). Stabilität erhalten Keratine durch Disulfidbrücken ([12] S. 178) ([11] S. 142).
Keratintypen in Haut und Haar
Im menschlichen Gewebe kommen abhängig von der Art des Gewebes über 30 verschiedene Typen von Keratinen vor ([4] S. 22). Die zwanzig Cytokeratine (CK) (Keratine der Epithelien) werden in zwei Klassen unterteilt: saure Cytokeratine vom Typ I (CK 9-20) mit einer molekularen Masse von 40 000 – 64 000 Da und basische Cytokeratine vom Typ II (CK 1-8) mit einem Molekulargewicht von 52 000 – 68 000 Da ([2] S. 39). Abhängig von der Schicht, aber auch innerhalb einer Schicht, unterscheiden sich die Kombinationen der Cytokeratine. Die unverhornten Basalzellen enthalten die Cytokeratine CK 5 und 14, die in der verhornten Zone und in der Übergangszone (Stratum spinosum und Stratum granulosum) durch die Cytokeratine CK 1 und CK 10 ersetzt werden. In Fußsohlen und Handinnenflächen kommt zusätzlich noch das Cytokeratin CK 9 im Stratum lucidum vor ([2] S. 97 f.). Im Haar liegen zehn unabhängige Keratintypen vor (molekulare Masse: 44 000 – 46 000 Da) ([1] S. 23). Keratine der menschlichen Hornsubstanz besitzen einen Gehalt von ca. 5 % an Cystein- Resten, die über Disulfidbrücken (s. Abb. 12) mit anderen Proteinsträngen, wie im Haar die „schwefelreichen Keratine“ (s. S. 24), vernetzt sind und so die Struktur stabilisieren und widerstandsfähig für chemische und physikalische Einflüsse machen. Besonders die globulären N- und C-terminalen Enden der Haarkeratine (s. Abb. 25 a)) enthalten viel Cystein und somit viele Disulfidbrücken. Deshalb werden diese schlecht biegsamen Keratine mit hohem Cystein-Gehalt als „hart“
bezeichnet. Weiche Keratine findet man unter anderem in der Haut ([4] S. 22 ff.).
II Theoretischer Hintergrund – 2.2 Proteine 27
Einbau von Keratin in die Haut
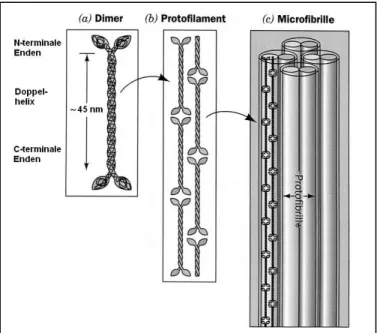
Abhängig von der Art des Cyto- keratins lagern sich Proteinunter- einheiten in der Epidermis in unterschiedlichen Kombinationen zu Intermediärfilamenten zusam- men ([2] S. 39 f.). Mit Begleit- proteinen wie dem Filaggrin (s. Kap. 2.2.7.) werden diese in- trazellulär gebündelt und über Desmosomen an der Zellmem- bran verankert (s. Abb. 24). Bei dem Aufbau der Intermediärfi- lamente dimerisieren zuerst je ein saurer Keratintyp und ein basi- scher Keratintyp zu einer Super- helix. Zwei Superhelices bilden dann um 50 % gegeneinander versetzt ein Tetramer, das mit weiteren Tetrameren zu einem Protofilament polymerisiert. Jeweils zwei Protofilamente erzeugen eine Protofibrille; vier von diesen lagern sich wiederum zu einem Intermediärfilament zusammen (s. Abb. 24).
Einbau von Keratin im Haar
Die Bildung der Intermediärfilamente des Haares geschieht auf demselben Wege wie in der Haut: Das α-Keratin des Haares besteht aus zwei Polypeptidketten, die eine Superhelix bilden. Die beiden C- und N-terminalen Enden sind globulär.
Mehrere Superhelices lagern sich zu einem Protofilament zusammen, das aus zwei Reihen Kopf-Schwanz-verbundener Superhelices besteht. Vier Protofi- brillen, die aus je zwei Protofilamenten bestehen, bilden wieder ein Intermediär- filament, eine Mikrofibrille (s. Abb. 25) ([11] S. 142). Die Mikrofibrillen sind von kleineren Proteinen, den „schwefelreichen Keratinen“ umgeben, mit denen sie
Abb. 24 Molekularbau der Cytokeratinfilamente
über Disulfidbrücken zu den Makrofibrillen poly- merisieren. Viele paral- lele Makrofibrillen sind die Bausteine der Haar- zellen (s. Abb. 26).
Die schwefelreichen Ke- ratine haben einen viel höheren Cystein-Gehalt (27 % im Haar) als die fibrillenbildenden Kera- tine ([4] S. 24). Zusam- mengehalten werden die
Zellen durch Desmosomen und interzelluläre Lipide wie Cholesterinsulfat (s. Kap. 2.4.4) ([3] S. 784).
Daraus lassen sich die besonderen Eigenschaften des Haares ableiten: Beim Er- hitzen und gleichzeitigem Befeuchten des Haares mit Wasser ist es fast auf das dop- pelte seiner Länge dehnbar. Die α-Helices werden dabei so lange gedehnt, bis sie in die gestreckte β-Konformation (Faltblatt- struktur) übergehen. Dabei werden Wasser- stoffbrückenbindungen in den α-Helices ge- löst. Wird das Haar gestreckt getrocknet, behält es den lang gezogenen Zustand, den es allerdings bei Wiederbefeuchten verliert ([4] S. 24 ff.) ([12] S. 179). Diese Dehnbarkeit und die Möglichkeit, die Wasserstoffbrückenbindungen spalten und neu knüpfen zu können macht man sich bei dem Legen von Dauerwellen zu Nutze (s. Versuch 16: Dauerwelle vs.
Wasserwelle).
Abb. 26 Haaraufbau (Modell)
Haar- zelle
Abb. 25 Molekularbau der Haarkeratinfilamente
II Theoretischer Hintergrund – 2.2 Proteine 29
2.2.3 Kollagen
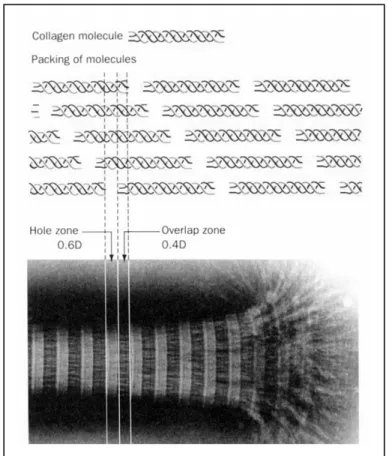
Kollagen (griech.: colla, Leim, Knochenleim) ist ebenfalls ein Faserprotein, jedoch liegt es extrazellulär als Stützsubstanz vor und besteht aus zugfesten und flexiblen wasserunlöslichen Fasern. Ein typisches Säugetier besitzt mehr als 30 Strukturvarianten von Kollagen in Bindegeweben wie Dermis, Knochen, Sehnen und Knorpel. ([12] S. 178 ff.) Jede Variante hat dabei eine etwas andere Primär- struktur und somit auch eine andere Funktion. Eines der am häufigsten vor- kommenden Kollagene ist das Typ-1-Kollagen (s. unten) ([11] S. 144). Kollagene machen 90 % der Proteine und 72 % des Trockengewichtes der Haut aus ([4] S.
26).
Beim Erhitzen in kochendem Wasser werden die Kollagenmoleküle denaturiert und es entsteht eine klebrige, starre Lösung. Man macht sich dies in vielen Berei- chen zunutze. So gewinnt man beispielsweise die formgebende Gelatine aus tie- rischem Bindegewebe.
Die molekulare Struktur von Kollagen
Kollagenfasern bestehen aus Tropokollagenmolekülen. Diese sind aus einer Tripelhelix aufgebaut, bei der drei parallele, linksgängige Polypeptidketten, die α-Ketten, zu einer rechtsgängigen, superhelicalen Struktur gewunden sind (s. Abb. 27) ([11] S. 144). Die Kollagenhelix, die links- gängige α-Kette, ist einzigartig und hat eine spezifische Aminosäurezusammensetzung:
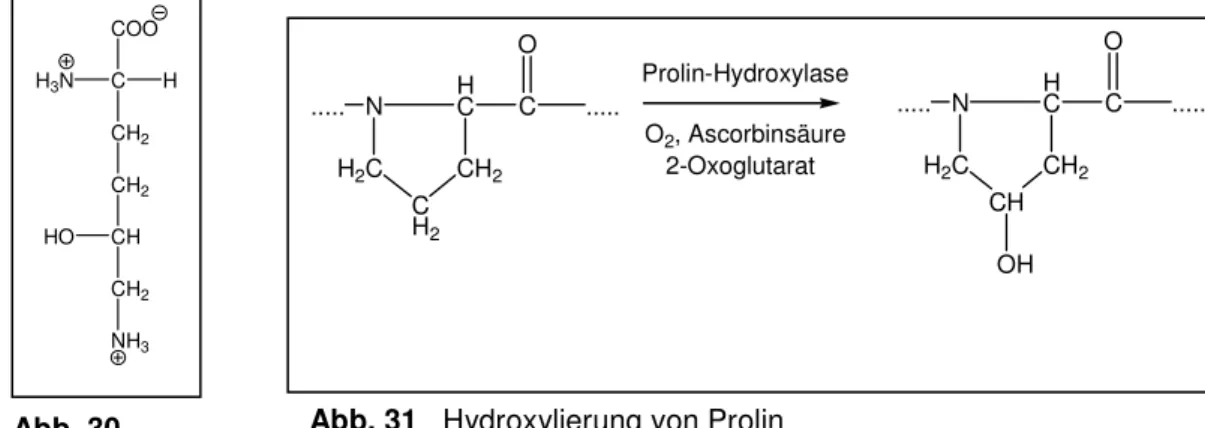
ca. 35 % Glycin, 11 % Alanin und 21 % Prolin bzw. 4-Hydroxyprolin (Hyp) (s. Abb. 28). Durch den hohen Gehalt an Prolin wird die Ausbildung einer α-Helix verhindert (s. Kap. 2.2.1) ([12] S. 178 f.). Pro Windung enthält die α-Kette etwa drei
Aminosäure-Reste in der charakteristischen Reihenfolge Gly – X – Pro oder Gly – X – Hyp, wobei X für einen beliebigen Aminosäure-Rest steht. Nur den kleinen Glycin-Resten ist es möglich, an den engen Berührungspunkten der drei α-Ketten im Inneren der Tripelhelix zu sitzen, während die Prolin-/Hydoxyprolin-Reste
Abb. 28
4-Hydroxyprolin
H2N C OOC
CH2 H
H2C C OH
Abb. 27 H
Kollagentripelhelix