Elektro(nik)geräte
Laugungsverhalten von Kupfer
aus einer Elektro- und Elektronikaltgerätefraktion
Christoph Sorger, Stefan Luidold und Stefan Konetschnik
1. Versuchsdurchführung ...392
2. Resultate ...395
2.1. Ergebnisse der Vorversuche ...395
2.2. Resultate der Versuche mit H2SO4 und H2O2 ...396
2.3. Ergebnisse der Versuche mit HNO3 ...399
3. Diskussion ...402
4. Zusammenfassung ...403
5. Literatur ...404 Auf Grund der steigenden Nachfrage nach elektrischen sowie elektronischen Utensilien liegt auch ein großes Augenmerk in der Verwertung dieser Produkte nach Ablauf ihrer Lebensdauer. Dahingehend fallen weltweit etwa 45 Millionen Tonnen Elektroaltgeräte (EAG; engl.: waste electrical and electronic equipment; WEEE) mit einer Wachstumsrate von vier bis fünf Prozent an [UNU-IAS The Global E-Waste Monitor 2014]. Jedoch stellt die komplexe und stark variierende Zusammensetzung dieser End of Life-Produkte eine große Herausforderung in Hinblick auf die Etablierung eines geeigneten Recycling- prozesses dar. EAG bestehen aus Metallen (etwa vierzig Prozent) sowie organischen (etwa dreißig Prozent) und keramischen (etwa dreißig Prozent) Komponenten. Ein rentabler Aspekt für einen Wiedergewinnungsprozess ist in den Elementen Kupfer (Cu), Nickel (Ni) und die Edelmetalle (Silber (Ag), Gold (Au), Palladium (Pd), usw.) wiederzufinden. Dem gegenüber stehen gefährliche sowie umweltschädliche Substan- zen, welche bei der Herstellung dieser Produkte mitverarbeitet werden. Z.B. enthalten Leiterplatten (printed circuit boards; PCBs) Flammschutzmittel, welche bromiert sein können. Bei einer direkten Verbrennung entstehen hierbei gesundheitsgefährdende halogenierte Dioxine und Furane. Des Weiteren können die Gehalte an etwaigen be- inhalteten Schwermetallen zu Problemen führen. [1]
Hinsichtlich der Recyclingmethodik von EAG existieren verschiedenste Möglichkeiten.
Diese reichen von pyro- oder hydrometallurgischen Prozessschritten bzw. in diversen Kombinationen. Ein neues Verfahren erlaubt es diese Schrotte zu hundert Prozent di- rekt einzuschmelzen, wobei der organische Bestandteil als Energieträger fungiert. Ein Teilschritt von diesem Verfahrensweg ist die Laugung einer Metalllegierung. Die folgen- den Kapitel beschäftigen sich mit den grundlegenden Möglichkeiten dieses Schrittes.
Elektro(nik)geräte
Bei den nasschemischen Optionen richtet sich das Hauptaugenmerk auf die Verar- beitung von Cu auf Grund des hohen Anteils in Elektronikschrotten. Hierbei können saure (Schwefelsäure, Salzsäure, Salpetersäure, usw.) sowie mit Ammoniak versetzte oxidierende Laugungsschritte Einsatz finden. Die wichtigsten Bestandteile zur Rück- gewinnung stellen die Edelmetalle wegen des hohen Marktpreises dar. Mittel, welche hierbei Anwendung finden können, sind Lösungsmittel, wie Cyanide, Halogene, Thioharnstoffe (Thiourea) und Thiosulfate. Eine Möglichkeit Leiterplatten von Mo- biltelefonen zu recyceln ist in Bild 1 ersichtlich. [5, 6]
PCBs von Handyschrott
Schwefelsaure Laugung von Kupfer
Fällung von Silber (NaCl)
Chloridische Laugung von Palladium
Zementation (Al)
Cyanid-Laugung von Gold und Silber
Aktivkohle-Adsorption Filtration
Filtration
Filtration
Filtration
Filtration
Verbrennung flüssig
flüssig
flüssig
flüssig
flüssig fest
fest
fest Abfall
fest
Rück- gewinnung
von Cu
Recycling
fest AgCl, Cu
Pd, Ag, Au, Cu
Au, Ag, Pd, Cu
Bild 1:
Fließbild zur hydrometallurgi- schen Verarbeitung von Handy- Leiterplatten
Quelle: Quinet, P. et al.: Recovery of precious metals from electronic scrap by hydrometallurgical processing routes.
Minerals Metallurgical Process 22, 2005, pp. 17-22
Verfahren zur Anreicherung von diversen Metallen stellen Methoden, wie z.B. die Sol- ventextraktion, Adsorption an Aktivkohle oder auch die Option eines Ionenaustausches dar. Faktoren, welche bei hydrometallurgischen Verfahren Berücksichtigung finden müssen, sind unter anderem die Temperatur, der Säuregehalt (und somit der pH-Wert), das Fest/Flüssig-Verhältnis sowie die Rührgeschwindigkeit. Zur Rückgewinnung ver- schiedenster Elemente stehen des Weiteren die Methoden der Gewinnungselektrolyse oder chemische Reduktionsprozesse zur Verfügung. [2, 4]
1. Versuchsdurchführung
Experimentell erfolgte die Laugung von einer verdüsten Cu-Legierung. Neben Cu (etwa 85 Prozent) enthält diese weitere wichtige Nebenelemente, wie Sb, Ni, Sn und Pb, sowie in Spuren Fe, Zn und die Edelmetalle. Eine Rasterelektronenmikroskop-Aufnahme (REM-Aufnahme) ist in Bild 2 zu erkennen. Es zeigt sich, dass diese Legierung neben
Elektro(nik)geräte
Cu einen erheblichen Anteil an Antimon (bis acht Prozent) enthält, welches haupt- sächlich in Form seines Oxids in Kunststoffen – zur Verbesserung des Flammschutzes – zu finden ist. Die Korngröße des Einsatzmaterials reicht von ungefähr 50–500 µm.
1 mm
Laugungsmittel, welche hierbei untersucht wurden, sind Schwefelsäure (H2SO4) mit Wasserstoffperoxid (H2O2) als Oxidationsmittel und Salpetersäure (HNO3). Als Vor- versuche fand die dreifache Durchführung der Laugungen mit 2 M H2SO4 + 2 M H2O2 sowie 2 M HNO3 und 10 g Einsatzmaterial in einem 250 ml Gefäß bei einer Temperatur von 50 °C statt. Weiters erfolgte die Erstellung eines Versuchsplanes mittels MODDE 11, wobei für jede Säure 16 Versuche stattfanden. Die Parameter hierfür lauten wie folgt:
Laugung mit H2SO4 und H2O2
• Fest/Flüssig-Verhältnis: 50 g/l konstant
• Konzentration: 1–3 mol/l H2SO4
• Konzentration: 1–3 mol/l H2O2
• Temperatur: 30–70 °C Laugung mit HNO3
• Fest/Flüssig-Verhältnis: 50–100 g/l
• Konzentration: 2–4 mol/l HNO3
• Temperatur: 50–80 °C
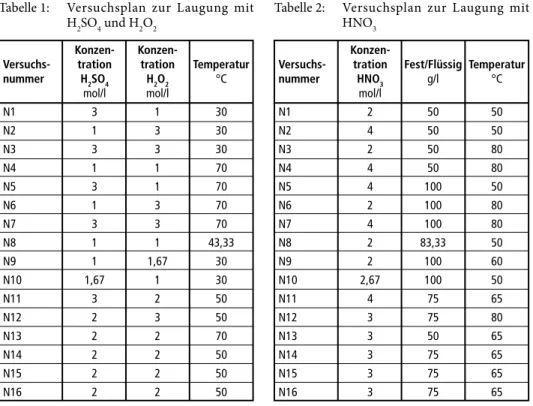
Tabelle 1 und Tabelle 2 zeigen die durchgeführten Experimente der beiden Versuchsplä- ne mit den unterschiedlichen Säuren. Hierbei sind die unterschiedlichen Experimente mit variierenden Parametern aufgezeigt, wobei die sogenannten Zentrumsversuche jeweils dreimal erfolgen müssen.
Bild 2:
REM-Aufnahme der Cu-Legie- rung für die hydrometallurgi- sche Verarbeitung
Elektro(nik)geräte
Die prinzipielle Durchführung der Experimente nutzte ein doppelwandiges Glasgefäß, wobei die Cu-Legierung mit destilliertem Wasser in diesem vorgelegt und H2SO4, H2O2 sowie HNO3 sukzessive über einen Tropftrichter zugegeben wurden, um die Wärmeentwicklung kontrollieren zu können. Insgesamt fanden die Laugungen mit Tabelle 1: Versuchsplan zur Laugung mit
H2SO4 und H2O2
Konzen- Konzen-
Versuchs- tration tration Temperatur nummer H2SO4 H2O2 °C
mol/l mol/l N1 3 1 30 N2 1 3 30 N3 3 3 30 N4 1 1 70 N5 3 1 70 N6 1 3 70 N7 3 3 70 N8 1 1 43,33 N9 1 1,67 30 N10 1,67 1 30 N11 3 2 50 N12 2 3 50 N13 2 2 70 N14 2 2 50 N15 2 2 50 N16 2 2 50
Tabelle 2: Versuchsplan zur Laugung mit HNO3
Konzen-
Versuchs- tration Fest/Flüssig Temperatur
nummer HNO3 g/l °C
mol/l
N1 2 50 50 N2 4 50 50 N3 2 50 80 N4 4 50 80 N5 4 100 50 N6 2 100 80 N7 4 100 80 N8 2 83,33 50 N9 2 100 60 N10 2,67 100 50 N11 4 75 65 N12 3 75 80 N13 3 50 65 N14 3 75 65 N15 3 75 65 N16 3 75 65
Bild 3:
Darstellung einer durchgeführten Laugung
Elektro(nik)geräte
Nach der Filtration des Laugungsrückstands mit einem aschefreien Filterpapier der Po- rengröße 5–8 µm fand eine Auffüllung der Lösung mit destilliertem Wasser auf 500 ml statt. Zur Analyse wurde diese einer ICP/MS-Untersuchung zugeführt, um auf die Laugungsausbeute schließen zu können. Dem Rückstand wiederfuhr eine Glühung bei 600 °C und vier Stunden Haltezeit, um diesen für eine REM-Analyse vorzubereiten.
2. Resultate
In diesem Kapitel sind die Ergebnisse der unterschiedlichen Experimente für die erwähnten Laugungsmittel aufgezeigt.
2.1. Ergebnisse der Vorversuche
Die Ergebnisse der Vorversuche von H2SO4 mit H2O2 (jeweils 2 M) sind in Bild 5 zu erkennen. Hierbei lässt sich sehen, dass Cu sowie Ni beinahe vollständig in Lösung gehen. Dennoch ist zu erwähnen, dass auch ein gewisser Anteil an Sb und Ag gelöst wurden, was sich nachteilig auf eine Weiterverarbeitung der Produkte (Lösung und Rückstand) auswirken kann. Deshalb lag in weiterer Folge das Hauptaugenmerk auf das Verhalten von Cu und Sb bei den unterschiedlichen Parametern.
Bild 6 zeigt die Verteilung der Elemente für die Vorversuche mit HNO3 (ebenfalls 2 M). Wieder ist zu erkennen, dass Cu und Ni beinahe komplett in Lösung sind. Im Gegensatz zu den vorhergehenden Versuchen verbleibt hierbei Sb jedoch fast vollständig im Rückstand. Weiters wurde Pb in diesem Fall beinahe zu hundert Prozent sowie Sn praktisch nicht gelöst.
Doppelwandiges Glasgefäß Magnetrührer Temperaturfühler
Tropftrichter Rückflusskühler
Regulierwasser Einlauf Regulierwasser Auslauf
Bild 4: Schema des Versuchsaufbaus 250 ml statt, weshalb diverse Faktoren
(z.B. F/Fl-Verhältnis; bei 50 g/l à 12,5 g Einsatzmaterial) umgerechnet werden mussten. Die Regelung der Temperatur fand mittels Wasserbecken sowie einem Thermostat von LAUDA statt. Eine Haltezeit von zwei Stunden kam für jedes Experiment zur Anwendung, um zu gewährleisten, dass die Suspension ausreagieren konnte. Des Weiteren fand ein Magnetrührer Anwendung, um eine gute Durchmischung sicherzustellen.
Bild 3 zeigt einen durchgeführten Ver- such und in Bild 4 ist der schematische Versuchsaufbau zu sehen.
Elektro(nik)geräte
2.2. Resultate der Versuche mit H
2SO
4und H
2O
2In diesem Kapitel folgt die Abhandlung der Laugungen anhand des zuvor erwähnten Versuchsplans mittels H2SO4 und H2O2. Cu sowie Ni lassen sich großteils lösen, wo- hingegen Pb (als PbSO4) fest zurückbleibt. Die Lösungsraten der weiteren Elemente schwanken auf Grund der unterschiedlichen Prozessparameter (Sn: 3–36 %, Ag: 0–8 %).
Bild 7 zeigt den Verlauf des prozentuellen Anteils der gesamten Auflösung des Ein- satzmaterials gegen die Konzentration an H2SO4 und H2O2 sowie die Temperatur. Die konstanten Faktoren belaufen sich für die unterschiedlichen Kurven auf 2 mol/l H2SO4, 2 mol/l H2O2 und 50 °C. Aus diesen Ergebnissen lässt sich eine prozentuelle Auflösung von bis zu über 80 % entnehmen.
In Bild 8 und Bild 9 sind die prozentuellen Auflösungen von Cu sowie Sb zu erkennen.
Die konstanten Parameter entsprechen denen aus Bild 7. Der gelöste Anteil von Cu
Sb Ni Pb
100 80 60 40 20 Massenanteil
%
0 Cu
Lösung
Fe Sn Ag Au
Rückstand H2SO4 mit H2O2
Bild 5:
Elementverteilung der Vorver- suche mittels H2SO4 mit H2O2
Sb Ni Pb
100 80 60 40 20 Massenanteil
%
0 Cu
Lösung
Fe Sn Ag Au
Rückstand HNO3
Bild 6:
Verteilung der Elemente der Vorversuche mittels HNO3
Elektro(nik)geräte
schwankt hierbei von 88–93 %, jener von Sb von 5–30 %, was darauf schließen lässt, dass die Löslichkeit des letzteren Elements stark von den Prozessparametern abhängt. In Bild 10 ist des Weiteren die prozentuelle Auflösung von Sb in Abhängigkeit der Konzentra- tionen von H2SO4 sowie H2O2 bei einer moderaten Temperatur von 50 °C ersichtlich.
Dies impliziert, dass Sb mit steigendem Gehalt an H2SO4 verstärkt in Lösung geht.
Gelöst
%
75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90
H2SO4 mol/l
1,0 1,2 1,4 1,6 1,8 2,0 2,2 2,4 2,6 2,8 3,0 1,0 1,2 1,4 1,6 1,8 2,0 2,2 2,4 2,6 2,8 3,0 30 35 40 45 50 55 60 65 70 H2O2 mol/l Temperatur ºC
Bild 7: Gesamte Auflösung bei den Laugungsversuchen mit H2SO4 und H2O2, konstante Faktoren:
2 M H2SO4, 2 M H2O2 und 50 °C
Cu in Lösung
%
85 86 87 88 89 90 91 92 93 94 95
H2SO4 mol/l
1,0 1,2 1,4 1,6 1,8 2,0 2,2 2,4 2,6 2,8 3,0 1,0 1,2 1,4 1,6 1,8 2,0 2,2 2,4 2,6 2,8 3,0 30 35 40 45 50 55 60 65 70 H2O2 mol/l Temperatur ºC
Bild 8: Auflösung von Cu bei den Laugungsversuchen mit H2SO4 und H2O2, konstante Faktoren:
2 M HSO, 2 M HO und 50 °C
Elektro(nik)geräte
Des Weiteren ist in Tabelle 3 bzw. Bild 11 die Zusammensetzung des Rückstands aus einem Laugungsversuch mit den Parametern 3 M H2SO4, 3 M H2O2 sowie 70 °C er- sichtlich, wobei diese Analyse mittels Rasterelektronenmikroskop erfolgte. Hierbei lässt
Sb in Lösung
%
0 5 10 15 20 25 30 35
H2SO4 mol/l
1,0 1,2 1,4 1,6 1,8 2,0 2,2 2,4 2,6 2,8 3,0 1,0 1,2 1,4 1,6 1,8 2,0 2,2 2,4 2,6 2,8 3,0 30 35 40 45 50 55 60 65 70 H2O2 mol/l Temperatur ºC
Bild 9: Auflösung von Sb bei den Laugungsversuchen mit H2SO4 und H2O2, konstante Faktoren:
2 M H2SO4, 2 M H2O2 und 50 °C
H2O2 mol/l
0 1,2 1,4 1,8 2,0 2,4 2,8 3,0
H2SO4 mol/l
1,0 1,2 1,4 1,6 1,8 2,0 2,2 2,4 2,6 2,8
2,2
1,6 2,6
1,75 3,50 5,25 7,00 8,75 10,50 12,25 14,00 15,75 17,50 19,25 21,00 22,75 24,50 26,25 28,00 29,75 31,50 33,25
26,25
24,50 22,75 19,25
17,50 15,75 14,00 12,25 10,50
8,75
7,00
Sb in Lösung
%
21,00
Temperatur 50 ºC 3,0
Bild 10: Auflösung von Sb bei den Laugungsversuchen mit H2SO4 und H2O2, konstanter Faktor:
50 °C
Elektro(nik)geräte
sich ein hoch antimonhaltiges Produkt (in oxidischer Form) erkennen, welches auf dieses Element weiterverarbeitet werden kann. Daneben sind noch ein gewisser Anteil an Sn, Pb sowie Cu enthalten. Zu- sätzlich soll Erwähnung finden, dass sich hierin Edelmetalle befinden, welche aber auf Grund der Nachweisgrenze mittels dieser Methode nicht bestimmbar waren.
Tabelle 3: Zusammensetzung des Rückstands aus dem Versuch mit 3 M H2SO4, 3 M H2O2 und 70 °C
Element Sb O Sn Pb Cu Rest Gew.-%
Anteil 45,0 27,8 10,7 9,6 5,9 1
2.3. Ergebnisse der Versuche mit HNO
3Ähnlich dem vorhergehenden Kapitel sind hier die Ergebnisse der Laugungsversuche mit HNO3 abgehandelt. Mit geeigneten Prozessparametern können Cu, Ni sowie Pb vollständig gelöst werden, wohingegen Sb und Sn weitestgehend im Rückstand verblei- ben. Im Gegensatz zu den Versuchen mit Schwefelsäure fällt aber bei diesen Versuchen der Gehalt an gelöstem Ag deutlich höher aus (teilweise bis neunzig Prozent).
In Bild 12 ist die gesamte prozentuelle Auflösung des Einsatzmaterials in Abhängigkeit von der Konzentration an HNO3, des Fest/Flüssig-Verhältnisses sowie der Tempera- tur ersichtlich. Die konstanten Faktoren belaufen sich auf 3 mol/l HNO3, einem Fest/
Flüssig-Verhältnis von 75 g/l sowie 65 °C. Hierbei ist eine zunehmende Auflösung mit steigendem Säuregehalt zu erkennen.
Bild 13 und Bild 14 zeigen das Verhalten von Cu und Sb bei den Laugungsversuchen mit HNO3. Mit steigendem HNO3-Gehalt nimmt die Löslichkeit von Cu zu, womit sich dieses Element praktisch vollständig lösen lässt. Sb hingegen verbleibt fast komplett im Rückstand (über 99 %), woraus eine gute Trennung resultiert. Diese Tatsache ist nochmals in Bild 15 verdeutlicht, wo der Gehalt des in Lösung gegangenen Sb gegen die HNO3-Konzentration und dem Fest/Flüssig-Verhältnis bei einer Temperatur von 65 °C aufgetragen ist.
1 mm
Bild 11:
Aufnahme des Rückstands aus dem Versuch mit 3 M H2SO4, 3 M H2O2 und 70 °C
Elektro(nik)geräte
Gelöst
%
0 60 80 100
HNO3 mol/l
2,0 2,2 2,4 2,6 2,8 3,0 3,2 3,4 3,6 3,8 4,05052 54 56 58 60 62 64 66 68 70 50 55 60 65 70 75 80 85 100 Fest/Flüssig g/l Temperatur ºC
95 90 72 74 76 78
Bild 12: Gesamte Auflösung bei den Laugungsversuchen mit HNO3, konstante Faktoren: 3 M HNO3, F/Fl: 75 g/l, 65 °C
Fest/Flüssig g/l
50 55 60 70 75 85 95 100
HNO3 mol/l
2,0 2,2 2,4 2,6 2,8 3,0 3,2 3,4 3,6 3,8
80
65 90
45 50 55 60 65 70 75 80 85 90 50 95
Cu in Lösung
%
Temperatur 65 ºC 55 60
65
70 75 80
85 90
95
Max
4,0
Bild 13: Auflösung von Cu bei den Laugungsversuchen mit HNO3, konstanter Faktor: 65 °C
Elektro(nik)geräte Sb in Lösung
%
0 1 2
HNO3 mol/l
2,0 2,2 2,4 2,6 2,8 3,0 3,2 3,4 3,6 3,8 4,050 52 54 56 58 60 62 64 66 68 70 50 55 60 65 70 75 80 85 100 Fest/Flüssig g/l Temperatur ºC
95 90 72 74 76 78
Bild 14: Auflösung von Sb bei den Laugungsversuchen mit HNO3, konstante Faktoren: 3 M HNO3, F/Fl: 75 g/l, 65 °C
Fest/Flüssig g/l
50 55 60 70 75 85 95 100
HNO3 mol/l
2,0 2,2 2,4 2,6 2,8 3,0 3,2 3,4 3,6 3,8
80
65 90
0,5 0,6 0,7 0,8 0,9 Sb in Lösung
%
Temperatur 65 ºC 0,4
4,0 0,5
0,6
0,7
0,8
0,4
Bild 15: Auflösung von Sb bei den Laugungsversuchen mit HNO3, konstanter Faktor: 65 °C
Elektro(nik)geräte
In Hinblick auf den Rückstand zeigt Tabelle 4 die Zusammensetzung von die- sem aus dem Versuch mit den Parametern 3 M HNO3, 50 g/l F/Fl sowie 65 °C. Des Weiteren ist dieser in Bild 2 als REM- Aufnahme ersichtlich. Es handelt sich wiederum um ein hochantimonhaltiges
Tabelle 4: Zusammensetzung des Rückstands aus dem Versuch mit 3 M HNO3, F/Fl = 50 g/l und 65 °C
Element Sb O Sn Cu Ni Pb Gew.-%
Anteil 57,8 25,8 15,4 0,6 0,3 0,1
oxidisches Produkt mit einem gewissen Anteil an Sn. Cu, Ni und Pb liegen in geringen Konzentrationen vor, was darauf schließen lässt, dass diese Elemente fast vollständig in Lösung gebracht wurden. Auch hier ist zu erwähnen, dass dieser Rückstand noch einen gewissen Gehalt an Edelmetalle enthalten muss, dieser aber mittels REM/EDX nicht detektiert werden konnte.
1 mm
Bild 16:
Aufnahme des Rückstands aus dem Versuch mit 3 M HNO3, F/Fl = 50 g/l und 65 °C
3. Diskussion
Anhand der Ergebnisse lässt sich eine Abschätzung anstellen, wie sich diverse Elemen- te aus einer Elektronikschrottfraktion bei der Laugung in unterschiedlichen Medien verhalten (in diesem Fall H2SO4 mit H2O2 sowie HNO3). Mit den Vorversuchen konnte gezeigt werden, dass sich Cu sowie Ni zum größten Teil in diesen Säuren lösen. Sb hingegen verbleibt bei den Versuchen mit HNO3 im Gegensatz zu jenen mit H2SO4 fast vollständig im Rückstand. Dies führt auf die Tatsache zurück, dass dieses festes Sb2O3 bildet. Pb verbleibt in Schwefelsäure fast vollständig im Rückstand, während es sich in Salpetersäure komplett löst. Im Gegensatz hierzu erweist sich Sn bei den Versuchen mit HNO3 als unlöslich, wobei feste Metazinnsäure (H2SnO3) entstehen kann [3]. Das Verhalten von Ag zeigt eine geringe Löslichkeit, wobei hierbei auf das niedrigere Vorkommen im Einsatzmaterial und somit auf eine ungenaue Detektier- barkeit verwiesen werden muss.
Elektro(nik)geräte
Bei den Versuchen mit H2SO4 lässt sich eine Auflösung der Cu-Legierung bei mode- raten Konditionen von über 80 Prozent verzeichnen, wobei sich das Kupfer mit einer Schwankungsbreite von 88 bis 93 Prozent löst. Ein Abfall der Löslichkeit (gesamt und Cu) ist bei einem mittleren Säuregehalt zu erkennen. Dies kann auf unterschiedliche chemische Wechselwirkungen der im Einsatzmaterial befindlichen Elemente sowie Verbindungen rückzuführen sein. Der Gehalt an löslichem Sb steigt mit zunehmender Säurekonzentration. Der sich gebildete oxidische Rückstand aus einem der Experimente (3 M H2SO4, 3 M H2O2 und 70 °C) verzeichnet einen hohen Anteil an Sb sowie nicht zu vernachlässigende Gehalte an Sn, Pb und Cu.
Die Salpetersäureversuche zeigen, dass mit zunehmender Säurekonzentration sowie sinkendem Fest/Flüssig-Verhältnis die Auflösung des gesamten Einsatzmaterials und von Cu (bis hundert Prozent) steigt. Dies impliziert, dass es im untersuchten Bereich einer gewissen Menge an Säure bedarf, um eine möglichst vollständige Reaktion diverser Elemente zu gewährleisten. Sb verbleibt in diesem Medium bei- nahe komplett im Feststoff auf Grund der zuvor erwähnten Tatsache, wodurch sich eine gute Trennung ergibt. Dennoch muss hierbei berücksichtigt werden, dass Salpetersäure ebenfalls einen gewissen Anteil an Ag löst, worauf bei weiteren Verfahrensschritten in Hinsicht auf die erhaltenen Produkte zu achten ist. Diese Separation spiegelt sich bei den Analysen eines Rückstandes wider (Versuch mit 3 M HNO3, F/Fl = 50 g/l und 65 °C). Dieser ist sehr antimon- (Sb2O3) sowie zinnhaltig (H2SnO3), mit geringen Spuren an Cu, Ni und Pb.
Im Vergleich zu H2SO4/H2O2 lässt sich mittels Salpetersäure eine bessere Trennung di- verser Elemente erzielen. Dennoch kann eine relativ gute Separation anhand geeigneter Prozessparameter auch mit Schwefelsäure erzielt werden. Ökonomisch gesehen steht die Tatsache im Vordergrund, dass HNO3 im Gegensatz zu H2SO4 verhältnismäßig teuer ist, sowie Ag sich ebenfalls in diesem relativ gut lösen lässt, und es somit zu erhöhten prozesstechnischen Herausforderungen kommen kann. Abgesehen von diesen Aspekten bedarf es bei industriellen Anwendungen mit nitratbasierten Laugungsmedien einer gesonderten Abwasseraufbereitung.
Vorzugsweise sollten in weiteren Prozessschritten eine Gewinnung von Cu und Ni aus der Lösung erfolgen, sowie eine weitere Aufarbeitung des Rückstandes, Abtrennung von Sb und Rezyklierung der Edelmetalle (Ag, Au, Pd, usw.) stattfinden. Dies lässt sich beispielsweise mit weiteren Laugungsschritten, Solventextraktion, Fällungsprozessen, Elektrolyseverfahren, usw. bewerkstelligen.
4. Zusammenfassung
Elektronikschrott stellt in der heutigen Gesellschaft einen hohen Anteil an EoL- Produkten dar. Auf Grund der wertvollen beinhaltenden Elemente (Metalle) sowie gesundheits- und umweltgefährdenden Substanzen ist die Notwendigkeit gegeben, diesen fachgerecht zu verwerten bzw. zu recyceln.
Elektro(nik)geräte
Deshalb wurde die hydrometallurgische Verarbeitung einer aus einem pyrometallur- gischen Vorprozess zur Verarbeitung von WEEE erhaltenen Legierung behandelt. Da in diesen neugewonnenen Einsatzmaterialien vorzugsweise Cu wiederzufinden ist, erfolgte die Anpassung der Laugung auf dieses Element. Eine Trennung von diver- sen weiteren Bestandteilen und deren Wiedergewinnung soll hierbei erzielt werden.
Schwefel- sowie auch Salpetersäure stellen hierbei geeignete Medien dar. Es besteht dennoch der Bedarf geeignete Prozessparameter zu finden, um einen passenden Recyclingprozess etablieren und verschiedene Elemente rückgewinnen zu können, vor allem mit einem wichtigen Schwerpunkt auf die Edelmetalle. Dazu sind weitere Untersuchungen, in hydrometallurgischer als auch pyrometallurgischer Hinsicht von Nöten, um dies gewährleisten zu können.
Danksagung
Die Autoren bedanken sich für die finanzielle Unterstützung durch das österreichische Bundesministerium für Wissenschaft, Forschung und Wirtschaft und die Nationalstif- tung für Forschung, Technologie und Entwicklung.
5. Literatur
[1] Cucchiella, F.; D’Adamo, I.; Koh, S. C. L.; Rosa, P.: Recycling of WEEEs: An economic assessment of present and future e-waste streams. Renewable and Sustainable Energy Reviews 51, 2015, pp. 263-272
[2] Khaliq, A.; Rhamdhani, M. A.; Brooks, G.; Masood, S.: Metal Extraction Processes for Electronic Waste and Existing Industrial Routes: A Review and Australian Perspective.Resources 2014, 3, pp. 152-179
[3] Mecucci, A.; Scott, K.: Leaching and electrochemical recovery of copper, lead, and tin from scrap printed circuit boards, J. Chem. Technol. Biotechnol. 77 (4), 2002, pp. 449-457
[4] Park, Y. J.; Fray, D. J.: Recovery of high purity precious metals from printed circuit boards.
J. Hazard. Mater. 2009, 164, 1152–1158
[5] Quinet, P. et al.: Recovery of precious metals from electronic scrap by hydrometallurgical pro- cessing routes. Minerals Metallurgical Process 22, 2005, pp. 17-22
[6] Tuncuk, A. et al.: Aqueous metal recovery techniques from e-scrap: Hydrometallurgy in recyc- ling. Minerals Engineering 25, 2012, 28-37
Die Deutsche Nationalbibliothek verzeichnet diese Publikation in der Deutschen Nationalbibliografie; detaillierte bibliografische Daten sind im Internet über http://dnb.dnb.de abrufbar
Karl J. Thomé-Kozmiensky, Daniel Goldmann (Hrsg.):
Recycling und Rohstoffe – Band 10
ISBN 978-3-944310-34-3 TK Verlag Karl Thomé-Kozmiensky
Copyright: Elisabeth Thomé-Kozmiensky, M.Sc., Dr.-Ing. Stephanie Thiel Alle Rechte vorbehalten
Verlag: TK Verlag Karl Thomé-Kozmiensky • Neuruppin 2017
Redaktion und Lektorat: Dr.-Ing. Stephanie Thiel, Elisabeth Thomé-Kozmiensky, M.Sc.
Erfassung und Layout: Claudia Naumann-Deppe, Janin Burbott-Seidel, Anne Kuhlo, Sandra Peters, Ginette Teske, Gabi Spiegel, Cordula Müller
Druck: Universal Medien GmbH, München
Dieses Werk ist urheberrechtlich geschützt. Die dadurch begründeten Rechte, insbesondere die der Übersetzung, des Nachdrucks, des Vortrags, der Entnahme von Abbildungen und Tabellen, der Funk- sendung, der Mikroverfilmung oder der Vervielfältigung auf anderen Wegen und der Speicherung in Datenverarbeitungsanlagen, bleiben, auch bei nur auszugsweiser Verwertung, vorbehalten. Eine Vervielfältigung dieses Werkes oder von Teilen dieses Werkes ist auch im Einzelfall nur in den Grenzen der gesetzlichen Bestimmungen des Urheberrechtsgesetzes der Bundesrepublik Deutschland vom 9.
September 1965 in der jeweils geltenden Fassung zulässig. Sie ist grundsätzlich vergütungspflichtig.
Zuwiderhandlungen unterliegen den Strafbestimmungen des Urheberrechtsgesetzes.
Die Wiedergabe von Gebrauchsnamen, Handelsnamen, Warenbezeichnungen usw. in diesem Werk berechtigt auch ohne besondere Kennzeichnung nicht zu der Annahme, dass solche Namen im Sinne der Warenzeichen- und Markenschutz-Gesetzgebung als frei zu betrachten wären und daher von jedermann benutzt werden dürfen.
Sollte in diesem Werk direkt oder indirekt auf Gesetze, Vorschriften oder Richtlinien, z.B. DIN, VDI, VDE, VGB Bezug genommen oder aus ihnen zitiert worden sein, so kann der Verlag keine Gewähr für Richtigkeit, Vollständigkeit oder Aktualität übernehmen. Es empfiehlt sich, gegebenenfalls für die eigenen Arbeiten die vollständigen Vorschriften oder Richtlinien in der jeweils gültigen Fassung hinzuzuziehen.