-}\ Methoden zur Anreicherung von Liquorzellen
Methods for Preparation of Cells from Cerebrospinal Fluid (CSF)
- ; R. lehmitz
Labor für Klinische Chemie und Liquorforschung, Nervenklinik, Universität Rostock
Zusammenfassung:
In der Übersicht werden verschiedene Verfahren der Anreiche- rung von Liquorzellen auf Objektträgern beschrieben und zytolo- gische Vergleichsuntersuchungen zur Zellausbeute und Zelldiffe- renzierung vorgestellt. Die Bedeutung, die Zellanreicherungsme- thoden und morphologische Liquorzytologie unter den aktuell möglichen Verfahren der Zellcharakterisierung für die Liquorzy- todiagnostik haben, wird diskutiert. Als optimale Liquorzellan- reicherungsmethode von den in der Übersicht dargestellten Ver- fahren wird die kombinierte Zentrifugations-Sorptionskammer- Methode eingeschätzt. Unter Einbeziehung von Polykationen-be- schichteten Objektträgern liefert sie Liquorzellpräparate mit für statistische Berechnungen ausreichender Zellzahl. Die Qualität der zytologischen Präparate ermöglicht die Zuordnung der Zel- len nach den Kriterien, die in mehreren Monographien auf der Grundlage von Sedimentkammerpräparaten beschrieben wur- den. Zelldifferenzierungsergebnisse, die sich aus dem kombi- nierten Verfahren ergeben, dürften den In-vivo-Verhältnissen am besten entsprechen. Für alle beschriebenen Techniken gilt, daß die Verwendung von Polykatipnen-beschichteten Objektträgern die Zellausbeute verbessert, ihre relativ große Variabilität aber nicht aufhebt.
Schlüsselwörter:
Liquorzytologie — Zellanreicherungsmethoden — Polykationen- beschichtete Objektträger - Vergleichsuntersuchungen Summary:
Different methods of enrichment of CSF cells on slides are des- cribed and comparative cytological findings of cell recovery and cell differentiation are presented. The diagnostic importance of slide preparation techniques with respect to morphological cyto- logy of CSF cells is discussed. The two step centrifugation-sorp- tion chambertechnique givesthe best results concerning cell re- covery and cell differentiation. In combination with polycationic coated slides cell preparations are obtained, which enab'le stati- sfically sufficient evaluation. The quality of these cell prepara- tions allows cell differentiation according to the criteria docu- mented in recent monographs of CSF cytology. The results of cell differentiation are regarded to be closest to the in vivo Situa- tion. The cell recovery is improved by use of polycationic slides in all enrichment techniques described, but the relatively high variability of cell recovery iiTnbt reduced by polycationic slides.
Cerebrospinal fluid cytology - cell preparation methods - poly- cationic coated slides - comparison of different techniques.
timieren bzw. neue zu inaugurieren, sind so alt wie die Liquorzy- tologie selbst.
Die Durchflußzytometrie löst z. Z. noch nicht alle Fragen, die an die Liquorzytodiagnostjk gestellt werden. Für die Charakterisie- rung von Zellfunktionszuständen (u. a. Aktivierungsgrad) bzw.
die Suche nach diagnostisch relevanten Zellen auf der Grund- lage von Zellzyklusuntersuchungen kann ein Durchflußzytome- ter sicher viel leisten. Die Suche nach Tumorzellen (u. a. bei Leu- kämien und Lymphomen), die Diagnostik und Verlaufsbeobach- tung von Blutgungen in die Liquorräume anhand der Makropha- gentätigkeit bzw. die Differenzierung von Entzündungen ein- schließlich Therapiekontrolle sind zur Zeit noch überwiegend an die lichtmikroskopische Auswertung von Liquorzellpräparaten gebunden. Durch Vorbehandlungen der Liquorzellen für die Durchflußzytometrie (u. a. Zellverluste bei Inkubationen und Wa- schungen) ist die quantitative Aussage (relative Zellanteile) si- cher von den In-vivo-Verhältnissen entfernt, wie es bei Objektträ- gertechniken mit Zellverlust der Fall ist. Gealterte Liquorzellen (u. a. bedingt durch Transportzeiten) verändern je nach Zelltyp ihre Form bzw. Struktur. Damit sind Zellzuordnungen nach dem Streulichtprinzip (Durchflußzytometer) sicher erschwert, wäh- rend die Lichtmikroskopie in diesen Fällen noch eher zu Aussa- gen in der Lage ist. Bei allen Standardisierungsversuchen von Zellanreicherungstechniken muß immer berücksichtigt werden, daß neben den methodischen Charakteristika eine Reihe ande- rer Faktoren die quantitativen und qualitativen zytologischen Er- gebnisse beeinflussen (Tab. 1). Über die Wirkung des Liquors auf die Adhärenz sowie das Migrationsverhalten von Leukozyten wurde berichtet (17, 18).
Im folgenden werden Varianten von bereits etablierten Verfahren (Sedimentkammer), neuere Entwicklungen (Sorptionskammer) und kombinierte Methoden (Zentrifugatioh/Sorptionskammer) vorgestellt und bewertet. Zellausbeuten und Differenzierungser- gebnisse sind vergleichend dargestellt. Zusätzlich wird über die Wirksamkeit von Polykationen-beschichteten Objekträgern be- richtet und ein Test zur Verwendbarkeit von beschichteten Ob- jektträgern beschrieben.
Polykationen als Adhärenzverstärker für Zellen
Zellanreicherungsverfahren, die unter Einbeziehung von Objekt- trägern ablaufen, nutzen die Eigenschaft von Zellen, an Glas- oberflächen zu adhärieren. Mit polykationischen Substanzen (z. B. Poly-L-Lysin) beschichtete Glasoberflächen führen infolge elektrostatischer Wechselwirkungen zu einer stabileren Adhä- renz von Zellen (19-23). Auch für die Liquorzellpräparation sind Polykationen (Poly-L-Lysin) eingesetzt worden (24, 25). Aller- dings sind die Zellen angereicherter Liquorproben (Zentrifuga- tion) durch störungsfreie Sedimentation aus einem „Tropfen"
Die Zytologie besitzt neben der Proteinanalytik für die Liquor- diagnostik bei neurologischen Erkrankungen einen erheblichen Stellenwert (1-5). Neben der morphologischen Charakterisie- rung der Liquorzellen auf der Grundlage zytologischer und zyto- chemischer Standardfärbeverfahren werden zunehmend mono- klonale Antikörper eingesetzt, um Subpopulationen bzw. Aktivie- rungszustände von Zellen zu charakterisieren (6-12). Prinzipiell werden zwei Wege beschritten, um Liquorzellen zu untersuchen, denn neben den Objektträgertechniken hat auch die Durchfluß- zytometrie Eingang in die Liquorzytodiagnostik gefunden (13-16). Es muß berücksichtigt werden, daß der Üquor cerebro- spinaiis eine quantitativ zellarme und für Zellen instabile Flüs- sigkeit ist. Bestrebungen, die Zellanreicherungsverfahren zu op-
Tab. 1: Einflußgrößen, die Adhärenzbereitschaft und damit Aus- beute und Qualität von Liquorzellen bei Objektträgertechniken modulieren
1. Genetisch determinierte Bereitschaft zur Adhärenz.
2. Aktivierungszustand der Zellen (Antigenstimulation).
3. Präadhärenz im Transportgefäß (Plaste, Glas).
4. Präadhärenz bei Vorzentrifugation (Plaste, Glas).
5. Vorbehandlung der Zellen (Vorfixierung).
6. Natürliches Milieu der Zellen (u. a. Proteine, Lymphokine).
7. Zusammensetzung von Zellzuchtmedium-Zusatz.
8. Methodenbedingtes artifizielles Spreading (Sediment-
• kammer).
9. Nachbehandlung der Zellen (Trocken- oder Feuchtfixierung).
10. Oberfläche der Objektträger (evtl. Polykationen-beschichtet).
41
auf Pölykationen-beschichtete Objektträger aufgebracht worden.
Ob Ladungsträger auf Objektträgern auch bei Zellanreicherungs- verfahren, die nicht durch störungsfreie Sedimentation der Zel- len charakterisiert sind (Saugkräfte in Sedimentkammer und nach Verzögerung auch in Sorptionskammer), die Zeliausbeute verbessern, war ungeklärt.
Neben Poly-L-Lysin hat sich auch Pöly-dimethyl-didHyl-ammO' niumchlorid (PDDA) für die Verbesserung der Adhärenz von Zel- len als geeignet erwiesen (26). PDDA (MG ca. 100000) ist als wäßrige Lösung eingesetzt worden (0,4-1,0 g/l). Die Beschich- tung der Objektträger erfolgt durch Einstellen in PDDA-Lösung (45 min), anschließendes Spülen mit aqua bidest (5 min) und Lufttrocknung. Über verbesserte Zellausbeuten durch Einsatz von PDDA-beschichteten Objektträgern in Zellanreicherungsver- fahren wurde berichtet (27-29).
Zu den Lagerungsmöglichkeiten von beschichteten Objektträ- gern gibt es verschiedene Angaben (staubfrei bei Raumtempera- tur, luftdicht bei -20 °C), Angaben zum Verwendungszeitraum sind nicht genau definiert (25, 26). Daher wurde ein Beschich- tungstest entwickelt zur Überprüfung der Qualität der Beschich- tung bzw. der Erhaltung der Funktionsfähigkeit nach Lagerung (30). Indikatorzellen in diesem Test sind gewaschene Humanery- throzyten, die auf PDDA-beschichteten Objektträgern zur Adhä- renz gebracht und anschließend einem Überspülstreß ausge- setzt werden (Kontrollen sind-unbeschichtete Objektträger). Das Feuchtpräparat wird anschließend hinsichtlich Morphologie und Quantität der Erythrozyten beurteilt. Erythrozyten auf beschich- teten Objektträgern behalten ihre runde Form und sind in größe- rer Zahl vorhanden, auf unbeschichteten Objektträgern überwie- gen spindelförmig ausgezogene Erythrozyten und Stechapfelfor- men. PDDA-beschichtete Objektträger dürfen nicht länger als 20.
Tage gelagert werden, da später das typische Beschichtungsbild nicht mehr nachzuweisen ist. Bei Einhaltung der experimentel- len Bedingungen sind die Ergebnisse sehr gut reproduzierbar (Details siehe 30).
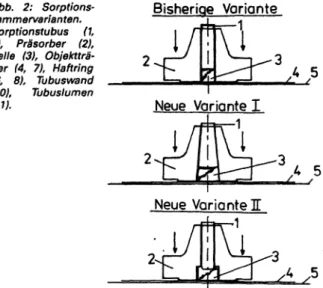
Vergleichende Untersuchungen mit der Sedimentkammer Die Liquorzellanreicherung mit der Sedimentkammer (31) hat weite Verbreitung gefunden. Den Wert der Methode belegen mehrere Monographien (1, 3, 4). Alle Modifikationen des Verfah- rens (4, 32—37) liefern qualitativ gute Liquorzellbilder, der Zell- verlust liegt jedoch in Bereichen von 60-90%. Zellverluste be- treffen vor allem die Lymphozyten (1, 4, 34, 38, 39), denen hin- sichtlich ihrer quantitativen Populationsverteilung diagnostische Relevanz zukommt. Die Hauptursache für den Zellverlust beim Sedimentkammer-Verfahren ist das Absaugprinzip über Filterpa- pier. Durch inkonstante Druckübertragung vom Hebelsystem (Modifikationen u. a. mit Schraub- oder Federverschluß) auf den zylindrischen Glastubus sind zusätzliche Zellverluste möglich, da als Folge der Zutritt des Liquors zum Filterpapier nicht stan- dardisiert ist. Mit Veränderungen der Form des Sedimentations- tubus und des oberen Gummiaufnahmeteils (Abb. 1) wird eine direkte Druckübertragung vom Gummiteil auf den Tubus ge- währleistet. Vergleichsuntersuchungen der Variante II mit dem zylindrischen Tubus belegen die Wirksamkeit der methodischen Veränderung. Variante II ergibt eine Verdopplung der Zellaus- beute (Hauptzuwachs durch Lymphozyten), allerdings werden
Figur 1 Figur 2
Abb. 1: Sedimentkammer - Gummitubus mit Glas. 1 - Sedi- mentationsröhrchen, 2 - Gummitubus; 3 - Liquor, 4 - Filterpa- pier, 5 - Objektträger. Pfeilrichtung = Druckrichtung.
42 Lab.med. 15: 42 (1991)
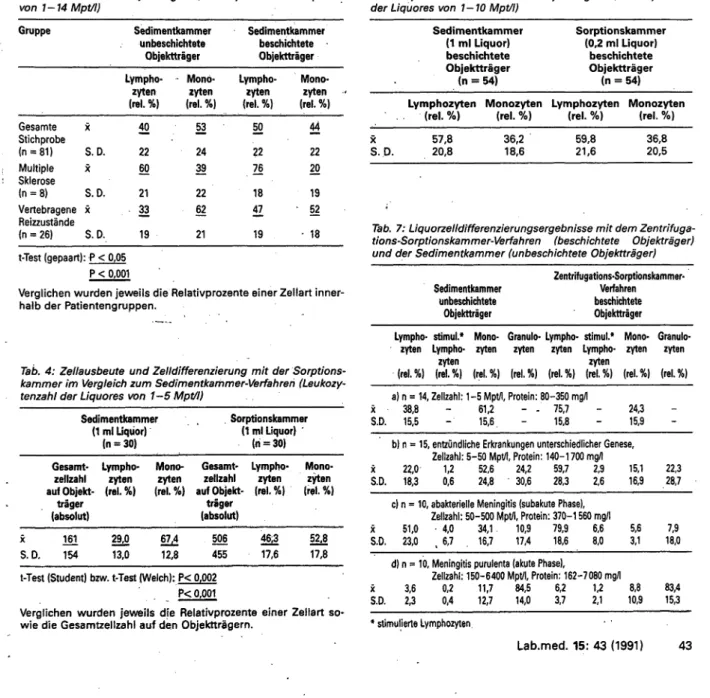
Abb. 2: Sorptions- kammervarianten.
Sorptionstubus (t 9), Präsorber (2l Zelle (3), Objektträ- ger (4, 7), Haftring (6, B), Tubuswand (10), Tubuslumen (11).
Bisherige Vorionte -1
Neue Variante!
Tab. 2: Zelldifferenzierungsergebnisse im Liquor cerebrospinalis unter Verwendung von zwei Sedimentkammer-Varianten (Leuko- zytenzahl der Liquores von 1-5 Mpt/l)
Sedimentkammer (bisherige Variante)
(n =40)
Sedimentkammer (Variante II)
(n = 40) Lymphozyten Monozyten Lymphozyten Monozyten
(rel.%) (rel. %) (rel. %) (rel. %) S.D.
34,2 21,7
61,5 24,2
42,0 23,8
53,9 25,6 t-Test (gepaart): P < 0,01
P < 0,002
Zellausbeuten von 15% nicht überschritten (36). Obwohl die Zellausbeute nur in relativ geringem Umfang erhöht wurde, un- terschieden sich die mittleren Differenzierungsergebnisse für Lymphozyten und Monozyten signifikant (Tab. 2).
Vergleichende Untersuchungen mit der Sedimentkammer unter Verwendung von Polykationen-beschichteten Objektträgern ha- ben gezeigt, daß die Polykationenbeschichtung zu einer Erhö- hung der mittleren Zellausbeute von 4,0% (kleinster Wert: 0,4%, größter Wert: 10,5%, n = 78) auf 9,5% (kleinster Wert: 1,6%, größter Wert: 34,5%, n = 78) führt und gleichzeitig die Differen- zierungsergebnisse signifikant verändert werden (27, 28). In Ta- belle 3 sind Ergebnisse zur Zelldifferenzierung dargestellt. Me- thodische und statistische Details sind den Mitteilungen zu ent- nehmen (27, 28).
Vergleichende Untersuchungen mit der Sorptionskammer Das Prinzip der Sorptionssedimentation besteht darin, daß die Porosität der Kammerwandung eines Sedimentationstubus aus saugfähigem Material (u. a. Keramik) mit Verzögerung freigege- ben wird (Abb. 2). Zeitlich begrenzter Sorptionsstop wird er- reicht durch einen festen Präsorber, mit dem die Sorptionskam- mer ausgekleidet ist, bzw. durch eine Präsorptionsflüssigkeit, die die Kammerwand partiell sättigt (38, 40, 41). Als feste Präsorber sind Polyacrylate, die bei physiologischem pH-Wert flüssigkeits- durchlässig werden, sehr gut geeignet (unveröffentlichte Ergeb- nisse). Die Präsorption mit Flüssigkeit (Zellzuchtmedien) hat sich jedoch bisher durchgesetzt (Abb. 2, Figur 2), da es technologisch · nicht gelungen ist, eine Präsorberschicht so aufzutragen, daß standardisierte Laufzeiten der Kammersysteme entstehen. Die Vorsättigung der Sorptionskammer kann sowohl von innen als auch von außen erfolgen (29, 41). Alle Sorptionskammerergeb- nisse, die in dieser Übersicht dargestellt sind, wurden mit Kam- mern erstellt, die durch Präsorptionsflüssigj<eit vorgesättigt wur- den.
Mit der Sorptionskammer erhaltene zytologische Präparate sind von guter Qualität (38, 40, 42). Vergleichende Untersuchungen ergaben, daß die Sorptionskammer gegenüber der Sediment- kammer eine höhere Zellausbeute liefert, und daß auch gleich- zeitig die Differenzierungsergebnisse beeinflußt werden (29, 38, 43). Die Zellausbeute mit der Sprptionskammer ist auf das Drei- fache gesteigert, Differenzierungsergebnisse verschieben sich signifikant zugunsten der Lymphozyten (Tab. 4),
Werden sowohl für das Sedimentkammerverfahren als auch die Sorptionskammer PDDA-beschichtete Objektträger eingesetzt, wird der Unterschied in der Zellausbeüte noch deutlicher (Tab.
5). Die beschichteten Objektträger verbessern auch die Ergeb- nisse der Sorptionskammer (Tab. 5). Bemerkenswert ist, daß die Differenzierungsergebnisse für die Sedimentkamrherpräparate im Mittel die Sorptionskammerwerte erreichen (Tab. 6). Bedingt durch die Polykationenbeschichtung führt die Erhöhung der Zell- ausbeute in der Sedimentkammer zu dieser Angleichung der Werte, was bei einer mittleren Zellausbeute von 10% nicht unbe- dingt zu erwarten war.
Tab. 5: Minlere Liquorzellausbeute (Prozent vom Wert des Wahl- ergebnisses mit der Fuchs-Rosenthal-Kammer [± 100%]) mit der Sedimentkammer und der Sorptionskammer unter Verwen- dung von PDDA-beschichteten Objektträgern (Leukozytenzahl der Liquores von 1-5 Mpt/l)
X
S.D.
R
Sedimentkammer (1 ml Liquor) beschichtete Objektträger (n = 46)
9,1 5,7 2,0/25,4
Sorptionskammer (0,2 ml Liquor) unbeschichtete Objektträger
(n = 46) 24,1 19,2 4,0/58,5
Sorptionskammer (0,2 ml Liquor)
beschichtete Objektträger (n = 46)
45,4 25,9 12,3/82,5 t-Test (Student) bzw. t-Test (Welch): P < 0,001
R: Angabe zur Variationsbreite (niedrigster Wert/höchster Wert)
Verglichen wurde die Zellausbeute (Prozent) mit der Sedimentkammer (Ob- jektträger beschichtet) und der Sorptionskammer (Objektträger beschichtet) sowie die Zellausbeute (Prozent) zwischen den Sorptionskammerwerten.
Tab. 3: Mittlere Zelldifferenzierungsergebnisse von Sediment- kammerpräparaten unter Verwendung von u n beschichteten und PDDA-beschichteten Objektträgern (Leukozytenzahl der Liquores von 1-14 Mpt/l)
Gruppe Sedimentkammer
unbeschichtete Objektträger Lympho-
zyten (rel. %) Gesamte
Stichprobe (n = 81) Multiple Sklerose (n = 8) Vertebragene Reizzustände (n = 26)
X
S.D.
S.D.
X
S.D.
40 22 60 21 33 19
- Mono- zyten (rel.%)
53 24 39 22 62 21
Sedimentkammer beschichtete - Objektträger Lympho-
zyten (rel.%)
50 22 76 18 47 19
Mono- zyten (rel. %)
44 22 20 19 ' 52
• 18 t-Test (gepaart): f_<_0,05
P < 0,001
Verglichen wurden jeweils die Relativprozente einer Zellart inner- halb der Patientengruppen.
Tab. 4: Zellausbeute und Zelldifferenzierung mit der Sorptions- kammer im Vergleich zum Sedimentkammer-Verfahren (Leukozy- tenzahl der Liquores von 1-5 Mpt/l)
Sedimentkammer (t ml Liquor)
(n = 30)
X
S.D.
Gesamt- zellzahl auf Objekt
träger (absolut)
1H 154
Lympho- zyten - (rel.%)
29,0 13,0
Mono·
zyten (rel.%)
67,4 12,8
. Sorptionskammer (1 ml Liquor) '
(n = 30) Gesamt-
zellzahl auf Objekt
träger (absolut)
506 455
Lympho- zyten - (rel.%)
46,3 17,6
Mono- zyten (rel.%)
52,8 17,8 t-Test (Student) bzw. t-Test (Welch): P< 0,002
P< 0,001
Verglichen wurden jeweils die Relativprozente einer Zellart so- wie die Gesamtzellzahl auf den Objektträgern.
Tab. 6: Mittlere Zelldifferenzierungsergebnisse von Sediment- kammer- und Sorptionskammerpräparaten unter Verwendung von Polykationen-beschichteten. Objektträgern (Leukozytenzahl der Liquores von 1-10 Mpt/l)
Sedimentkammer (1 ml Liquor) beschichtete Objektträger (n = 54)
Sorptionskammer (0,2 ml Liquor)
beschichtete Objektträger (n = 54) Lymphozyten Monozyten Lymphozyten Monozyten . (rel.%) (rel.%) (rel.%) (rel.%)
S.D. 57,8
20,8 36,2
18,6 59,8
21,6 36,8
20,5
Tab. 7: Liquorzelldifferenzierungsergebnisse mit dem Zentrifuga- tions-Sorptionskammer-Verfahren (beschichtete Objekträger) und der Sedimentkammer (u n beschichtete Objektträger)
Sedimentkammer unbeschichtete
Objektträger
Zentrifugations-Sorptionskammer- Verfahren beschichtete Objektträger Lymphe·· stimul.* Mono- Granulo- Lympho- stimul.* Mono- Granulo·
zyten Lympho· zyten zyten zyten Lympho· zyten zyten zyten zyten
(rel.%) (rel.%) (rel.%) (rel.%) (rel.%) (rel.%) (rel.%) (rel.%) a) n = 14, Zellzahl: 1-5 Mpt/l, Protein: 80-350 mg/l
38,8 - 61,2 - -' 75,7 - 24,3 S.D. 15,5 - 15,6. - 15,8 - 15,9 b) n = 15, entzündliche Erkrankungen unterschiedlicher Genese,
Zellzahl: 5-50 Mpt/i, Protein: 140-1 700 mg/l 22,0 1,2 52,6 24,2 59,7 2,9 15,1 S.D. 18,3 0,6 24,8 30,6 28,3 2,6 16,9
c) n = 10, abakterielle Meningitis (subakute Phase), Zellzahl: 50-500 Mpt/l, Protein: 370-1 560 mg/l 51,0 - 4,0 34,1 . 10,9 79,9 6,6 5,6 S.D. 23,0 % 6,7 . 16,7 17,4 18,6 8,0 3,1
d) n = 10, Meningitis purulenta (akute Phase),
Zellzahl: 150-6400 Mpt/l, Protein: 162-7080 mg/l 3,6 0,2 11,7 84,5 6,2 1,2 8,8 S.D. 2,3 0,4 12,7 14,0 3,7 2,1 10,9
22,328,7
18,07,9
83,415,3
* stimulierte Lymphozyten
Lab.med. 15:43(1991) 43
Vergleichende Untersuchungen mit dem Zentrifugations-Sorptionskammer-Verfahren
Über Liquorzellanreicherung durch Kombination von schonen- der Vorzentrifugation mit anschließender Zytozenlrifugation ist berichtet worden (44-46). Wir nutzen ein kombiniertes Verfah- ren (Zentrifugation/Sorptionskammer), um mehrere zytologi- sehe Präparate erstellen zu können (47). Der Liquor wird zu- nächst zentrifugiert (15 min, 200 x g), der zellfreie Überstand bis auf ca. 200 \ abgehoben, und anschließend erfolgt nach Zusatz von 50 Zellzuchtmedium (Zusatz von HEPES und Albumin) die Resuspendierung der Zellen. Eine vorbereitete Sorptionskam- mer (Präsorption) wird dann mit 250 Liquorzellsuspension be- schickt. Die verwendeten Objektträger sind mit PDDA beschich- tet (Details siehe 47).
Vergleichende liquorzytologische Ergebnisse (Zentrifugations- Sorptionskammer-Verfahren/Standard-Sedimentkammer-Methode mit unbeschichteten Objektträgern) aus der Klinik für Kinderheil- kunde der Universität Rostock sind in Tabelle 7 dargestellt. Die Werte des Abschnittes a zeigen, daß sich das Verhältnis von Lymphozyten zu Monozyten umkehrt. Auch die Ergebnisse in Abschnitt b und c belegen die Verschiebung (Erhöhung) der Zell- relationen zugunsten der Lymphozyten. Granulozytenwerte sind im Mittel kaum beeinflußt. Bei Liquores, deren Granulozytenan- teil größer als 70% ist, sind die Lymphozyten- und Monozyten- werte erwartungsgemäß nur wenig verändert ("Abschnitt d). Fehl- interpretationen einer Meningitis purulenta sind bedingt durch den hohen Anteil von Granulozyten nicht möglich, bei Vorliegen eines „ bunten "Zellbildes führte der Einsatz des Zentrifugations- Sorptionskammer-Verfahrens zu einer besseren Erkennung des Stadiums der Erkrankung bzw. der Therapieeinflüsse.
Weitere vergleichende Differenzierungsergebnisse aus Liquores von Erwachsenen gehen aus Tabelle 8 hervor. Sowohl für das Zentrifugations-Sorptionskammer-Verfahren als auch die Sedi- mentkammer-Methode wurden hier PDDA-beschichtete Objekt- träger genutzt. In Liquores mit normalen Zellzahlen (Abschnitt a) ergaben sich mit dem kombinierten Verfahren im Mittel signifi- kant höhere Lymphozytenwerte. Dieser Effekt ließ sich auch bei Liquores mit pathologischen Zellzahlen nachweisen, war aller- dings nicht mehr signifikant. Bedingt durch die Verwendung von PDDA-beschichteten Objektträgern auch im Sedimentkammer- Verfahren differieren die Zellrelationen zwischen beiden Metho- den nicht so stark, wie dies in der Studie mit den Kinderliquores der Fall war, in der die Sedimentkammer nach Standard (ohne Objektträgerbeschichtung) eingesetzt wurde. Die mittlere quanti- tative Zellausbeute in der Sedimentkammer (PDDA-Objektträ- ger) betrug 7,1 % (kleinster Wert: 1,5%, größter Wert: 18,1 %, n = 50). Im Zentrifugations-Sorptionskammer-Verfahren ergaben sich für den Zentrifugationsschritt eine Wiederfindungsrate (Mit- telwert) von 66,1 % (kleinster Wert: 39,1 %, größter Wert: 93,2%,
Tab. 8: Liquorzelldifferenzierungsergebnisse mit dem Zentrifuga- tions-Sorptionskammer-Verfahren (beschichtete Objektträger) und der Sedimentkammer (beschichtete Objektträger)
Sedimentkammer beschichtete Objektträger
Zentrifugations-Sorptionskammer:
Verfahren beschichtete Objektträger Lympho- stimul.* Mono- Granulo- Lympho- stimul.* Mono- Granulo-
zyten Lympho- zyten zyten zyten Lympho- zyten zyten zyten zyten
(rel.%) (rel.%) (rel.%) (rel.%) (rel.%) (rel.%) (rel.%) (rel.%) a)n = 30,Zellzahl:1-5Mpt/l
x 52.7 0,7 38,8 ' 1,2 66,4 0,2 ( 31,4 1,3 S.D. 20,9 1,2 21,3 3,8 17,8 4,3 17,8 . 3,3
b) n = 17, Zellzahl: 6-116 Mpt/l - ·
x 61,9 2,6 21,2 10,4 71,4 3,7 15,8 6,4 S.D. 23,6 4,3 16,9 · 18,1 18,5 4,2 14,1 12,4 t-Test nach Student: P < 0,01
* stimulierte Lymphozyten
n « 24), für die Zellausbeute in der Sorptionskammer ein Mittel- wert von 35,4% (kleinster Wert: 18,7%, größter Wert: 65,8%, n
= 24). Für beide methodischen Schritte zusammen läßt sich im Mittel eine Wiederfindung von ca. 25% kalkulieren. Auf den Ob- jektträgern (Sorptionskammer) war das Zellangebot im Mittel um den Faktor 7 höher (Variationsbreite: 3-15).
Das Zentrifugations-Sorptionskammer-Verfahren unter Einbezie- hung von Polykationen-beschichteten Objektträgern kann von den in der Übersicht vorgestellten Objektträgertechniken als op- timale Methode angesehen werden. Die Vorzentrifugation der Li- quorprobe (mehrere Milliliter) bedingt, daß trotz geringerer Zell- ausbeute (ca. 25%) ein höheres quantitatives Zellangebot auf den Objektträgern vorliegt als bei der Einschritt-Sorptionskam- mer-Methode (0,2-1,0 ml Liquor, ca. 35% Zellausbeute). Zelldif- ferenzierungsergebnisse, die aus dem kombinierten Verfahren resultieren, dürften den In-vivo-Verhältnissen am nähesten kom- men.
Schrifttum:
1. KÖLMEL, H. W.: Zytologie des Liquor cerebrospinalis. Weinheim; Deerfield Beach, Fl.: Edition Medizin, VCH (1986).
2. SCHMIDT, R. M.: Der Liquor cerebrospinalis: Untersuchungsmethoden und Diagno- stik. Band 1 und 2. VEB Georg Thieme, Leipzig (1987).
3. SCHMIDT, R. M.: Atlas der Liquorzytologie. Johann Ambrosius Barth, Leipzig (1978).
4. OEHMICHEN, M.: Cerebrospinal fluid cytology. An introduction and atlas. Thieme Verlag, Stuttgart (1976).
5. KULCZYCKI, J.: Atlas cytologiczny plynu mozgowo rdzeniowego. Panstwowy Zaklad Wydawnictw Lekarskich Warszawa (1988).
6. FREDRIKSON, S., KARLSSON-PARRA. A., OLSSON, T., LINK, H.: HLA-DR antigen ex- pression on T-cells from cerebrospinal fluid in multiple sclerosis and aseptic meningo- encephalitis. Clin. exp. Immunol. 68, 298-304 (1987).
7. GUSEO, A.: Rapid determination of CSF lymphocyte subsets by labeled microsphe- res. J. Neuroimmunol. 13, 117-122 (1986).
8. COAKHAM, H. B., GARSON, J. A., BROWNELL, B., ALLAN, P. M., HARPER, E. l..
Lane, F. B., KEMSHEAD, J. T: Use of monoclonal antibody panel to identify malignant cells in cerebrospinal fluid. Lancet i, 1095-1097 (1984).
9. KÖLMEL, H. W., SUDAU, C.: Cell count and ratio of helper/inducer to suppressor/cy- totoxic T-cells in the cerebrospinal fluid of patients with multiple sclerosis. J. Neurol.
236, 424-426 (1989).
10. HOHLFELD, R., BRÜSKE-HOHLFELD, L, SCHWARTZ, A., BROCKE, U.. TOYKA, K. V.:
Analyse von Oberflächenmarkern auf Liquorzellen. D t seh. med. Wschr. 109, 1760-1762 (1984).
11. POLMAN, C. H., DE GROOT, C. J. A., KOETSIER, J. C., SMINIA, T., VEERMAN, A. J. R:
Cerebrospinal fluid cells in multiple sclerosis and other neurological diseases: an im- munocytochemical study. J. Neurol. 234, 19-22 (1987).
12. PFADENHAUER, K., SCHLIMOK, G.: Leptomeningealkarzinose - neue diagnosti- sche Möglichkeiten durch Tumorzellmarkierung mit monoklonalen Antikörpern. Ner- venarzt 61, 228-230 (1990).
13. SALONEN, R., ILONEN, J., JAGERROOS, H., SYRJALA, H., NURMI, T, REUNANEN, M.: Lymphocyte subsets in the cerebrospinal fluid in active multiple sclerosis. Ann.
Neurol. 25, 500-502 (1989).
14. TOURNIER-LASSERVE, E.,· LYONCAEN, O., ROULLET, E., BACH, M. .: -2 receptor and H LA class II antigen on cerebrospinal fluid cells of patients with multiple sclerosis and other neurological diseases. Clin. exp. Immunol. 67, 581-586 (1987).
15. FREEDMAN, M. S., LOERTSCHER, R., CASHMAN, N. R., DUQUETTE, P., BLAIN, M., ANTEL, J. P.: Immunoregulatory properties of T-cell lines derived from the systemic and intrathecal compartments: a phenotypic and functional study. Ann. Neurol. 27, 258-265 (1990).
16. MIX, E., OLSSON, T., CORREALE, J., BAIG, S., KOSTULAS, V„ OLSSON, O., LINK, H.: B-cells expressing CD5 are increased in cerebrospinal fluid of patients with mul- tiple sclerosis. Clin. exp. Immunol. 79, 21-27 (1990).
17. LEHMITZ, R., GRAP, H., SCHULZE, H., ZIEGLER, K.: Der Leukozyten-Adhärenz-ln- hibitions(LAI)-Test: Vorrichtung zur Durchführung und Anwendungsmöglichkeiten.
Z. med. Lab.diagn. 23, 49-54 (1982).
18. MEYER-RIENECKER, H. J., LEHMITZ, R., JENSSEN, H. L: Lymphokine-like factors in cerebrospinal fluid: occurrence of,LIF and MSF in multiple sclerosis and chronic me- ningoencephalitis. Allergie u. Immunol. 29, 31 -40 (1983).
19. MAZIA, D., SCHATTEN, G., SÄLE, W.: Adhesion of cells to surfaces coated with po-.
lylysine. Applications to electron microscopy. J. Cell. Biol. 66, 198-200 (1975).
20. SANDERS, S. K., ALEXANDER, E. L, BRAYLAN, R. C.: A high-yield technique for preparing cells fixed in Suspension for scanning electron microscopy. J. Cell Biol. 67, 476-480 (1975).
21. TSUTSUI, K., KUMON, H., ICHIKAWA. H., TAWARA, J.: Preparative method for sus- pended biological materials for SEM by using of polycationic substance layer. J. Elec- tron Microsc. 25, 163-168 (1976).
22. BROSS, K. J., PANGALIS. G.'A., STAATZ, C. G., BLUME, K. G.: Demonstration of cell surface antigens and their antibodies by the peroxidase-antiperoxidase method.
Transplantation 25, 331 -334 (1978).
23. WATTS, K. C., HUSAIN, O. A. N., TUCKER, J. H., STARK, M., EASON, R, SHIPPEY, G., RÜTOVITZ, D., FROST, G. T. B.: The use of cationic polyelectrolytes the prepara- tion of cell monolayers for automated cell scanning and diagnostic cytopathology.
Analyt. Quant. Cytol. 6, 273-278 (1984).
24. HOHLFELD, R., SCHWENDEMANN, G., SCHWARTZ, A., BRÜSKE-HOHLFELD, l..
FAHSBENDER, A., TOYKA, K. V.: Typisierung von Liquorzellpopulationen mit monoklo- nalen Antikörpern. In: KÖLMEL, H. W. (Hrsg.) Zytologie des Liquor cerebrospinalis.
Weinheim; Deerfield Beach, FL: Edition Medizin, VCH (1986).
25. KRANZ, B. R., THIEL, E., THIERFELDER, S.: ZNS-Befall bei lymphohämopoetischen Neoplasien: Inzidenz und immunzytologischer Nachweis im Liquor. In: KÖLMEL, H. W.
(Hrsg.) Zytologie des Liquor cerebrospinalis. Weinheim; Deerfield Beach, FL: Edition Medizin, VCH (1986).
44 Lab.med. 15: 44(1991)
26. KUPPER, H., TYPLT, H., GRIMMECKE, H. D., FIEBId, H.: Objektträgertest zur im- munfluoreszenzmikroskoplschen und enzymimmunologischen Erfassung von Zell- membranantigener». Allergie u. Immunol. 29, 223-228 (1903).
27. LEHMITZ. R.: Verwendung von Polykatipnen-beschichteten Objektträgern für Zell- anreicherungsverfahren. Z. med. Lab.diagn. 28, 222-224 (1987).
28. LEHMITZ, R., MÜLLER, H.f KRETSCHMER, G.: Liquorzellähreicherung mit der Se- dimentkammer unter Verwendung von Polykationen-beschichteten Objektträgern.
Psychiat, NeuroL med. Psychol. 41, 751 -754 (1989).
29. LEHMITZ, R., JOHN, H., KRETSCHMER, G.; UquorzellanreScherung mit der Sedi- mentkammer und der Sorptionskammer unter Verwendung von Polykationen-be- schichteten Objektträgern. 2. med. Lab.diagn. 30, 403-405 (1989).
30. LEHMITZ, R.: Untersuchungen zur Verwendbarkeitsdauer von Polykationen-be- schichteten Objektträgern. Z. med. Lab.diagn. 29, 408-410 (1988),
31. SAYK, J.: Ergebnisse neuer liquor-cytologischer Untersuchungen mit dem Sedi- mentkammer-Verfahren. Ärztl. Wschr. 9. 1042-1046 (1954).
32. KLEINE, T. 0.: Neue Labormethoden für die Liquordiagnostik. Georg Thieme Verlag Stuttgart-New York (1990).
33. KÖLMEL, H. W.: Liquorzytologie. Springer-Verlag, Berlin-Heidelberg-New York (1978). .
34. BOTS. G. T A. M., WENT, L.'N., SCHABERG, A.: Results of a Sedimentation techni- que for cytology of cerebrospinal fluid. Acta Cytol. 8, 234-241 (1964).
35. KOLAR, O., ZEMAN, W.: Spinal fluid cytomorphology. Description of apparatus, technique and findings. Arch. Neurol. 18, 44-51 (1968).
36. LEHMITZ, R.: Liquorzellanreicherung mit der Sedimentkammer. Vergleichende me- thodische Untersuchungen, Psychiat. Neuroi, med. Psychol. 40, 228-231 (1988).
37. WIETHÖLTER, H., OEHMIGHEN, M., SAYER, H.: Qualitative Liquorzelldiagnostik.
Methode und Aussagekraft. Münch. med. Wschr. 121, 631-636 (1979).
38. LEHMITZ, R., SAYK, J., KRETSCHMER, G.: Zellsedimentation .mit der Sorptions- kammer. Vergleichende liquorzytologische Untersuchungen. Z. med. Labor.diagn. 22, 224-228 (1981).
39. DEN HARTOG JAGER, W. A.: Cytopathology of the cerebrospinal fluid examined with the Sedimentation technique after Sayk. J. Neurol. Sei. 9, 155-177 (1969).
40. SAYK, J., LEHMITZ, R.: Die Sorptionskammer. Eine neue Methode der spontanen Zellsedimentation. Dt. Gesundh.-Wesen 34, 2561-2565 (1979).
41. LEHMITZ, R., SAYK, J., KRETSCHMER, G.: Sorptions-Sedimentation. Ein Verfahren zur Anreicherung von Zellen. Biol. Rdsch. 17, 379-382 (1979).
42. MOUBARAK, E.: Sorptions-Sedimentation. Ein neues Verfahren zur Anreicherung von Zellen auf Objektträgern. Dissertation A, Rostock (1981).
43. OLISCHER, R. M., LEHMITZ, R., ZELE, J.: Zur Zellenanreicherung und ihren Ergeb- nissen in der Zytodiagnostik des Liquor cerebrospinalis. Dt. Gesundh.-Wesen 36, 1027-1030 (1981).
44. -WURSTER, U., STARK, E., ENGELHARDT, P.: Liquorzytologie nach kombinierter Zentrifugation und Zytozentrifugation im Vergleich zu Sedimentation und Membranfil- tration. Ärztl. Lab. 30, 184-188 (1984).
45. BEUCHE, W: Liquorzytologie. Lab.med. 11, 451-452 (1987).
46. REIBER, H.: Aktuelle Methoden der Liquoranalytik. Lab.med. 12, 101-109 (1988).
47. LEHMITZ, R.: Liquorzellanreicherung auf Objektträgern mit einem kombinierten Zentrifugatrons-Sorptionskammer-Verfahren. Z. Klin. Med. 44,1375-1376 (1989).
Anschrift des Verfassers:
Dr. rer. nat. Reinhard Lehmitz Universität Rostock Nervenklinik
Labor für Klinische Chemie und Liquorforschung Gehlsheimer Straße 20
0-2540 Rostock 40
Zellmorphologie und Zellausbeute bei einer neuen
Zytozentrifugentechnik mit gleichzeitiger Gewinnung von zellfreiem Überstand
Cytomorphology and Cell Yield in a New; Cytocentrifugal Technique.Allowing the Collection of the Cell-free Supernatant '
G. Schwarz
Hettich-Zentrifugeh, Forschungs- und Entwicklungsabteilung, Tuttlingen
Zusammenfassung:
Es wird eine neue Zytozentrifugentechnik für die Herstellung von mikroskopischen üquorzell-Präparaten vorgestellt. Mit Hilfe einer Zyto-Kammer, die eine Dichtung zwischen der Zyto-Kam- mer und dem Objektträger besitzt werden die Zellen direkt auf den Objektträger aufzentrifugiert Der zellfreie Überstand bleibt nach der Zentrifugation erhalten und kann für chemische Analy- sen benutzt werden. Die feuchte Einzelzell-Schicht wird durch eine zentrifugale Trocknung für 'die Romanowsky-Giemsa-Fär- bung präpariert. Dies .geschieht unmittelbar nach der Zellsedi- mentation und dem Entfernen des größten Teils der Überstands- flüssigkeit mittels einer Pipette. Auf diesem Weg können viele der üblichen Zellschädigungen und Trocknungsartefakte vermie- den werden. Die Zellen liegen gut ausgebreitet auf dem Objekt- träger vor. Bei niedriger Zellkonzentration fand sich eine ver- stärkte Zellausbreitung der Lymphozyten. Proben mit einer hö- heren Zellzahl ergeben meist sehr gute Präparate. Schwieriger ist es, zell· und eiweißarme Proben zu guten zytologischen Prä- paraten zu verarbeiten. In solchen Fällen hilft die Zugabe von Albumin. Diese zweistufige Methode ergibt Zellausbeuten bis zu 90%.
Schlüsselwörter:
Liquor cerebrospinalis - Zytozentrifugation - Zentrifugale Trocknung - Lympnozyten - Monozyten
Summary:
A new cytocentrifugal technique is presented for the preparation of miCroscopical slides of cerebrospinal fluid cells. With the help of a cyto-chamber having a sealing between the cyto-chamber and the slide the cells are sedimented directly onto the slide via centrifugation. The cell free supernatant is still present after the centrifugation and can be used for chemical analysis. After the Sedimentation and removing of'the most supernatant fluid by a pipette the wet cell monolayer is prepared for Romanowsky- Giemsa-staining by a drying centrifugation step. In this way many of the injurious changes of the cells and drying artefacts may be avoided. The cells are well flattened on the slide. With lo- wer cell concentration it was found an enlargement of the lym- phocytes. Samples having a higher cell count can be prepared with high quality. Some difficulties may occur with samples showing a Iow cell count and a Iow protein content. In this cases we could improve the results by the adding of albumin. This two step procedure leads to a cell yield of up to 90%.
Keywords:
Cerebrospinal fluid - cytocentrifugation - centrifugal drying - lymphocytes - monocytes
45