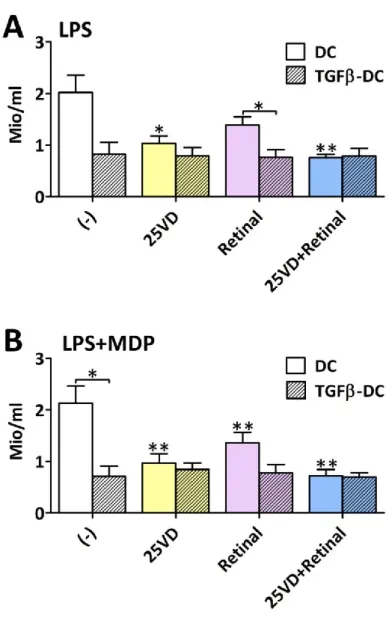
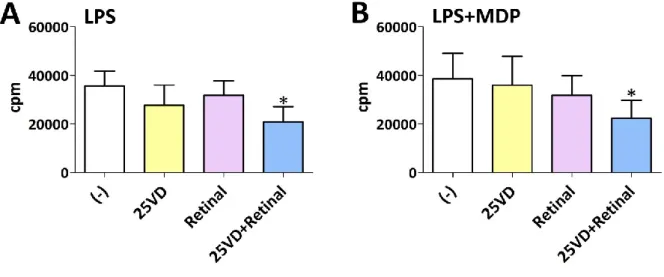
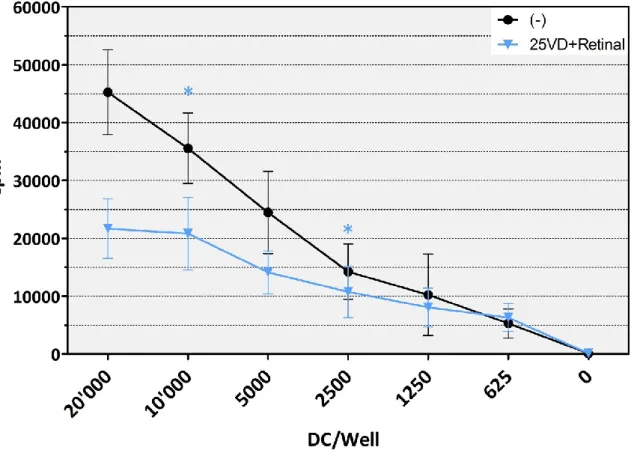
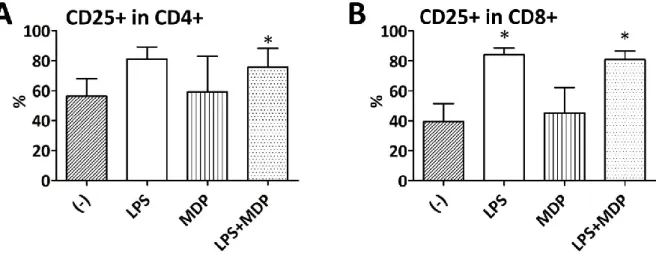
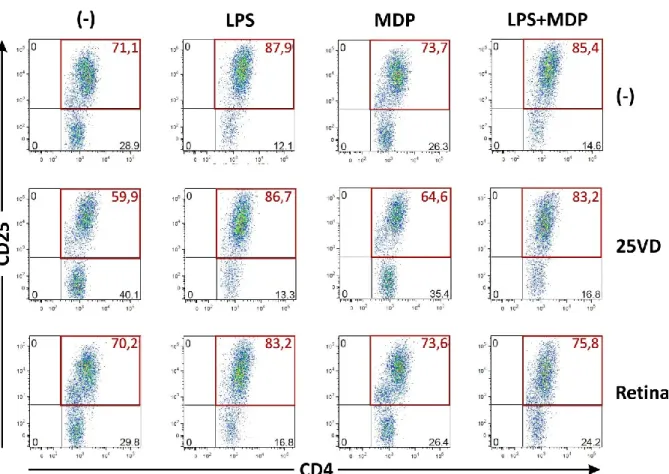
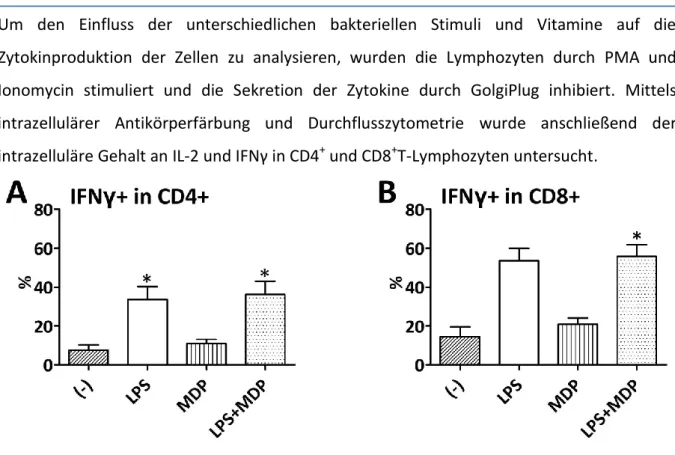
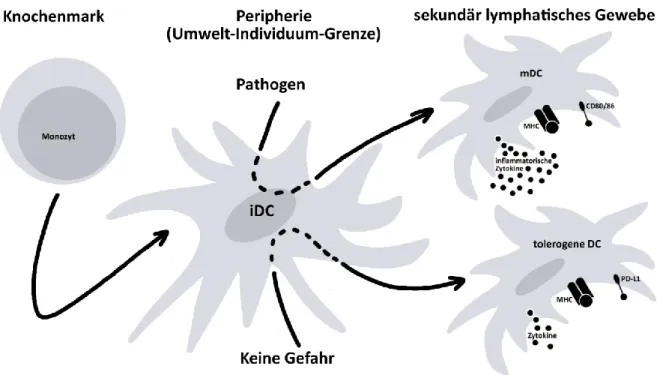
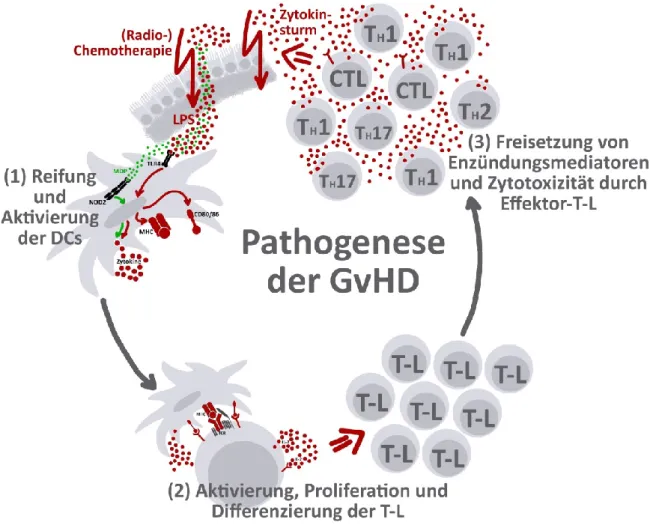
auf humane T-Zellen Einfluss von Vitamin D und Vitamin A
Volltext
Abbildung
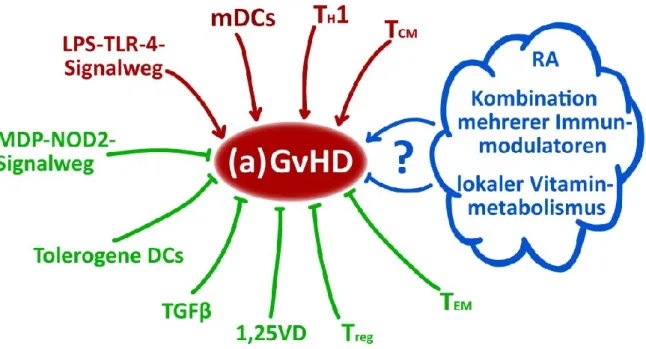
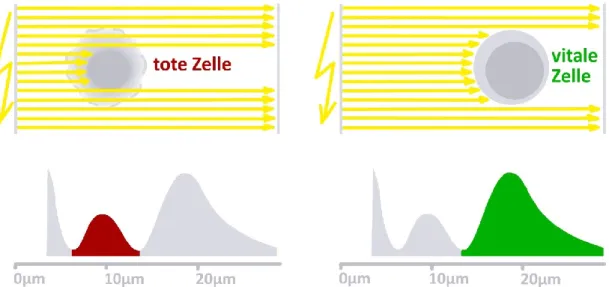
ÄHNLICHE DOKUMENTE
Vitamin D spielt eine zentrale Rolle für die Knochengesund- heit und damit für die Osteoporose-Prophylaxe.. Auch das Immunsystem profitiert von ausreichend Vitamin D, denn es
Zwischen Ende Oktober und März kann unser Körper selbst nicht ausreichend Vitamin D
Dies sollte bei der Vit D Dosisanpassung im Falle einer Unterversorgung/ Mangel berücksichtig werden, damit es zu keiner unbeabsichtigten Überdosierung kommt.. Klinisch bewährt
• Über die Ernährung oder Sonnenexposition ist eine Überdosierung nicht möglich. Multivitaminbrausetabletten) oder hochdosierten Vitamin- D-Supplementen (Tropfen); insbesondere
Laif ® 900 Balance darf nicht eingenommen werden bei bekannter Allergie gegenüber Johanniskraut oder einem der sonstigen Bestandteile?. Hinweise: Ausreichende Erfahrungen über
Eine aktuelle Untersuchung der Universität von Tel Aviv zeigt, dass bei Asthmapatienten mit einem Vi- tamin-D-Dezifit das Risiko, einen Asthmaanfall zu er- leiden, um 25 Prozent
Vielfältige Wirkungen – Es ist eine Folge der geringen Sonnenexposition: Ausgerechnet mit dem Vitamin, das streng genommen gar keines ist, weil der Körper es selbst
Entscheidend für diese Änderungen waren – wie die DGE mitteilte – Studien zur Knochengesundheit, die zeig- ten, dass das Risiko für Kno- chenbrüche und Stürze bei Senioren durch