Funktionelle Farbstoffe und Pigmente: Julia Böcher
Hinweis
Bei dieser Datei handelt es sich um eine Wissenschaftliche Hausarbeit (1.
Staatsexamensarbeit), die am Fachbereich Chemie der Philipps-Universität Marburg angefertigt wurde.
Weitere Wissenschaftliche Hausarbeiten können auf der Seite http://www.chids.de/veranstaltungen/wiss_hausarbeit.html eingesehen und heruntergeladen werden.
Zudem stehen auf der Seite www.chids.de weitere Versuche, Lernzirkel und Experimentalvortäge bereit.
Dr. Ph. Reiß, im Juli 2007
Wissenschaftliche Hausarbeit im Rahmen der Ersten Staatsprüfung
für das Lehramt an Gymnasien im Fach Chemie,
eingereicht dem Amt für Lehrerbildung
– Prüfungsstelle Marburg -
Vorgelegt von: Julia Böcher Steinweg 4
35096 Weimar/ Niederwalgern Thema: Funktionelle Farbstoffe und Pigmente Gutachter: Dr. P. Reiß
Datum: 03.09.2007
Inhaltsverzeichnis
Inhaltsverzeichnis
1. Einleitung... 1
1.1 Literatur...2
2. Die Theorie der Farbigkeit... 3
2.1 Elektromagnetische Strahlung... 3
2.1.1 Spektralfarben... 7
2.1.2 Komplementärfarben...9
2.2 Farbwahrnehmung, additive und subtraktive Farbmischung...9
2.3 Wechselwirkungen von Licht und Materie...15
2.3.1 Farbigkeit durch Absorption... 15
2.3.1.1 Farbigkeit anorganischer Verbindungen...16
2.3.1.2 Farbigkeit von delokalisierten π-Elektronensystemen...20
2.3.1.3 Farbigkeit durch Elektronen in Leitungsbändern... 30
2.3.2 Farbigkeit durch Emission...32
2.3.2.1 Fluoreszenz und Phosphoreszenz... 33
2.3.3 Farbigkeit durch Richtungsänderung des Lichts... 37
2.3.3.1 Farbigkeit durch Brechung... 37
2.3.3.2 Farbigkeit durch Streuung... 40
2.3.3.3 Farbigkeit durch Interferenz... 41
2.4 Literatur...43
3. Klassifizierung farbiger Substanzen...46
3.1 Literatur...51
4. Funktionelle Farbstoffe und Pigmente... 52
4.1 Was ist ein funktioneller Farbstoff beziehungsweise ein funktionelles Pigment?...53
4.2 Geschichte der funktionellen Farbstoffe... 53
4.3 Klassifizierung funktioneller Farbstoffe... 55
Inhaltsverzeichnis
4.3.1 Funktionelle Farbstoffe, deren Anwendung auf Lichtabsorption beruht... 55
4.3.2 Funktionelle Farbstoffe, deren Anwendung auf Lichtemission beruht...59
4.3.3 Funktionelle Farbstoffe, deren Anwendung auf lichtinduzierter Polarisation beruht. 65 4.3.4 Funktionelle Farbstoffe, deren Anwendung auf elektrischer und photoelektrischer Aktivität beruht...66
4.3.5 Funktionelle Farbstoffe, deren Anwendung auf photochemischer Aktivität beruht... 80
4.4 Literatur:...82
5. Experimenteller Teil...84
5.1 Theorie der Farbigkeit...84
5.1.1 Licht und Farbe... 84
5.1.1.1 Lichtbrechung und Spektralfarben... 84
5.1.1.2 Farbmischungen...86
5.1.1.3 Komplementärfarben... 88
5.1.2 Farbigkeit durch Absorption elektromagnetischer Strahlung... 91
5.1.2.1 Delokalisierte π-Elektronensysteme... 91
5.1.2.2 Komplexe...96
5.1.3 Farbigkeit durch Lichtemission...98
5.1.4 Farbigkeit durch Richtungsänderung des Lichts... 100
5.1.4.1 Farbigkeit durch Brechung ... 100
5.1.4.2 Farbigkeit durch Streuung... 102
5.1.4.2 Farbigkeit durch Interferenz... 105
5.2 Funktionelle Farbstoffe... 107
5.2.1 Funktionelle Farbstoffe, deren Anwendung auf Lichtabsorption beruht... 107
5.2.1.1 Solvatochromie...108
5.2.1.2 Thermochromie...114
5.2.1.3 Anthocyane als UV-Schutzpigmente...119
5.2.2 Funktionelle Farbstoffe, deren Anwendung auf Lichtemission beruht...121
Inhaltsverzeichnis
5.2.2.2 Der Fluoreszenzsolarkollektor...135
5.2.3 Funktionelle Farbstoffe, deren Anwendung auf photoelektrischer Aktivität beruht143 5.2.3.1 Chlorophyll als funktioneller Farbstoff... 143
5.2.3.1 Spektrale Sensibilisierung von Silberhalogeniden ... 155
5.2.4 Funktionelle Farbstoffe, deren Anwendung auf photochemischer Aktivität beruht. 158 5.2.4.1 Farbänderung durch Photochemie... 158
5.2.4.2 Photochromie...162
5.3 Literatur...169
6. Didaktische und methodische Betrachtung... 172
6.1 Einordnung in den hessischen Lehrplan... 172
6.2 Methodik... 177
6.3 Fächerübergreifender und fächerverbindender Unterricht...180
6.4 Literatur...183
7. Versuchsvorschriften...184
Anhang... 219
Abbildungsverzeichnis...219
Tabellenverzeichnis...223
R-Sätze... 223
Kombinierte R-Sätze...226
S-Sätze... 229
Kombinierte S-Sätze... 232
Gefahrensymbole... 234
Versicherung...237
1. Einleitung
1. Einleitung
Seit jeher verwendet der Mensch farbige Substanzen für die Gestaltung seiner Umwelt. So weisen Relikte aus der Altsteinzeit darauf hin, dass schon unsere Urahnen vor über 30.000 Jahren farbige Substanzen in Form von Höhlenmalereien für künstlerische Zwecke nutzten [1]. Auch in späteren Epochen verloren die Farben nichts von ihrer Anziehungskraft. Farben galten als Statussymbole, weshalb sich beispielsweise nur Kaiser und Kardinäle mit purpurnen Textilien schmücken durften, die mit dem äußerst teuren Drüsensekret der Purpurschnecke gefärbt wurden. Allgemein stellten Farben im vorindustriellen Zeitalter ein Luxusprodukt dar, da nur natürliche Ressourcen für die Gewinnung von farbigen Substanzen zur Verfügung standen. Erst Mitte des 19. Jahrhunderts gelang die erste Synthese eines synthetischen Farbstoffs. Von da an war eine stürmische Entwicklung immer neuer farbiger Substanzen zu verzeichnen. Dies hatte einen rasanten Aufschwung der farbverarbeitenden Industrie zu Folge, so weisen einige Namen bedeutender deutscher Chemiekonzerne, wie BASF (Badische Anilin- und Sodafabrik) und Hoechst (früher Farbwerke Bayer und Farbwerke Hoechst) auf diese Zeit des industriellen Aufschwungs hin [2]. Von da an war Farbe kein Luxusprodukt mehr.
Farben gehören so seit jeher zu unserem Leben, wir kleiden uns mit farbigen Textilien, essen gefärbte Lebensmitttel und nutzen sie auch sonst für eine Vielfalt ästhetischer Zwecke. Doch trotz ihrer permanenten Gegenwart haben Farben nichts von ihrer Faszination und ihrem Einfluss auf unser Gefühlsleben verloren.
Neben den farbigen Substanzen, deren Einsatz sich auf die Erfüllung ästhetischer Zwecke beschränkt, existieren jedoch auch Farbmittel, die eine wohl definierte Funktion erfüllen. Man spricht nun von funktionellen Farbstoffen und Pigmenten. Die ältesten Vertreter dieser Klasse farbiger Verbindungen sind in der Natur zu finden. Neben der Tinte des Tintenfischs, die diesen vor Fraßfeinen schützt, den Warnfarben einiger Insekten (Mimikry)
1. Einleitung
oder den leuchtenden Farben vieler Blüten, die dazu dienen, bestäubende Insekten anzulocken, ist das Chlorophyll der wohl bedeutendste natürliche funktionelle Farbstoff. Doch auch Industrie und Forschung beschäftigen sich seit einiger Zeit mit solchen funktionellen Farbmitteln.
Im Zentrum dieser Arbeit stehen, neben der Entstehung des Sinneseindrucks Farbe, solche funktionellen Farbstoffe und Pigmente. Neben der theoretischen Behandlung des Themas „Theorie der Farbigkeit“ sowie der breiten Palette von Anwendungsmöglichkeiten in Industrie und Technik soll hier vor allem die Verwendung solcher Verbindungen im Alltag sowie deren Vorkommen und Funktion in der Natur fokussiert werden. Darauf aufbauend beschäftigt sich diese Arbeit auch mit möglichen Experimenten bezüglich dieser Themen, sowie mit dem Lehrplanbezug und der realisierbaren Umsetzung im Unterricht.
Es soll betont werden, dass keine vollständige und allumfassende Behandlung des Themas Ziel dieser Arbeit ist. Vielmehr sollen anhand ausgewählter exemplarischer Themen und Versuche Anregungen geliefert werden, wie die konventionelle Behandlung des Themas „Farbstoffe“ im Unterricht durch die Integration neuer Aspekte, auch in Bezug auf die im hessischen Lehrplan geforderte Berücksichtigung anwendungsbezogener und technischer Aspekte [3], ergänzt werden kann.
1.1 Literatur
[1] N. Welsch, C. C. Liebmann. Farben. 2. Auflage. Spektrum . München 2006 (S. 11)
[2] H. Rampf, S. Schaumann-Eckel. Abiturhilfe Chemie. Organische Chemie Aufbauwissen. Band 681. Mentor. 2001 München (S. 76)
[3] http://lernarchiv.bildung.hessen.de/archiv/lehrplaene/gymnasium/
2. Die Theorie der Farbigkeit
2. Die Theorie der Farbigkeit
Erscheint uns ein Gegenstand farbig, ist dies das Resultat der Wechselwirkung von elektromagnetischer Strahlung, Materie sowie dem Auge und den reiz- verarbeitenden Vorgängen im Gehirn des Menschen. Farbigkeit entsteht erst in unserem Gehirn und ist keine Eigenschaft, die einem farbigen Gegenstand zuteil wird.
Um die Entstehung des Sinneseindrucks Farbigkeit zu verstehen, muss man sich also zunächst mit den einzelnen Komponenten beschäftigen, deren Zusammenwirken zu diesem Sinneseindruck führt.
2.1 Elektromagnetische Strahlung
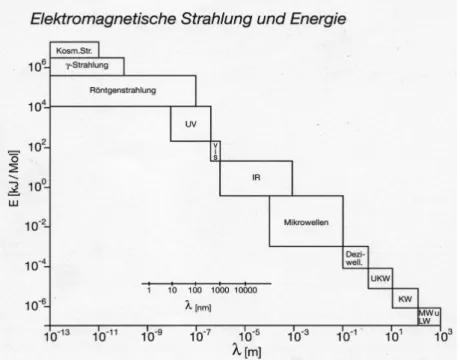
Licht ist der vom Menschen wahrnehmbare Bereich des Spektrums elektromagnetischer Strahlung. Das gesamte Spektrum der elektromagnetischen Strahlung umfasst kosmische Strahlung, γ-Strahlung, Röntgenstrahlung, UV-Strahlung, den visuellen Bereich (VIS), Infrarot- Strahlung, Mikrowellen und die Radiowellen (siehe Abb. 1).
Abbildung 1: Spektrum elektromagnetischer Strahlung (Quelle: Fonds der chemischen Industrie. Farbstoffe und Pigmente
(S. 27))
2. Die Theorie der Farbigkeit
Elektromagnetische Strahlung kann nach der klassischen Strahlungstheorie als eine sich wellenförmig ausbreitende Strahlung aufgefasst werden. Zur Charakterisierung dieser Strahlung dienen die folgenden Größen:
• Wellenlänge (λ)
• Frequenz (ν)
• Amplitude (A)
• Ausbreitungsgeschwindigkeit (Lichtgeschwindigkeit = c)
Die Wellenlänge gibt die Entfernung zwischen zwei Maxima einer Welle an (siehe Abb. 2). Die Frequenz steht in direktem Zusammenhang zur Wellenlänge elektromagnetischer Strahlung: Sie entspricht der Anzahl der Wellen, die im Zeitraum einer Sekunde einen bestimmten Ort passieren. Die SI-Einheit für die Frequenz ist das Hertz (Hz) wobei 1 Hz = 1 s-1.
Die Amplitude beschreibt die maximale Auslenkung der Wellen aus der Mittellage (siehe Abb. 2), allerdings kann sie nicht gemessen werden. Da jedoch die Intensität des Lichts, welche einen messbaren Wert darstellt, proportional zum Quadrat der Amplitude (A2) ist, kann die Amplitude der Welle berechnet werden.
Die Geschwindigkeit, mit der sich elektromagnetische Strahlung ausbreitet, wird als Lichtgeschwindigkeit (c) bezeichnet. Im Vakuum beträgt diese Ausbreitungsgeschwindigkeit für alle elektromagnetischen Wellen 2,9979 ∙ 10 8 m ∙ s -1 (cVakuum = konstant).
2. Die Theorie der Farbigkeit
Zwischen der Ausbreitungsgeschwindigkeit, der Frequenz und der Wellenlänge gilt die folgende Beziehung:
(1) c = λ ∙ ν c = Lichtgeschwindigkeit (konst.) λ = Wellenlänge
ν = Frequenz
Mit Hilfe der klassischen Strahlungstheorie werden viele Eigenschaften der elektromagnetischen Strahlung ausreichend erfasst, wie beispielsweise die Ausbreitung des Lichts, die Brechung, Beugung und Reflexion. Außerdem können Aussagen über die Intensität des Lichts gemacht werden, die in direktem Zusammenhang mit der Amplitude stehen.
Es existieren jedoch Eigenschaften der elektromagnetischen Strahlung, die sich alleine mit der klassischen Strahlungstheorie nicht erklären lassen. Für ein umfassendes Verständnis benötigt man die Quantentheorie.
Max Planck ist der Begründer der Quantentheorie, die er 1900 vorstellte. Nach dieser Theorie kann man sich elektromagnetische Strahlung nicht wie bisher als Welle, sondern als Teilchenstrom vorstellen. Diese Annahme resultiert aus der Beobachtung, dass elektromagnetische Strahlung nur in definierten Portionen aufgenommen bezeihungsweise abgegeben werden kann. Diese Energieportionen werden als Quanten bezeichnet, deren Energie in direktem Zusammenhang mit der Frequenz der Strahlung steht und durch die folgende Gleichung beschrieben wird:
(2) E = h ∙ ν E = Energie eines Quants
h = Plancksches Wirkungsquantum ν = Frequenz
Auch Einstein beschäftigte sich mit den Eigenschaften der elektromagnetischen Strahlung. Er kam zu den Ergebnissen, dass man sich Licht als Strom von
2. Die Theorie der Farbigkeit
Quanten (Photonen = Quanten im VIS-Bereich) vorstellen kann, die sich mit Lichtgeschwindigkeit bewegen, wobei die Energie eines Photons abhängig von der Lichtgeschwindigkeit und der Masse eines Photons ist:
(3) E = m ∙ c2 E = Energie eines Quants
m = Masse eines Photons
c = Lichtgeschwindigkeit (konst.)
Auf de Broglie geht schließlich die Beschreibung von allen massebehafteten Teilchen als Welle zurück. Über den Zusammenhang der Energie eines Photons (E = h ∙ ν) mit der Frequenz der Wellenlänge (ν), die sich auch durch ν = c ∙ λ -1 ausdrücken lässt, ergibt sich :
(4) E = h ∙ c ∙ λ -1
Durch Einsetzen der Einsteinschen Gleichung E = m ∙ c2 erhält man:
(5) m ∙ c2 = h ∙ c ∙ λ -1 λ = h ∙ (m ∙ c)-1
Nach de Broglie kann man nicht nur Teilchen, die sich mit Lichtgeschwindigkeit bewegen, sondern alle fliegenden Teilchen als Welle beschreiben:
(6) λ = h ∙ (m ∙ v)-1 m = Masse
v = Geschwindigkeit
Beide Theorien beschreiben verschiedene Eigenschaften der elektromagnetischen Strahlung sehr gut, jedoch ist es nicht möglich, mit einer
2. Die Theorie der Farbigkeit
erfassen. Aus diesem Grund wählt man zur Beschreibung der Strahlungseigenschaften eine der beiden Theorien aus, je nach dem welche Theorie einen bestimmten Sachverhalt besser erfasst und beschreibt. Man spricht aus diesem Grund vom Welle-Teilchen-Dualismus [1], [2], [3].
2.1.1 Spektralfarben
Für die Entstehung des Sinneseindrucks Farbe ist der sichtbare Bereich des Strahlungsspektrums (VIS) verantwortlich. Das menschliche Sehorgan nimmt elektromagnetische Strahlung zwischen 400 und 750 nm als weißes Licht wahr, welches eine Mischung verschiedener Wellenlängen (polychromatisch) darstellt. Mittels eines Prismas ist es möglich, dieses Gemisch verschiedener Wellenlängen zu trennen. Beim Eintritt des Lichts in das Prisma wird das Licht aufgrund der veränderten Ausbreitungsgeschwindigkeit im neuen Medium, gebrochen, das heißt aus seiner ursprünglichen Bahn gelenkt. Kürzere Wellenlängen werden dabei stärker gebrochen als längere Wellenlängen, was zu einer Zerlegung des Lichts in die einzelnen Wellenlängen führt (monochromatisch). Das menschliche Auge ordnet jeder dieser Wellenlängen des monochromatischen Lichts eine bestimmte Farbe zu (siehe Tabelle 1) [4].
Tabelle 1: Wellenlängen der Spektralfarben
Wellenlänge [nm] Farbe
400 - 435 violett
435 - 480 blau
480 - 490 grün-blau
490 - 500 blau-grün
500 - 560 grün
560 - 580 gelb-grün
580 - 595 gelb
595 - 605 orange
605 - 750 rot
2. Die Theorie der Farbigkeit
Die Farben, die bei der Zerlegung des Lichts in die unterschiedlichen Wellenlängen entstehen, bezeichnet man als Spektralfarben. Schon 1666 zeigt Sir Isaac Newton, dass man Licht in die Spektralfarben zerlegen kann (siehe Abb. 3). Führt man die Spektralfarben mittels einer Sammellinse wieder zusammen, entsteht erneut weißes Licht (siehe Abb. 4) [5].
Abbildung 3: Zerlegung weißen Lichts in seine Spektralfarben
(Quelle: N. Welsch, C. C. Liebmann. Farben. 2. Auflage. Spektrum . München 2006 (S. 294))
Abbildung 4: Rekombination farbigen Lichts zu weißem Licht
(Quelle: N. Welsch, C. C. Liebmann. Farben. 2. Auflage. Spektrum . München 2006 (S. 295))
2. Die Theorie der Farbigkeit 2.1.2 Komplementärfarben
Weißes Licht stellt also eine Mischung aller Wellenlängen von 400 bis 750 nm und somit eine Mischung aller empfundenen Spektralfarben dar. Nun ist es möglich, einen bestimmten Bereich dieser elektromagnetischen Strahlung auszublenden beziehungsweise zu subtrahieren. Dies erreicht man, indem man einen geeigneten Farbfilter in den Strahlengang der Spektralfarben hält und die restlichen Strahlen mittels einer Sammellinse rekombiniert. Die verbleibenden Spektralfarben addieren sich zu einer Mischfarbe. Würde man beispielsweise mit einem Filter die Spektralfarbe Rot aus dem Strahlengang entfernen, verblieben die Spektralfarben Gelb, Grün, Blau und Violett. Die restlichen Spektralfarben würden sich nach den Regeln der additiven Farbmischung (siehe 2.2) zu grünem Licht addieren. Würde man nun die grüne Farbe, die durch Mischung der einzelnen Spektralfarben entstand, mit der aus dem Strahlengang entfernten roten Spektralfarbe vereinigen, so würden sich diese beiden Farben zu weißem Licht ergänzen. Lichtfarben-Paare, die sich zu weißem Licht ergänzen, werden Ergänzungs- oder Komplementärfarben genannt. Eine absorbierte Spektralfarbe und die beobachtete Mischfarbe aus den übrigen Spektralfarben verhalten sich wie Komplementärfarben [6].
2.2 Farbwahrnehmung, additive und subtraktive Farbmischung
Es ist wichtig, zwischen der additiven und der subtraktiven Farbmischung zu unterscheiden. Um diese zwei unterschiedlichen Arten der Farbmischung zu verstehen, muss man zunächst begreifen, wie der Sinneseindruck Farbe zustande kommt.
Der Mensch ist mit verschiedenen Sinnesorganen ausgestattet. All diese Sinnesorgane sind für bestimmte Reize sensibel. Das Auge ist sensibel für elektromagnetische Strahlung im Bereich von 400 – 750 nm. Fällt Licht dieser Wellenlänge ins Innere des Auges und trifft auf die Sinneszellen, die sich in der Netzhaut befinden, so setzen diese Sinneszellen den Reiz (Licht) in neuronale Signale für das Gehirn um. Im Gehirn entsteht dann eine Helligkeits- beziehungsweise Farbempfindung. Das Auge hat zwei Typen von Rezeptoren.
2. Die Theorie der Farbigkeit
Zum einen sind das die für das Hell-Dunkel-Sehen verantwortlichen Zapfen und zum anderen die Stäbchen, die für das Farben-Sehen zuständig sind. Beide Rezeptortypen befinden sich in der Netzhaut des Auges.
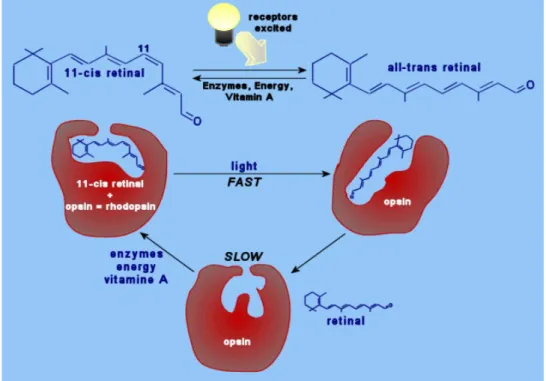
Die Stäbchen stellen die Mehrheit der Sehzellen dar. Mit 120 Millionen Stäbchen pro Auge ermöglichen uns diese, äußerst lichtempfindlichen Photorezeptoren bei extrem schwachem Licht zu sehen (skotisches Sehen oder Dämmerungssehen). Jedes Stäbchen ist mit etwa 100 Millionen Molekülen des Sehfarbstoffs Rhodopsin (Sehpurpur) ausgestattet. Es handelt sich hier um ein Farbstoffmolekül, welches mit einem Eiweiß verbunden ist (Chromoproteid).
Das eigentliche Farbstoffmolekül ist das 11-cis-Retinal. Dieses Farbstoffmolekül kann entwerder in cis- oder trans-Konfiguration vorliegen.
Das 11-cis-Retinal ist an das Protein Opsin gebunden. Trifft nun ein Photon auf das Farbstoffmolekül, so verändert das 11-cis-Retinal seine Konformation und wird zum 11-trans-Retinal. Diese Konformationsänderung hat zur Folge, dass das Protein nicht mehr an das Farbstoffmolekül binden kann, was seinerseits zur Entstehung eines Nervensignals in den angrenzenden Nervenzellen führt (siehe Abb. 5).
Abbildung 5: Isomerisierung des Rhodopsins
(Quelle:http://cas.bellarmine.edu/tietjen/HumanBioogy/Sensory/Rhodopsin.gif (05.07.07)
2. Die Theorie der Farbigkeit
Somit ist für das Sehen ein Farbstoff zuständig, der Photonen bestimmter Energie (Wellenlänge) absorbiert. Stäbchen haben ihr Absorptionsmaximum bei 500 nm (siehe Abb. 6).
Bei Tageslicht sind die Stäbchen nicht in der Lage, die Reize (Licht) zu verarbeiten, da ihr Sehfarbstoff durch die permanente Absorption von Photonen inaktiviert ist (Überreizung). Für diese Bedingungen gibt es die Zapfen. Sie ermöglichen uns das Farben-Sehen bei Tag. Aufgrund ihrer bis zu 100.000-fach geringeren Lichtempfindlichkeit arbeiten sie unter Tageslicht- Bedingungen, für die Dämmerung sind sie hingegen zu licht-unempfindlich.
Da es bei Tag an Licht nicht mangelt, existieren in einem Auge auch nur ca. 6 Millionen Zapfen.
Das Farben-Sehen wird durch drei unterschiedliche Zapfen-Typen ermöglicht.
Diese unterscheiden sich durch ihre eingelagerten Sehfarbstoffe, die Photonen unterschiedlicher Energie (Wellenlänge) absorbieren (siehe Abb. 6). Die unterschiedlichen Absorptionsmaxima gehen auf den unterschiedlichen Bau des Opsins in den verschiedenen Zapfen-Typen zurück. Man unterscheidet zwischen lang-, mittel- und kurzwellenlängensensitiven Zapfen (L-, M-, K- Zapfen) beziehungsweise zwischen Rot-, Blau- und Grün-Zapfen (R, B, G) wobei die Bezeichnungen irreführend sind, da die Blau-Zapfen eher violettes Licht absorbieren und die Rot-Zapfen eher im rot-orangenen Bereich ihr Absorptionsmaximum haben [7] .
Abbildung 6: Absorptionsspektren der Sehzellen
(Quelle: N. Welsch, C. C. Liebmann. Farben. 2. Auflage. Spektrum . München 2006 (S.241))
2. Die Theorie der Farbigkeit
Das Auge ist also nur für drei Farben empfindlich: Rot-Orange, Grün und Violett (trichromatisches Farbensehen). Wie aber ist es zu erklären, dass wir noch viele andere Farbtöne wahrnehmen können, wobei die Zahl der wahrnehmbaren Farbtöne auf 1,5 – 2 Millionen geschätzt wird[8]?
Es fällt auf, dass die Absorptionskurven der verschiedenen Sehpigmente sich stark überlappen. Durch diese Überlappung ist es möglich, dass zwei Zapfen gleichzeitig gereizt werden, was dazu führt, dass beide Zapfen ein Nervensignal senden, welche im Gehirn verrechnet werden und den Sinneseindruck einer Mischfarbe erzeugen. Durch die gleichzeitige Reizung der violett- und rot-orange-empfindlichen Zapfen entsteht der Eindruck der Farbe purpur. Gelb entstünde bei der gleichzeitigen Reizung der rot-orange- und grün-empfindlichen Photorezeptoren. Dies klingt zunächst falsch, denn wie jeder aus Erfahrung mit dem Farbmalkasten weiß, entsteht aus der Mischung der Farben Rot-Orange und Grün niemals Gelb, da Gelb eine Grundfarbe (in der Kunst) darstellt. Es muss sich also um zwei verschiedene Arten der Farbmischung handeln. Trifft farbiges Licht auf die Photorezeptoren, verrechnen diese das Gehirn nach den Regeln der additiven Farbmischung.
Dies tritt beim Mischen von farbigem Licht auf, beispielsweise wenn mit verschiedenen Projektoren unterschiedliche Farben auf eine Wand projiziert werden (siehe Abb.7). Verschiedene Lichtfarben-Paare ergänzen sich dabei zu den folgenden Farben:
Rot-Orange + Grün → Gelb Grün + Violett → Blau Violett + Rot-Orange → Rot Gelb + Violett → Weiß
Weißes Licht würden wir also bei gleichzeitiger und gleich intensiver Reizung aller drei Zapfen-Typen empfinden. Auch aus der Mischung zweier Komplementärfarben entstünde weißes Licht.
2. Die Theorie der Farbigkeit
Bei der subtraktiven Farbmischung wird ein bestimmter Teil des auftreffenden Lichtes absorbiert, dass bedeutet dieser Teil wird aus dem gesamten sichtbaren Spektrum subtrahiert. Entfernt man aus dem gesamten Spektrum des weißen Lichts eine der drei Grundfarben des Auges (Rot- Orange, Grün oder Violett), so resultieren daraus die drei Grundfarben der Kunst Gelb, Cyan und Magenta:
Weiß – Violett → Rot-Orange + Grün → Gelb Weiß – Grün → Violett + Rot-Orange → Magenta Weiß – Rot-Orange → Violett + Grün → Cyan
Abbildung 7: Additive Farbmischung
(Quelle: N. Welsch, C. C. Liebmann. Farben. 2. Auflage. Spektrum . München 2006 (S. 130))
2. Die Theorie der Farbigkeit
Werden zwei der drei Grundfarben des Auges subtrahiert, ergibt sich daraus die dritte Grundfarbe des Auges:
Weiß – Violett + Rot-Orange → Grün
Weiß – Grün + Violett → Rot-Orange Weiß – Rot-Orange + Grün → Violett
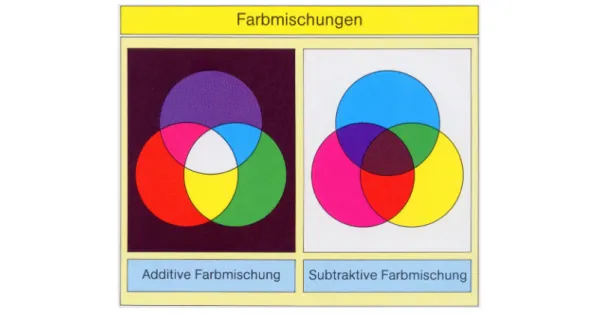
Subtraktive Farbmischung tritt also auf, wenn Strahlung durch lichtabsorbierende Stoffe verändert wird, und nur der verbleibende Teil des weißen Lichts reflektiert wird, der von den Photorezeptoren wahrgenommen werden kann. Kombiniert man die drei reinen Pigmente der Kunst (Gelb, Magenta und Cyan) absorbieren diese Farben das gesamte weiße Licht und man erhält die Farbe Schwarz (siehe Abb. 8) [9].
Abbildung 8: Farbmischungen
(Quelle: Fonds der chemischen Industrie. Folienserie Farbstoffe und Pigmente. Textheft (S. 23))
2. Die Theorie der Farbigkeit
2.3 Wechselwirkungen von Licht und Materie
Farben können durch Absorption von Licht, durch Emission von Licht sowie durch Wechselwirkung von Licht und Materie, durch Richtungsänderung des Lichts, entstehen (siehe Tabelle 2).
Tabelle 2: Wechselwirkung von Licht und Materie [10]
Wechselwirkung von Licht und Materie
Elektronentyp Absorption:
Anregung von Elektronen
Elektronen in
Übergangsmetallionen
d-d-Übergänge Charge Transfer Delokalisierte Elektronen
Elektronen in Leitungsbändern Emission:
Übergänge von angeregten Elektronen
Elektronen in angeregten Energieniveaus
Richtungsänderung des Lichts
durch Elektronen
Elektronen
in der Atomhülle Brechung Streuung Interferenz Beugung 2.3.1 Farbigkeit durch Absorption
Ein häufiger Grund für die Entstehung von Farbe ist die Absorption von Licht.
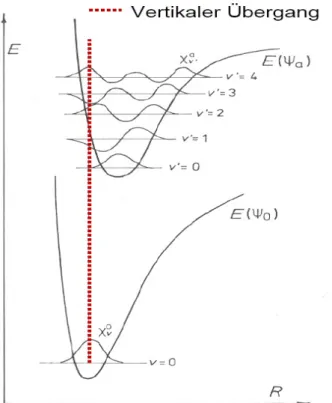
Durch die Absorption von Photonen bestimmter Energie (Wellenlänge) werden Elektronen in Molekülen oder Ionen angeregt, das heißt sie werden auf höhere Energieniveaus angehoben. Man spricht in diesem Fall von Elektronenanregung. Bei der Betrachtung von Atomen gilt, dass die Energiedifferenz zwischen dem angeregten Zustand (Ψ1) und Grundzustand (Ψ0) exakt der Energie des absorbierten Photons entspricht (siehe Abb. 9).
Abbildung 9: Energiedifferenz zwischen angeregtem und Grundzustand
(6) ΔE = Ψ1 – Ψ0 = h ∙ ν Ψ0
ΔE Ψ1
2. Die Theorie der Farbigkeit
Im Gegensatz dazu werden in Molekülen zusätzlich zur Elektronenanregung, welche sich nur mit geeigneten Bindungstheorien (MO-Theorie, Ligandenfeldtheorie) beschreiben lässt, noch Schwingung (durch IR-Strahlung) und Rotation (durch Mikrowellen) angeregt. Somit gilt:
(7) Eges. = Eelektr. + Evibr. + Erot.
Der nicht absorbierte Teil der Strahlung wird reflektiert und als Farbe wahrgenommen, wobei die wahrgenommene Farbe komplementär zur absorbierten Farbe ist. Aufgrund dessen erscheinen uns die meisten Übergangsmetall-Verbindungen (Komplexe), organische Moleküle, die über ausgedehnte delokalisierte π-Elektronensysteme verfügen, sowie Verbindungen mit Leitungsbändern farbig [11].
2.3.1.1 Farbigkeit anorganischer Verbindungen
Übergangsmetalle verfügen neben den kernnahen s- und p- Orbitalen noch über fünf d- Orbitale (Lanthanoide, Actinoide zusätzlich dazu: f-Orbitale). Die d- Orbitale bestimmen die chemischen und physikalischen Eigenschaften dieser Elemente sowie die extrem ausgeprägte Neigung, Komplexe auszubilden.
Komplexe sind meist farbige Koordinationsverbindungen, die aus einem Zentralteilchen (Übergangsmetall-Ion), welches Lücken in seiner Elektronenkonfiguration aufweist, und der Ligandenhülle (Moleküle, die über mindestens ein freies Elektronenpaar verfügen) aufgebaut sind. Ein Zentralteilchen lagert meist mehrere Liganden um sich herum, wobei das Zentralteilchen (Übergangsmetall-Ion) eine Lewis-Säure und der Ligand eine Lewisbase darstellt. Je nachdem, wie viele Bindungen vom Zentralatom zu den Liganden ausgehen, und in welcher geometrischen Anordnung sich die Liganden um das Zentralteilchen anlagern, resultiert daraus ein bestimmter Koordinationspolyeder (linearer Komplex, Tetraeder, quadratisch planarer Komplex, Oktaeder).
Um die Farbigkeit der Komplexe zu verstehen, muss man sich zunächst mit der Ligandenfeld-Theorie beschäftigen, mit der es möglich ist, Aussagen über die
2. Die Theorie der Farbigkeit
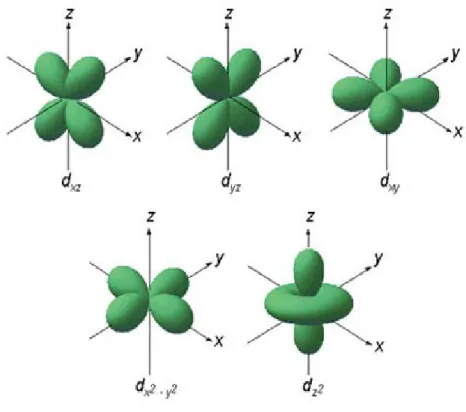
Verbindungen zu treffen. Grundlage dieser Theorie ist die Annahme, dass sich die Liganden und das Zentralteilchen elektrostatisch abstoßen. Je nachdem, über welche Raumebene die Liganden sich bei der Bildung eines Komplexes dem Zentralteilchen nähern, erfahren bestimmte d-Orbitale besonders starke Abstoßungskräfte, welche dann energetisch angehoben werden. Um dies im Detail zu begreifen, benötigt man zunächst eine Vorstellung bezüglich der Lokalisation der fünf d-Orbitale:
Bei der Bildung eines oktaedrischen Komplexes nähern sich sechs Liganden über die Raumachsen des Koordinatensystems an, wobei diejenigen d-Orbitale, welche auf den Achsen des Koordinatensystems liegen, besonders stark abgestoßen und daher in ihrer Energie angehoben werden (dx2
-y2 und dz2). Die d- Orbitale, deren Ladungsdichte sich zwischen den Liganden befindet, werden sehr viel weniger durch elektrostatische Wechselwirkung beeinflusst (dxz, dyz, dxy) und ihre Energie wird abgesenkt (siehe Abb. 11).
Abbildung 10: d-Orbitale
(Quelle: http://www.zum.de/Faecher/Materialien/beck/chemkurs /bilder/3dorb.jpg (14.06.2007))
2. Die Theorie der Farbigkeit
Die Energiedifferenz zwischen den eg- und t2g-Orbitalen wird als ΔO (O = Oktaeder) bezeichnet.
Falls die Spinpaarungsenergie nicht größer als ΔO ist, werden die d-Orbitale nach dem Pauli-Prinzip mit Elektronen besetzt, wobei ein Low-Spin-Komplex entsteht.
Läge beispielsweise ein [Ti(H2O)6] 3+- Komplex vor, müsste man ein d- Elektron in einem t2g-Orbital unterbringen. Die Elektronen, die sich in einem der t2g-Orbitale befinden, können durch Absorption elektromagnetischer Strahlung im VIS-Bereich in ein energetisch höher gelegenes eg-Orbital angeregt werden (siehe Abb. 12).
[Ti(H2O)6] 3+ weist ein Absorptionsmaximum bei der Wellenlänge 490 nm auf und absorbiert blaues und grünes Licht, weshalb uns der Komplex Rot-Violett erscheint. Aus dem Wert des Absorptionsmaximums kann die Energiedifferenz
Abbildung 12: Anregung eines Elektrons durch elektromagnetische Strahlung Abbildung 11: Aufspaltung der d-Orbitale
eg
ΔO
ΔO
ΔO = h ∙ ν d
eg
t2g
eg
t2g t2g
2. Die Theorie der Farbigkeit
Durch den Austausch von Liganden ergibt sich eine Farbänderung und somit eine Änderung von ΔO. Diese Änderung von ΔO ist ein Maß dafür, wie stark ein Ligand ist. In der spektrochemischen Reihe werden die Liganden, nach dem Grad der Aufspaltung der d-Orbitale eingereiht:
I- < Br- < Cl- < F- < OH- < C2O4-< H2O < NH3 < en < NO2- < H- < CN- [12].
Ein weiterer Grund für die Farbigkeit von Komplexen ist neben der Anregung von d-Elektronen das Auftreten von Charge-Transfer-Phänomenen. In den so genannten Charge-Transfer-Komplexen werden Elektronen durch Absorption von Photonen zwischen Liganden und Metall-Ionen übertragen, dabei unterscheidet man zwischen der Elektronenübertragung vom Liganden zum Metall-Ion (L → M), vom Metall-Ion zum Liganden (M → L) oder zwischen zwei Metall-Ionen (M → M).
L → M: Aus einem besetzten Molekülorbital des Liganden wird durch Absorption eines Photons bestimmter Wellenlänge ein Elektron in ein unbesetztes oder halb besetztes Molekülorbital des Metall-Ions angeregt. Ein Beispiel für einen solchen Komplex wäre das Rhodanit ([Fe(SCN)3(H2O)3]).
Hier geht ein nichtbindendes Elektron des Liganden in ein Molekülorbital des Eisens über. Man könnte sagen, dass Eisen(III) zu Eisen(II) reduziert wird und parallel dazu der Thiocyanat-Ligand zu einem SCN-Radikal oxidiert wird (siehe Abb. 13).
Auch die starke Farbe einer Kaliumpermanganat-Lösung beruht auf der Elektronenverschiebung vom Liganden (Sauerstoff) zum Metall-Ion (Mn(VII)).
M → L: Aus einem besetzten Molekülorbital des Zentralteilchens erfolgt durch
Abbildung 13: Elektronenübertragung im Rhodanit-Komplex
Fe OH2 H2O
H2O
S SCN
SCN
CN
Fe OH2 H2O
H2O
S SCN
SCN
CN
3+ E = hv 2+
∙
2. Die Theorie der Farbigkeit
Absorption eines Photons geeigneter Wellenlänge der Übergang eines Elektrons in ein unbesetztes Molekülorbital des Liganden. Ein Beispiel für einen solchen Charge-Transfer-Komplex wäre das Ferroin ( [Fe(phen)3]2+).
M → M: Besonders intensive Farben sind bei Komplexen zu finden, die Metall-Ionen in unterschiedlicher Oxidationsstufe enthalten, wie dies beispielsweise im Berliner Blau der Fall ist: [FeFe(CN)6]1-. Hierbei wird ein Elektron vom Eisen(II) zum Eisen(III) übertragen:
2.3.1.2 Farbigkeit von delokalisierten π-Elektronensystemen
Farbige organische Stoffe weisen ein gemeinsames Strukturmotiv auf: Sie alle verfügen über ein ausgedehntes System konjugierter Doppelbindungen. Die Größe dieses Systems steht in unmittelbarem Zusammenhang zu der Energie (Wellenlänge) des absorbierten Lichts. Anhand der Absorptionsmaxima von Polyenen (CH2-(CH=CH)n-CH2) wird deutlich, dass mit der Zahl der konjugierten Doppelbindungen die Wellenlänge des absorbierten Lichts zunimmt und somit die Energiedifferenz zwischen dem elektronischen Grundzustand und angeregtem Zustand abnehmen muss (siehe Tabelle 3).
Tabelle 3: Absoptionsmaxima von Polyenen [13]
n Absorptionsmaxima [nm]
2 225 (UV)
3 257 (UV)
4 300 (UV)
6 344 (UV)
8 386 (UV)
10 430 (violett)
12 460 (blau)
14 485 (grüngelb)
Abbildung 14: Elektronenübertragung im Berliner Blau Fe N C Fe CN
CN NC
NC
NC CN
CN CN
CN NC
Fe N C Fe CN CN
NC
NC
NC CN
CN CN
CN NC
3+ 2+ E = hv 2+ 3+
2. Die Theorie der Farbigkeit
Demnach muss ein Zusammenhang zwischen den konjugierten Doppelbindungen, welche eine hohe Delokalisation (Mesomerie) der π- Elektronen ermöglichen, und den geringeren Energiedifferenzen zwischen Grund- und angeregtem Zustand bestehen.
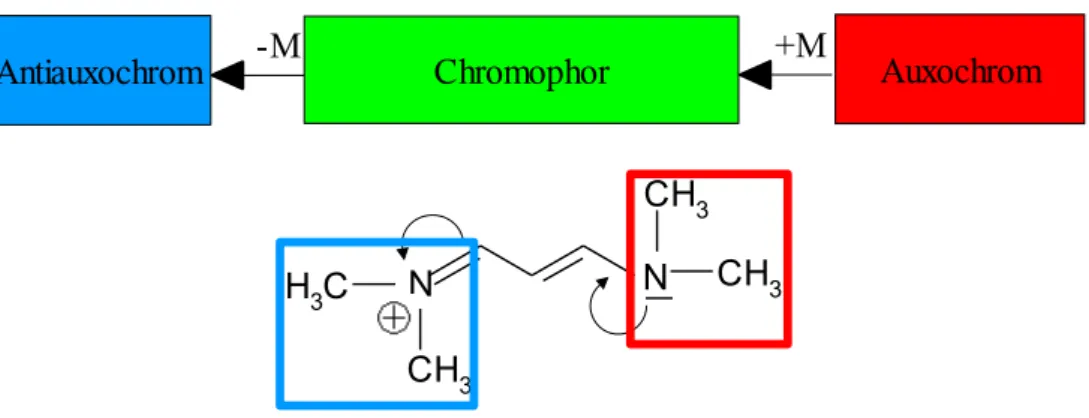
Jedoch ist nicht nur die Länge des konjugierten Doppelbindungssystems allein verantwortlich für das Absorptionsmaximum. Bestimmte funktionelle Gruppen können zu einer zusätzlichen Delokalisierung der π-Elektronen beitragen, wie dies bei den Cyaninen ((CH3)2N-(CH=CH)n-CH=N(CH3)2+ Cl-) der Fall ist (siehe Tabelle 4). Bezüglich dieses Sachverhalts stellte O. N. Witt schon 1876 seine „Theorie der chromophoren und auxochromen Gruppen“ auf. Auf Basis empirisch gewonnener Beziehungen besagt diese Theorie, dass farbige organische Verbindungen aus Chromophoren (Farbträgern) und Auxochromen (farbverstärkenden Gruppen) aufgebaut sind. Hierbei handelt es sich um funktionelle Gruppen, die das Absorptionsmaxima eines Chromophors (delokalisiertes π-Elektronensystem) in den längerwelligen Bereich verschieben (Bathochromer Effekt). Auxochrome Gruppen, wie beispielsweise -OH, -NH2, -OR,-NR2 oder -SO3H, erhöhen die Elektronendichte innerhalb des Chromophors durch einen +M-Effekt. Zusammen mit einem Auxochrom wirken antiauxochrome Gruppen, die sich durch einen -M-Effekt auszeichnen und Ladungsdichte aus dem konjugierten π-Elektronensystem ziehen, wie dies beispielsweise bei Nitrogruppen, Ammoniumgruppen und Carbonylgruppen der Fall ist. Durch das Zusammenwirken dieser beiden Gruppen resultiert eine verstärkte Delokalisierung der π-Elektronen [14].
Abbildung 15: Verstärkte Delokalisierung der π-Elektronen durch Auxochrome Gruppen in einem Cyaninmolekül
CH3 CH3 CH3
C
H3 N N
Chromophor Auxochrom
Antiauxochrom -M +M
2. Die Theorie der Farbigkeit
Tabelle 4: Absorptionsmaxima von Cyaninen [15]
n Absorptionsmaxima [nm]
2 420 (violett)
3 519 (grün)
4 620 (rot)
6 848 (IR)
Witts Farbentheorie gibt jedoch keinen Aufschluss darüber, warum konjugierte π-Elektronensysteme durch relativ energiearme elektromagnetische Strahlung angeregt werden. Um dies zu verstehen, ist es ratsam, die einfache Hückel- MO-Rechnung zu betrachten, die den Zusammenhang zwischen der Länge des konjugierten π-Elektronensystems und dem Abstand von Grund- und angeregtem Zustand liefert.
Das HMO-Modell stellt eine Vereinfachung des MO-Modells dar. Hückel, der Begründer dieses Modells, führte die folgenden Annahmen, die der Vereinfachung dienen sollen, ein:
1.) In Molekülen sind die Atome über σ-Bindungen verknüpft, diese werden von den π-Bindungen überlagert.
2.) Das π-Bindungssystem und das der σ-Bindungen beeinflussen sich nicht und werden daher als unabhängig voneinander betrachtet.
3.) Man betrachtet nur das π-Bindungssystem, welches man mit Hilfe von Mehrzentren-MOs, die man durch Linearkombination der p-AOs erhält, beschreibt. Diese erlauben den π-Elektronen freie Delokalisation über das betrachtete System [16].
Atomorbitale stellen mathematisch gesehen eine Wellenfunktion dar. Durch Quadrierung dieser Wellenfunktion erhält man die Aufenthalts- wahrscheinlichkeit eines Elektrons. Im Falle der p-AOs besitzt diese Wellenfunktion eine Knotenfläche und somit eine räumliche Orientierung, z.B.
in Richtung x-, y- oder z-Achse. Anschaulich lassen sich die p-AOs als Doppelkeulen darstellen, wobei eine Keule einen positiven und die andere Keule einen negativen Wert hat (siehe Abb. 16).
2. Die Theorie der Farbigkeit
Nun kann man durch Aneinanderfügen der zwei Atomorbitale zwei Molekülorbitale bilden. Je nachdem, ob man die beiden positiven und negativen Keulen zur Deckung bringt, entsteht ein bindendes Molekülorbital.
Bringt man jedoch jeweils die negative Keule mit der positiven Keule zur Deckung, entsteht ein antibindendes Molekülorbital mit einer Knotenebene:
Mathematisch gesehen bedeutet die Überlappung der Orbitale eine Linearkombination der AO-Wellenfunktionen:
(8) Ψn = Cnpzn + Cn+1pz(n+1)
Auch bei mehratomigen Molekülen verfährt man analog der Gleichung (siehe Abb. 18). Die Anzahl der p-AOs entspricht der Zahl gebildeter MOs. Bei einer ungeraden Zahl (n) an p-AOs entstehen je n-1 bindende und n-1 antibindende MOs sowie ein nichtbindendes MO. Je geringer bei der Kombination der AOs die Zahl der entstehenden Knotenebenen ist, desto tiefer liegt das gebildete MO auf der Energieskala.
+ -
_
x y z
Abbildung 16: p-Atomorbital
Abbildung 17: Kombination von Atomorbitalen antibindend
bindend
C C
H H H
H
1 2
2. Die Theorie der Farbigkeit
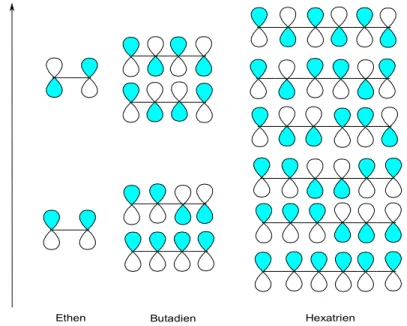
Die neu gebildeten Molekülorbitale werden nach dem Pauli-Prinzip mit π- Elektronen besetzt. Im Falle des Ethen-Moleküls gibt es zwei π- Elektronen , die auf zwei Molekülorbitale verteilt werden müssen. Daraus resultiert, dass das untere (bindende) MO mit zwei Elektronen besetzt wird und das antibindende MO demnach leer ist. Die Elektronen können von dem höchsten besetzten Molekülorbital (HOMO = highest occupied molecul orbital) in das niedrigste unbesetzten Molekülorbital (LUMO = lowest unoccupied molecul orbital) durch die Absorption Photonen geeigneter Energie angeregt werden (siehe Abb. 19).
E E
HOMO LUMO
E = h ∙ ν
Ψ1 Ψ2
Ψ2 Ψ3 Ψ4
Ψ1 Ψ2 Ψ3 Ψ4 Ψ5 Ψ6
Ψ1
Abbildung 18: Molekülorbitale von Olefinen
E
Ethen Butadien Hexatrien
Abbildung 19: Elektronenanregung durch elektromagnetische Strahlung
2. Die Theorie der Farbigkeit
Durch die Kombination mehrerer p-AOs entstehen Polyene, die über konjugierte π-Elektronensysteme verfügen, wobei mit zunehmender Anzahl von π-Bindungen der Abstand zwischen HOMO und LUMO kontinuierlich abnimmt (siehe Abb. 18). Je kleiner die Energiedifferenz zwischen HOMO und LUMO wird, desto geringer wird die benötigte Anregungsenergie. Somit ergibt sich mit zunehmender Kettenlänge linearer Polyene eine Verschiebung der absorbierten Wellenlänge in den längerwelligen Bereich. Würde man eine Linearkombination eines unendlich langen Polyens durchführen, so würde sich die Energiediffernz einem Grenzwert annähern.
Um quantitative Aussagen über die Anregungsenergie eines organischen Moleküls zu treffen, eignet sich die Behandlung eines „Teilchens im eindimensionalen Kasten“.
Betrachtet man beispielsweise einen Polymethincyanin-Farbstoff, erstreckt sich ober- und unterhalb der Ebene des Moleküls dessen π-Elektronensystem in Form einer Ladungswolke, in welcher sich die π-Elektronen annähernd frei bewegen können (siehe Abb. 20).
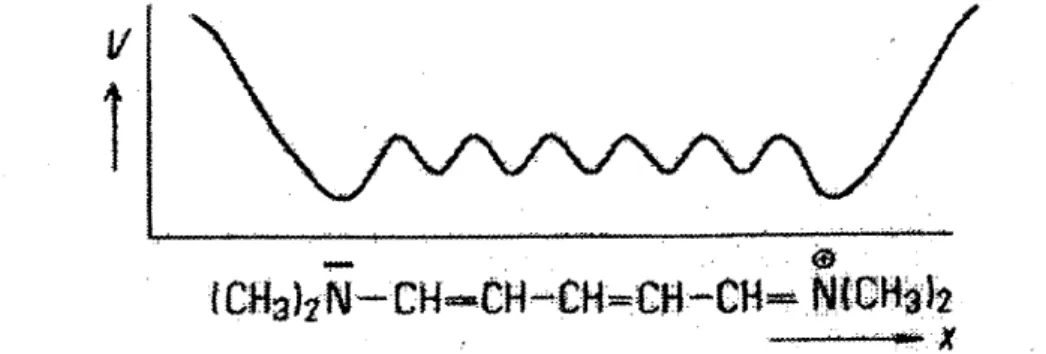
Die potentielle Energie (V) eines π-Elektrons kann man, unter Berücksichtigung der stärkeren Anziehungskräfte in der Nähe von positiv geladenen Atomrümpfen längs der Polymethinkette wie folgt darstellen:
Abbildung 20: π-Elektronenwolken im Kerngerüst eines Polymethincyaninfarbstoffs
Abbildung 21: Potentielle Energie eines Elektrons längs des Molekülgerüsts (Quelle: Skriptum: Versuchsbeschreibungen für das Praktikum Physikalische Chemie für
2. Die Theorie der Farbigkeit
Man kann den Verlauf der potentiellen Energie jedoch auch näherungsweise als einen rechteckigen Verlauf darstellen:
Hierbei nimmt man an, dass die π-Elektronen im Bereich des π- Elektronensystems frei beweglich sind. Die potentielle Energie V eines π- Elektrons kann man daher längs der Kohlenstoffkette des Moleküls als näherungsweise konstant betrachten und an den Enden des Farbstoffmoleküls muss V als unendlich angenommen werden.
Mit dem „Modell des Teilchens im Kasten“ kann man die Energieverteilung leicht beschreiben. In dieser Modellvorstellung werden die π-Elektronen als DE BROGLIE-Wellen dargestellt, die an den Enden des Kastens reflektiert werden und so durch Interferenz stehende Elektronenwellen ausbilden (siehe Abb. 23).
Abbildung 22: Vereinfachter Verlauf der potentiellen Energie V (mit L = Länge des π- Elektronensystems)
L
0 L
N CH N
N
CH CH CH CH
N CH CH CH CH N
2. Die Theorie der Farbigkeit
Die zugehörige WellenfunktionΨ längs der Koordinate x lautet:
(9) Ψ
L x Asinnπ
= n = 1,2,3,....
L = Länge des Kastens ≡ Länge des Moleküls A = Amplitudenfaktor
Der Amplitudenfaktor A ist willkürlich und sollte zweckmäßig so festgelegt werden, dass die Normierungsbedingung
(10) 1
0
2 =
∫LΨ dx
gilt. Somit ergibt sich für Ψ:
(11)
L x n L
sin π 2 ⋅
=
Ψ
Für die Wellenlänge Λ der stehenden Welle aus (11) gilt:
(12)
n L
= 2
Λ mit n = 1,2,3,...
Nach DE BROGLIE besteht zwischen der Wellenlänge und der Geschwindigkeit u eines Elektrons die Beziehung:
(13)
u m
h
= ⋅ Λ
h = Plancksches Wirkungsquantum m = Masse eines Elektrons
2. Die Theorie der Farbigkeit
Somit erhält man mit (12) und (13) für die Energie eines π-Elektrons :
(14) 2
2 2 2
8
2 n
mL V h
m u V
E = + ⋅ = + mit n = 1,2,3,...
Das Auffüllen der zur Verfügung stehenden Energieniveaus erfolgt nun nach dem PAULI-Prinzip, das heißt die Niveaus werden beim Energieärmsten beginnend mit je zwei Elektronen besetzt.
Für den längstwelligen Übergang, d.h. die Energiedifferenz zwischen dem HOMO (höchstes besetztes Orbital) und dem LUMO (niedrigstes unbesetztes Orbital), gilt:
(15) ( )
8
2 2 2 2
HOMO HOMO LUMO
LUMO n n
mL E h
E
E= − = −
∆
Die Quantenzahlen können folgendermaßen berechnet werden:
(16) nHOMO= j+1 nLUMO = j+2
j = Anzahl der konjugierten Doppelbindungen.
Somit ergibt sich aus (16) eingesetzt in (15):
(17) 8 (( 1) ( 1) ) 8 2 (2 3) 2 2
2 2
2 ⋅ + − + = ⋅ +
=
∆ j
mL j h
mL j E h
Mit Hilfe der Bohrschen-Frequenzbedingung
E = h ∙ υ; bzw.: E = h ∙ c / λ
kann nun die Wellenlänge λ des absorbierten Lichts berechnet werden:
2. Die Theorie der Farbigkeit
(18)
3 2
1 8 2
= +
= ∆
j h
c mL E
λ hc
Die Länge L des Moleküls kann ebenfalls durch Zahl j der konjugierten Doppelbindungen ausgedrückt werden, bassierend auf der Annahme, dass sich die π-Elektronen um eine Bindungslänge über die endständigen Atome in der konjugierten Kette erstrecken:
(19)
) 0
2 2
( j d
L= +
d0 = Länge einer C-C-Bindung = 140 pm
Ersetzt man nun L in (1.10) so erhält man:
(20)
3 2
) 1
32 0 ( 2
+
⋅ +
= ⋅
j j h
c λ md
Jedoch gelten diese Überlegungen nur für ein Molekül mit einer Kette gleicher Atome. Sobald eines der Atome durch ein anderes Atom ersetzt wird (beispielsweise wird ein Kohlenstoff-Atom in einer Methinkette durch ein Stickstoffatom ersetzt), ergibt sich ein anderer Verlauf für die Potentialkurve, so dass die π-Elektronen nicht mehr an jedem Ort im Molekül die gleiche Aufenthaltswahrscheinlichkeit besitzen. Somit ergibt sich auch ein kleinerer Wert für die Gesamtenergie E des Moleküls.
E wird hierbei umso kleiner sein, je größer die Antreffwahrscheinlichkeit des Elektrons im Bereich des substituierten Atoms ist.
Da die Antreffwahrscheinlichkeit proportional zum Quadrat der Wellenfunktion Ψ des Elektrons ist, hängt somit die Energieerniedrigung vom Verlauf der DE BROGLIE-Welle längs des Molekülskelettes ab.
Besitzt nun ein Molekül an der Stelle des substituierten Atoms im obersten besetzten Zustand einen Knoten der Wellenfunktion (Ψ = 0), dann wird die Energie in diesem Zustand unbeeinflusst bleiben. Besitzt dieses Molekül im
2. Die Theorie der Farbigkeit
ersten unbesetzten Zustand einen Bauch, so wird die Energie im Vergleich zu dem Molekül mit der homogenen Kette absinken. Damit wird die Anregungsenergie geringer [17].
2.3.1.3 Farbigkeit durch Elektronen in Leitungsbändern
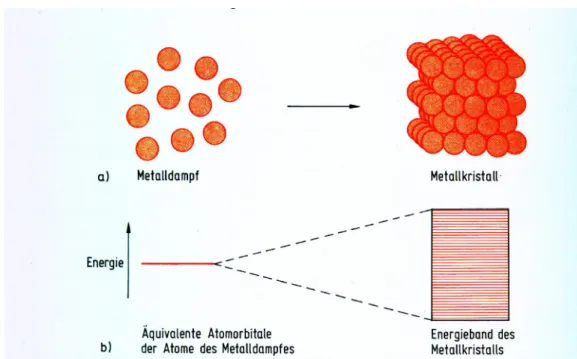
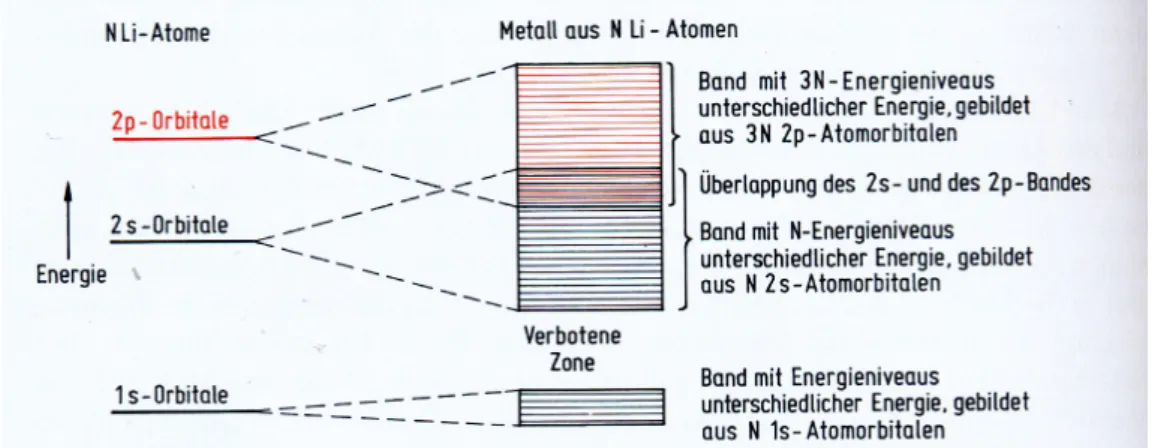
Ein weiteres Modell erklärt die Farbe bestimmter Festkörper mittels Energiebändern. Als Beispiel kann man ein Metall-Kristall betrachten: Ein solcher Metallkristall wird aus vielen einzelnen Metallatomen gebildet. Nähern sich die Metallatome eines Metallgases einander an, resultieren daraus Wechselwirkungen der entarteten Atomorbitale der Metallatome. Wie in 2.3.1.2 beschrieben kann man einzelne AOs miteinander kombinieren (Linearkombination), wobei die entstehende Zahl der Molekülorbitale der Zahl der Atomorbitale entspricht. Wird nun ein solcher Metallkristall aus 1020 Atomen gebildet, so entstehen 1020 Molekülorbitale, die sich in ihrer Energie unterscheiden, aber sehr nahe beieinander liegen, man spricht daher auch von Energiebändern (siehe Abb. 24). Diese MOs, die aus gleichen entarteten AOs gebildetet wurden, erstrecken sich über den gesamten Kristall und Elektronen, die diese MOs besetzten, sind somit über den gesamten Kristall delokalisiert.
Abbildung 24: Aufspaltung entarteter AO eines Metalldampfes bei der Bildung eines Kristallgitters
2. Die Theorie der Farbigkeit
Da jedes Metallatom über unterschiedliche AOs (1s, 2s, p) verfügt, bilden sich natürlich auch mehrere solcher Energiebänder. Diese Energiebänder können sehr nahe beieinander liegen und sich überlappen oder durch einen Energiebereich getrennt sein. Ist dies der Fall, spricht man von einer so genannten Verbotenen Zone (siehe Abb. 25).
Nach dem Pauli-Prinzip werden alle MOs, die ein Energieband bilden, mit Elektronen besetzt. Das energetisch höchste mit Elektronen besetzte Energieband wird als Valenzband bezeichnet und das energetisch niedrigste unbesetzte Energieband als Leitungsband. In Metallkristallen überlappt das Valenzband immer mit dem darüber liegenden Leitungsband. Ist das Valenzband durch eine breite Verbotene Zone vom Leitungsband getrennt, spricht man von einem Isolator. In manchen Verbindungen (Halbleiter) ist diese Verbotene Zone jedoch so schmal, dass Elektronen aus dem Valenzband in das Leitungsband durch Energiezufuhr (Lichtabsorption) angeregt werden können, weshalb uns Halbleiter farbig erscheinen [18].
Abbildung 25: Energiebänder eines Lithiumkristalls
(Quelle: E. Riedel. Anorganische Chemie. 5. Auflage. De Gruyter Verlag. Berlin 2002. (S. 178))