Hinweis
Bei dieser Datei handelt es sich um ein Protokoll, das einen Vortrag im Rahmen des Chemielehramtsstudiums an der Uni Marburg referiert. Zur besseren
Durchsuchbarkeit wurde zudem eine Texterkennung durchgeführt und hinter das eingescannte Bild gelegt, so dass Copy & Paste möglich ist – aber Vorsicht, die Texterkennung wurde nicht korrigiert und ist gerade bei schlecht leserlichen Dateien mit Fehlern behaftet.
Alle mehr als 700 Protokolle (Anfang 2007) können auf der Seite
http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html eingesehen und heruntergeladen werden.
Zudem stehen auf der Seite www.chids.de weitere Versuche, Lernzirkel und Staatsexamensarbeiten bereit.
Dr. Ph. Reiß, im Juli 2007
Ubungen im Experimentalvortrag zur ·.
anorganischen Chemie
Sommersemester 1996
Vortragsthema:
Düngemittel
Referent: Jan Merle Datum: 27.07.1996
Düngemittel Inhaltsübersicht:
1. Einleitung / Definition
Versuch 1: Inhaltsstoffe von Volldüngern
2. Herstellung
Versuch 2: Simulation des Ostwaldverfahrens Versuch 3: Superphosphatdarstellung
3. Boden
Versuch 4: pH - Bestimmung nach VDLUFA Versuch 5: Phosphatbestimmung nach VDLUFA
Versuch 6: Absorptionsverhalten des Bodens gegenüber Anionen und Kationen
4. Spurennährstoffe
Versuch 7: Hydrokultur
a) mit kompletter Nährlösung b) mit N - Mangelnährlösung Versuch 8: Eisen(lIl) neben Phosphat
5. Düngemittel und Geld
Versuch 9: Zersetzung von Ammoniumnitrat
6. Anhang
7. Literaturquellen
1. EinleitungI Definition
Werden auf einem Acker jahrelang dieselben Früchte angebaut und abgeerntet, ohne daß dem Boden bestimmte für das Wachstum der Pflanze förderliche Substanzen zugeführt werden, so nimmt der Ertrag von Jahr zu Jahr ab. Dieses Phänomen wird Bodenermüdung genannt.
Schon sehr früh wurde erkannt, daß das Einarbeiten von organischen Abfällen ( Mist, Gülle, Küchenabfälle) und das Einarbeiten von Ernteabfällen (Stroh) in die abgeernteten Felder zu einer Ertragssteigerung führt.
Ein weiteres Mittel, um die Bodenfruchtbarkeit zu erhalten, ist der Fruchtwechsel ( Weiterentwicklung der Dreifelderwirtschaft [Wintersaat, Sommersaat, Brache] ).
Der erste Chemiker, der sich erfolgreich mit den Thema Bodenermüdung bzw.
Düngemittel beschäftigte, war Justus von Liebig.
Liebig veröffentlichte 1857 in "Liebiq' s Annalen der Chemie und Pharmacie" in dem Text :"Über einige Eigenschaften der Ackerkrume" die Resultate eines selbst
durchgeführten Experimentes. Liebig untersuchte, welche (Nähr-)Stoffe von Pflanzen aus dem Boden und dem darin enthaltenen Wasser aufgenommen werden. Liebig wählte zur Untersuchung die Wasserlinse (Lemna trissulea), da ihre Wurzeln nicht den Boden berühren. Pflanzen, die im Boden wurzeln, lassen sich nur mit größerem Aufwand untersuchen, da der Boden selbst ein sehr komplexes Gebilde darstellt.
Liebig faßte die Ergebnisse seiner Untersuchung in einer Tabelle zusammen:
Asche der Wasserlinse Salzrückstand des Wassers aus dem Botanischen Garten 100 Th. Getrocknete Linsen 1Liter enthält 0,415Grm.
gaben16,6Th. Asche. In IOO Salzrückstand (schwach Th. Schwach geglühter Asche geglüht). In 100 Th. der Salze sind enthalten: sind enthalten:
3,97 0,471 0,721 2,619 8,271 3,24 7,36
8,730 6,09 12,35
16,82 35,00
5.08 12,264
5.897 10,10
1.-15 13. If>
Kalk Bittererde Kochsalz Chlorkalium Kali
Natron
Eisenoxid mit Spuren von Thonerde
Phosphorsäure Schwefelsäure Kieselsäure
Liebig :11 Es fand offenbar eine Auswahl statt, die Pflanze nahm die löslichen
Mineralbestandtheile in den Verhältnissen auf, wie sie sie für ihren Lebensproceßbedurfte, und keineswegs in den Verhältnissen, in denen sie ihr von der Flüssigkeit dargeboten wurden.11
Pflanzen entziehen dem Boden während ihres Wachstums Mineralstoffe.
Um die Bodenfruchtbarkeit über lange Jahre hinweg sichern zu können, müssen die Mineralstoffe dem Boden wieder zugeführt werden. Dies kann in Form von Fäkalien und Ernterückständen geschehen. In früheren Jahrhunderten, als der größte Teil der Bevölkerung noch in der Landwirtschaft tätig war, gab es kaum Verluste an Nährstoffen, da der größte Teil der Nährstoffe dem Boden wieder zugeführt wurde.
Heutzutage arbeiten aber nur noch weniger als 5% der Bevölkerung der
Bundesrepublik Deutschland in der Landwirtschaft. Der Verlust an Mineralstoffen durch den Verkauf von pflanzlichen und tierischen Produkten muß somit wieder ausgeglichen werden.
(vgl. Folie 1)
Versuch 1: Inhaltsstoffe von Volldüngern
Bei diesem Versuch sollen die wichtigsten Inhaltsstoffe von Volldüngern
nachgewiesen werden. Die wichtigsten Inhaltsstoffe sind Kaliumverbindungen, Stickstoffverbindungen (vor allem Nitrate und Ammoniumverbindungen) und
Phosphate. Während des Vortrages wurde der Volldünger NPK 10/12/18 von Amfert verwendet.
a) Nachweis von Ammoniumverbindungen
Versuchsmaterial :
Volldünger, Kaliumhydroxidplätzchen, Spatel, Becherglas, Spritzflasche mit Wasser, Indikatorpapier.
Durchführung:
1 g Dünger werden mit 1 g Kalimhydroxidplätzchen und 1 ml ,Wasser vermischt. Es bildet sich Ammoniak, der sich am Geruch erkennen läßt oder mit feuchtem
Indikatorpapier nachgewiesen werden kann.
Reaktionsg/eichung :
NH4+(aq) + OH-(aq) +K+(aq) ~ H20 + NH3(Q)1 +K+(aq)
(Ammoniak entweicht aus stark alkalischer Lösung)
b) Kaliumnachweis
Versuchsmateria/:
Volldünger, Tiegel, 2 Pipetten, Salzsäure (konz.), Tondreieck, Dreifuß, Perchlorsäure (konz.), Demoreagenzglas, Spritzflasche mit Wasser.
Durchführung:
Eventuell vorhandene Ammoniumverbindungen werden mit konzentrierter Salzsäure mehrmals abgeraucht. Der Rückstand wird mit 20mL Wasser aufgenommen und filtriert. Das Abrauchen und das Filtrieren wurden im Vortrag aus Zeitgründen nicht demonstriert. Das Filtrat wird in ein Demoreagenzglas gegeben und mit 10mL Perchlorsäure versetzt. Es bildet sich ein feinkristalliner Niederschlag aus Kaliumperchlorat.
c) Phosphatnachweis
Versuchsmateria/:
Volldünger, 2 Bechergläser, Trichter mit Filterpapier, Spritzflasche mit Wasser, Salpetersäure (c=2mol/L), 5% i g e Ammoniummolybdatlösung.
Durchführung:
2 g Dünger werden weitestgehend in 60mL desto Wasser gelöst und filtriert. 1mL des Düngerfiltrates werden zu 20mL Salpetersäure ( c=2mol/L) gegeben und mit 10mL 5% iger Ammoniummolybdatlösung versetzt. Es bildet sich ein kräftiger gelber Niederschlag aus Ammonium - molybdato - phosphat.
Reaktionsgleichung:
12(NH4) 6Mo7024 + 7H3P0 4 + 51HN03 ~ 7(NH4)3[P(Mo1204o] +51NH4N0 3 + 36H20
Heute wissen wir, daß jede Pflanze zum Wachsen Licht, Luft, Wärme, Wasser und Mineralstoffe benötigt.
Die von Pflanzen benötigten Mineralstoffe werden unterteilt in :
a) Makronährstoffe: Stickstoff, Phosphor, Kalium, Calcium, Magnesium b) Mikronährstoffe: Schwefel, Eisen, Kupfer, Mangan, Zink, Bor, Chlor und Molybdän.
Es ist anzunehmen, daß Pflanzen noch weitere Nährstoffe benötigen. Jedoch konnte nur von den oben genannten Mineralstoffen die Notwendigkeit für das
Pflanzenwachstum nachgewiesen werden. Die Unterscheidung nach Makro- und Mikronährstoffen erfolgt nur nach der Menge der Nährstoffe, die Pflanzen benötigen.
Aus dem Chemielexikon Römpp wurde folgende Definition für Düngemittel entnommen.
Definition: In der BRD werden als Düngemittel alle Stoffe angesehen, die dazu bestimmt sind, mittelbar oder unmittelbar Nutzpflanzen zugeführt zu werden, um ihr Wachstum zu fördern oder ihren Ertrag zu erhöhen oder ihre Qualität zu verbessern.
Man teilt die Düngemittel nach ihrer Herkunft ein in Wirtschaftsdünger und Handelsdünger. Die Wirtschaftsdünger werden im Bereich des Bauernhofes gewonnen. Zu den Handelsdüngern zählt man die mineralischen, die organischen, die organisch - mineralischen Düngemittel und die Dünger mit Spurennährstoffen.
Die Mineraldünger werden umgangssprachlich als Kunstdünger bezeichnet.
Düngemittel, die Phosphor, Kalium und Stickstoff enthalten, werden umgangssprachlich als Volldünger bezeichnet.
Phosphor, Kalium und Stickstoff bilden in den meisten Böden gemessen am Bedarf die größten Mangelkomponenten. Da sie zudem zu den Makronährstoffen gehören sind sie für die Düngemittelindustrie die wichtigsten Düngemittelkomponenten.
Volldünger werden meist mit einer NPK - Formel versehen.
Bsp.: Amfert NPK 13+ 12+21
Dies bedeutet, daß der Dünger zu 13 Gew% aus Stickstoff, zu 12 Gew% aus Phosphorpentoxid und zu 21 Gew% aus Kaliumoxid besteht.
Liebig war der Erste, der erkannte, welche Stoffe die wichtigsten Düngemittelkomponenten sind. Er schrieb hierzu:
Liebig : "Die Pflanzenfruchtbarkeit wird erhöht durch Ammoniak, Alkalien und phosphorsaure Salze."
2. Herstellung
Der zweite Teil des Vortrages beschäftigt sich mit der Herstellung der für die Düngemittelindustrie in großen Mengen benötigten Kalium-, Stickstoff- und Phosphorverbindungen.
Vor 1860 wurden Kaliumverbindungen hauptsächlich aus Holzasche gewonnen. Die auf diese Weise gewonnenen Kaliumverbindungen sind jedoch viel zu teuer, um sie als Düngemittel verwenden zu können.
1856 stieß man in Staßfurt bei Magdeburg bei der Steinsalzförderung auf bitter schmeckende, für den Verzehr nicht geeignete Salze und lagerte diese auf Halden.
Mit dem Aufkommen der Mineralstofftheorie Liebigs und der Entdeckung des hohen Kaliumgehalts der Abraumsalze wurde 1857 begonnen, die Abraumsalze zu
Düngezwecken zu benutzen. Der Chemiker Frank entwickelte 1860 ein Verfahren, um Kaliumchlorid von Natriumchlorid zu trennen und somit die Qualität des
Kalidüngers zu steigern.
Vor ca. 200 Millionen Jahren gab es in Nord- und Mitteleuropa ein riesiges
Binnenmeer, das zur offenen See hin durch eine schmale Festlandsschwelle, eine Barre, abgetrennt war. Zur damaligen Zeit waren die Temperaturen in Mitteleuropa wesentlich höher und die Niederschlagsmenge geringer, so daß das Binnenmeer gelegentlich austrocknete. In der Reihenfolge ihrer Löslichkeit kristallisierten
Anhydrit, Steinsalz und schließlich Kali- und Magnesiumsalze aus. Die Salzschichten wurden mit Tonmineralien, die der Wind herbeiwehte, überdeckt. Nach erneutem Einbruch von Meerwasser wiederholte sich das oben beschriebene Geschehen mehrmals.
Zusammensetzung des Meersalzes in % :
cr 55,29
Na+ 30,59
8042- 7,69
Mg2+ 3,73
Ca2+ 1,20
K+ 1,11
C032- 0,21
B( 0,19
Die verschiedenen Kalirohsalze:
Hartsalz ( KCI, NaCI, MgS04 * H20) 8ylvinit (KCI, NaCI )
Carnalit (KCI * MgCI2 * 6H20 (Doppelsalz ))
K20 - Anteil 12 - 15%
15 - 25 0/0 10 - 120/0
Zur Aufarbeitung der Kalirohsalze werden heute drei Verfahren angewandt.
1. Das Heißlöseverfahren
Beim Heißlöseverfahren nutzt man aus, daß die Löslichkeit von Kaliumchlorid mit steigender Temperatur in Wasser zunimmt, während die Löslichkeit von
Natriumchlorid abnimmt.
2. Das Flotationsverfahren
Beim Flotationsverfahren werden die Rohsalze in eine gesättigte Salzlösung
gegeben und mit Flotationsstoffen versetzt, die sich selektiv an Kaliumchloridkristalle anlagern. In die Flotationstrübe eingeblasene Luft lagert sich an
Kaliumchloridkristalle, treibt diese an die Oberfläche, wo sie mechanisch abgestreift werden.
3. Das elektrostatische Verfahren (ESTA)
Beim E8TA - Verfahren nutzt man aus, daß unterschiedliche Kristalle sich in einen elektrischen Feld unterschiedlich stark aufladen (vgl. Folie 2).
Die Luft besteht zu 78% aus Stickstoff. Elementarer Stickstoff kann jedoch von Pflanzen nicht genutzt werden. Pflanzen können Stickstoff nur in Form von Nitrat oder in geringem Umfang auch in Form von Ammoniumverbindungen aufnehmen.
Um den Luftstickstoff für Pflanzen verfügbar zu machen, muß er chemisch gebunden werden.
Für die Düngemittelindustrie sind momentan zwei Verfahren von großer Bedeutung.
Zum einen das "Haber - Bosch - Verfahren", bei dem Ammoniak direkt aus den Elementen hergestellt wird, und zum anderen das "0stwald - Verfahren", bei dem Ammoniak zu Nitrat oxidiert wird.
Versuch 2: Simulation des Ostwald - Verfahrens
Bei diesem Versuch soll das in der Industrie angewandte Ostwald - Verfahren simuliert werden.
Versuchsmaterial :
2 Stativstangen mit Stativplatte, 1 Querstange, 3 Klemmen nach Kaufmann, 2L Becherglas, 2 Waschflaschen, 1 Sicherheitswaschflasche, 1 schwerschmelzbares Glasrohr, 3 Klemmen, Vakuumpumpe (regelbar), Ammoniaklösung (w=O,25), Platin - Rhodium - Katalysator auf Aluminiumoxid, Bunsenbrenner, Hebebühne, Feuerzeug, 8 Doppelmuffen, Essigsäure (c=2moI/L), 2 Pipetten, Reagenz nach Lunge 1+2, Demoreagenzglas. (Eine Skizze zum Aufbau befindet sich im Anhang auf Folie 5.)
Durchführung:
Der im schwerschmelzbaren Glasrohr befindliche Katalysator wird bis zur Rotglut mit dem Bunsenbrenner erhitzt. Die Vakuumpumpe wird angestellt und so reguliert, daß ein schwacher Ammoniakstrom durch die Apparatur geleitet wird. Wird nun der Bunsenbrenner ausgestellt, so glüht der Katalysator durch die bei der Reaktion
freiwerdende Wärme weiter. Nach 10 Minuten kann der Versuch beendet werden. Im Kondenswasser, das sich in der zweiten Waschflasche gebildet hat, kann mittels der Lungereaktion Nitrit leicht nachgewiesen werden.
Reaktionsgleichungen (Technik):
1. Stufe: Oxidation von Ammoniak an Platin/Rhodium Katalysator 4N H3 +502 ~ 4NO +6H20 (-904 KJ/mol)
2. Stufe: Oxidation des Stickstoffmonoxid zu Stickstoffdioxid (-114 KJ/mol)
3. Stufe: Absorption des Sickstoffdioxids in Wasser 3N02 +H20 ~ 2HN03+ NO (-73 KJ/mol)
Der bei der Simulation des Ostwald - Verfahrens nicht verbrauchte Ammoniak löst sich im Kondenswasser der zweiten Waschflasche. Dadurch erhält man ein
alkalisches Milieu. In alkalischer Lösung disproportioniert Stickstoffdioxid zu Nitrit und Nitrat.
Reaktionsgleichungen (Simulation):
NH3 + H20 H NH4+ +OH- (Lösung reagiert alkalisch) 2N02 +20H- ~ N03- + N02- + H20
Die Reaktionsgleichungen zum Nitritnachweis nach Lunge befinden sich im Anhang auf Folie 3.
Liebig schlug 1840 vor, die Wirkung des bereits unmittelbar als Düngemittel
benutzten Knochenmehls durch Behandlung mit Schwefelsäure zu erhöhen, d.h. den Anteil des löslichen Phosphats zu erhöhen. Das durch Aufschluß mit Schwefelsäure erzeugte Düngemittel ist das älteste technisch erzeugte Düngemittel.
Die ersten Produktionsstätten wurden in England errichtet. In Erdgruben wurde Knochenmehl mit Schwefelsäure übergossen und nach einigen Tagen herausgeholt.
Das so erzeugte Düngemittel hieß zunächst in England "Gerrnan Compost", da es auf Anraten eines Deutschen (Liebig) produziert wurde. Später wurde die
Bezeichnung Superphosphat üblich. Der Bedarf an Phosphat läßt sich aber nicht mit
Knochenmehl decken, deshalb wurde Knochenmehl bald durch den billigeren und in größeren Mengen vorkommenden Apatit ersetzt.
Zu Düngezwecken wird außerdem noch Thomasmehl und Rheniaphosphat eingesetzt. Auf diese beiden Phosphatdünger wird hier aber nicht weiter eingegangen.
Bei der Produktion von Superphosphat wird 60% der Weltschwefelsäureproduktion verbraucht. Dies zeigt die große wirtschaftliche Bedeutung der
Superphosphatindustrie.
Der Einsatz anderer Säuren, wie Salzsäure oder Salpetersäure, ist in der Technik nicht von Bedeutung. Jedoch wird gelegentlich Phosphorsäure eingesetzt, da das entstehende Reaktionsprodukt aus Apatit und Phosphorsäure einen P205 - Gehalt von bis zu 50% haben kann. Allerdings ist die Produktion von Phosphorsäure sehr teuer, so daß zumeist nur Schwefelsäure eingesetzt wird.
Gibt man Apatit und Schwefelsäure in einem bestimmten Verhältnis zusammen, so erhält man nach einigen Tagen ein festes Produkt, das nicht weiter aufgearbeitet werden muß.
Versuch 3: Superphosphatdarstellung
Gibt man Apatit in leicht saure Lösung, so läßt sich kein Phosphat nachweisen. Gibt man jedoch Superphosphat in leicht saure oder neutrale Lösung, so läßt sich
Phosphat nachweisen. Das in der Technik angewandte Verfahren zur Superphosphatherstellung läßt sich im Labor leicht nachahmen.
Versuchsmaterial :
1g Apatit (fein gemörsert), Mörser, Schwefelsäure(konz), Spritzflasche mit Wasser Ammoniummolybdatlösung (5% - ig), Bunsenbrenner, Feuerzeug, 3 Pipetten, Demoreagenzglasständer, 2 Demoreagenzgläser.
Durchführung:
0,4g Apatit werden im Mörser mit 10mL kozentrierter Schwefelsäure übergossen.
Nach kurzer Zeit wird 1mL der entstandenen Lösung in ein Reagenzglas mit 20mL Wasser gegeben und mit 1mL der Ammoiummolybdatlösung versetzt. Das
Reagenzglas wird in der Bunsenflamme erhitzt bis sich ein gelber Ammoniummolybdatophosphatniederschlag bildet.
In ein zweites Reagenzglas gibt man 20mL Wasser und 0,6g Apatit, 1mL konz Schwefelsäure und 1mL der Ammoniummolybdatlösung. Auch nach kräftigem Erhitzen fällt kein Niederschlag.
Reaktionen bei der Superphosphatproduktion:
1. Schritt:
CaSF(P04) 3+ 5H2S04 ==> 3H3P04 + 5CaS04 +HF (abgeschlossen nach 5 - 20 min)
2. Schritt:
CaSF(P04) 3 + 7H3P04 ==> 5Ca(H2P04) 2+ HF
- Phosphatnachweis (vgl. Versuch 1)
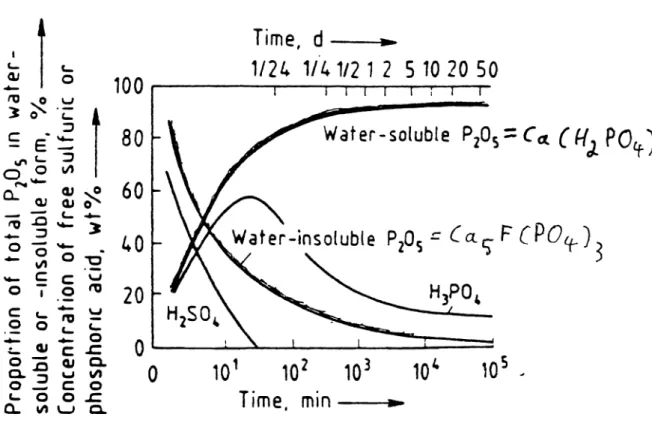
Ein Zeitdiagramm der bei der Superhosphatherstellung ablaufenden Reaktionen befindet sich im Anhang auf Folie4.
3. Boden
Boden ist Gemenge aus Ton, Schluff, Sand, Steinen, Kalk und Humus.
Pflanzennährstoffe werden aufgrund ihrer elektrischen Ladung an die Ton- und Humusteilchen angelagert. Je geringer der Ton- und Humusgehalt des Bodens ist, desto geringer ist auch die Nährstoff- und Wassethaltekraft des Bodens.
Aufgrund dieser für Pflanzen so wichtigen Eigenschaft werden Böden in Artgruppen unterteilt:
Einteilung der Böden in Artgruppen
I überwiegend Sand (leicht) 11 überwiegend Lehm (mittel) 111 überwiegend Ton (schwer)
Tongehalt in 0/0 0-12
12,1 - 25 ab 25,1
Nach Bodennutzung, Bodenartgruppe und Menge an pflanzenverfügbaren Nährstoffen richtet sich die Menge an Düngemitteln, die dem Boden zugeführt werden sollten. Um einen ungefähren Richtwert für die erforderliche
Düngemittelmenge geben zu können, muß die Gehalts- bzw. Versorgungsstufe des Bodens mit den Nährstoffen festgestellt werden.
Gehaltsklasseneinteilung (bei Ackerland)
mg K20 in 100g Boden bei Artgruppe Gehaltsklasse
bzw.
Versor un sstufe A niedrig
B mittel C hoch D sehr hoch E bes. hoch
mg P20Sin 100g Boden
0-6 7 - 14 15 - 25 26 - 29 ab 40
0-4 5 - 11 12 - 20 21 - 29 ab 30
11 0-6 7 - 14 15 - 25 20 - 39 ab 40
111 0-8 9 -19 20 - 33 34 - 49 ab 50 Die Menge an pflanzenverfügbaren Nährstoffen ist aber nicht nur von der
Versorgungsstufe, sondern auch von dem pH - Wert im Boden abhängig. Boden ist ein Gemenge an Feststoffen, aber der pH - Wert ist nur für wäßrige Lösungen definiert. Daher ist es notwendig, sich auf ein einheitliches Verfahren zur pH - Wertmessung zu einigen. Im Methodenbuch der VDLUFA (Verband deutscher landwirtschaftlicher Untersuchungs- und Forschungsanstalten) gibt es folgende Methode:
Versuch 4: pH - Bestimmung nach VDLUFA
Versuchsmaterial :
10g lufttrockener Boden, Calciumchloridlösung (c=0,01), pH - Meter, Stoppuhr, Erlenmeyerkolben (1 OOmL).
Durchführung:
1Og lufttrockener Boden werden in 25mL der Calciumchloridlösung unter kräftigem Rühren aufgeschlämmt. Nach 30 Minuten wird ein zweites Mal kräftig gerührt, und nach 60 Minuten wird der pH - Wert mit dem pH - Meter gemessen.
Reaktion:
Austausch von H30 + - Ionen gegen Ca2+- Ionen an den Bodenteilchen.
Der pH - Wert im Boden wird vor allem durch den Anteil an Calciumcarbonat geregelt. Deshalb wird der pH-Wert im Boden mit der Versorgung an Kalk gleichgesetzt.
Gehaltsklasse pH - Wert bei Kalkung in dtlha CaO
bzw. Bodenartgruppe
Versorgungs -
stufe I 11 111 I 11 111
A niedrig unter 5,6 unter 6,4 unter 6,6 15 30 50
C hoch 5,6 - 6,0 6,4 - 6,8 6,6 - 7,0 10 15 15
E bes. hoch ab 6,1 ab 6,9 ab 7,1 0 0 0
Während des Vortrages wurde eine Bodenprobe von einen Acker nahe bei Cappel untersucht. Es wurde ein pH - Wert von 4,7 gemessen. Der VDLUFA schlägt in diesem Fall eine Kalkung von 30 dt/ha, berechnet als Calciumoxid, für das nächste Jahr vor, um einen für die Nutzung als Ackerland möglichst günstigen pH - Wert zu erreichen.
Bei phosphathaitigen Düngemitteln findet man oft den Ausdruck "citratlöslich", Die meisten Phosphate sind in Wasser schwer löslich. Sie werden aber von
Pflanzenwurzeln dennoch zu einem großen Teil aufgenommen, da diese arg. Säuren ausscheiden, welche die Phosphate wenigstens teilweise in lösliche Verbindungen
umwandeln. Viele Versuche haben nun gezeigt, daß diese von den Wurzeln
ausgeschiedenen Säuren der Auflösefähigkeit von 2% iger Citronensäure entspricht.
Versuch 5: Phosphatbestimmung nach VDLUFA
Prinzip: Extraktion des Nährstoffes Phosphor mit einer sauren, auf pH 4,1 gepufferten, Lösung aus Calciumacetat, Calciumlactat und Essigsäure aus lufttrockenen Böden und anschließender photometrischer Bestimmung.
(CAL - Methode nach VDLUFA)
Versuchsmaterial :
Waage, Kunststoffschüttelflasche, Magnetrührer, Trichter, Filterpapier, Bechergläser, Demoreagenzgläser, Demoreagenzglasständer, Photometer, Bodenprobe, CAL - Vorratslösung (77g Calciumlactat, 39,5g Calciumacetat, 89,5ml Eisessig in 1L Wasser), Cal - Gebrauchslösung (CAL - Vorratslösung mit Wasser 1:5 verd.),
Phosphat-Standard-Vorratslösung (3,835g Kaliumdihydrogenphospat in 1L Wasser), Phosphat-Standard-Gebrauchslösung (50ml der Vorratslösung zu 1L verdünnen), Eichstandardlösungen (0, 5, 10,...,70 mL Phosphatstandard-Gebrauchslösung mit 40mLCAL - Vorratslösung versetzen und auf 500mL auffüllen. Die Lösungen entsprechen Bodenproben mit 0, 5, 10, ..., 70 mgP 20s/1 OOg Boden.),
Ammoniummolybdatlösung (50g/L), Reduktionslösung (1,25 g Ascorbinsäure, 350mg Zinn(II)-Chlorid-Dihydrat und 50mL Salzsäure(1 Omol/L) mit Wasser zu 1OOmL auffüllen)
Durchführung:
a) Vorbereitung der Bodenprobe:
5g lufttrockener Boden in die Kunststoffschüttelflasche einfüllen mit 100mL CAL - Gebrauchslösung versetzen und 90 Minuten mit dem Magnetrührer mischen.
Anschließend filtrieren, wobei die ersten 5mL des Filtrates verworfen werden.
b) Messen:
1OmL des Bodenfitrates mit 15mL Wasser versetzen, 1mL Molybdatreagenz und 1mL Reduktionslösung zugeben und gut mischen. Nach 10 Minuten bis 24 Stunden mit dem Photometer messen. Jeweils 25mL der Eichstandardlösungen mit 1mL
Molybdatreagenz und 1mL Reduktionslösung versetzen und mit dem Photometer messen.
Aus den gewonnenen Daten kann in einem Diagramm die Extinktion gegen Phosphatgehalt aufgetragen werden (vgl. Anhang), wobei die Meßpunkte eine Gerade ergeben sollten.
(Für schulische Zwecke ist eine Colorimetrische Bestimmung ausreichend.) c) Auswertung:
Während des Vortrages wurde eine Bodenprobe von einen Acker nahe bei Cappel untersucht. Es wurde eine Extinktion von 0,46 gemessen. Mit Hilfe der zuvor gemessenen Standardeichreihe läßt sich die Phosphationenkonzentration leicht graphisch bestimmen (vgl. Anhang). Die Bodenprobe hat einen Phosphatgehalt von 18mg P20s/100g Boden. Dies entspricht der Versorgungsstufe C. Das ist der
optimale, d.h. anzustrebende Wert nach VDLUFA. Der Landwirt, der diesen Acker bebaut, sollte im nächsten Jahr die selbe Menge Phosphatdünger verwenden, die er auch in diesem Jahr zugeführt hat.
Reaktionen:
Bei der Photomertrischen Bestimmung wird die Extinktion gemessen, die durch das gebildete Molybdänblau hervorgerufen wird.
Molybdänblau (Mischoxide des 4-6 wertigen Molybdäns)
[ instabiles Molybdänblau erhält man durch Reduktion von Molybdatlösung in Schwefelsäure (w(H2S04)=0,25 bis 0,75). Ist die Konzentration der Schwefelsäure höher oder geringer, so verschwindet die Blaufärbung wieder.]
Stabiles Molybdänblau erhält man bei Anwesenheit von Phosphat:
2 Mo02 +8 Mo03 +H3P04 ~ H3P04 * (Mo02 *4 Mo03) 2
Die Versorgungsstufe des Bodens mit Nitrat oder Phosphat ist nicht von der
Bodenartgruppe abhängig. Bei Ammonium oder Kalium hingegen wird die Einteilung in Versorgungsstufen von der Bodenartgruppe abhängig gemacht.
Versuch 6: Absorptionsverhalten des Bodens gegenüber Anionen und Kationen Boden ist ein sehr guter Kationentauscher, da sowohl die Tonminerale
(Alumosilikate) als auch die Humusteilchen negativ geladen sind.
Versuchsmaterial :
2 große Trichter, 2 Faltenfilter, Stativstange mit Platte, 2 Doppelmuffen, 2 Stativringe, 4 Bechergläser (1 OOmL), 40 g lufttrockener Boden, Methylenblau, Methylorange.
Durchführung:
2 Bechergläser werden mit jeweils 40mL Wasser gefüllt. In das erste gibt man etwas Methylenblau, so daß die Lösung gut durchsichtig ist. In das zweite gibt man soviel Mehylorange, so daß die Lösung gut durchsichtig ist. Nun mischt man jeweils 20 mL der Farbstofflösung mit 20g Boden, filtriert ab und vergleicht mit der
Ausgangslösung.
Während die Methylenblau - Lösung fast vollständig entfärbt wurde, ist die Methylorange - Lösung nahezu unverändert.
Reaktion:
Austausch von Kationen an den Bodenpartikeln.
Bei Methylorange ist das farbgebende Teilchen negativ geladen(Anion), während bei Methylenblau das farbgebenbde Teilchen positiv (Kation) geladen ist. Die Strukturen von Methylenblau und Methylorange sind im Anhang auf Folie 4 abgebildet.
Sehr wichtig ist die Kenntnis dieser Bodeneigenschaft für die Stickstoffdüngung.
Zwar nehmen Pflanzen aus dem Boden im wesentlichen nur Stickstoff in Form von Nitrat auf, dennoch ist es nicht sinnvoll, mit Nitraten zu düngen, da der Boden Nitrat nur in geringem Umfang sorbiert. Zur Stickstoffversorgung des Bodens eignet sich deshalb Ammoniak viel besser, der langsam durch Bodenbakterien zu Nitrat oxidiert wird, und, somit von Pflanzen aufgenommen werden kann.
4. Spurennährstoffe
Die Böden in Deutschland bieten den Pflanzen alle Spurennährstoffe in
ausreichendem Maße an. Nur an sehr wenigen Lagen tritt ein Mangel an einigen Spurennährstoffen ein. Spurennährstoffe spielen in der Landwirtschaft also nur eine untergeordnete Rolle.
Wichtig werden die Spurennährstoffe bei der erdlosen Kultur von höheren Pflanzen, der sog. Hydrokultur. Bei Hydrokulturen muß die wäßrige Nährlösung neben den Makronährstoffen auch die Mikronährstoffe enthalten.
Knopp veröffentlichte 1865 ein Rezept für eine Nährlösung, die zumindest alle Makronährstoffe enthält. Dieses Rezept wird im wesentlichen auch heute noch
unverändert benutzt. Da im Grundwasser aber in der Regel nicht alle Mikronährstoffe in einem ausreichendem Maße vorkommen, sollten der Nährlösung noch
Spurennährstoffe zugesetzt werden. In vielen Experimenten hat sich Hoaglands A - Z - Lösung bewährt.
Nährlösung (nach Knopp 1865)
0,57gCa(N03)2,0, 14gKN03, 0, 14gKH2P04, 0, 14gMgS04 und eine Spur Eisen( 11) - Sulfat in 1 Liter Wasser.
Lösung für Spurennährstoffe (Hoaglans A - Z Lösung)
11gH3B03, 7gMnCI4* 4H20, 1gCUS04 * 5H20, 1gAI2(S04)3, 1gNiS04* 7H20,
1gCo(N03) 2 * 6H20, 1gTi02 (in Form löslicher Salze), 0,5gLiCI, 0,5gSnCI2 * 2H20,
0,5gKI, 0,5gKBr in 18 Liter Wasser. 1mL Lösung der Spurennährstoffe zu 1Liter einer üblichen Nährlösung.
Versuch 7: Hydrokultur
a) mit kompletter Nährlösung b) mit N - Mangelnährlösung
Mit diesen Versuch soll gezeigt werden, daß Pflanzen zum Leben und Wachsen nicht auf Boden angewiesen sind. Fehlt in der Nährlösung ein Nährstoff oder ist er in
zu geringem Maße vorhanden, so kommt es zu stark vermindertem Wachstum oder zum Absterben der Pflanze.
Versuchsmaterial :
Nährlösung nach Knopp und Hoaglang (Lösung a), Nährlösung nach Knopp und Hoagland, in der alle Nitrate durch Chloride ersetzt wurden, 4 Maiskeimlinge (ungefähr 10 cm groß), 4 Erlenmeyerkolben (1 OOmL), Aluminiumfolie.
Durchführung:
2 Erlenmeyerkolben werden 4cm hoch mit der kompletten Nährlösung (Lösung a), und 2 Erlenmeyerkolben mit N - Mangel - Nährlösung (Lösung b) befüllt. In jeden Erlenmeyerkolben wird eine Maispflanze gegeben und mit Aluminiumfolie befestigt.
Die Pflanzen müssen nun drei Wochen an einem sonnigen Platz stehen und regelmäßig mit den Nährlösungen gegossen werden.
Beobachtung:
Die Pflanzen mit der kompletten Nährlösung wachsen in den drei Wochen sehr rasch, während die Pflanzen mit der N - Mangel -Nährlösung nur sehr wenig wachsen und eine leichte Gelbfärbung der Blätter zeigen.
Für diesen Versuch wurden Maispflanzen ausgewählt, weil sie sehr schnell wachsen und besonders empfindlich auf N - Mangelernährung reagieren.
Versuch 8: Eisen(lIl) neben Phosphat
Versuchsmaterial :
Eisenlösung 1 (2mL Ferleaf [ein Eisendünger der Firma Lebosol] werden mit desto Wasser in einem Erlenmeyerkolben auf 80mL aufgefüllt), Eisenlösung 2 (0,7357g FeCI3 *6H20 in 80mL desto Wasser lösen), Phosphatlösung (2gK2HP04 in 60mL desto Wasser lösen), Demoreagenzglasständer, 2 Demoreagenzgläser.
[Eisenlösung 1 und Eisenlösung 2 besitzen dieselbe Konzentration an Eisenionen.]
Durchführung:
Das Demoreagenzglas 1 wird mit Eisenlösung 1 bis zur Hälfte gefüllt, und das Demoreagenzglas 2 wird mit Eisenlösung 2 bis zur Hälfte gefüllt. Zum
Demoreagenzglas 2 gibt man einige Milliliter der Phosphatlösung. Es bildet sich ein voluminöser Niederschlag. Zu Demoreagenzglas 1 gibt man langsam
Phosphatlösung zu, bis das Demoreagenzglas fast vollständig gefüllt ist. Es bildet sich kein Niederschlag.
Reaktionen:
Reagenzglas 2: Fe3+(aq) +P043
- ~ FeP04J,
Reagenzglas 1: [Fe EDTA]-+P043- ~ keine Reaktion
Im Reagenzglas 1 bildet sich kein Eisenphosphat - Niederschlag, da das Eisen durch EDTA maskiert ist. Die Struktur des EDTA - Komplexes befindet sich im Anhang auf Folie 4.
Tritt in einem Boden ein Mangel an einem Spurennährstoff auf, so muß der Nährstoff in einer löslichen, von Pflanzen aufnehmbaren Form dem Boden zugeführt werden.
So kann man Eisenmangel nur unzureichend beheben, wenn man dem Dünger Eisenchlorid zufügt, da ein großer Teil des Eisens mit dem im Boden vorhandenen oder durch Düngemittel zugeführten Phosphat schwerlösliches Eisenphosphat bildet.
Der von der Firma Lebosol angebotene Eisendünger Ferleaf enthält deshalb Eisen, das durch EDTA komplexiert worden ist. Fast alle Spurenmetalldünger enthalten die Metalle in Form von EDTA - Komplexen, da diese sehr stabil sind und von Pflanzen gut aufgenommen werden können.
5. Düngemittel und Geld
Alle Pflanzennährstoffe müssen zum Aufbau pflanzeneigener Substanzen in genügender Menge, zum richtigen Zeitpunkt, im richtigen Verhältnis, in
aufnehmbarer Form und am richtigen Ort zur Verfügung stehen. Derjenige Nährstoff, der im Verhältnis zum Bedarf in geringster Menge aufnehmbar vorhanden ist, ist entscheidend für die Höhe des Ertrages. Dieser Sachverhalt ist auch bekannt unter dem Namen: Gesetz vom Minimum.
Dieses Gesetz wird oft veranschaulicht durch die Minimumtonne (vgl. Folie 6).
Durch einen beliebig großen Mehraufwand an Düngemitteln kann aber der Ertrag nicht beliebig gesteigert werden. In Extremfällen kann die Ertragszunahme sogar negativ sein(vgl. Folie7 oben).
Der Mehrertrag selbst ist für den Landwirt aber nicht entscheidend. Im allgemeinen ist der Landwirt mehr daran interessiert, den höchsten Ertrag zu erzielen (zur Rentabiltätsfunktion des Ertragsfaktors Düngung vgl. Folie7 unten).Die Düngemittelmenge muß wohldosiert sein. Die Regel "viel hilft viel" gilt bei der Düngung nicht, wohl aber "viel kostet viel".
Unsachgemäßer Umgang mit Düngemitteln führt aber nicht nur zu einem geringeren Gewinn. Durch unsachgemäßen Umgang kann es zu langfristigen Bodeschäden und zu einer Schädigung von Grundwasser, Flüssen und Meeren oder direkten
Gesundheitsschäden kommen.
Besondere Vorsicht ist beim Umgang mit Ammoniumnitat geboten.
Bei Düngemittelbränden bilden sich aus Ammoniumnitrat auch Nitrosegase. Handelt es sich um reines Ammoniumnitrat so kann es auch zu Explosionen kommen.
Anfang der zwanziger Jahre ereignete sich eine Explosion in einer deutschen Düngemittelfabrik, in der große Mengen Ammoniumnitrat gelagert wurden, bei der ein großer Teil der Belegschaft getötet wurde. Seitdem ist der Anteil von
Ammoniumnitrat der in Deutschland vertriebenen Düngemitteln beschränkt. Zudem muß das Ammoniumnitrat mit Zuschlägen (z. B. Ammoniumsulfat) versetzt werden, um die Explosivität herabzusetzen.
Versuch 9: Zersetzung von Ammoniumnitrat
Versuchsmaterial:
1Spatelspitze Ammoniumnitrat, 1 dickwandiges Reagenzglas, Feuerzeug, Bunsenbrenner, Stativstange mit Bodenplatte, Klemme, Abzug.
Durchführung:
Das Ammoniumnitrat wird in das Reagenzglas gegeben und mit der Bunsenflamme erhitzt. Das Ammoniumnitrat zersetzt sich unter Feuererscheinung, bei sehr
trockenem Ammoniumnitrat auch explosionsartig.
Reaktionsgleichung :
a) NH4N03 ~ N20 +2H20 (-124 kJ/mol)
(-206 kJ/mol) a) ab 170°C
b) bei Anwesenheit von Chlorid oder höheren Temperaturen
tolie 1:
[ Kreislauf der Nährstoffe
Sogenannter «offener Kreislauf der Nährstoffe», gültig für einen einzelnen Landwi rtschaftsbetri eb.
Futter- mittel
Düngemittel
I
HelSverlÖSun Flotation Elektrostatisches Verfahren
"
o
ä)'
f\.)
naß und kalt trocken und kalt
20 40 &0 80 100 120
Temperatur in
oe
Feingemahlenes Rohsalz
.:-;. . -K~nditionierungs-
.'.:.. I mittel
~
Trennu~von kaliumchlorid (KCI) und Kieserit MgSq.·t!zO)aus dem Kali-Rohsalz (kCl+Na •MGSQ4·H:zO)in trockenem ZUstand durch Ablenkung In einem elektrischen Feld
~-Flotations- mittel
. .. .,.
. . . .
Feingemahlenes Rohsalz
.
Flotationslauge '.
.. ...
','i:. ..
Trennung von kaliumchlorid (KCI) aus dem Kali-fmhsalz (kCI+ NaCl+Mg~•H20)in nassem ZUstand
QbnlWlrmezUfuhr durch Aufschwimmen (Aotieren) Trennung von Kaliumchlorid (KCI) aus dem
Kali-Rohsalz (kCI+NaCI+MgSo.. ·HrA) in nassem Zustandbeisteigender Temperatur
--
°320.=
~ 240Q)
~ 1&0
(.)
:9cn
i
rI.~'.'.
:·:·:-.~:-~Filtern
...
... ... -
Rohsalz ~:
-
I"
... . .. . . .. . ...
...
Heiße +
Filtern lösung Kühlen
/ L~~
Ig~CII-
.. · ·
.
'.
•
vi ·
: 1+•
:1 ..
Trennen~vorbehandeln
.
JA;
/ ~"'.
.. .... .... . ..
...
...
Filtern Trocknenund
~&
.n.l'.'n
~
Flotations- lauge Filtern
,
••Luftblasen j
...
A... ....
...
... - ....
,
....•....
Folie 3 :
HÜ3S-o-NH2 +
Sulfanilsäure ("Lunge 1")
~N
*
H0' '0' +
K
Diazotierung
+
)
Diazonium - Ion (farblos)
Kupplung
- - - )
+
+
Cl - Naphtylamin ("lunge 2")
Azofarbstoff (rot)
*
Das reagierende Agens bei der Kupplung ist nicht die Salpetrige Säure sondern das Nitrosyl- Kation,N H +
0;' '0' + H • + H
O=N-O'
'H
-- · [():::N]
+ + H20Nitrosyl - Kation
Folie 4:
•
f
c- I -
QJ 0
100
...-
~ ~ u
3 0 "t:
f
:J BO
c E-~
-
" , L . . :Joa..~\6-0
'"
cu~ 60QJ QJ 0
- j 5 c . . ...
,." ~ :-
... ::J
0 - " ' - 40
~ 0Vt 0 -0-._
\6- C C u
0
-
0 ra20
I
c: e- ~ro u
0 0 L. c...
... ~ 0
----0 -cu c.cQ.I C. 0
a.~ u
'"
00'=
c 0'- 0 o s:
Cl. ~ \..) c..
Time, d ~
1/24 1/41/2125102050
101 102 103 104 105 •
Time, min ~
Figure 13. Reaction ofMorocco phosphate rock with 76~/O
sulfuric acid
Methylenblau :
c~
Kation ist farbig Methylorange :
~
NAnion ist farbig
Reaktionsgleichungen:
a) Fe3. (aq)+PO/- - > FeP04.J..
b) [Fe EDTAr +
pol- +>
EDTA4-= [(02CCH2hN -CH2 - CH2 - N(CH2C02h14-
Ethylendiamintetraaeetat Folie 5:
Versuch 8: Eisen-(III) neben Phosphat
Versuchsaufbau für das Ostwald - Verfahren
I s, t1~
et1b
f-e n n e ... ,
1. \v'c s
cht" l
l1sche ~.Va5GhtLas{he
mit
Am~Ohiakim
(;sbod.
_-9> Va kuu
m-pumpe
\
3. 'Ja
5'h f Las ehe
m; t Nat
t-0 ...l
d U9 e
~_ Folie 6 .
LDie Minimumstonne
zum «Gesetz vom Minimum» nach Justus von Liebig, 1855.
Das Fass kann nur bis zur niedrigsten Daube gefüllt werden.
Folie 7 :
Düngemittel und Geld
WACHSTUMSKURVE UND GESETZ VOM ABNEHMENDEN ERTRAGSZUWACHS
r I Ertragszuwachs 1
I
Das Gesetz vom abnehmenden Ertragszuwachs : Bei gleichbleibendem Mehraufwand nimmt der Zuwachs je Aufwandeinheit ab.
DIE RENTABILlTÄTSFUNKTION DES ERTRAGSFAKTORS DÜNGUNG
Düngungskosten (feste + variable)
Mehrertrag durch Düngung (Geldwert)
obere Grenze der rentablen Düngung maximaler
Reingewinn
feste
r7--+----if----+---4---lDüngu ngskosten
Düngungsdosis Höc!lstertrag (kg x ha-1 ) untere Grenze
der rentablen Düngung
maximale Verzinsung des Düngerkapitals Geld x ha"
Clro
ECl)...
..c
Cl)
~
~N
.c
Cl)c
-
ol/)~
BESTIMMUNG VON'IJHOSPHOR UND KALIUM IM
CALCIUM~~C~AT..LAcrAT.(CAL)-AUSZUG
'. ;~•.J .~
1 Zweck und Anwendungsbereich
Böden mit natürlichen Carbonatgehalten bis zu 15%,Gärtnerische Erden und Substrate (s. Bemerkung 8.1).
2 Prinzip'
Extraktion der Nährstoffe Phosphor und Kalium mit einer sauren, auf pH 4,1 gepufferten Lösung aus Calciumacetat, Calciumlactat und Essigsäure aus lufttrockenen Böden (jedoch auch feldfeuchten Moor- und Anmoorböden) bzw. Gärtnerischen Erden und Substra- ten, die vor der Bestimmung auf einen zum Eintopfen optimalen Wassergehalt eingestellt wurden, und anschließend photometrische Bestimmung.
3 Reagenzien
3.1 Extraktionslösung
3.1.1 CAL-Vorratslösung: 770 g Calciumlactat, C6H10Ca06 •5 H20 ,zur Bodenuntersuchung, und 395 g Calciumacetat, (CH3COO)2 Ca · xH20, getrocknet zur Bodenuntersuchung, in je 3Iheißem Wasser lösen und beide Lösungen vereinigen. Nach dem Abkühlen 895 ml Essigsäure (p = 1,06g/rnl) zugeben und mit Wasser auf 10I auf- füllen.
3.1.2 CAL-Gebrauchslösung: 10ICAL-Vorratslösung (3.1.1) mit Wasser auf 50Iverdünnen. Die Lösung enthält je 0,05mol/lCalciumacetat und -lactat und 0,3 mol/l Essigsäure (pH-Wert 4,1). Zur Kontrolle 100 ml mit Natronlauge (c =1 mol/l) gegen Phenolphthalein ti- trieren (Sollverbrauch 30 ml).
3.2 Standardlösungen für Phosphor und Kalium
3.2.1 Standard-Vorratslösung: 3,835 g Kaliumdihydrogenphosphat und 5,815 g Kaliumchlorid mit Wasser zu 1Ilösen. 1 ml enthält 2,0 mg p205und5,0 mg~O(s.Bemerkung8.2).
3.2.2 Standard-Gebrauchslösung: 50 ml Standard-Vorratslösung (3.2.1) mit Wasser auf 1Iverdünnen. 1 ml enthält 100 JJgP20Sund 250JJg
~O.
A 6.2.1.1 Calcium-Acetat-Lactat (CAL) BODENUNTERSUCHUNG Calcium-Acetat-Lactat (CAL) A 6.2.1.1
3.2.3 3.2.3.1
3.2.3.2
3.2.3.3 3.3 3.3.1
3.3.2
3.3.3
4 4.1 4.2 4.3 4.4 4.5
BODENUNTERSUCHUNG
Eich-Standardlösungen für Phosphor
o-2 - 5 - 10 - 20 - .... 70 ml Standard-Gebrauchslösung (3.2.2) in 500-ml-Meßkolben mit je 40 ml CAL-Vorratslösung (3.1.1) verset- zen und mit Wasser zur Marke auffüllen. 25 ml jeder Lösung ent- halten 0 - 10 - 25 - 50 - 100 - .. - 350 JJg P20S und entsprechen 0 - 2 - 5 - 10 - 20 - .. - 70 mgP205/100 g Boden.
für Kalium
o -2 - 4 - .. - 20 ml Standard-Gebrauchslösung (3.2.2) in 100-ml- Meßkolben mit je 40 ml CAL-Vorratslösung (3.1.1) versetzen und mit Wasser zur Marke auffüllen. Die Lösungen enthalten 0 - 5 - 10 - .. - 50 mg ~O/l und entsprechen 0 - 10 - 20 - .. - 100 mg
~O/I00g Boden, wenn sie direkt in das Flammenphotometer eingesaugt werden.
Zur Konzentration der Eichlösungen und zu einem vereinfachten Verfahren der Herstellung s. Bemerkung 8.3.
Färbereagenzien für die Phosphorbestimmung nach der Verbands- methode (s. Bemerkung 8.4)
Ammoniummolybdatlösung,8 [(NH4)6Mo7024 • 4~O] =50 g/I:
50 g Ammoniumheptamolybdat in etwa 800 ml Wasser von ca.
50°C lösen und nach dem Erkalten mit Wasser auf1I auffüllen.
Die Lösung ist mehrere Wochen haltbar.
Reduktionslösung: 1,25gAscorbinsäure und 350 mg Zinn(II)-chlo- rid, SnCl2 · 2 H20 ,in 50 ml Salzsäure" (c =10mol/l) lösen und mit Wasser auf 100 ml auffüllen. Die Lösung täglich frisch bereiten.
Zur Herstellung der Lösung 3.3.2 in einer Form, die mehrere Mo- nate haltbar ist, s. Bemerkung 8.5.
Geräte
Waage, 10 mg ablesbar
Kunststoff..Schüttelflaschen mit Schraubverschluß, 300 ml Fas- sungsvermögen (s. Bemerkung 8.6)
Dosiergeräte für 100 ml und 1 ml Verdünnungsgerät,10 ml + 15ml
Schüttelmaschine, rotierend mit 30-35 Ll/rnin oder exzentrischer Horizontalschüttlet mit 140 Stößen/rnin (Konstruktionsangaben bei SCHüLLER, 1969)
"
om·
0:>
BODENUN'rERSUCHUNG Calcium-Acetat-Lactat \~AL) A 6.2.1.1 A 6.2.1.1 Calcium-Acetat-Lactat (CAL) BODENUNTERSUCHUNG
4.6
4.7 4.8
4.9 4.10
5 5.1
5.2 5.2.1
Methodengerechtes Filtriergerät (in der Regel Eigenherstellung) zum gleichzeitigen Filtrieren mehrerer Proben (s. Bemerkung 8.7) oder weithalsige Auffanggefäße (ca. 200 ml Fassungsvermögen) und Kunststofftrichter,die 100 ml Bodenextrakt auf einmal fassen Faltenfilter,phosphor- und kaliumfrei,fein- bis mittelporig
Reagenzgläser, dickwandig, Fassungsvermögen 30 ml, mit Stopfen, ggf. mit Marken bei 10 ml und 25 ml
Spektralphotometer oder Filterphotometer, Interferenzfilter mit Schwerpunkt bei 580 nm (s. Bemerkung 8.8)
Flammenphotometer mit Interferenzfilter, Schwerpunkt bei 767nrn,ggf. Atomabsorptions-Spektralphotometer
Durchführung
Herstellen des Extraktes
5 g lufttrockenen. auf 2 mrn gesiebten Mineralboden (Moor- und Anrnoorböden, Gärtnerische Erden und Substrate s. Bemerkung 8.9) in Schüttelflaschen (4.2) einwiegen, mit 100 ml CAL-Ge- brauchslösung (3.1.2) versetzen, einige Male umschwenken, für Überkopfschütteln Flaschen verschließen, (bei horizontalem Stoß unverschlossen) 90 min maschinell schütteln, filtrieren und die er- sten 5-10 rnl des Filtrats verwerfen.
Kalibrieren der Meßgeräte für Phosphor
Standard-Eichreihe (3.2.3.1) mit25 ml Lösungje Eichpunkt in der gleichen Weise wie Bodenextrakte anfärben (s. 5.3.1) und die Ex- tinktion bei 580 nm in Küvetten mit 10 mm Schichtdicke gegen den Reagenzienblindwert (10 ml CAL-Gebrauchslösung +15 ml Was- ser +1 ml Molybdatreagenz +1 ml Reduktionslösung) messen.
Extinktionen (x) gegen mg P20s/100 g Boden (y) auftragen und daraus eine von mg zu mg fortschreitende Tabelle anfertigen bzw.
aus den Wertepaaren das Steigungsmaß (tga)der Regressionslinie als Verfahrenskonstante berechnen (auf jedem wissenschaftlichen Taschenrechner einprogrammiert; Formeln s. z. B. bei SACHS, 1984). Sie beträgt unt.er den angegebenen Färbe- und Meßbedin- gungen ca. 44,5.
Bis zu einemP20s-GehaIt von 60 mg/IOD g Boden ist die Regressi- onslinie linear und bis 70 mg nur so schwach gekrümmt, daß die Verfahrenskonstante für praktische Zwecke bis dahin gilt (s.
HOFFMANNund OHNESORGE, 1966).
5.2.2
5.3 5.3.1
5.3.2
5.3.3
6 6.1
für Kalium
Flammenphotometer mit dem Eich-Standard (3.2.3.2) für 100 mg
~O/100g Boden bei 767 nm auf den 100-Punkt der Skala einre- gulieren, Eichreihe durchmessen, bei Abweichungen von der Li- nearität (im unteren Bereich je nach Photometertyp möglich) eine entsprechende Tabelle anlegen oder bei völliger Linearität die Ver- fahrenskonstante wie für Pberechnen (s. Bemerkung 8.10).
BestimmungderNährstoffgehalte Messen von Phosphor
10ml Filtrat und 15 ml Wasser in Reagenzgläser (4.8) dosieren [am besten mit einem Verdünnungsgerät (4.4), um Mischen einzuspa- ren], je 1ml Molybdatreagenz (3.3.1) und 1ml Reduktionslösung (3.3.2) jeweils in die Mitte der Flüssigkeitsoberfläche zudosieren (s.
Bemerkung 8.11), Stopfen aufsetzen, gut mischen und ab 10 min bis 24 h nach dem Anfärben die Extinktion bei 580 nm mit dem Photometer (4.9) in einer 10-mm-Küvette gegen den Reagenzien- blindwert (s. 5.2.1) messen.
Zum Ersatz der nicht auf allen automatischen Meßstraßen prakti- kablen Anfärbung nach der beschriebenen Verbandsmethode s. Al- ternativen in Bemerkung 8.12.
Messen von Kalium
Das Filtrat direkt in das Flammenphotometer einsaugen und den Meßwert bei 767 nm ablesen (wegen evtl. Störungen s. Bemerkung 8.13).
Kontrollmaßnahmen
Bei Auftreten von Gehalten über 70mgP20Sbzw.100 mg ~Oje 100 g Boden, Filtrate entsprechend verdünnen und die Proben er- neut messen. Verdünnungsfaktor bei Berechnung der Ergebnisse berücksichtigen. Zur Kontrolle der Photometer s. Bemerkung 8.14.
Berechnung
Ermittlung der Nährstoffgehalte
In der überwiegenden Zahl der Fälle sind keine Rechenoperatio- nen nötig, da moderne, mit einem Mikroprozessor ausgestattete Geräte den Nährstoffgehalt der Proben nach entsprechender Ein- stellung direkt in mg Nährstoff je100g Boden ausgeben.
In Photometern ohne Mikroprozessoren, die auswechselbare Ska- len besitzen, direkt in mg Nährstoff/lOO g Boden selbst kalibrierte Skalen einlegen, sonst angezeigte Werte aus Eichkurveoder Eich- tabelle in mg Nährstoff/lOO g Boden entnehmen bzw. mit Hilfe der
."
o
Ci)"
co