Zur Lokalisation und Bindungsform des Urans in Biofilmen
Kay Großmann
Zur Lokalisation und Bindungsform des Urans in Biofilmen
D I S S E R T A T I O N
zur Erlangung des akademischen Grades
Doctor rerum naturalium (Dr. rer. nat.)
vorgelegt
der Fakultät Mathematik und Naturwissenschaften der Technischen Universität Dresden
von
Diplom-Chemieingenieur (FH) Kay Großmann geboren am 01. 10. 1977 in Dresden
Gutachter: Herr Prof. Dr. Gert Bernhard
Frau Prof. Dr.-Ing. Rhena Krawietz Prof. Dr. Petra Panak
Eingereicht am: 09.06.08
Tag der Verteidigung: 13.11.2008
Für Charlotte Thekla Großmann
Inhaltsverzeichnis
Zusammenfassung...I Summary ... V Danksagung... VIII
1. Motivation und Zielstellung ... 1
2. Biofilme... 3
2.1. Vorkommen und Bildung von Biofilmen...3
2.2. Aufbau und Struktur von Biofilmen...7
2.3. Bedeutung von Biofilmen ...11
2.4. Wechselwirkungen von Schwermetallen mit Biofilmen...12
3. Uran... 16
3.1. Wässrige Chemie des Urans...16
3.2. Redoxchemie des Urans ...18
3.3. Urankreislauf in der Natur...19
4. Fluoreszenzspektroskopie und –mikroskopie des Urans ... 22
4.1. Grundlagen der Fluoreszenz...22
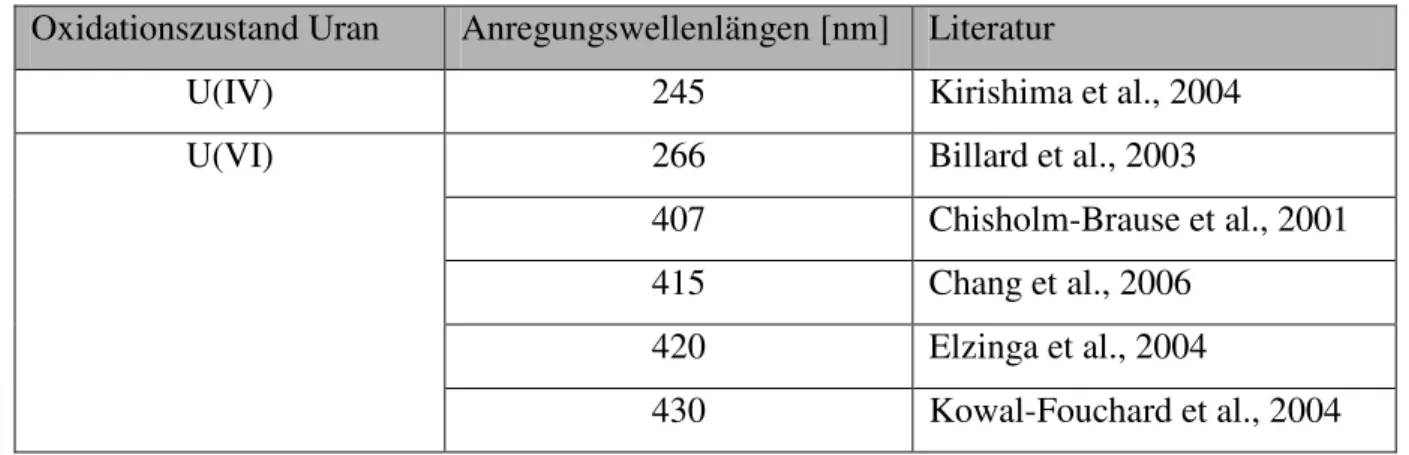
4.2. Fluoreszenzeigenschaften des Urans...23
4.3. Experimentelle Methoden der Fluoreszenzspektroskopie von Uran...26
4.4. Experimentelle Methoden der Fluoreszenzmikroskopie des Urans ...27
5. Entwicklung eines gekoppelten Systems konfokale Laser Scanning Mikroskopie (CLSM)-Laserfluoreszenzspektroskopie (LIFS) zur Uranlokalisierung und Bestimmung der Uranbindungsform ... 32
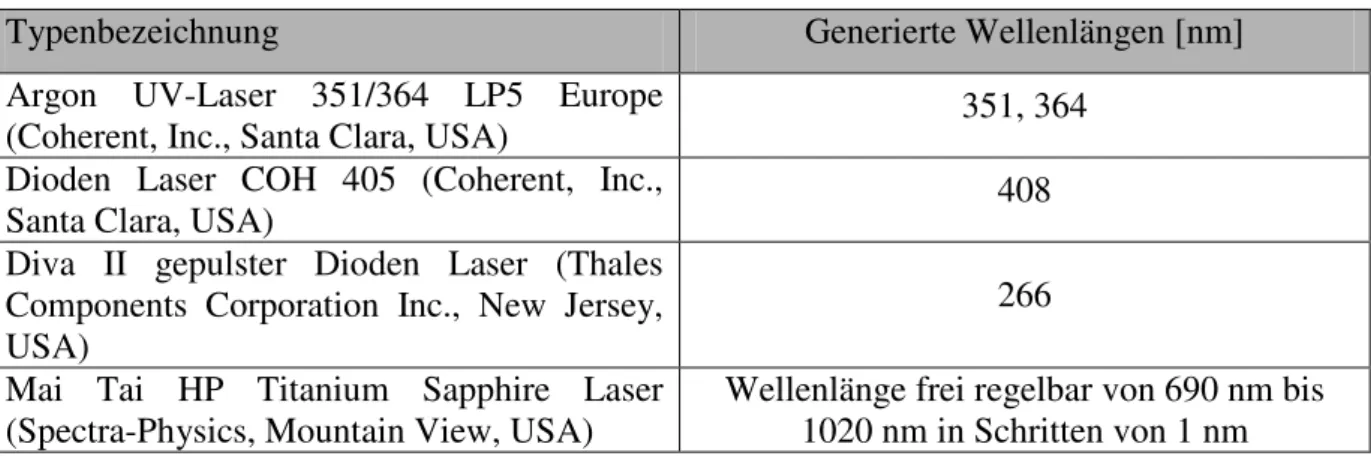
5.1. Aufbau und Beschreibung des Systems ...33
5.2. Bestimmung der Detektionskenngrößen zur Fluoreszenzempfindlichkeit des Systems gegenüber Uran...38
5.2.1. Theoretische Abschätzung ... 38
5.2.2. Bestimmung von Kenngrößen... 43
5.2.2.1. Ermittlung der optimalen Wellenlänge für Multiphotonenanregung von U(IV) und U(VI) ...43
5.2.2.2. Bestimmung der Fluoreszenzempfindlichkeit des Systems gegenüber Uran ...55
5.3. Entwicklung der Tieftemperaturmikroskopie ...70
5.3.1. Experimente zur Änderung von Fluoreszenzeigenschaften bei tiefen Temperaturen ... 73
5.3.2. Integration der Kryotechnik in das gekoppelte System ... 81
6. Uranspeziation in Biofilmen ... 83
6.1. Anzucht von Biofilmen ...83
6.2. Charakterisierung der Biofilme...85
6.2.1. Optische Charakterisierung ... 85
6.2.2. Charakterisierung der mikrobiellen Zusammensetzung der Biofilme ... 86
6.3. Bestimmung physikalisch-chemischer Parameter im Biofilm ...87
6.3.1. Mikrosensorische Sauerstoffmessung ... 89
6.3.2. Metabolische Aktivität von atmenden Bakterien ... 93
6.3.3. Interpretationen und Schlussfolgerungen zu den mikrosensorischen und mikroskopischen Ergebnissen ... 94
6.4. Visualisierung und Bestimmung der Bindungsform von Uran im Biofilm ...97
6.5. Vergleichende Messungen zu Uran(V) ...102
6.5.1. Bestimmung des Fluoreszenzspektrums von Uran(V)... 102
6.5.2. Anregung von Uran(V) mit 408 nm... 105
6.5.3. Untersuchungen zur Oxidation von vierwertigen Uranspezies im gekoppelten CLSM/LIFS-System... 109
6.6. Auswertung ...118
7. Ausblick ... 120
8. Experimentelle Einzelheiten ... 122
8.1. Herstellung der verschiedenen Uranverbindungen ...122
8.2. Ermittlung der optimalen Wellenlänge für Multiphotonenanregung von U(IV) und U(VI) ...123
8.3. Bestimmung der Fluoreszenzempfindlichkeit des Systems gegenüber Uran ...125
8.4. Experimente zur Änderung von Fluoreszenzeigenschaften bei tiefen Temperaturen ...126
8.5. Anzucht von Biofilmen ...127
8.6. Biofilme und Uran...128
8.7. Bestimmung der mikrobiellen Zusammensetzung...128
8.8. Mikrosensorische Messung der Sauerstoffkonzentration im Biofilm...129
8.9. Metabolische Aktivität von atmenden Bakterien ...130
8.10. Bestimmung des Fluoreszenzspektrums von Uran(V)...131
8.11. Anregung von Uran(V) mit 408 nm...131
8.12. Untersuchungen zur Oxidation von vierwertigen Uranspezies im gekoppelten
CLSM/LIFS-System...132
9. Literaturverzeichnis... 134
10. Abkürzungen und Symbole... 149
11. In Verbindung mit dieser Arbeit entstandene Publikationen ... 152
Zusammenfassung
Zusammenfassung
Vor dem Hintergrund des Eintrages von Uran in die Umwelt durch Uranabbau und Uranverarbeitung, einschließlich Sanierung, durch die Waffenproduktion und den Verschuss von Munition aus abgereichertem Uran, aber auch vor dem Hintergrund der Endlagerproblematik sind Untersuchungen zur Mobilisierung und Immobilisierung des Urans notwendig. Mit der vorliegenden Arbeit wird ein Beitrag zur Aufklärung des Ausbreitungsverhaltens des Urans, eines der wichtigsten Actinidenelemente, geleistet.
Um bessere Voraussagen zur Ausbreitung eines Schadstoffes in der Umwelt treffen zu können, sind detaillierte Kenntnisse zur Bindungsform des Schadstoffes und zu dessen Wechselwirkungen mit der umgebenden Materie notwendig. Uran wird in natürlicher Umgebung hauptsächlich über die wässrige Phase transportiert. Dieser Transport kann dabei sowohl in gelöster Form, an Nanopartikel sorbiert oder kolloidal erfolgen. Die Immobilisierung des transportierten Urans aus der Wasserphase erfolgt hauptsächlich durch Wechselwirkungen mit Gesteinen oder Mineralen, Wechselwirkungen mit organischen Substanzen (z.B. Huminstoffen) sowie durch Wechselwirkungen mit Mikroorganismen. Im Rahmen dieser Arbeit sollte der Einfluss, welchen die Mikrobiologie auf das Ausbreitungsverhalten von Uran ausübt näher betrachtet werden. Untersuchungen zu den Wechselwirkungen von Uran mit einzelnen, individuellen Mikroorganismen sind dabei bereits für verschiedene Spezies bekannt. Der Einfluss von Biofilmen, welche vom Großteil der auf der Erde lebenden Mikroorganismen als bevorzugte Lebensform genutzt werden, auf das Ausbreitungsverhalten von Uran, ist jedoch nur unzureichend untersucht und eröffnet Raum für neue notwendige Forschungsaktivitäten.
Eine maßgebliche Eigenschaft zur Erklärung der verschiedenen Wechselwirkungsprozesse von Uran im Biofilm ist die Bindungsform des Schwermetalls in seiner Umgebung. Zur Bestimmung der Bindungsform war es notwendig eine Kombination aus komplementären Analysetechniken einzusetzen. In der vorliegenden Arbeit wurde deshalb durch Kopplung der konfokalen Laser Scanning Mikroskopie (CLSM) mit der laserinduzierten Fluoreszenzspektroskopie (LIFS) ein System entwickelt, welches eine in situ Speziation von fluoreszierenden Schwermetallen innerhalb verschiedener komplexer biologischer Systeme ermöglicht. Dieses Messsystem zeichnet sich durch folgende Leistungsmerkmale aus:
• Mehrgewinn an Informationen über die Probe durch die Kopplung von mikroskopischer Visualisierung und spektroskopischer Information,
• räumliche und objektbezogene Zuordnung der analysierten „Regions of Interest“ (ROI) innerhalb der untersuchten Probe durch die Verbindung mit der Mikroskopie,
• Charakterisierung der chemischen Umgebung und Bindungsform des Urans im analysierten Probenvolumen (gelöst oder fest) durch Verbindung mit der Spektroskopie,
• Darstellung und chemische Charakterisierung in kleinsten Volumina durch Anwendung des konfokalen Prinzips in Mikroskopie und Spektroskopie,
• große Bandbreite in der spektralen Analyse und visuellen Darstellung der Probe durch eine Vielzahl an verschiedenen Laserwellenlängen, welche in das System eingekoppelt sind (Beispielsweise Einkopplung von 266 nm, 408 nm und eines Multiphotonenlasers zur Anregung von sechswertigen Uranspezies),
• Nutzung der Mehrphotonenfluoreszenzanregung der Probe durch Einkopplung eines MaiThai HP Multiphotonenlasers in das Gesamtsystem.
Untersuchungen zur Anwendbarkeit und Empfindlichkeit des Systems, bezogen auf die Fluoreszenz von sechswertigem Uran an verschiedenen Uranmineralen und Uranylstandardlösungen, zeigten eine sehr gute Übereinstimmung der spektralen Lage der gewonnenen Ergebnisse mit vergleichbaren Daten der laserinduzierten Fluoreszenzspektroskopie. Für alle untersuchten Mineralphasen konnten hier bei Anregung mit 408 nm und der Multiphotonenanregung, zu LIFS-Literaturdaten, ähnliche Emissionsbandenlagen gefunden werden. Die Bestimmung der Leistungsfähigkeit des Systems zeigte, dass bei einer Pinholeeinstellung des Konfokalmikroskops von einem Airy, mit einem 10er Luftobjektiv, Urankonzentrationen von bis zu 1×10-4 M detektiert werden können. Dies entspricht etwa 1,77×109 fluoreszierenden Teilchen im angeregten konfokalen Volumen. Bei größtmöglicher Öffnung des Pinholes konnten Urankonzentrationen von 1×10-
6 M detektiert werden.
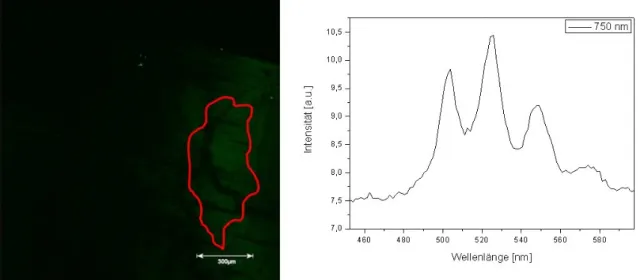
Bei Untersuchungen zum Einfluss von Biofilmen auf die Uran-Migration in der Umwelt konnten im mikroskopischen Abbild zwei unterschiedliche Arten fluoreszierender Partikel, innerhalb von auf Biotit und Glas aufgewachsenen Mischkulturbiofilmen, beobachtet werden.
Die beobachteten Partikel waren zwischen 1 und 7 µm breit und bis zu 20 µm lang.
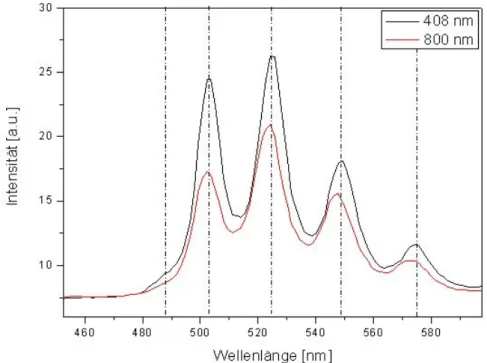
Laserfluoreszenzspektroskopische Messungen bei Anregung mit Licht der Wellenlänge 408 nm an diesen Partikeln zeigten, zum einen charakteristische Fluoreszenzspektren im
Zusammenfassung
Bereich von 415-475 nm, was der Fluoreszenz von Uran(V) zugeordnet wurde, und zum anderen charakteristische Spektren im Bereich von 480-560 nm, was typisch für das Uran(VI)-Fluoreszenzsignal ist. Diese erstmals spektroskopisch identifizierten Uran(V)- und die Uran(VI)-Partikel konnten gleichzeitig innerhalb des Biofilms aufgefunden werden.
Hierbei wird davon ausgegangen, dass es sich bei den Uran(VI)-Partikeln um mikrobiologisch beeinflusste Ausfällungen von Uran(VI) im Biofilm und bei den Uran(V)-Partikeln um mikrobiologisch beeinflusste Redoxvorgänge handelt. Die Anwesenheit von Uran(VI) und Uran(V) innerhalb eines Biofilms zeigt deutlich, dass die Reduktion des sechswertigen Urans zum vierwertigen Uran als Einelektronenschritt über die fünfwertige Zwischenstufe und nicht als Zweielektronenschritt abläuft. Der Nachweiß von vierwertigem Uran innerhalb der Biofilmproben konnte bis zum jetzigen Zeitpunkt aufgrund von technischen Limitationen (Fluoreszenzanregung von Uran(IV) nur mit 245 nm möglich) des Gesamtsystems noch nicht untersucht werden.
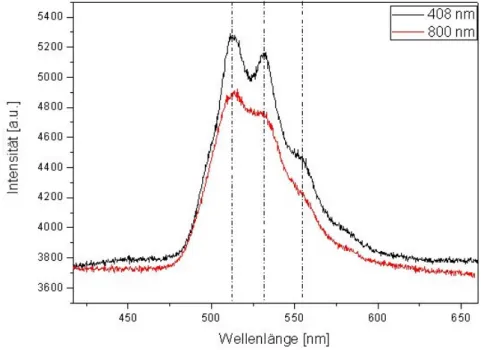
Vergleichende Untersuchungen zur erstmalig im Biofilm gefundenen Fluoreszenz von Uran(V) zeigten an verschiedenen Uran(V)-Proben vergleichbare Spektren. Beispielsweise zeigten laserspektroskopische Untersuchungen zum Fluoreszenzspektrum von aquatischem Uranyl(V) in Perchloratmedium, bei Raumtemperatur und Anregung mit 255 nm, ein Fluoreszenzsignal mit einem Bandenmaximum bei 440 nm. Die Fluoreszenzlebensdauer des vermessenen Uran(V) wurde in diesem Versuch mit 1,10 ± 0,03 µs bestimmt.
In weiteren Versuchen wurde die Fluoreszenz von einem aquatischen [U(V)O2(CO3)3]5-- Komplex spektroskopisch untersucht. Aufgrund der bekannten Quencheffekte durch Carbonat wurde dieser Versuch unter kryogenen Bedingungen bei 153 K durchgeführt. Die Probe wurde mit zwei verschiedenen Laserwellenlängen, 255 nm und 408 nm, zum Fluoreszieren angeregt. Das resultierende Fluoreszenzspektrum von Uran(V) wurde für beide Anregungswellenlängen zwischen 380 nm und 440 nm detektiert. Die Emissionsmaxima des gewonnenen Uran(V)-Signals konnten bei Anregung mit 255 nm, bei 404,7 nm und bei Anregung mit 408 nm, bei 413,3 nm bestimmt werden. Die bestimmte Fluoreszenzlebensdauer für diesen Carbonatokomplex bei Anregung mit 255 nm betrug 120 µs bei Temperaturbedingungen von 153 K.
Die Oxidation vom vierwertigen Uran zum Uran(VI), über die Zwischenstufe des Uran(V) wurde anhand von verschiedenen vierwertigen Uranfestphasen (Uraninit, UCl4) und einer vierwertigen 1×10-2 M Uranstandardlösung mit Hilfe der gekoppelten CLSM/LIFS-Methode beobachtet. Es zeigte sich für alle untersuchten Proben, dass sich mit der Zeit ein
Fluoreszenzsignal entwickelte, welches eindeutig der Fluoreszenz von Uran(V) zugewiesen werden konnte. Es konnte anhand dieser Proben mikroskopisch und spektroskopisch gezeigt werden, dass sich das Uran(V)-Signal nach einiger Zeit bildete und in Abhängigkeit von der Zeit wieder verschwand. Mit fortschreitender Zeit und Oxidation konnte für diese Proben spektroskopisch ein Uran(VI)-Signal detektiert werden. Für die UCl4-Probe war es sogar möglich, Uran(V) und Uran(VI) mikroskopisch innerhalb von einer Probe darzustellen und die nicht fluoreszierenden Bereiche Uran(IV) zuzuordnen. Diese Ergebnisse weisen eindeutig auf ein metastabiles Uran(V)-Zwischenprodukt bei der Oxidation des Uran(IV) zum Uran(VI) hin.
Die mikrobielle Reaktion von Mischkulturbiofilmen auf eine Uranzugabe, in umweltrelevanten Konzentrationen (1×10-5 M und 1×10-6 M) wurde elektrochemisch mit Hilfe von Sauerstoff-Mikrosensoren untersucht. Die Messungen zeigten, dass die Sauerstoffkonzentration in urankontaminierten Biofilmen mit steigender Biofilmtiefe schneller abnahm, als in Biofilmen, welche nicht mit Uran kontaminiert wurden. Die Sauerstoffzehrung in den urankontaminierten Biofilmen konnte beispielsweise für die obere Biofilmschicht (0-63 µm Eindringtiefe der Sensorspitze) mit 61,7 nmol cm-3s-1 berechnet werden. Vergleichend zu diesen Ergebnissen wurden Färbeexperimente mit 5-cyano-2,3- ditolyl tetrazolium chloride (CTC) und 4,6-diamidino-2-phenylindole (DAPI) durchgeführt, um die höhere respiratorische Aktivität der Bakterien im, mit Uran versetzten, Biofilm fluoreszenzmikroskopisch nachzuweisen. Analysen zur mikrobiologischen Diversität der Biofilme mit Hilfe von 16S rRNA Gendatenbanken zeigten, dass die Zugabe von Uran in umweltrelevanten Konzentrationen keine Änderung in der mikrobiellen Diversität im Biofilm bewirkt. Die gemessenen Sauerstoffprofile können also nicht mit einer Veränderung der Mikroorganismenpopulation begründet werden.
Summary
Summary
Uranium is a radioactive and toxic heavy metal. It is introduced into the environment by uranium mining activities, by uranium processing operations including remediation, but also by the use of uranium in armour-penetration ammunitions. In uranium contaminated soils and sediments it is a potential environmental risk for the human health. Also its possible leakage from possible high level waste repositories in geological formations has to be assessed. Since uranium is toxic and radioactive it represents an environmental health hazard and therefore its geochemical behaviour, i.e. its dispersion and its migration behaviour in nature requires detailed studies to avert potential harmful effects for humans. The present study will contribute for a better understanding of the migration processes of uranium in nature.
To better predict the migration behaviour of uranium in nature it is necessary to built up an improved understanding on the chemical speciation and its reactivity with the surrounding matter. The immobilization of aqueous uranium occurs mainly through interactions with surrounding minerals, organic substances or microorganisms. The aim of this work is to give a better understanding for the interactions between uranium and biofilms, the most popular form of life for bacterial communities. In this context many scientists investigate the role of the single individual bacteria for the migration of uranium but not the role of the naturally biofilms.
To investigate the speciation of uranium inside of such biofilms it was necessary to use a combination of complementary techniques. Because of this confocal laser scanning microscopy (CLSM) and laser induced fluorescence spectroscopy were coupled to give an opportunity to study in situ the speciation of fluorescent heavy metals in complex biological systems. This new measuring system is distinguished by the following characteristic features:
• Additional information by coupling microscopic with spectroscopic information,
• Three-dimensional and object-specific assignment for the region of interest (ROI) inside the investigated sample
• characterization of the chemical bonds of uranium inside the sample based on its spectroscopic fingerprint
• Visualisation and chemical characterization in smallest volumes
• Large number of possibilities for the spectroscopic analysis, because of many different laser wavelengths implemented in the coupled system
• Possibility of multi photon excitation.
Comparative studies with different uranium(VI)-minerals and uranium(VI)-solutions in many different concentrations between conventional fluorescence spectroscopy and the new coupled method show very similar results in respect to the positions of the fluorescence emission bands. The detection limit of the coupled system for uranium(VI) in solution was determined for a pinhole of one airy and an magnification of 100 and was found to be approximately 1×10-4 M uranium(VI). This detection limit could be further reduced down to 1×10-6 M uranium when the pinhole was completely opened.
Fluorescent uranium(V) and uranium(VI) particles were observed for the first time in vivo by the combined laser fluorescence spectroscopy and confocal laser scanning microscopy approach in a living multispecies biofilm grown on biotite plates. These particles ranged between 1 and 7 µm in width and up to 20 µm in length. Laser fluorescence spectroscopy was used to identify these particles. After an excitation with 408 nm the particles showed either a characteristic fluorescence spectrum in the wavelength range of 415-475 nm, indicative for uranium(V), or in the range of 480-560 nm, which is typical for uranium(VI). Particles of uranium(V) as well as uranium(VI) were simultaneously observed in the biofilms. These uranium particles were attributed for uranium(VI) to biologically mediated precipitation and for uranium(V) to redox processes taking place within the biofilm. The detection of uranium(V) in a multispecies biofilm was interpreted as a short-lived intermediate of the uranium(VI) to uranium(IV) redox reaction. Its presence clearly documents that the uranium(VI) reduction is not a two electron step but that only one electron is involved.
The luminescence spectrum of uranyl U(V) in aqueous perchlorate solution was detected for the first time at room temperature in the UV–Vis region with a peak maxima at 440 nm and a fluorescence lifetime of 1.10 ± 0.03 µs using an excitation wavelength of 255 nm.
In addition, the fluorescence characteristics of the stable aqueous uranyl(V)-carbonate complex [U(V)O2(CO3)3]5- was determined in a frozen solution (T = 153 K) by time resolved laser-induced fluorescence spectroscopy (TRLFS). Two different wavelengths of 255 nm and 408 nm, respectively were used to independently of each other excite the uranyl(V)-carbonate species. The resulting U(V) fluorescence emission bands were detected between 380 and
Summary
440 nm, with a maxima at 404.7 nm (excitation with 255 nm) and 413.3 nm (excitation with 408 nm), respectively. The fluorescence lifetime of the uranyl(V)-carbonate species was determined at 153 K as 120 µs. TRLFS investigations at room temperature, however, showed no fluorescence signal at all.
The oxidation process from uranium(IV) to uranium(VI) was investigated on solid uraninite UO2 (s) and UCl4 and in addition in a 1×10-2 M uranium(IV)-solution by the coupled method of confocal laser scanning microscopy and laser induced fluorescence spectroscopy. All of these samples show, after only a few minutes (x-y minutes angeben) of exposure in air atmosphere and using an excitation of 408 nm, a characteristic fluorescence signal indicative for uranium(V). A few minutes later this uranium(V)-signal disappeared and changed into a uranium(VI)-signal implying further oxidation. For the UCl4-sample it was possible to visualize uranium(V) and uranium(VI) simultaneously on one individual particle. These results shows that uranium(IV) does not directly oxidate to uranium(VI) but via an intermediated into the metastable uranium(V).
The effect of uranium added in ecologically relevant concentrations (1×10-5 M and 1×10-6 M) to stable multispecies biofilms was studied by electrochemical oxygen microsensors. The measurements exposed to uranium showed that the oxygen concentration decreased faster with increasing biofilm depth compared to the uranium free biofilms. In the uranium containing biofilms, the oxygen consumption, calculated from the steady-state microprofiles, showed high consumption rates of up to 68 nmol cm-3s-1 in the top layer (0 – 70 µm). Staining experiments with 5-cyano-2,3-ditolyl tetrazolium chloride (CTC) and 4,6-diamidino-2- phenylindole (DAPI) confirmed the high respiratory activities of the bacteria in the upper layer. Analysis of the amplified 16S rRNA gene fragments showed that the addition of uranium in ecological relevant concentrations did not change the bacterial diversity in the stable multispecies biofilms and is therefore not responsible for the different oxygen profiles in the biofilms.
Danksagung
Die vorliegende Arbeit entstand im Institut für Radiochemie des Forschungszentrums Dresden-Rossendorf e. V. und wurde von der Deutschen Forschungsgemeinschaft gefördert (DFG-Geschäftszeichen: AR 584 / 1-1).
An dieser Stelle sei es mir gestattet, mich bei Herrn Prof. Dr. Gert Bernhard für die Gesamtbetreuung dieser interessanten Arbeit bedanken.
Meinem direkten Betreuer Herrn Dr. Thuro Arnold danke ich sehr für die interessante Aufgabenstellung zu dieser Arbeit, die Vielzahl an wertvollen Hinweisen sowie für seine ständige Bereitschaft zu Diskussion und Hilfestellung.
Ebenso danke ich Frau Dr. Evelyn Krawczyk-Bärsch für ihre Anregungen, ihre Unterstützung und ständige Diskussionsbereitschaft.
Frau Prof. Dr.-Ing. Rhena Krawietz vom Fachbereich Maschinenbau/Verfahrenstechnik, Lehrgebiet Physik der Hochschule für Technik und Wirtschaft Dresden (FH) danke ich für die externe Betreuung meiner Arbeit sowie für die Bereitschaft zur Durchführung eines kooperativen Promotionsverfahrens zwischen der Technischen Universität Dresden und der HTW-Dresden (FH).
Herrn Prof. Dr. Dr. h. c. E. Herrmann danke ich für die Bereitschaft die vorliegende Arbeit zu begutachten.
Mein herzlichster Dank gilt auch der Arbeitsgruppe „Angewandte Mikrobiologie“ der Technischen Universität Dresden, im besonderen Frau Prof. Dr. Isolde Röske, Herrn Dr. Axel Wobus und Frau Susann Hofmann, welche bei mikrobiologischen Fragestellungen mehr als nur einen Projektpartner darstellten.
Dem Werkstattteam des Institutes für Radiochemie, Herrn Dirk Falkenberg, Herrn Bernd Hiller und Herrn Steffen Henke danke ich für die schnelle Fertigung gewünschter Reaktoren und die Hilfe und Tipps beim Ausbau des gekoppelten CLSM/LIFS-Systems.
Gedankt sei auch den Doktoranden unseres gemeinsamen Schreibraums: Maja Glorius, Sandra Lehmann, Bo Li, Katarina Müller und Robin Steudtner für die vielen gewinnbringenden Diskussionen. Insbesondere möchte ich mich dabei bei Robin Steudtner für die gute und erfolgreiche Zusammenarbeit bedanken.
Herrn Dr. Nils Baumann danke ich für die Einführung in das und die Unterstützung beim fluoreszenzspektroskopischen Messen und Herrn Dr. Vinzenz Brendler danke ich für die zahlreichen Diskussionen zur Auswertung der TRLFS-Spektren.
Danksagung
Mein Dank gilt auch den nicht namentlich genannten Mitarbeiterinnen und Mitarbeitern des Institutes für Radiochemie für ihre stets freundliche und hilfsbereite Zusammenarbeit. Ohne sie wäre diese Arbeit nicht möglich gewesen.
Nicht zuletzt möchte ich mich bei meiner Freundin Sina Brockmann für ihre Geduld und Rücksichtnahme in den zurückliegenden Monaten bedanken.
Insbesondere möchte ich auf diesem offiziellen Weg meinen Eltern Danke sagen. Sie haben mir diese Universitätsausbildung ermöglicht, mir jederzeit und in jeder Hinsicht zur Seite gestanden und mich nicht zuletzt fortlaufend ermuntert, diese Doktorarbeit fertig zu stellen.
1. Motivation und Zielstellung
Die Hinterlassenschaften des ehemaligen Uranerzbergbaus und die Notwendigkeit der Errichtung von Endlagern, für abgebrannte Brennelemente aus Kernkraftwerken führen dazu, dass das Verhalten von umweltrelevanten Actiniden weltweit zunehmend in den Blickpunkt rückt. In diesem Zusammenhang spielt vor allem das radioaktive und stark toxische Element Uran eine große Rolle. Sowohl in gefluteten Bergwerken, als auch in Abraumhalden, welche atmosphärischen Niederschlägen ausgesetzt sind, besteht ein großes Risiko des Eintrages von migrierendem Uran in den Lebensraum des Menschen. Der Haupteintragsweg ist dabei der Wasserpfad. Gelöstes Uran, aber auch an Nanopartikel sorbiertes Uran, Uraneigenkolloide und Uranpräzipitate können mit Hilfe von eindringendem Wasser aus der Grube oder dem Endlager ausgespült und ins Grundwasser eingetragen werden. Die Immobilisierung des Urans aus der Wasserphase, durch Bestandteile der natürlichen Umgebung, wurde anhand von Sorptionsexperimenten an verschiedenen Mineralphasen (Baumann et al., 2005), Komplexbildungs- und Redoxuntersuchungen mit verschiedenen organischen und anorganischen Liganden (Fonseca et al., 2004; Sachs et al., 2007) und Reaktionen des Urans mit planktonischen Bakterienreinstkulturen (Sheloblina et al., 2004; Nyman et al., 2006) bereits vielfach untersucht. Da aber mit 99 % der größte Teil der auf der Erde lebenden Mikroorganismen nicht planktonisch sondern in Form von Biofilmen auftritt (Flemming 1994), sind die hier gefundenen Ergebnisse nur begrenzt auf umweltrelevante Prozesse übertragbar. Diese Wechselwirkungen zwischen Uran und Biofilmen, der bevorzugten Lebensform der Mikroorganismen in der Natur, wurden bis jetzt jedoch nur unzureichend untersucht.
Zielstellung dieser Arbeit ist es, die möglichen Wechselwirkungen von Uran mit Biofilmen und Biofilmbestandteilen zu untersuchen. Dafür ist es besonders wichtig, die Bindungsformen des Urans im Biofilm in Abhängigkeit von der Oxidationsstufe des Urans und von den geochemischen Parametern innerhalb des Biofilms aufzuklären. Zur Realisierung dieser Zielstellung sollte durch die Kopplung der konfokalen Laser Scanning Mikroskopie (CLSM) und der laserinduzierten Fluoreszenzspektroskopie (LIFS), eine Methode entwickelt werden, mit welcher Uran innerhalb von verschiedenen Biofilmen, in naturrelevanten Konzentrationen, in situ und nahezu zerstörungsfrei untersucht werden kann. Eine solche zerstörungsfreie Untersuchung erlaubt das Vermessen von ein und derselben Biofilmprobe zu
Motivation und Zielstellung
verschiedenen Stadien des Wachstums. Die konfokale Mikroskopie soll innerhalb dieses Systems eine räumliche Darstellung der zu untersuchenden Proben gewährleisten. Dies führt dazu, dass der Biofilm hinsichtlich seiner Struktur (Kolonien, extrazelluläre polymere Substanzen [EPS], Zellen) charakterisiert werden kann. Im untersuchten Biofilmsystem gefundenes immobilisiertes Uran soll somit im dreidimensionalen Raum der Probe dargestellt und lokalisiert werden. Die chemische Charakterisierung des im Biofilm immobilisierten Urans, hinsichtlich seiner chemischen Umgebung und seines Oxidationszustandes, soll zeitgleich vom kombinierten System mit Hilfe der laserinduzierten Fluoreszenzspektroskopie durchgeführt werden. Das System soll somit sowohl visuelle, strukturelle (mikroskopische) als auch chemische (spektrale) Informationen über die zu untersuchende Probe wiedergeben.
Die mit dieser Methode gewonnenen kombinierten Daten sollen einen deutlichen Beitrag zur Aufklärung der Wechselwirkungen von Uran im Biofilm und dessen Bindungsverhalten im Biofilm liefern. Nach dem Aufbau des gekoppelten mikroskopischen und spektroskopischen Systems soll dieses hinsichtlich seiner Sensitivität gegenüber der Urankonzentration an verschiedenen Modellsystemen getestet, und auf Biofilmsysteme überführt werden. Zur Unterstützung der dabei gewonnen Daten, sollen die Proben zur Gewinnung von verschiedenen geochemischen Parametern, zusätzlich mit Hilfe von Mikrosensoren untersucht werden.
2. Biofilme
Der größte Teil der auf der Erde lebenden Mikroorganismen (99%) lebt in Aggregaten in Form von Flocken, Filmen, Matten und Schlämmen (Flemming, 1994). Diese Lebensform der Mikroorganismen ist mit einem Alter von 3,5 Milliarden Jahren die älteste bekannte Form des gemeinsamen Lebens und wird als Biofilm bezeichnet (Schopf et al., 1983). Nach Costerton et al. (1995), handelt es sich bei Biofilmen um, in eine Matrix eingebettete, an einer Phasengrenzfläche aufgewachsene Bakterienpopulationen. Obwohl die Bakterienspezies in Biofilmen zumeist dominieren, können je nach Standort auch andere Mikroorganismen, wie zum Beispiel Pilze, Algen und tierische Einzeller vorhanden sein (Flemming und Wingender, 2001). In allen Erscheinungsformen sind die Mikroorganismen in einer Matrix aus extrazellulären polymeren Substanzen (EPS) eingebettet. Die EPS spielen in dieser Form des organisierten Lebens nicht nur als Einbettmedium, sondern unter anderem auch beim Schutz der Mikroorganismen vor Umweltgiften eine zentrale Rolle (Flemming und Wingender, 2000).
2.1. Vorkommen und Bildung von Biofilmen
Obwohl wir sie kaum wahrnehmen, sind Biofilme in unserer Umgebung allgegenwärtig. Sie bieten den Mikroorganismen einen speziellen Lebensraum, der sie schützt und verschiedenste Synergieeffekte begünstigt. Zur Entstehung der Biofilme müssen in der Umgebung die folgenden Voraussetzungen gegeben sein:
• Es müssen Grenzflächen (Wasser/Feststoff; Feststoff/Luft; Wasser/Luft),
• genügend Wasser,
• mikrobiell verwertbare Nährstoffe und
• die Mikroorganismen selbst vorhanden sein.
Da es Mikroorganismen gibt, die sich an extreme Umgebungen angepasst haben, können auch lebensfeindliche natürliche Biotope, wie zum Beispiel schwefelhaltige heiße Quellen, hypersaline und saure Seen, Heißwassersysteme, arktische Zonen oder heiße Wüsten sowie bidestilliertes Wasser von ihnen besiedelt werden (Krumbein und Villbrandt, 1993). Sogar in hoch bestrahlten Bereichen von Kernkraftwerken (Flemming, 1991), in mit toxischen Schwermetallen beladenen sauren Grubenwässern (Bond et al., 2000) und mit Schwefelsäure gelaugten Uranminen (Panak et al., 1998) wurden Biofilme gefunden. Somit gibt es in der
Biofilme
Umwelt praktisch keine Oberfläche, die nicht von Mikroorganismen besiedelt ist oder besiedelt werden kann (Flemming und Wingender, 2000).
Die Lebensvorgänge von Bakterien innerhalb der Biofilmgemeinschaft unterscheiden sich signifikant von denen in freier Suspension (planktonische Lebensweise). Zu den wichtigsten Eigenschaften eines Biofilms gehört, dass die Zellen stabile Gemeinschaften bilden können in denen verschiedene Spezies in Synergie zusammen leben. Diese Gemeinschaft wird von der EPS-Matrix über längere Zeit stabil gehalten (Flemming, 2000). In durchströmten Gewässern und Bioreaktoren werden somit einzelne Bakterien, die sich innerhalb eines Biofilms befinden nicht so leicht ausgespült. Das Leben in solch einer Gemeinschaft erlaubt die sequentielle Verwertung von schwer abbaubaren Substanzen. Da die EPS-Matrix auch als Nährstoff- und Wasserspeichermedium fungiert, ist das Leben im Biofilm, gerade in nährstoffarmer Umgebung eine Überlebensstrategie (Fletcher, 1991). Innerhalb eines solchen Biofilms werden durch Sauerstoffgradienten ökologische Nischen geschaffen, welche sowohl aeroben als auch anaeroben Bakterien eine Lebensgrundlage bieten (De Beer et al., 1994). Weitere Vorteile für das Leben innerhalb der Biofilmgemeinschaft liegen im besseren Schutz der Bakterien vor Stoßbelastungen, pH-Extremen und Salzbelastungen. Die Schutzwirkung der EPS vor Umweltgiften (Geesey et al., 1988), Bioziden und Antibiotika (Costerton und Lashen, 1984) spielt unter anderem eine zentrale Rolle in der Medizin. Die Wirksamkeit von Penicillin zum Beispiel wird in Biofilmen, deren Zellen Beta-Lactamasen absondern, äußerst gehemmt. Die Antibiotika werden von den Enzymen schneller abgebaut, als sie durch Diffusion nachgeliefert werden können. Somit bleiben die tieferen Zonen des Biofilms von den Antibiotika unbehelligt (Costerton und Stewart, 2001).
Biofilme sind heterogene Systeme. Trotz der großen Vielfalt und Komplexität der Faktoren, die die Bildung eines Biofilms beeinflussen, kann dessen Entwicklung grundsätzlich in verschiedene Phasen unterteilt werden (Flemming, 1994; Flemming und Wingender, 2001).
Voraussetzung für das Anwachsen eines Biofilms an einer Phasengrenzfläche ist es, dass die Mikroorganismen durch Transportvorgänge zur Oberfläche gelangen. Dieser Transport erfolgt überwiegend durch Konvektion bis zu einer laminaren Grenzschicht, in der die Fließgeschwindigkeit bis zur Oberfläche hin vollständig abnimmt. Die eigentliche Entstehung von Biofilmen basiert prinzipiell auf der Anheftung von Mikroorganismen an das Substrat (Aufwuchsoberfläche), der Vermehrung zu Mikrokolonien und deren Zusammenwachsen zu reifen Biofilmen (Abbildung 2-1). Diese Phasen der Biofilmbildung konnten von Großmann
et al. (2005) im Rahmen einer rasterelektronenmikroskopischen Studie beobachtet werden (Abbildung 2-2).
Abbildung 2-1: Schematische Darstellung der Biofilmbildung an einer Oberfläche (nach: Environmental Biotechnology CRC Pty Ltd.)
Im Allgemeinen wird bei der Adhäsion der Bakterien an das Substrat nicht direkt die Oberfläche des Substrates besiedelt, sondern ein so genannter „conditioning film“. Dieser Film besteht aus irreversibel adsorbierten organischen Makromolekülen (z.B. Huminstoffe) und wird innerhalb von Sekunden in fast allen Umgebungen an der Oberfläche gebildet (Flemming, 1991). Die Besiedlung der Oberfläche ist zunächst noch reversibel, kann aber auf Grund zunehmender Wechselwirkungen zwischen dem Substrat und den Mikroorganismen beziehungsweise deren EPS irreversibel werden. Weitere Ansiedlungen von Bakterien und bakterielles Wachstum führen zur Ausbildung von Mikrokolonien auf dem Substrat (Bishop, 1997). Sobald sich die ersten Bakterien auf der Oberfläche angesiedelt haben (die sogenannten Primärbesiedler), besteht die Möglichkeit, dass Bakterien anderer Arten indirekt über diese Zellen der Primärbesiedler an der Oberfläche fixiert werden (Sekundärbesiedler).
Charakteristisch für diese Phase der Biofilmbildung ist die Auslösung der EPS-Produktion.
Verschiedene Studien zeigten, dass innerhalb dieses Stadiums der Biofilmbildung die biofilminterne Kommunikation der Bakterien, das so genannte „quorum sensing“ eine wichtige Rolle spielt (O’Toole und Kolter, 1998; Pesci und Iglewski, 1999; Parsek und Greenberg, 2000; Loo et al., 2000). Bei dieser Kommunikationsform werden von den einzelnen Bakterien, Signalmoleküle gebildet und ausgeschieden, die von anderen Bakterien wieder aufgenommen werden. Li et al. (2002) untersuchten in diesem Zusammenhang die Möglichkeit zur Biofilmbildung von Streptococcus mutans Mutanten, bei denen einige Gene
Biofilme
des quorum sensing Signalsystems deaktiviert wurden. Dabei stellte sich heraus, dass diese Bakterien im Vergleich zu nicht genetisch veränderten Streptococcus mutans Spezies einen abnormalen Biofilm bildeten.
Abbildung 2-2: Rasterelektronenmikroskopische Aufnahmen der Entwicklung eines Pseudomonas aeruginosa Biofilms auf einer Biotitoberfläche im wässrigem System; a,b,c) zunehmende Besiedlung der Oberfläche durch reversible und irreversible Adhäsion, d) EPS – Produktion und Bildung einer Mikrokolonie, e) Vernetzung der Mikrokolonien untereinander auf der Biotitoberfläche, f) reifer Biofilm (Großmann et al., 2005)
Biofilme können so lange wachsen, bis sich ein Gleichgewicht zwischen der Neubildung des Biofilms und der, durch Umgebungsbedingungen beeinflussten Ablösung des Biofilms
einstellt (Plateau-Phase). Die Ablösung der Biofilmorganismen kann zum Beispiel durch Scherkräfte erfolgen. Dabei werden die Mikroorganismen als einzelne Zellen abgelöst (Erosion), oder als ganze Biofilmfetzen entfernt (Sloughing). Es gibt aber auch Hinweise, dass die Mikroorganismen den Biofilm aktiv in Form von Schwärmerzellen verlassen (Flemming und Wingender, 2001).
2.2. Aufbau und Struktur von Biofilmen
In den Anfängen der Biofilmforschung (1978-1990) wurden Biofilme als unstrukturierte in EPS gebettete Ablagerung von bakteriellen Zellen verstanden (Donlan und Costerton, 2002).
Es wurde davon ausgegangen, dass sich Biofilmeigenschaften wie Porosität, Porengrößenverteilung, Dichte und Populationsvielfalt mit steigender Biofilmdicke kaum ändern. Diese Annahme basierte auf fehlerhaften Analysetechniken, wie zum Beispiel der Elektronenmikroskopie, bei welcher aufgrund des benötigten Hochvakuums nur ein dehydrierter Biofilm untersucht werden konnte. Mit der Einbeziehung der konfokalen Laser Scanning Mikroskopie (CLSM) und der damit erzielten dreidimensionalen Auflösung in Biofilmuntersuchungen wurde herausgefunden, dass Biofilme keine strukturell homogenen Einfachschichten von Bakterien auf einer Oberfläche sind, sondern als heterogen in Zeit und Raum beschrieben werden können (Lewandowski, 2000). Lebende, hydratisierte Biofilme können im Gegensatz zur Elektronenmikroskopie mit der CLSM untersucht werden. Solche hydratisierten Biofilme bestehen aus Zellen (etwa 15 Vol%) und Matrixmaterial (etwa 85 Vol%) (Donlan und Costerton, 2002). Die Zellen sind dabei in eine Matrix aus extrazellulären polymeren Substanzen in Form von Türmen oder Pilzen eingebettet (Abbildung 2-3). Diese Pilz- und Turmeinheiten werden Mikrokolonie genannt und bilden den strukturellen und funktionellen Hauptbestandteil eines Biofilms (Costerton, 1995). Mikrokolonien können aus einer oder mehreren verschiedenen Bakterienspezies bestehen, wobei jede Biofilmzelle in einer räumlich abgegrenzten Mikronische lebt, deren Charakteristika das Zellverhalten beeinflussen (Costerton et al., 1994). Wasserkanäle und Poren durchsetzen den Biofilm zwischen den einzelnen Mikrokolonien (Lawrence et al., 1991) und befördern die Umgebungslösung in Form eines konvektiven Transportes (de Beer et al., 1994a). Dabei bilden sie ein weit verzweigtes Transportsystem aus, das bis auf das Substrat reichen kann.
Der mittlere Porendurchmesser nimmt dabei von der Grenzfläche Biofilm/Wasser zum Substrat hin ab (Bishop, 1997). Studien an Reinkulturbiofilmen und Mischkulturbiofilmen zeigen, dass diese Struktur mit einigen Variationen universal ist (Donlan und Costerton,
Biofilme
2002). Beispielweise wurde bei erhöhten Scherkräften eine Deformation der Mikrokoloniestruktur zu einer Kaulquappen–Form, welche in der Lösung schwingt beobachtet (Stoodley et al., 1998). Weitere wichtige strukturelle Charakteristika von Biofilmen sind das sporadische Aufbrechen einzelner Mikrokolonien und das Ablösen von Biofilmfetzen und einzelnen Bakterien von der Oberfläche. Ausgelöst werden die beiden letztgenannten Prozesse dann, wenn die Dehnbarkeit der Biofilmmatrix überschritten ist.
Diese Freisetzungsprozesse haben einen großen Einfluss in der Medizin, da sie für das Ausbrechen von chronischen, bakteriellen Infektionen verantwortlich sind.
Abbildung 2-3: Schematische Darstellung einer Biofilmstruktur (nach Costerton, 1995). Zu sehen sind die EPS- geformten pilzartigen Strukturen mit den eingebetteten Bakterien, welche von Poren und Kanälen durchzogen sind. Die blauen Pfeile deuten den konvektiven Transport innerhalb der Kanäle an.
Wichtige Hinweise auf die Heterogenität von Biofilmen bieten zudem Studien mit Mikrosensoren. Die effektive Sauerstoffdiffusion beispielsweise sinkt von der Biofilm/Wasser Grenzfläche zur Grenzfläche Biofilm/Substrat ab (Bishop, 1997). Da innerhalb der Pilzstrukturen nicht der konvektive sondern der diffusive Stofftransport dominiert (de Beer et al., 1994 a), kann dies die Bildung anaerober Bereiche zur Folge haben.
Dies geschieht dann, wenn aerobe Mikroorganismen an der Oberfläche den Sauerstoff schneller veratmen als er nachdiffundieren kann. De Beer (1994) zeigte, dass innerhalb eines in aerober Umgebung aufgewachsenen Biofilms komplett anaerobe Abschnitte vorhanden sein können. Diese Heterogenität tritt nicht nur beim Sauerstoff auf, sondern auch bei allen
anderen wichtigen Faktoren, wie zum Beispiel Stoffwechselprodukten und pH-Werten (Flemming und Wingender, 2001).
Um den Aufbau eines Biofilms, seine Struktur und Stabilität, und die in ihm ablaufenden Transportmechanismen zu verstehen, ist eine genaue Kenntnis der Eigenschaften der EPS, welche die Schlüsselmoleküle für die Organisationsform „Biofilm“ darstellen, erforderlich (Sutherland, 2001). Dies ist eine Grundlage für die biotechnische Nutzung von Biofilmen sowie für die Erarbeitung von Maßnahmen zur Kontrolle und Bekämpfung unerwünschter Biofilme.
Extrazelluläre polymere Substanzen sind definiert als biologische Polymere mikrobiellen Ursprungs, die an der Bildung mikrobieller Aggregate beteiligt sind (Geesey, 1982). Die EPS- Matrix in Biofilmen ist sehr heterogen aufgebaut und ihre Bestandteile können stark variieren, je nachdem welche Mikroorganismen zugegen sind und unter welchen Nährstoffbedingungen, beziehungsweise hydrodynamischen Bedingungen sie leben (Flemming und Wingender, 2001). Sowohl Prokaryonten (Bakterien, Archaea) als auch Eukaryonten (Algen, Pilze) sind im Biofilmverband fähig EPS zu produzieren (Flemming und Wingender, 2002). Die meisten EPS sind Makromoleküle, die sich aus wiederholenden, ähnlichen oder identischen Untereinheiten zusammensetzen. Diese Makromoleküle bilden zusammen mit Wasser, was mit bis zu 98 Masse-% (Wingender et al., 1999) den Hauptbestandteil der EPS darstellt, ein stark hydratisiertes Gel. Der Anteil der EPS an der gesamten organischen Matrix im Biofilm variiert zwischen 50 und 90% (Francis, 1998; Madsen und Alexander, 1985). Beim verbleibenden Teil handelt es sich um Zellen. In Tabelle 2-1 sind die wichtigsten Komponenten der EPS und deren Anteil am Gesamtsystem EPS zusammengestellt.
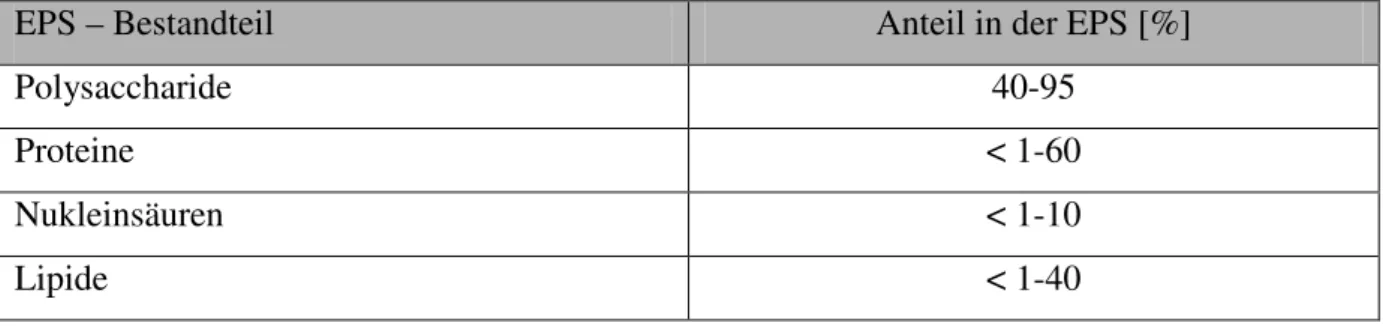
Tabelle 2-1: Zusammensetzung von extrahierter EPS und der Anteil der Einzelkomponenten am Gesamtsystem EPS (Flemming und Wingender, 2002)
EPS – Bestandteil Anteil in der EPS [%]
Polysaccharide 40-95
Proteine < 1-60
Nukleinsäuren < 1-10
Lipide < 1-40
Welche Bestandteile bei der Isolierung von EPS aus Biofilmen gefunden werden ist sehr stark von der Isolierungsmethode abhängig. Die am besten untersuchten Komponenten der EPS sind die Polysaccharide. Aus diesem Grund ist es auch heute noch eine weit verbreitete, aber
Biofilme
nicht zutreffende Annahme, dass die EPS im Wesentlichen aus Polysacchariden bestehen (Flemming und Wingender, 2000). Neben den Polysacchariden können aber auch Proteine einen Hauptbestandteil der EPS ausmachen und sogar mengenmäßig dominieren (Jahn et al., 1999). Bei Biofilmen acidophiler Organismen auf Pyrit wurden Lipide als Hauptbestandteile der EPS-Matrix nachgewiesen (Sand und Gehrke, 1999). In verschiedenen Studien werden auch Huminstoffe der Definition der EPS zugeordnet. Bei Huminstoffen handelt es sich aber nicht um EPS im engeren Sinne, da diese nicht bei der Biofilmbildung von den Bakterien abgesondert werden, sondern bereits im natürlichen Medium vorliegen. Die zwischen den Makromolekülen der EPS vorherrschenden Wechselwirkungen beruhen nicht auf kovalenten Bindungen, sondern auf sogenannten schwachen Wechselwirkungen. Im Prinzip kommen für diese Bindungsform drei Typen von Wechselwirkungen in Frage (Flemming und Wingender, 2000):
• Hydrophobe Wechselwirkungen (Van-der-Waals-Kräfte; Bindungsenergie 2,5 kJ/mol),
• Elektrostatische Wechselwirkungen (Bindungsenergie 12-29 kJ/mol) und
• Wasserstoffbrückenbindungen (Bindungsenergie 10-30 kJ/mol).
Zusätzlich ist noch die Verflechtung und Verknotung fädiger Makromoleküle (Entanglement) bei der Bindungsbetrachtung mit einzubeziehen. Definitionsgemäß sind die EPS außerhalb der Zellen lokalisiert. Dahin gelangen sie, durch:
• die aktive Sekretion,
• die Ablösung von Bestandteilen der äußeren Membran (Gram–negative Zellen) oder der Zellwand (Gram–positive Zellen),
• die Lysis von Zellen, beziehungsweise
• die Sorption aus der wässrigen Umgebung.
Vom Standpunkt der mikrobiellen Ökologie aus hat die EPS somit zusammenfassend die wichtige Funktion der Bereitstellung einer gelförmigen Matrix, in der die Mikroorganismen über längere Zeiträume hinweg immobilisiert sind. Dies soll mit einem minimalen Aufwand an Energie und Material geschehen. Die Tatsache, dass nur etwa 1 bis 2 Vol% EPS zur Bindung von etwa 98 bis 99 Vol% Wasser benötigt werden, zeigt die Effizienz dieser Strategie (Flemming und Wingender, 2001).
2.3. Bedeutung von Biofilmen
Biofilme gelten als die älteste Lebensform. Es wird davon ausgegangen, dass im Verlauf der Evolution innerhalb solcher Biofilme, Mikroorganismen entstanden sind, die zur Photosynthese fähig waren und somit den ersten Sauerstoff in die ursprünglich anaerobe Erdatmosphäre eingebracht haben (Franck und Stadelhofer, 1988). Auch bei der Bildung von fossilen Brennstoffen und Lagerstätten verschiedener Elemente wie zum Beispiel Eisen, Kupfer, Blei, Uran und Schwefel sind Biofilme beteiligt (Ehrlich, 1996). Chemolithotrophe Bakterien, welche Gestein besiedeln, können durch die Abscheidung von komplexbildenden Substanzen und verschiedenen Säuren die Verwitterung der Gesteine beschleunigen. Da bei der Gesteinsverwitterung verschiedene für die Mikroorganismen essentielle Metallionen, wie Eisen und Mangan herausgelöst werden, tragen die Biofilme maßgeblich zur Bioverfügbarkeit der Metallionen bei (Schopf et al., 1983). Eine wichtige Rolle für den Stoffwechsel von Pflanzen spielen Biofilme, die sich an den Wurzeln von Pflanzen (Rhizosphäre) gebildet haben. Die Rhizosphäre gilt als „hot spot“ für die mikrobielle Besiedelung (Bolton et al., 1993). Die Ursache hierfür liegt in der hohen Konzentration und Verfügbarkeit von Nährstoffen im Wurzelbereich. Die Mikroorganismen nutzen dabei sowohl Zellinhaltsstoffe abgestorbener Wurzelzellen, als auch die von den Wurzeln aktiv abgegebenen Stoffe als Nahrungsquelle.
In der heutigen Zeit werden Biofilme in die Gruppen „erwünschte Biofilme“ und
„unerwünschte Biofilme“ unterteilt. Gerade in der Technik gibt es dabei eine Vielzahl von
„unerwünschten Biofilmen“, welche zu großen Kosten und Problemen führen können.
Beispiele hierfür sind Biofilme auf Wärmetauschern. Diese Biofilme wirken, sobald sie den Wärmetauscher besiedeln, wie Isolatoren und behindern somit den Wärmefluss. In der Wasseraufbereitung können Biofilme zu so genanntem „Biofouling“ führen, was Akkumulationen, bis hin zu Verstopfungen der Wasserleiter zur Folge hat (Flemming, 2002).
Ein weiters Problem stellt die mikrobiologische Materialzerstörung dar (Schweisfurth und Heitz, 1989; Gaylarde und Morton, 2002). Bei metallischen Materialien können Biofilme die
„mikrobiologisch induzierte Korrosion“ verursachen, wobei durch den Stoffwechselumsatz der Mikroorganismen die chemische Zusammensetzung des umgebenden Mediums verändert wird. So sind beispielsweise starke pH-Absenkungen durch Säurebildung möglich oder es werden Korrosionsinhibitoren aufgebaut (Linhardt, 1999). Neben technischen Problemen können Biofilme auch eine medizinische, beziehungsweise hygienische Konsequenz aufweisen. An der Zerstörung des Zahnschmelzes zum Beispiel sind Biofilme als so
Biofilme
genannter „Plaque“ beteiligt. Biofilme können weiterhin als Infektionsquelle fungieren. Dabei dienen sie Krankheitserregern als Unterschlupf und Lebensraum, der diese gegenüber Antibiotika, Desinfektionsmitteln oder der Immunabwehr des Wirtes schützt. Nach heutigen Erkenntnissen kommen pathogene Mikroorganismen nur vorübergehend in natürlichen Biofilmen vor (Flemming und Wingender, 2001; Heuberger, 1999). Eine Vielzahl der Bakterien in Biofilmen besitzt eigentlich keine pathogene Wirkung. Jedoch können selbst diese fakultativ pathogenen Bakterien im Biofilmverband, in großen Dichten vorkommend, zu Komplikationen für den Wirtsorganismus führen (Heuberger, 1999).
Bei den „erwünschten Biofilmen“ handelt es sich um Biofilme welche technisch genutzt werden können. Dies geschieht vor allem im großen Maßstab in der Abwasserreinigung. Hier gibt es verschiedene Biofilm-Techniken, die meist nach den jeweiligen Reaktortypen benannt sind. Als Beispiele hierfür können Tropfkörper Reaktoren (Pöpel, 1964), Fluidbett-Reaktoren (Mishra und Sutton, 1991) und Sandfilter mit Nitrifikation und Denitrifikation (Müller und Sekulov, 1975) genannt werden. Die Reinigung von Abluft kann ebenfalls mittels Anwendung von Biofilmen erreicht werden (Bardtke, 1990). Auch für die Beseitigung fester Abfälle kann das mikrobielle Abbaupotential genutzt werden (Tabasaran und Bidlingmaier, 1981). Im Bereich der Biotechnologie werden Biofilme zum Beispiel für die Herstellung von Essig durch Mikroorganismen, die auf Buchenholzspänen haften und den Alkohol aus der flüssigen Phase umsetzen, genutzt. Ein weiterer interessanter Bereich, in dem Biofilme im großen Umfang genutzt werden, ist die mikrobielle Erzlaugung (Ehrlich und Brierley, 1990).
Schwefeloxidierende Bakterien setzen dabei die Metall-Kationen von sulfidischen Erzen frei.
Der gleiche Vorgang, jedoch nicht vom Menschen gefördert, findet auch in Abraumhalden statt und führt somit zu stark sauren und schwermetallbelasteten Sickerwässern (Acid Mine Drainage).
2.4. Wechselwirkungen von Schwermetallen mit Biofilmen
Da Biofilme sich an Grenzflächen der Wasserphase ansiedeln, spielen sie auch bei ablaufenden Sorptions- und Desorptionsprozessen und bei der eventuellen Umsetzung sorbierter Stoffe eine wichtige Rolle (Flemming et al., 1996). Der Einfluss, den sie dabei auf die Bestimmung von Sorptionsisothermen ausüben, ist in vielen Fällen unbekannt. Das von Biofilmen sorbierte Material ist entweder biologisch abbaubar, und kann somit in den Metabolismus aufgenommen werden, oder es wird vom Biofilm chemisch modifiziert, beziehungsweise unverändert gespeichert (Flemming und Leis, 2002). Biofilme bieten somit
eine Quelle und eine Senke für sorbierte Substanzen. Die sorbierten Stoffe können von Biofilmen direkt aus dem fließenden Medium akkumuliert werden (Geesey, 1987) und in Form von anorganischen Ionen, organischen Substanzen, Ausfällungen, Partikeln und Wasser vorhanden sein. Grob lassen sich im Biofilm vier sehr verschiedene Sorptionsbereiche unterscheiden (Flemming und Leis, 2002):
• EPS (Wingender und Flemming, 1999; Geessey und Jang, 1990) o Geladene Gruppen (COO-; SH-; SO42-; H2PO4-…)
o Unpolare Gruppen (Aromaten, Aliphaten, hydrophobe Regionen in Polysacchariden)
• Zellwände (Doyle, 1989)
o Äußere Membran der gram-negativen Zellen (Lipide)
o Murein oder Teichonsäure (Peptidoglycan) für gram-positive und gram- negative Zellen, wobei der Beitrag bei gram-negativen Bakterien sehr gering ist
• Cytoplasmatische Membran (Lipide)
• Cytoplasma (Ford und Mitchell, 1992).
Die Sorption von Substanzen kann sowohl aktiv als auch passiv erfolgen (Flemming und Leis, 2002). Unter aktiver Bindung wird die Absonderung von Chelatbildnern und Ausfällungsprodukten durch die Bakterienzelle, als direkte Reaktion auf das Auftreten der Substanz verstanden. Auch die Aufnahme von Schwermetallen ins Cytoplasma durch das Stofftransportsystem ist eine Form der aktiven Bindung. Die Adsorption durch bakterielle Oberflächen wird als passive Bindung bezeichnet und geschieht durch elektrostatische Wechselwirkungen zwischen der kationischen Substanz und den anionischen Gruppen auf der Zelloberfläche. Die passive Bindung wird durch Ionenaustausch, hauptsächlich in der EPS und in der Zellwand, durch Ausfällung und durch komplexierende Biofilmkomponenten, die immer präsent sind und nicht als direkte Reaktion auf die gebundene Spezies gebildet werden, ausgelöst.
Biofilme zeigen ein sehr großes Bindungsvermögen für Wasser, das sie aus der Umgebung aufnehmen. Gut hydratisierte Biofilme können aus 85-98% Wasser bestehen. Der Großteil des Wassers ist dabei in der EPS gebunden. Der exakte Bindungsmechanismus ist jedoch nicht klar. Die Definitionen von „stark gebundenem“ und „schwach gebundenem“ Wasser sind rein hypothetisch (Marcus, 1995).
Metalle und organische Stoffe können im Biofilm auf verschiedenen Wegen aufgenommen werden. Beispielsweise ergaben Studien, dass Schwermetalle, wie Zn, Cd und Ni
Biofilme
überwiegend an den Zellwänden gebunden werden, während Benzol, Toluol und Xylol (BTX) eher an der stark hydratisierten EPS-Matrix binden (Späth et al., 1998). Aber auch die EPS kann eine breite Vielfalt an Metallen binden. Beispiele hierfür sind Pb2+, Co2+, Ag+ und Fe2+. Theoretische Abschätzungen, basierend auf der Anzahl der verfügbaren Carboxyl- und Hydroxylgruppen im Biofilm, deuten auf eine hohe Bindungskapazität, vor allem für saure Polysaccharide hin (Flemming und Leis, 2002). Die Affinität der EPS Metalle zu binden variiert abhängig vom spezifischen Metall und den beteiligten Mikroorganismen (Geessey und Jang, 1990). Untersuchungen ergaben, dass einige EPS sogar eine hohe Affinität für Metallpartikel aufweisen (Mittelman und Geesey, 1985; Scott et al., 1986).
Biosorption konnte zudem auch für verschiedene Pestizide (Paris et al., 1977) und Herbizide (Urey et al., 1976) nachgewiesen werden. Abgetöteter Belebtschlamm wies in diesen Untersuchungen ähnliche Anreicherungsdaten wie lebende Zellen auf, was auf einen Sorptionsvorgang durch Lipide ohne Stoffwechselvorgänge hindeutet.
Für Uran kommen im Biofilm verschiedene Möglichkeiten der Wechselwirkung in Frage.
Beispielsweise konnte von Panak et al. (1998) anhand von aus Uranminen isolierten Bakterien der Spezies Thiobacillus ferrooxidans ATCC 33020 gezeigt werden, dass dieser Stamm in der Lage ist, Uran in die Bakterienzelle aufzunehmen, beziehungsweise an der bakteriellen Zellwand zu binden. Weiterführende Studien mit diesem Bakterienstamm zeigten, für den Hauptteil des Urans, eine irreversible Bindung an der Biomasse (Panak et al., 1999). Untersuchungen mit Hilfe der TRLFS belegten hier die Bildung von innersphärischen Komplexen zwischen Uran und den Bakterien. Eine Möglichkeit der passiven Wechselwirkung von Bakterien mit Uran zeigt der Stamm UFZ B375 (Babel et al., 2000).
Diese Bakterien metabolisieren Sulfat zu Schwefelwasserstoff oder Sulfid. Dabei steigt im Zuge der Sulfatreduktion der pH-Wert und Uran fällt als Metallsulfid aus. Auch mikrobiologisch beeinflusste Redoxreaktionen von Uran wurden bereits beobachtet. Wu et al.
(2006) beobachteten beispielsweise die durch Anaeromyxobacter dehalogenans 2CP-C hervorgerufene Reduktion von gelöstem sechswertigem Uran in die vierwertige Oxidationsstufe. Während dieser Studien konnte gezeigt werden, dass es sich bei dem Elektronendonor zur Uran(VI)-Reduktion dieser Versuche um Wasserstoff handelt.
Umgekehrt, sind auch Uran oxidierende Bakterien sind bekannt. Beispielsweise untersuchten DiSpirito und Tuovinen (1982) die Reaktionskinetik der Oxidation von Uran(IV) durch Thiobacillus ferrooxidans. Dabei fanden sie heraus, dass die Reaktionskinetiken auf einen direkten biologischen Oxidationsmechanismus hinweisen. Auch für verschiedene, mögliche
EPS-Bestandteile wurden bereits Wechselwirkungen mit Uran nachgewiesen. So konnten Koban et al. (2003) mittels TRLFS und potentiometrischer Titration im pH-Bereich von pH 3 bis pH 10 eine Komplexbildung zwischen α-D-glucose 1-phosphat und Uran nachweisen.
Studien zu Wechselwirkungen von Huminsäuren mit Uran zeigten ebenfalls die Bildung von Urankomplexen (Sachs et al., 2007). Auch Komplexbildungsreaktionen von verschiedenen Nukleinsäuren und Proteinen mit Uran konnten bereits nachgewiesen werden (Chevari und Likhner, 1969). Allen genannten Studien der Wechselwirkungen mit Uran ist jedoch gemeinsam, dass die Wechselwirkungen lediglich mit einer einzelnen Bakterienspezies oder einem einzelnen Reagenz, nicht aber mit einem komplexen Biofilmsystem durchgeführt wurden. Um die Prozesse, der mikrobiellen Uransanierung besser beherrschen und großtechnisch nutzbar machen zu können ist es wichtig, die einzelnen Wechselwirkungen und Bindungsformen zwischen Uran und Biofilm zu verstehen.
Fluoreszenzspektroskopie und –mikroskopie des Urans
3. Uran
Uran (Uranium IUPAC) ist mit der Ordnungszahl 92 und einer Atommasse von 238,0289 g/mol das schwerste natürlich vorkommende Element. Entdeckt wurde es 1789 von dem deutschen Chemieprofessor und Apotheker Martin Heinrich Klaproth (1743-1817) in Form eines aus dem Mineral Pechblende isolierten Oxides (UO2). Das Element wurde von seinem Entdecker nach dem Planeten Uranus benannt. Mit einem Anteil von 2-4 mg Uran pro Kilogramm Erdkruste ist das Element relativ häufig vertreten (Craft et al., 2004). Uran gehört zur Reihe der Actinoide (Actinide), welche die Elemente der Ordnungszahl 89 (Actinium) bis 103 (Lawrencium) umfasst, und durch die schrittweise Auffüllung der 5f-Elektronenschale gekennzeichnet ist. Die Elektronenkonfiguration des Urans wird dabei wie folgt beschrieben (Greenwood und Earnshaw, 1990):
1s22s22p63s23p63d104s24p64d104f145s25p65d105f36s26p66d17s2.
Wie alle Actinoide unterliegt auch Uran dem radioaktiven Zerfall. Beispielsweise sind die Isotope 238U und 235U Ausgangsnuklide für zwei von drei der natürlichen Zerfallsreihen (238U:
Uran-Radium-Reihe; 235U: Uran-Actinium-Reihe). Insgesamt gibt es 23 Isotope des Urans (Magill et al., 2006), wovon drei natürlich auftreten (Tabelle 3-1).
Tabelle 3-1: Isotopenzusammensetzung und Halbwertszeiten des natürlichen Urans (Hollemann und Wiberg, 1995)
Natürliche Nuklide 234U 235U 238U
Rel. Häufigkeit an Unat (%) 0,005 0,720 99,275
Halbwertszeit (a) 2,455×105 7,038×108 4,468×109
3.1. Wässrige Chemie des Urans
Die Löslichkeit des wichtigsten Uranminerals, des Uraninits (UO2) ist unter anoxischen Bedingungen sehr gering. Unter oxischen Bedingungen sind Uranvorkommen von Sekundärmineralisationen geprägt, die durch eine Oxidation des Uran(IV) zu Uran(VI) hervorgerufen werden (Rösler, 1991). Typische entstehende Sekundärmineralisationen der Uraninit-Alteration sind zum Beispiel Uran(VI)-silikate (beispielsweise: Boltwoodit) oder Uran(VI)-phosphate (beispielsweise: Autunit) (Arnold, 2008; Jensen, 2002). Uran(VI)- Minerale sind in der Natur weit verbreitet und stellen aufgrund ihrer Löslichkeit unter
oxidierenden Bedingungen den Haupteintrag für die Uran-Gehalte in Wässern dar (Langmuir, 1978). Gelöstes Uran kann in Abhängigkeit von verschiedenen Parametern, wie zum Beispiel pH-Wert, Redoxpotential und Konzentration an komplexierenden Stoffen in verschiedenen Bindungsformen in der Natur vorkommen. Abbildung 3-1 zeigt in einem Speziationsdiagramm die Bindungsmöglichkeiten von sechswertigem Uran in wässriger Lösung unter atmosphärischen Bedingungen.
Abbildung 3-1: Uran(VI)-Speziesverteilung im pH-Bereich von 2 bis 10 bei einer Urankonzentration von 1×10-5 M U(VI) und einer Ionenstärke von 0,1 M NaClO4 unter atmosphärischen Bedingungen; Die Berechnung der Speziesverteilung erfolgte mit Hilfe des Speziationsprogrammes EQ3/6 (Wolery, 1992) unter Einbeziehung der Komplexbildungskonstanten nach Guillaumont et al. (2003).
Es ist deutlich zu erkennen, dass unter den gewählten Bedingungen bei den pH-Werten 2-5,5 ohne Präsenz von komplexierenden Stoffen das freie Uranylion dominiert. Mit steigendem pH-Wert findet die Hydrolyse des Uranylions statt und die Anzahl der vorherrschenden Uranspezies nimmt zu (Langmuir, 1978, Grenthe et al., 1992). Die weitere Erhöhung des pH- Wertes führt zu einer Dominanz der Uran-Carbonatokomplexe innerhalb der Lösung.
Für natürliche Systeme ist bekannt, dass beispielsweise uranhaltige saure Wässer durch hohe Sulfatkonzentrationen gekennzeichnet sind (Jenk, 1995). In diesem geochemischen Milieu wird die Uranspeziation durch verschiedene Uran(VI)-Sulfato-Komplexe (UO2SO4, UO2(SO4)22-) dominiert (Geipel et al., 1996). Natürliche Wässer können bei neutralen bis leicht basischen pH-Werten durch das Gleichgewicht mit dem Kohlendioxid der Luft hohe Carbonatgehalte aufweisen. Unter diesen Bedingungen werden stabile Uran(VI)-Carbonato- Komplexe (UO2CO3, UO2(CO3)22-, UO2(CO3)34-) gebildet (Grenthe et al., 1992). Zur Komplexierung des Urans in natürlichen Wässern können aber auch weitere Liganden wie zum Beispiel Fluorid (Langmuir, 1978), Phosphat (Brendler et al., 1996) oder Huminstoffe
Fluoreszenzspektroskopie und –mikroskopie des Urans
(Sachs, 2007) beitragen. Mit steigender Konzentration des Uran(VI) nimmt, aufgrund der Löslichkeit, die Bildung der Festphasen und Anteil an polymer Uran(VI)-Spezies zu (UO2)3(OH)5+, (UO2)2(OH)3CO3- zu (Grenthe et al., 1992).
In wässriger Lösung kann das Uran durch Sorptionsprozesse an der Grenzfläche fest-flüssig angereichert werden. Der Begriff Sorption steht hier für die Prozesse der Oberflächenausfällung, der Adsorption, des Ionenaustausches, der Absorption durch die Festphase und Redoxreaktionen an der Phasengrenze. Sorptionsexperimente von Uran an geologischen Oberflächen (Mineralen) sind bereits auf breitem Gebiet untersucht und zeigen, dass hierbei insbesondere Eisen(hydr)oxide (Yanase et al., 1991; Arnold et al., 1998) aber auch im geringen Maße Alumosilikate (Kang et al., 2003; Krepelova et al., 2006) von Bedeutung sind.
3.2. Redoxchemie des Urans
Die sechs Außenelektronen in den 5f-, 6d- und 7s- Niveaus des Urans (siehe Elektronenkonfiguration, Kapitel 3) bestimmen die möglichen Oxidationstufen, in welchen das Element auftreten kann. In seinen chemischen Verbindungen tritt Uran in fünf Oxidationsstufen (+2, +3, +4, +5, +6) auf (Lide, 1994), wobei nur die Oxidationsstufen +4 und +6 stabil genug sind, um von genereller Wichtigkeit zu sein. Dabei sind die Verbindungen des Uranylions UO22+ im Gegensatz zu den vierwertigen Verbindungen sehr gut löslich. Zweiwertige Verbindungen des Urans treten nur bei verdünnten festen Lösungen von Halogeniden UX2 in Erdalkalimetallhalogeniden MX2 auf (Hollemann und Wiberg, 1995). Wässrige dreiwertige Uranlösungen sind ein gutes Reduktionsmittel und oxidieren an Luft sehr schnell zu Uran(IV) (Craft et al., 2004). Fünfwertiges Uran ist metastabil und disproportioniert in Anwesenheit von Wasser zu vier- und sechswertigen Uran (Clark et al., 1997). Die Redoxvorgänge des Urans werden in reversible und kinetisch gehemmte Vorgänge eingeteilt.
Reversible Vorgänge:
3 4
U +←→U ++e− mit E0= -0,607 V und
2
2 2
UO+←→UO ++e− mit E0= +0,063 V Kinetisch gehemmte Vorgänge:
4
2 2
2 4
U ++ H O←→UO++ H++e− mit E0= +0,613 V und
4 2
2 2
2 4 2
U ++ H O←→UO ++ H++ e− mit E0= +0,338 V
Die gezeigten kinetisch gehemmten Vorgänge sind Vorgänge, die mit einer Sauerstoffübertragung verbunden sind. Die Spaltung und die Bildung der Uran- Sauerstoffbindungen erfolgt dabei nur sehr langsam und ist pH-abhängig (Hollemann und Wiberg, 1995). Verschiedene Studien zur Reduktion und Oxidation von Uran in Anwesenheit von Bakterien zeigen, dass eine große Anzahl von Bakterien befähigt ist, die oben gezeigten Redoxpotentiale zu überwinden und Uran von der sechswertigen in die fünf-, beziehungsweise vierwertige Stufe oder umgekehrt zu überführen. Ein Überblick über uranreduzierende und uranoxidierende Bakterien wird von Wall und Krumholz (2006) gegeben. Entsprechend des Oxidationszustandes weist Uran in wässriger Lösung verschiedene Farben auf (Tabelle 3-2).
Tabelle 3-2: Farben von Uran-Ionen in wässriger Lösung (Hollemann und Wiberg, 1995)
Uran-Ion U3+ U4+ UO2+ UO22+
Farbe Purpurrot Smaragdgrün Blaßlila Gelb
3.3. Urankreislauf in der Natur
Uran ist Bestandteil von mehr als 150 natürlich vorkommenden Mineralen. Die Konzentration an Uran im Meerwasser kann bis zu 10 µg Uran pro kg Wasser betragen (Ehrlich, 1996). Dies entspricht im Allgemeinen etwa dem zehnfachen Wert des Süßwassers. Auch in Mineralwässern konnten regional unterschiedlich sehr hohe Konzentrationen von Uran festgestellt werden (siehe Tabelle 3-3).
Tabelle 3-3: Urangehalte verschiedener Mineralwässer (nach FAL-PB, 2000-2007)
Mineralwasser Herkunftsland Urangehalt in µg/l
Caffe Nero Italien 12,50
Volvic Frankreich 0,29
Drakenstein Südafrika 48,92
Hunyadi Janos Ungarn 65,76
Nürtinger Heinrichsquelle Deutschland 474,00
Gerolsteiner Sprudel Deutschland 0,79
Margon (Classic+Medium) Deutschland 0,05
![Abbildung 5-4: Spektrum der Quanteneffizienz der Andor iXonEM DU-888 bezogen auf die Wellenlänge (iXonEM+ DU-888 [back illuminated])](https://thumb-eu.123doks.com/thumbv2/1library_info/4564843.1599796/52.892.202.725.370.676/abbildung-spektrum-quanteneffizienz-andor-ixonem-bezogen-wellenlänge-illuminated.webp)