α−, β−, γ− Spektroskopie
Spektrometrieversuch
Es soll in einem Versuch 210Pb und die Töchter 210Bi und 210Po bestimmt werden.
Für die Versuche steht eine 210Pb-Lösung mit einer spezifischen Aktivität von 500 Bq/ml (Messdatum 01.10.2005) zur Verfügung.
Fragen:
1. Berechnen Sie die aktuelle spezifische Aktivität für 210Pb. Geben Sie dazu die Formel an.
2. Befindet sich das 210Pb Probe im Gleichgewicht mit ihren Töchtern 210Bi und 210Po?
3. Welche Nuklide der Probe können mit γ−Spektrometrie bestimmt werden?
Probenvorbereitung:
1. Stellen Sie eine Probe mit 10 Bq 210Pb durch Auftropfen auf ein Edelstahlplanchet her (für α− und γ−Spektrometrie)
2. Stellen Sie 3 Parallelproben mit je 10 Bq 210Pb + 5 ml Ultima Gold und 2 Blindproben mit MilliQ-Wasser (gleiches Volumen wie Pb) + 5 ml Ultima Gold her. Vials gut verschließen, Deckel beschriften, gründlich schütteln, Vial erst feucht dann trocken abwischen.
Messung:
1. α−Spektrometrie:
• Arbeitsschritte:
o Kammer belüften
o Standard/Probe auf Einschub in oberer Schiene unter den Detektor legen o Kammer schließen
o evakuieren
o Hochspannung langsam auf 40 V stellen
o Messzeit einstellen (5 min Standard / 15 min Probe) o Messung starten
o nach Beendigung Auswertung (gross area)
• Effizienzkalibrierung mit Standard 237Np (533,1 Bq) / 241Am (319,8 ) / 244Cm (128,6 Bq), aktuelle Gesamtaktivität: 981,5 Bq
Berechnung der Messeffektivität
• Probenmessung
Bestimmung des α−Peaks unter Berücksichtigung der Messeffektivität Der Nulleffekt der Anlage beträgt 2-3 Impulse/h.
2. γ−Spektrometrie:
• Verwendung vorhandener Effizienzkurve, Spektrendatei, Nulleffekt
• Messung 30 min
• Automatische Auswertung von 210Pb 3. α−/β−(LS)Spektrometrie:
• 3 Proben + 2 Nulleffektsproben werden in ein Rack einsortiert, und mit einem vorhandenen Programm mit α−/β− Separation (5 min / Probe) gemessen
• Ergebnis direkt in cpm (counts per minutes) 1 cpm=60 Bq Fragen
1. Welche Aktivitäten haben Sie für 210Pb, 210Bi und 210Po bestimmt?
2. Vergleichen Sie die Egebnisse der α−Spektrometrie mit dem α−Wert aus der LS- Messung
3. Was können Sie aus dem β−LS-Spektrum entnehmen?
Wechselwirkungen von Metallen in Biosystemen
Ziel:
Dieser Praktikumsversuch soll einen Einblick in die Bedeutung von Radionukliden und Schwermetallen in Biosystemen geben.
Dabei soll die Wirkung von Uran, als Vertreter der Radionuklide, mit der Wirkung ausgewählter nicht radioaktiver Schwermetalle auf das Wachstum von verschiedenen Bakterienstämmen verglichen werden.
Schlussendlich bietet dieser Versuch die Möglichkeit, sich mit (mikro-)biologischen Arbeitstechniken vertraut zu machen.
Aufgabenstellung:
• Untersuchen Sie den Effekt von Uran sowie weiterer Schwermetalle auf das Wachstum vier verschiedener Bakterienstämme!
• Bestimmen Sie für jeden Stamm die minimale Hemmkonzentration (MHK) und die minimale bakterizide Konzentration (MBK) für die untersuchten Schwermetalle!
• Vergleichen Sie Ihre Ergebnisse mit den Ergebnissen der anderen Gruppen und treffen Sie Aussagen zur Toxizität von Uran im Vergleich mit anderen Schwermetallen!
Durchführung:
Teil A: Metalltoleranztest
Jede Gruppe erhält einen fertigen Satz Agarplatten mit unterschiedlich hohen Urankonzentrationen. Darüber hinaus stellt jede Gruppe weitere Agarplatten mit vier verschiedenen Konzentrationen eines weiteren Schwermetalls her. Welche Metalle zum Einsatz kommen, entnehmen Sie bitte Tabelle 1. Für Wachstumskontrollen erhält jede Gruppe zusätzlich noch Agarplatten ohne Metallzusatz.
Tabelle 1: Zuweisung der Metalle zu den Praktikumsgruppen
Praktikumsgruppe Herzustellende Agarplatten Bereitgestellte Agarplatten (Tab. A1)
1 Cr U
2 Cu U
3 Cd U
1. Herstellung der Agarplatten
• In vier 500 ml-Erlenmeyerkolben werden je 3,0 g Agar eingewogen und mit 158 ml destilliertem Wasser gemischt.
• Die Kolben werden mit Sterilstopfen verschlossen, mit Aluminiumfolie abgedeckt und einem Stück Autoklavierband versehen.
• Dampfsterilisation der Agarsuspensionen bei 121 °C für 35 min und anschließende Aufbewahrung der Kolben im 70 °C-Brutschrank, um ein vorzeitiges Erstarren des Agars zu verhindern.
• Der noch warmen Agarlösung werden vor dem Gießen unter leichtem Rühren und sterilen Bedingungen folgende sterile Lösungen (Zusammensetzung in Tabelle A2) zugegeben.
Tabelle 2: Zusammensetzung des Nährmediums Lösung Volumen
Agarsuspension 158 ml 10 x Salzlösung 20 ml
10 % Pepton 20 ml
Glycerin 1 ml CaCl2 200 µl Thiamin 80 µl Metalllösung Siehe Tabelle 3
Tabelle 3: Metallkonzentrationen und entsprechende Zugabe zu 200 ml Medium Metall Konzentration
im Nährmedium
Zugabe je Kolben
Cr
0.1 mM 0.5 mM 2.0 mM 5.0 mM
20 µl 1 M Cr-Lösung 100 µl 1 M Cr-Lösung 400 µl 1 M Cr-Lösung 1 ml 1 M Cr-Lösung
Cu
0.5 mM 1.0 mM 4.0 mM 6.0 mM
100 µl 1 M Cu-Lösung 200 µl 1 M Cu-Lösung 800 µl 1 M Cu-Lösung 1,2 ml 1 M Cu-Lösung
Cd
0.001 mM 0.1 mM 0.5 mM 2.0 mM
20 µl 1 mM Cd-Lösung 20 µl 1 M Cd-Lösung
100 µl 1 M Cd-Lösung 400 µl 1 M Cd-Lösung
• Platten anschließend leicht geöffnet unter sterilen Bedingungen (in der Nähe der Brennerflamme und unter der Sterilbox) 5-10 min abkühlen lassen, anschließend abdecken und mit Gruppennummer, Metall und Konzentration beschriften!
2. Vorbereiten der Bakterienkultur
• Jede Gruppe erhält frisch gewachsene Vorkulturen eines Bakterienstammes (Tab. A3) und erntet die Zellen aus jeweils 10 ml Kulturmedium mittels Zentrifugieren (8000*g/ 10 min).
• Während des Zentrifugierens wird die optische Dichte der übrigen Zellsuspension bei einer Wellenlänge von 600 nm (OD600) bestimmt.
• Nach der Zentrifugieren wird der Überstand verworfen und das Pellet mit 10 ml steriler, physiologischer 0,9 %iger NaCl-Lösung gewaschen (Resuspendieren und erneutes Zentrifugieren).
• Während dieser Zentrifugation wird anhand der ermittelten OD600 das Volumen der 0.9 % NaCl-Lösung berechnet, um die OD600 jedes Bakterienstammes auf einen Wert von 1.0 einzustellen.
• Nach dem Zentrifugieren der Zellen werden diese im berechneten Volumen frischer 0,9 %iger NaCl-Lösung resuspendiert.
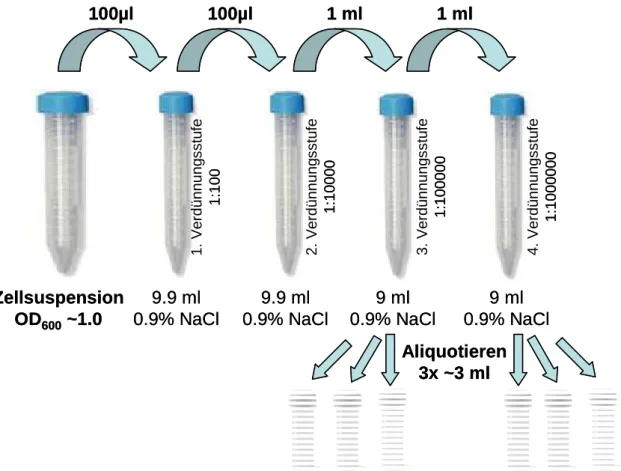
• Anschließend wird diese Zellsuspension verdünnt und aliquotiert (Abb. 1).
9.9 ml 0.9% NaCl
9.9 ml 0.9% NaCl
9 ml 0.9% NaCl
100µl 100µl 1 ml
Zellsuspension OD600~1.0
1 ml
9 ml 0.9% NaCl Aliquotieren
3x ~3 ml
1. Verdünnungsstufe 1:100 4. Verdünnungsstufe 1:1000000
3. Verdünnungsstufe 1:100000 2. Verdünnungsstufe 1:10000
9.9 ml 0.9% NaCl
9.9 ml 0.9% NaCl
9 ml 0.9% NaCl
100µl 100µl 1 ml
Zellsuspension OD600~1.0
1 ml
9 ml 0.9% NaCl Aliquotieren
3x ~3 ml
1. Verdünnungsstufe 1:100 4. Verdünnungsstufe 1:1000000
3. Verdünnungsstufe 1:100000 2. Verdünnungsstufe 1:10000
Abbildung 1: Verdünnungsreihe der Zellsuspensionen
3. Beimpfen der Platten
• Die fertig abgekühlten Agarplatten werden nun mit den drei verschiedenen Bakteriensuspensionen beimpft (zwei Stämme erhält man fertig geerntet, gewaschen und aliquotiert von den anderen Gruppen).
• Dazu werden je 50 µl der Verdünnungsstufen 3 und 4 mittels steriler Pipette direkt auf den Agar gegeben.
• Anschließend wird die Zellsuspension auf der Agarplatte mit einem Drigalskispatel verteilt (Abb. 2).
• Die Platten werden mit je zwei Streifen Parafilm verschlossen, um eine Kontamination mit Luftkeimen zu verhindern.
• Inkubation bei 30 °C für 48 h.
Abbildung 2: Ausspateln der Zellen
Teil B: Agardiffusionstest/ Lochtest
• Aus der Mitte einer zur Verfügung gestellten Agarplatte wird ein Loch ausgestanzt (der ausgestanzte Agar wird mit einer sterilen Pipettenspitze herausgehoben).
• Anschließend geben Sie 500 µl der ihrer Gruppe zugewiesen Metalllösung hinzu (die zu verwendenden Metalllösungen finden Sie in Tabelle A1).
• Lagern Sie die Platte unter der Sterilbox, bis die Metalllösung in den Nährboden eindiffundiert ist.
• Danach tragen Sie vier Teststämme (ein weiterer wird gestellt) strichförmig (Abb. 3) mit einer Impföse auf die Agarplatte auf und verschließen Sie die Platten mit Parafilm.
• Inkubation bei 30 °C für 48 h
Bacillus Stamm 1
Stamm 2
Stam m 3
Stamm 4
Bacillus Stamm 1
Stamm 2
Stam m 3
Stamm 4
Abbildung 3: Ausstrichmuster beim Agardiffusionstest/Lochtest
Teil C: Mikroskopie
Um die eingesetzten Bakterien sichtbar zu machen, untersuchen Sie diese mit Hilfe des Lichtmikroskops. Die Bakterien können bis zu 1000fach vergrößert betrachtet werden. Über die Kamera können die Bakterien auch über einen Bildschirm beobachtet werden.
• Dazu werden 2 µl der unverdünnten Bakteriensuspension auf einen Objektträger überführt und mit einem Deckgläschen abgedeckt (Abb. 4).
• Anschließend werden die Bakterien mit dem Lichtmikroskop Olympus BX61 vergrößert.
Zunächst wird das 40 x Objektiv mit dem Phasenkontrast 2 angewählt und der Objekttisch mit der Probe an das Objektiv heranbewegt. Sobald die richtige Ebene mit den Bakterien gefunden ist, wird davon mit der Kamera ein Bild gemacht. Anschließend wird die Probe mit der Feststelltaste wieder vom Objektiv wegbewegt und vom Objekttisch entfernt.
• Jetzt wird ein Tropfen Immersionsöl auf das Deckgläschen gegeben, die Probe erneut auf den Objekttisch gespannt und an das neu angewählte 100 x Objektiv mit dem Objekttisch heran bewegt. Sie müssen dabei beachten, dass der Phasenkontrast 3 eingestellt und das Auflicht eingeschaltet ist. In dieser Vergrößerung erneut ein Bild von den Bakterien machen.
Abbildung 4: Probenvorbereitung zur Lichtmikroskopie
Auswertung:
Teil A: Metalltoleranztest
1.) Treffen Sie Aussagen über das Wachstumsverhalten der untersuchten Bakterienstämme bei bestimmten Schwermetallkonzentrationen!
Zählen Sie dazu die Bakterien-Kolonien auf Ihren Agar-Platten. Wählen Sie die Verdünnungs- stufe mit 30-300 Kolonien pro Platte. Berechnen Sie die Anzahl der Kolonie-bildenden Einheiten (cfu=colony-forming units) pro ml Bakteriensuspension-Ausgangslösung für die Platten mit den verschiedenen Metallkonzentrationen sowie für die Kontrollplatten ohne zusätzliche Metalle.
2.) Vergleichen Sie ihre Ergebnisse mit den Ergebnissen der anderen Gruppe!
3.) Bestimmen Sie die MHK50 und die MBK!
Teil B: Lochtest
1.) Bestimmen Sie, bis zu welchem Abstand vom Loch ein Wachstum der getesteten Stämme erfolgt!
2.) Beurteilen Sie die Empfindlichkeit der Testbakterien gegenüber dem untersuchten Metall (empfindlich [e], mäßig empfindlich [m], unempfindlich [u])!
3.) Welche Faktoren könnten die Wirkung des Metalls auf das Wachstum der Testbakterien beeinflussen?
Teil C: Makroskopische und mikroskopische Charakterisierung der Bakterienstämme 1.) Treffen sie Aussagen zur Makromorphologie der untersuchten Stämme, d.h. über Farbe, Form und Oberflächenbeschaffenheit der gewachsenen Kolonien!
2.) Beschreiben sie die Mikromorphologie der untersuchten Bakterienstämme (Zellform, Zellgröße, Beweglichkeit, erkennbare Bildung von Sporen)!
ANHANG
Tabelle A1: Metallkonzentrationen der bereitgestellten Agarplatten.
Metall Konzentration
U
0.1 mM 0.25 mM
0.5 mM 1.0 mM
Tabelle A2: Zusammensetzung der benötigten Lösungen.
Lösungen Konzentration Bestandteile
Salzlösung
46,8 g/l 14,9 g/l 10,7 g/l 4,3 g/l 2,033 g/l
2,7 mg/l 143,3 g/l
NaCl KCl NH4Cl (NH4)2SO4
MgCl2
ZnSO4
Tris base
Pepton 10% Pepton
Glycerin Glycerin
CaCl2 100 mM CaCl2
Thiamin 50 mg/mL Thiamin
Tabelle A3: Klassifizierung der verwendeten Bakterienstämme.
Praktikumsgruppe Vorzubereitende Bakterienstämme
1 Sporosarcina sp.
2 Pseudomonas sp.
3 Escherichia coli
Alle (nur Lochtest) Bacillus sp.
Sorption von Uran an Quarz/Hämatit und an einem Bacillus-Isolat
Hintergrund:
Die Interaktion von Actinoiden mit der Umwelt kann auf vielfältige Art und Weise erfolgen.
Ausgehend vom natürlichen Vorkommen der Actinoide in Mineralien bzw. Gesteinsformationen ist die Wechselwirkung der Nuklide mit den sie umgebenden Mineralien und Gesteinen von besonderer Bedeutung. Durch das Grundwasser und andere natürliche und künstliche Wasserläufe können Actinoide mobilisiert bzw. aus dem Gestein herausgelöst werden. Diese Prozesse müssen beispielsweise bei der Untersuchung des Uranbergbaus und seiner Folgeschäden in Sachsen und Thüringen beachtet werden.[1-4] Selbst im Trinkwasser können Actinoide, insbesondere Uran, nachgewiesen werden.[5] Auch die Untersuchung der Interaktion mit der Biosphäre inner- und außerhalb des Wasserkreislaufs, vom Mikroorganismus über Pflanzen bis hin zum tierischen und menschlichen Organismus, ist von essentieller Bedeutung.[6-7]
Vor allem die zukünftige Endlagerung radioaktiver Abfälle macht die Untersuchung der Wechselwirkungen von Radionukliden mit der Umwelt unumgänglich. Die Untersuchung der Sorption ist eine geeignete Methode, um mit einfachen Mitteln Aussagen zum Retentionsvermögen der verschiedenen Adsorbenzien machen zu können.
Zur Beschreibung der Art und Bewertung der Stärke der Sorption dienen Verteilungskoeffizenten (KD) und Adsorptionsisothermen (z.B. Freundlich, Langmuir).[8-9] Dabei dienen die Massenspektrometrie (ICP-MS) und die Flüssigszintillationsmessung (LSC) zur Quantifizierung der sorbierten Radionuklide. Methoden wie time-resolved laser-induced fluorescence spectroscopy (TRLFS) und extended x-ray absorption fine structure (EXAFS) spectroscopy wiederum können Informationen zur möglichen Struktur der gebildeten Oberflächenkomplexe liefern. In diesem Versuch soll die LSC zur Messung der sorbierten Uran(VI)menge in Abhängigkeit der Umgebungsparameter dienen. Dies bietet die Möglichkeit einen ersten Einblick in das Sorptionsverhalten des Systems, ob Mineral oder Biosystem, zu erhalten.
Ziel:
Die Uran(VI)-Sorption an einem Biosystem und einem Mineral sollen miteinander verglichen werden. An dem mineralischen System soll zusätzlich die Abhängigkeit der Sorption von pH- Wert bzw. Fest-Flüssigverhältnis untersucht werden.
Vorbetrachtung:
Uranspeziation
Natürliches Uran Unat besteht aus den α-strahlenden Isotopen 238U (99,275 %, τ1/2 = 4,468⋅109 a, spezif. Aktivität = 1,244⋅10-2 Bq/µg), 235U (0,720 %, τ1/2 = 7,038⋅108 a, spezif. A = 7,997⋅10-2 Bq/µg) und 234U (0,005 %, τ1/2 = 2,455⋅105 a, spezif. A = 2,302⋅102 Bq/µg). Ein anderes wichtiges Uranisotop ist 233U (τ1/2 =1,592⋅105 a, spezif. A = 3,5656⋅102 Bq/µg). Es wird künstlich aus 232Th durch Neutroneneinfang und zweimaligen β-Zerfall gewonnen. 235U und 233U werden neben 239Pu als Kernbrennstoff eingesetzt.
In Abhängigkeit der Umgebungsbedingungen in der Lösung bildet Uran verschiedene Spezies aus. Diese kann man in einem Speziationsdiagramm darstellen.
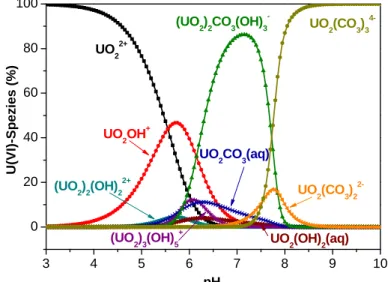
Als Beispiel ist in Abb. 1 das Speziationsdiagramm für Uran(VI) (1⋅10-6 M) in 0,1 M NaClO4 an Luft in Abhängigkeit des pH-Wertes gezeigt. Im sauren Bereich liegt Uran(VI) als Uranyl in Lösung vor, im Alkalischen dominieren verschiedene Uranylcarbonatokomplexe die Speziation.
Insbesondere bei der Interpretation der Sorptionsergebnisse sollte die jeweils vorliegende Speziation in Abhängigkeit der Umgebungsbedingungen beachtet werden.
Im biologischen Teil dieses Versuchs wird jedoch bei einer höheren Urankonzentration gearbeitet. Eine Änderung der Konzentration hat auch eine Änderung der Speziation zur Folge (Abb. 2).
3 4 5 6 7 8 9 10
0 20 40 60 80 100
U(VI)-Spezies (%)
(UO2)2(OH)22+
UO22+
UO2OH+
(UO2)3(OH)5+
(UO2)3(OH)42+
(UO2)4(OH)7+ (UO2)2CO3(OH)3-
UO2(CO3)22- UO2(CO3)34-
Abb. 1: Speziation von Uran(VI) (1 ⋅ 10-6 M) in 0,1 M NaClO4 an Luft (pCO2 = 10-3,5 atm) und RT (nur Spezies > 1 % dargestellt)
3 4 5 6 7 8 9 10
0 20 40 60 80 100
U(VI)-Spezies (%)
pH UO22+
UO2(CO3)34-
UO2OH+
(UO2)2CO3(OH)3-
(UO2)3(OH)5+
UO2(CO3)22- UO2CO3(aq)
(UO2)2(OH)22+
UO2(OH)2(aq)
Mineralische Systeme Quarz
Quarz (SiO2) ist das dritthäufigste Mineral der Erdkruste [10] und Bestandteil vieler Gesteine, insbesondere des Tons, der neben Salz und Granit als weiteres mögliches Deckgestein für ein Endlager radioaktiver Abfälle in Betracht gezogen wird. Bei der im Versuch verwendeten Quarzcharge handelt es sich um eine gesiebte Fraktion von < 63 µm Teilchengröße mit einer spezifischen Oberfläche von BET = 0,329 m2/g.
Hämatit
Eisen ist nach Aluminium mit 4,7 % das zweithäufigste Metall der Erdhülle. Da Eisen relativ unedel ist kommt es in der Natur meist gebunden in Form von Oxiden, Carbonaten und Sulfiden vor. Besonders weit verbreitet ist dabei des Mineral Hämatit (Fe2O3), da es in Gegenwart von Sauerstoff oft Endprodukt der Umwandlung verschiedener Eisenmineralien ist. Aufgrund des ubiquitären Auftretens von Hämatit und weiterer Eisenverbindungen beeinflussen diese den Transport zahlreicher Schadstoffe (Schwermetalle, eutrophierend wirkende Verbindungen und organische Fremdstoffe) sehr stark.[11]
Der im Praktikum verwendete Hämatit ist synthetischen Ursprungs und hat eine spezifische Oberfläche von 33,1 m²/g (N2-BET). Er wurde bei Temperaturen um 90 °C durch Umwandlung von frisch gefälltem Eisen(III)-hydroxid in schwach alkalischer Lösung erhalten.
Biologisches System
Das biologische System besteht aus Bakterienzellen der Gattung Bacillus, die aus einer Uranhalde isoliert, im entsprechenden Nährmedium angezüchtet, dann geerntet und in 0,1 M NaClO4 resuspendiert wurden. Diese Proben sind bereits vor Praktikumsbeginn vorbereitet.
Die verwendeten Bacillus-Isolate sind bekannt dafür, Uran sehr gut zu binden.[7, 12] Es kann mit der Außenhülle des Bakteriums bzw. an Kompartimenten im Innenraum der Zelle komplexieren. Die Bindung erfolgt dabei vorrangig über Phosphat- und Carboxylgruppen.
Flüssigszintillationsmessung (LSC)
Die Flüssigszintillationsmessung, im Englischen Liquid Scintillation Counting (LSC) genannt, ist eine Methode zur Aktivitätsbestimmung von Radionukliden durch die Detektion ionisierender Strahlung. Die Methode beruht auf dem 1908 von Rutherford und Geiger beobachteten Effekt, dass bestimmte Substanzen bei Kontakt mit ionisierender Strahlung mit der Emission von Licht reagieren. Diesen Effekt nennt man Szintillation und eine dazu befähigte Substanz Szintillator.
Bei der LSC wird ein Gemisch aus Probe und Szintillationscocktail (Ultima GoldTM) analysiert.
Der Cocktail, bestehend aus einem Lösungsmittel (Diisopropylnaphtalin), einem primären (2,5- Diphenyloxazol) und einem sekundären Szintillator (1,4-Bis(5-phenyl-2-oxazolyl)benzen), wird durch α- und β-Teilchen zur Emission von Lichtquanten angeregt.
Im Praktikum wird vorrangig 233U mittels LSC untersucht. Beim biologischen Teilversuch wird jedoch eine Mischung aus Unat und 233U verwendet. Bei dem durch LSC erhaltenen Resultat muss somit auch der Aktivitätsbeitrag von 238U und 234U beachtet werden.
Alternativ kann für die Quantifizierung des Urans auch die α-Spektrometrie genutzt werden.
Diese Methode liefert eine höhere Genauigkeit, nachteilig sind jedoch die aufwändigere Probenpräparation und die längere Messdauer.
Aufgaben
Ziel des Versuches ist es, die Uran(VI)-Sorption an verschiedenen Adsorbenzien zu untersuchen.
Dabei soll ein Biosystem mit zwei Mineralien (Quarz, Hämatit) verglichen werden. Die Uran(VI)-Konzentration ist dabei für alle Mineralversuche konstant bei [U] = 1⋅10-6 M bzw. für alle biologischen Versuche bei [U] = 1⋅10-4 M. Aufgrund der geringeren Nachweisgrenze und der besseren Praktikabilität werden die Versuche mit 233Uran bzw. einer Mischung aus Unat und
233Uran durchgeführt. Die Urankonzentration im Überstand der Suspensionen wird mittels LSC bestimmt.
Als Hintergrundelektrolyt wird bei allen Versuchen 0,1 M NaClO4-Lösung verwendet. Zur leichteren pH-Justierung wird bei pH 8,5 NaHCO3 zur Lösung gegeben.
Die drei Gruppen sollen folgende Versuche durchführen. Uran(VI)-Sorption an:
Gruppe 1:
• Bakterien, pH 4,5
• Quarz, S/L = 12 g/l
o Variation des pH-Wertes: pH = 4,5 ; 6,5 ; 8,5
Gruppe 2:
• Bakterien, pH 6,5
• Quarz, pH = 6,5
o Variation des S/L-Verhältnisses: 6 g/l ; 12 g/l ; 18 g/l Gruppe 3:
• Bakterien, pH 8,5
• Hämatit, S/L = 0,5 g/l
o Variation des pH-Wertes: pH = 4,5 ; 6,5 ; 8,5
Durchführung:
Biologisches System
Vorbereitung durch den Praktikumsleiter
Bakterienanzucht: Das Bacillus-Isolat wurde in 500 ml LB (Luria Broth)-Nährmedium angezüchtet. Die Zellen wurden nach zwei Tagen durch Zentrifugation (15 min, 10000 x g) geerntet. Die Zellpellets wurden zweimal mit 0,1 M NaClO4-Lösung gewaschen. Mit einem Teil der Zellpellets wird eine Trockenmassebestimmung durchgeführt, um die Ergebnisse später auf die Biomasse beziehen zu können. Der Trockenmassewert wird den Praktikumsdurchführenden vom Praktikumsleiter während des Praktikums mitgeteilt. Die restlichen Zellpellets werden in 0,1 M NaClO4 resuspendiert.
Probenaufarbeitung
Zentrifugation (6000 x g, 20 min)
LSC
Entnahme von 2 x 1 ml jedes Probenüberstandes, mit je 15 ml Ultima
GoldTM mischen Bestimmung der Uranaktivität
pH-Kontrolle Überkopfschüttler (Gesamtsorptionszeit: 1 h)
pH-Korrektur (Ist-Wert)
Aliquotierung der 100 ml-Uranyllösung (3 x 15 ml) und Zugabe zu den Bakterienpellets (Vortexer nutzen!)
+
1 x 15 ml Uranyllösung ohne Bakterien bei pH 3,0 +
1 x 15 ml Uranyllösung ohne Bakterien bei Gruppe 1: pH 4,5
Gruppe 2: pH 6,5 Gruppe 3: pH 8,5
Bakterienpräparation Präparation der Uranyllösung
pH-Einstellung: drei Aliquote à 50 ml Zellsuspension mit NaOH/HClO4
Gruppe 1: pH 4,5 Gruppe 2: pH 6,5 Gruppe 3: pH 8,5
Mischung: 100 ml bzw. 15 ml 0,1 M NaClO4
+ berechnetes Volumen Unat/233U- Stammlösung
[U] in den Proben: 1⋅10-4 M pH-Einstellung: mit NaOH/HClO4
Gruppe 1: 100 ml: pH 4,5; 15 ml: pH 3,0 Gruppe 2: 100 ml: pH 6,5; 15 ml: pH 3,0 Gruppe 3: 100 ml: pH 8,5; 15 ml: pH 3,0 (Achtung Gruppe 3 zusätzlich 1 M NaHCO3
zugeben! siehe Tabelle im Anhang) Überstand
abdekantieren Zentrifugation (6000 x g, 10 min)
Start Sorption Durchführung durch die Praktikanten
Gruppe 1: Quarz
Gruppe 3: Hämatit Gruppe 2: Quarz
Probenaufarbeitung
Zentrifugation:
Gruppe 1 + 2: 4000 rpm, 45 min Gruppe 3: 35000 rpm, 45 min (Ultrazentrifugation)
LSC
2 x 1 ml jedes Filtrats/Zentrifugats mit je pH-Kontrolle
Überkopfschüttler (Gesamtsorptionszeit: 1 h)
pH-Korrektur (Ist-Wert)
Zugabe des berechneten Volumens an 233U-Stammlösung [U] in jeder Probe: 1⋅10-6 M
Einwaage Mineral (± 0,3 mg) im gegebenen S/L für 10-ml-Ansätze
Herstellung: 0,1 M NaClO4, 1 M NaHCO3
Suspension der Einwaagen in 10 ml 0,1 M NaClO4
pH 8,5: Zugabe von 1 M NaHCO3
Start Sorption
pH-Einstellung laut Tabelle (s. Anhang) mit NaOH/HClO4
pH-Abhängigkeit S/L-Abhängigkeit
Gruppe 1 + 2: Filtration des Überstandes mit 450-nm-PES-Filter
Mineralisches System
Protokoll:
1. Protokollieren und kommentieren Sie den durchgeführten Versuch.
2. Werten Sie die LSC- und ICP-MS-Ergebnisse nachvollziehbar tabellarisch aus. Geben Sie die Ergebnisse in
o sorbiertes U (%)
o sorbierte µg U / mg Mineral bzw. Biomasse an.
Stellen Sie die Ergebnisse auch grafisch (nur beim Mineralversuch) dar. Bestimmen Sie den Aktivitätsbeitrag von 238U und 234U zur LSC ausführlich anhand eines Beispiels.
3. Führen Sie eine Fehlerbetrachtung durch.
4. Diskutieren Sie die Ergebnisse hinsichtlich der Speziation und Sorptionskinetik.
5. Berechnen Sie die Gesamtaktivität an 233U für den Mineralversuch. Betrachten Sie das Ergebnis bezüglich der Abschirmung.
Eine Gruppe fertigt ein Gesamtprotokoll an, das die Ergebnisse aller Gruppen für den Sorptionsversuch zusammenfasst.
1. Fassen Sie alle Ergebnisse für den biologischen Versuch zusammen und stellen Sie diese grafisch dar. Interpretieren Sie das Ergebnis.
2. Vergleichen Sie die Minerale hinsichtlich ihres Sorptionsverhaltens, beziehen Sie dabei die Ergebnisse auf die jeweilige spezif. Oberfläche der Minerale.
3. Betrachten Sie die Ergebnisse bezüglich ihrer Umweltrelevanz.
Literatur:
[1] G. Geipel, M. Thieme: J. Radioanal. Nucl. Chem., 183 (1994) S. 139.
[2] W. Schimmack, D. Klotz, R. Kretner, K. Bunzl: Radiochim. Acta, 88 (2000) S. 77.
[3] G. Bernhard, G. Geipel, V. Brendler, H. Nitsche: Radiochim. Acta, 74 (1996) S. 87.
[4] R. Michel, J. Feuerborn, A. Knochel, F. Miller, S. Ritzel, H.C. Treutler, W. von Tumpling, C. Sanke: Acta Hydroch. Hydrob., 33 (2005) S. 492.
[5] O. Prat, T. Vercouter, E. Ansoborlo, P. Fichet, P. Perret, P. Kurttio, L. Salonen: Environ.
Sci. Technol., 43 (2009) S. 3941.
[6] M. Anke, O. Seeber, R. Muller, U. Schafer, J. Zerull: Chem. Erde-Geochemistry, 69 (2009) S. 75.
[7] M.L. Merroun, J. Raff, A. Rossberg, C. Hennig, T. Reich, S. Selenska-Pobell: Appl.
Environ. Microbiol., 71 (2005) S. 5532.
[8] T. Zorn: Dissertation: Untersuchungen der Sorption von Uran(VI) an das Gestein Phyllit zur Bestimmung von Oberflächenkomplexbildungskonstanten, TU Dresden (2000).
[9] R. Kümmel, E. Worch: Adsorption aus wäßrigen Lösungen, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig (1990).
[10] H.J. Rösler: Lehrbuch der Mineralogie, Deutscher Verlag für Grundstoffindustrie, Leipzig (1991).
[11] R.M. Cornell, U. Schwertmann: The Iron Oxides, WILEY-VCH, Weinheim (2003).
[12] M.L. Merroun, S. Selenska-Pobell: J. Contam. Hydrol., 102 (2008) S. 285.
ANHANG: Übersicht der Versuchsproben:
Gruppe 1
Sorption von U(VI) an einem biologischen System
pH-Wert nach U-Zugabe Probe
Zugegebene Uranstammlösung
(µl) Soll Ist nach 1 h
Sorption Uran 1 zu 15 ml: 3,0
Uran 2 4,5
1 4,5 2 4,5 3
zu 100 ml:
4,5
Sorption von U(VI) an Quarz in Abhängigkeit vom pH-Wert
pH-Wert nach U-Zugabe Probe S/L
(g/l)
Einwaage (mg)
1 M NaHCO3
(µl)
Zugegebene Uranstamm-
lösung (µl) Soll Ist nach 1 h Sorption
Uran - - - 3,0
Nullprobe 1 12 - - 4,5 Nullprobe 2 12 - - 6,5 Nullprobe 3 12 21,65 - 8,5
1 12 - 4,5
2 12 - 4,5
3 12 - 6,5
4 12 - 6,5
5 12 21,65 8,5
6 12 21,65 8,5
Gruppe 2
Sorption von U(VI) an einem biologischen System
pH-Wert nach U-Zugabe Probe
Zugegebene Uranstamm-
lösung (µl) Soll Ist nach 1 h
Sorption Uran 1 Zu 15 ml: 3,0
Uran 2 6,5
1 6,5 2 6,5 3
Zu 100 ml:
6,5
Sorption von U(VI) an Quarz in Abhängigkeit vom S/L-Verhältnis
pH-Wert nach U-Zugabe Probe S/L
(g/l)
Einwaage (mg)
Zugegebene Uranstamm-
lösung (µl) Soll Ist nach 1 h Sorption
Uran - - 3,0
Nullprobe1 6 - 6,5 Nullprobe2 12 - 6,5 Nullprobe3 18 - 6,5
1 6 6,5
2 6 6,5
3 12 6,5
4 12 6,5
5 18 6,5
6 18 6,5
Gruppe 3
Sorption von U(VI) an einem biologischen System
pH-Wert nach U-Zugabe Probe 1 M NaHCO3
(µl)
Zugegebene Uranstamm-
lösung (µl) Soll Ist nach 1 h
Sorption Uran 1 - Zu 15 ml: 3,0
Uran 2 8,5
1 8,5 2 8,5 3
zu 100 ml:
216,5
Zu 100 ml:
8,5
Sorption von U(VI) an Hämatit in Abhängigkeit vom pH-Wert
pH-Wert nach U-Zugabe Probe S/L
(g/l)
Einwaage (mg)
1 M NaHCO3
(µl)
Zugegebene Uranstamm-
lösung (µl) Soll Ist nach 1 h Sorption
Uran - - - 3,0
Nullprobe 1 0,5 - - 4,5 Nullprobe 2 0,5 - - 6,5 Nullprobe 3 0,5 21,65 - 8,5
1 0,5 - 4,5
2 0,5 - 4,5
3 0,5 - 6,5
4 0,5 - 6,5
5 0,5 21,65 8,5
6 0,5 21,65 8,5
Speziationsbestimmung von Actiniden und Lanthaniden mittels spektroskopischer Methoden
Gliederung in drei Teilversuche:
1. Untersuchung der Uran(VI)-Speziation mittels ATR FT-IR Spektroskopie 2. Komplexierung von Uran(VI) durch umweltrelevante Liganden
3. Speziationsbestimmung von Eu(III) in Biofluiden mittels laserinduzierter Fluoreszenzspektroskopie
Teilversuch 1: Untersuchung der Uran(VI)-Speziation mittels ATR FT-IR Spektroskopie
1. Aufgabenstellung
Der Teilversuch soll Sie in die Grundlagen der Speziation von U(VI) in wässriger Lösung und deren schwingungsspektroskopischen Charakterisierung einführen.
Identifizieren Sie unter Anwendung der ATR-Technik der Fourier-transform
Infrarotspektroskopie die in Lösung vorliegenden U(VI)-Komplexe und vergleichen Sie kritisch die spektroskopischen Ergebnisse mit den thermodynamischen Daten!
Folgende Fragestellungen sollen bei diesem Teilversuch bearbeitet werden:
1. Untersuchung der Speziation von U(VI) in wässrigen Lösungen in Abhängigkeit der U(VI) Konzentration bei konstantem pH-Wert
2. Untersuchung der Speziation von U(VI) in mikromolaren wässrigen Lösungen in Abhängigkeit des pH-Wertes.
2. Theoretische und praktische Grundlagen U(VI) Speziation in wässrigen Lösungen
Speziationen beschreiben die in wässrigen Lösungen unter bestimmten Bedingungen existierenden Molekülkomplexe. Berechnete Speziationsmodelle basieren auf
thermodynamischen Daten, die im Allgemeinen durch potentiometrische Experimente oder mittels Flüssig-Flüssig-Extraktion bestimmt wurden und somit keine Strukturinformationen der Spezies enthalten. Für die Actiniden liegen diese experimentell bestimmten thermodynamischen Daten zusammengefasst und bewertet in einer Datenbank der Nuclear Enery Agency (NEA TDB) vor. Spektroskopische Untersuchungen, z.B. ATR FT-IR können diese Daten verifizieren.
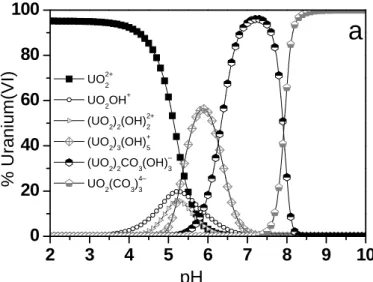
Abb. 1 zeigt die Speziesverteilung in einer wässrigen mikromolaren U(VI) Lösung über den pH- Bereich 2 – 10.
2 3 4 5 6 7 8 9 10
0 20 40 60 80 100
UO2+2 UO2OH+ (UO2)2(OH)2+2 (UO2)3(OH)+5 (UO2)
2CO
3(OH)–
3
UO2(CO3)4–3
% Uranium(VI)
a
ATR FT-IR Spektroskopie:
Im Pratikum werden die Uranyllösungen mithilfe eines IR-Spektrometers Vertex 80v der Firma Bruker Optics vermessen. Als internes Reflektionselement dient ein horizontaler Diamantkristall mit neun Oberflächenreflexionen unter einem Einfallswinkel von 45° (DURA SamplIR II, Smiths Inc.).
Abb. 2: Messprinzip der ATR FT-IR Spektroskopie und Foto der am IRC verwendeten ATR Einheit
Zur Analyse von wässrigen Lösungen wird eine Durchflusszelle eingesetzt, die direkt auf dem ATR-Kristall angebracht wird. Diese erlaubt es, wässrige Lösungen mit konstanter
Flussgeschwindigkeit (0,2 mL/min) über das optische Medium zu leiten. Dazu dient eine peristaltische Pumpe, die durch Verbindungsschläuche die zu analysierenden Lösungen aus den Probengefäßen direkt in die Durchflusszelle leitet (Abbildung 2).
3. Experimentelles Vorgehen Präparation der Lösungen
Für die Herstellung der U(VI) Messproben benötigen Sie Stammlösungen von UO2Cl2 und Natriumchlorid. NaCl wird als Hintergrundelektrolyt verwendet, da es keine Banden im
Wellenzahlbereich 1800 – 800 cm–1 besitzt. Vom Praktikumsbetreuer wird Ihnen eine 200 mM UO2Cl2 Lösung ausgehändigt. Für die NaCl Stammlösung berechnen Sie bitte die Einwaage laut Tab. 1 und stellen sie die Lösung anschließend unter Verwendung von destilliertem Wasser (MilliQ) her!
Tab. 1: Stammlösung zur Einstellung der Ionenstärke
Substanz NaCl
V [mL] 25
c [mol/L] 1
M [g/mol]
m [g]
Die Probelösungen werden unter Normaldruck und bei Raumtemperatur anhand Tab. 2 durch Zugabe der Stammlösungen hergestellt und mit MilliQ-Wasser aufgefüllt. Planen Sie dabei mögliche Volumenänderungen durch die anschließende Einstellung des pH-Wertes ein.
Kalibrieren Sie zunächst das pH Meter entsprechend der am Arbeitsplatz ausliegenden
Anleitung. Die pH-Werte werden unter Rühren auf eine Genauigkeit von ± 0.05 pH-Einheiten eingestellt.
Tab. 2: Parameter der Probelösung
Gruppe 1 Probe B1 Probe U1
V [mL] 25 25
Substanz NaCl UO2Cl2 NaCl UO2Cl2
c [mol/L] 0,1 - 0,1 5 x10-4
Zugabe
pH 2 2
Gruppe 2 Probe B2 Probe U2
V [mL] 100 25
Substanz NaCl UO2Cl2 NaCl UO2Cl2
c [mol/L] 0,1 - 0,1 5 x10-4
Zugabe
pH 4 4
Gruppe 3 Probe U3 Probe U4
V [mL] 25 25
Substanz NaCl UO2Cl2 NaCl UO2Cl2
c [mol/L] 0,1 5 x10-5 0,1 5 x10-3
Zugabe
pH 4 4
In-situ ATR FT-IR-Messung
Die IR-Messung und die Auswertung erfolgt mit der Software OPUS 6.0 unter Anleitung des Praktikumbetreuers. Kontrollieren Sie, ob Vakuum am Interferrometer anliegt und ob der Detektor ausreichend gekühlt ist. Im Folgenden wird das Interferrogramm justiert und ein Hintergrundspektrum des sauberen ATR-Kristalls aufgenommen.
Befüllen Sie die jeweiligen Proberöhrchen mit den zu vermessenden Lösungen. Gruppe 3
verwendet als Blanklösung B2 (hergestellt von Gruppe2) für die Uranproben U3 und U4. Spülen Sie die Schläuche durch Ablassen von ca. 2 mL, achten Sie darauf, dass dabei keine
Luftbläschen eingeschlossen werden. Setzen Sie die Durchflusszelle auf den ATR-Kristall auf, und schließen Sie den Zulauf und Ablauf an. Stellen Sie eine Durchflussgeschwindigkeit von 0.2 mL/min an der peristaltischen Pumpe am Ablauf ein.
Die Spektrenaufnahme beginnt mit der thermischen Konditionierung des Messsystems mit der Blanklösung (Zustand A). Nach ca. 10-15 Einkanalspektren wird mittels Ventil auf die
Uranyllösung umgeschaltet (Zustand B). Es werden weitere 15 Einkanalspektren aufgenommen.
Auf eine sachgerechte Trennung der Abfälle in aktive und inaktive ist zu achten. Nach der IR Messung wird die Duchflussapparatur entfernt und der Kristall mit MilliQ-Wasser, ca. 0,5 mL
Auswertung der aufgenommenen IR Spektren:
Zur Berechnung der Differenzspektren verwendet man die aufgenommenen Einkanalspektren (EKS) vor (Zustand A) und nach (Zustand B) der induzierten Veränderung des Systems (Zugabe von U(VI)).
B
A
EKSUO
EKS:1,2,3,4,5,6,7,8,9,10... :1,2,3,4,5,6,7,8,9,10,11...
22
⎯
⎯ →
⎯
+Die Software OPUS 6.0 berechnet diese Spektren mit Hilfe eines Rechenalgorithmus. Dafür wählen Sie die zuletzt aufgenommenen EKS vor dem Umstellen des Ventils aus, weil sich das System dann in einem thermischen Gleichgewicht befindet und weitere Spektren nach dem Umstellen. Das erstellte Makro in OPUS berechnet dann einzelne Differenzspektren und mittelt diese am Ende. Die Mittelwertbildung ermöglicht ein verbessertes Signal-Rausch-Verhältnis im Vergleich zu einem einzelnen Differenzspektrum.
Bsp.: Sie wählen EKS A8, A9, B6, B7
Opus berechnet: ⎟
⎠
⎜ ⎞
⎝
− ⎛
=
⎟⎠
⎜ ⎞
⎝
= ⎛
− A
B B
OD A
DB A[ ] log log
Es werden also 4 verschiedene Differenzspektren der Paare (A8;B6), (A9;B6), (A8;B7), (A9;B7) berechnet und anschließend gemittelt.
Die erhaltenen Differenzspektren werden als Datenpunkttabelle (.dpt) gespeichert und stehen Ihnen dann zur weiteren Auswertung, z.B. mit Origin zur Verfügung.
4. Auswertung
Tauschen Sie sich zur Auswertung des ATR FT-IR Teilversuches mit den anderen Gruppen aus.
Stellen Sie gemeinsam die aufgenommenen Spektren vergleichend grafisch dar und bestimmen Sie die Lage der Absorptionsbanden. Charakterisieren Sie anhand der spektroskopischen Befunde die U(VI) Speziation in wässriger Lösung in Abhängigkeit der U(VI) Konzentration und des pH-Wertes.
5. Literatur
[1] Quilès, F.; Burneau, A. Vibrational Spectroscopy 2000, 23, 231.
[2] Müller, K.; Brendler, V.; Foerstendorf, H. Inorganic Chemistry 2008, 47, 10127.
[3] Günzler, H.; Gremlich, H.-U. IR Spectroscopy. An Introduction, 1 ed.; Wiley-VCH:
Weinheim, 2002.
Teilversuch 2: Komplexierung von Uran(VI) durch umweltrelevante Liganden
1. Aufgabenstellung
Die Komplexierung von Uran(VI) ist zum einem pH abhängig und zu anderem abhängig vom Komplexierungspartner. Ziel des Praktikums ist es die Komplexierung des Uran(VI) durch UV/VIS-Spektroskopie bei verschiedenen pH Werten in Anwesenheit unterschiedlicher Liganden zu untersuchen.
2. Theoretische Grundlagen
Die Eigenschaft Licht zu absorbieren besitzen bei Uran die Oxidationsstufen +4, +5 und +6, wobei die Wellenlängenbereiche in denen sie Licht absorbieren unterschiedlich sind. Auf Grund dieser Tatsache ist es möglich die verschiedenen Oxidationsstufen parallel nach zu weisen. Abb.3 zeigt die UV/VIS-Spektren der drei verschiedenen Oxidationsstufen des Urans.
Abb. 3: Absorptionsspektren der drei Oxidationsstufen des Urans
So verschiebt sich das Bandenmaximum von 255 nm für Uran(V) im UV Bereich über das
Maximum von 414 nm für Uran(VI) bis zu einem Maximum von 647,5 nm für Uran(IV) [1-3]. Die Extinktionskoeffizienten für die einzelnen Oxidationsstufen sind mit 48,1 L·mol-1·cm-1 (U4+), 660 L·mol-1·cm-1 (UO2+) und 7,1 L·mol-1·cm-1 (UO22+) eher gering im Vergleich zu organischen Substanzen, bei denen die Extinktionskoeffizienten zwischen 1000 und 50000 L·mol-1·cm-1 betragen können [4].
Das Maximum der Lichtabsorption ist nur nicht von der Oxidationsstufe des Metall-Ions abhängig sondern auch von der Art des Liganden (Komplexpartner). Dabei zeigt Abb. 4 den Einfluss des Gegen-Ions auf das Uran(VI)-Absorptionsspektrum.
Abb. 4: Einfluss des Gegen-Ions auf Uran(VI)-Absorptionsspektrum
Zur Bestimmung der Komplexbildungskonstante werden konzentrationsabhängige UV/VIS- Spektren aufgenommen. Die Probelösungen besitzen in den meisten Fällen eine feste Metall- Konzentration, einen festen pH-Wert und eine feste Ionenstärke nur die Konzentration an Ligand wird schrittweise erhöht. Wie Abb. 5 zeigt, erhöht und verschiebt sich das Bandenmaximum des Uranylspektrums mit der Erhöhung der Cystein-Konzentration.
Abb. 5: Uran(VI)-absorptionsspektrum in Abhängigkeit von der Cystein-Konzentration (cU=0,001 M, I=0.5 M (NaClO4), pH 2) [5]
Als Maß der Stärke des Komplexes dient zu einem die Komplexbildungskonstante und für die qualitative Analyse die Verschiebung und Erhöhung des Absorptionsspektrum bei gleichen Konzentrationsverhältnissen.
3. Versuchsdurchführung Chemikalien:
Informieren Sie sich über Gefahrenhinweise und den Umgang mit folgenden Chemikalien:
- Uranylperchlorat UO2(ClO4)2
- Citronensäure C6H8O7
- Glucose C6H12O6
- Natriumcarbonat Na2CO3
- Natriumperchlorat Monohydrat NaClO4*H2O
Herstellung der Stammlösungen
Neben der Uranylperchlorat-Stammlösung (c = 0,1 mol/l), die am Arbeitsplatz bereits vorhanden ist, sind folgende Lösungen für den Versuch her zustellen. Die Feststoffe werden entsprechend der Tab. 3 eingewogen und mit destilliertem Wasser gelöst.
Tab. 3: Herstellung der Stammlösungen
Gruppe 1 Gruppe 2
Substanz Citronensäure Glucose Natriumcarbonat Natriumperchlorat
V (ml) 10 10 10 25
c (mol/l) 0,1 0,1 0,1 1
M (g/mol) m (g)
Gruppe 3 nimmt am UV/VIS Zweistrahlspektrometer die Baselinie auf. → siehe Spektrenaufnahme Baseline
Herstellung der Messlösungen:
Die vier Messlösungen (V = 10 ml) jeder Gruppe werden durch verdünnen der Stammlösungen hergestellt. Zuerst werden die einzelnen Lösungen entsprechend der Reihenfolge nach Tab. 4 zugegeben. Danach füllt man den Kolben mit dest. Wasser bis kurz unter dem Eichstrich und misst den pH-Wert. Anschließend wird durch Zugabe von verdünnter Perchlorsäure (HClO4) oder Natronlauge (NaOH) der gewünschte pH-Wert eingestellt. Nach Einstellung des pH-Wertes wird der Kolben bis zum Eichstrich mit dest. Wasser aufgefüllt. Zum Schluss wird der pH-Wert nochmals überprüft wobei die Abweichung vom Soll-Wert ± 0,05 Einheiten betragen darf.
Tab. 4: Herstellung der Probelösungen
Gruppe 1 Lösung UO2(ClO4)2
(mol/l)
C6H8O7
(mol/l)
C6H12O6
(mol/l)
Na2CO3
(mol/l)
NaClO4
(mol/l) pH
0,0001 0,001 - - 0,1
1
Zugabe (ml) 2
2 0,0001 - 0,001 - 0,1
Zugabe (ml) 2
3 0,0001 - - 0,001 0,1
Zugabe (ml) 2
4 0,0001 0,001 0,001 0,001 0,1
Zugabe (ml) 2
Gruppe 2 Lösung UO2(ClO4)2
(mol/l)
C6H8O7
(mol/l)
C6H12O6
(mol/l)
Na2CO3
(mol/l)
NaClO4
(mol/l) pH
0,0001 0,001 - - 0,1
1
Zugabe (ml) 5
2 0,0001 - 0,001 - 0,1
Zugabe (ml) 5
3 0,0001 - - 0,001 0,1
Zugabe (ml) 5
4 0,0001 0,001 0,001 0,001 0,1
Zugabe (ml) 5
Gruppe 3 Lösung UO2(ClO4)2
(mol/l)
C6H8O7
(mol/l)
C6H12O6
(mol/l)
Na2CO3
(mol/l)
NaClO4
(mol/l) pH
0,0001 0,001 - - 0,1
1
Zugabe (ml) 8
2 0,0001 - 0,001 - 0,1
Zugabe (ml) 8
3 0,0001 - - 0,001 0,1
Zugabe (ml) 8
4 0,0001 0,001 0,001 0,001 0,1 8
UV/VIS-Messung:
Die für die UV/VIS- Messung verwendete Küvette wird zuerst 2 mal mit der Messlösung gespült, anschließend werden ca. 3 ml dieser Lösung in die Küvette überführt und das UV-Spektrum aufgenommen. Zwischen den Messungen werden die Küvetten zusätzlich noch 2-mal mit dest.
Wasser gespült.
Spektrenaufnahme:
• Computer starten
• Computerprogramm Cary5 starten
• 2 mal mit Okay bestätigen Baseline: Wasser gegen Wasser
• Setup
• STORAGE → Datenpfad eingeben → Filename eingeben: blxxxx (z.B.: bl3001)
• SCAN MODE Start: 600 nm Ende: 300 nm
Data interval: 0,1 nm Speed: 60 nm/min.
• OPTIONS Source Change: 250 nm Detector Change: 850 nm
• BASELINE o.k.
• Baseline Correct → File name eingeben: blxxxx (bl3001)
• START
Probe: Probe gegen Wasser
• STORAGE → Datenpfad eingeben → Filename eingeben: lsgx (lsg1)
• OK
• SCAN Datentransfer:
In der linken Spalte ist die Wellenlänge und der rechten Spalte ist die Absorption dargestellt, die Darstellung des Spektrums erfolgt individuell.
4. Auswertung
Stellen Sie die aufgenommenen Uran-Absorptionsspektren in Abhängigkeit vom pH-Wert und vom eingesetzten Liganden grafisch dar. Tauschen Sie sich hierzu auch mit den anderen Gruppen aus! Vergleichen Sie das Aussehen sowie die Bandenlage und die daraus resultierende
Bandenverschiebung aller gemessenen Spektren miteinander. Zur qualitativen Analyse der Stärke des Komplexes nutzen Sie die Verschiebung und die Erhöhung der Absorptionsspektren und treffen Sie anhand dieser eine Aussage über die in Lösung vorherrschende Uran(VI)-Speziation in
Anwesenheit von umweltrelevanten Liganden.
5. Literaturverzeichnis Bücher:
W. Gottwald; Instrumentell-analytisches Praktikum; Band 4b; VCH-Verlag; 1996 W. Gottwald, K.H. Heinrich;UV/VIS-Spektroskopie für Anwender; VCH-Verlag; 1998 Publikationen:
[1] K.R. Howes, A. Bakac, J.H. Espenson, Inorganic Chemistry 27, No.5 (1988) 791-794.
[2] J.T. Bell, R.E. Biggers, J. Mol. Spectrosc. 18 (1965) 247-275.
[3] J.T. Bell, M.R. Billings, Journal of Inorganic & Nuclear Chemistry 37 (1975) 2529-2531.
[4] H.-H. Perkampus, UV-VIS Spectroscopy and ITS Applications, Springer-Verlag, Berlin, 1992.
[5] A. Gunther, G. Geipel, G. Bernhard, Polyhedron 26 (2007) 59-65.
Teilversuch 3: Speziationsbestimmung von Eu(III) in Biofluiden mittels laserinduzierter Fluoreszenzspektroskopie
1. Aufgabenstellung
Mit Hilfe der laserinduzierten Fluoreszenzspektroskopie (TRLFS) soll die Bindungsform von Europium(III) in einem natürlichen Biofluid untersucht und die Hauptspezies ermittelt werden.
Dazu wird zu verschiedenen menschlichen Urinproben Eu(III) zugegeben und die Lösungen spektroskopisch untersucht. Zusätzlich werden Referenzlösungen aus einzelnen Urinbestandteilen hergestellt und ebenfalls mit Eu(III) versetzt gemessen. Durch Vergleich der gemessenen Eu(III)- Spektren in Urin- und Referenzproben sollen dann Rückschlüsse auf dominierende Komplexe im Biofluid gezogen werden.
2. Theoretische Grundlagen
Fluoreszenz von Europium(III) – Komplexen:
Wird einer Probe Energie in Form von Licht im sichtbaren oder UV – Bereich hinzugefügt, wird ein Elektron aus einem Grundzustand (7F0 in Abb. 6) in einen energetisch höherliegenden Zustand angehoben (Absorption, rote Linien in Abb. 6). Unter Abgabe von Energie gelangt das Elektron wieder in den Grundzustand zurück. In den meisten Fällen verläuft diese Desaktivierung
strahlungslos unter Wärmeabgabe (schwarze Linien in Abb. 6). Auf diese strahlungslosen Prozesse kann zusätzlich eine Emission von Licht folgen, die so genannte Photolumineszenz (blaue Linien in Abb. 6). Dabei unterscheidet man zwischen Fluoreszenz und Phosphoreszenz (vgl. Seminarskript S.
11, Jablonski-Diagramm).
5D0
5D1
5D2
5L6
7F
0 1 2 3 4 5 6
578 nm 526 nm 394 nm 578 nm 592 nm 618 nm 700 nm
5D0
5D1
5D2
5L6
7F
0 1 2 3 4 5 6
578 nm 526 nm 394 nm 578 nm 592 nm 618 nm 700 nm
Abb. 6: Energieniveauschema für Absorptions- und Emissionsvorgänge im UV-VIS Bereich (Jablonski – Diagramm) für Europium(III) – Verbindungen
Wird die Probe nicht mehr angeregt, so finden nach und nach immer weniger Desaktivierungen statt, was zu einer exponentiellen Abnahme der Lumineszenzintensität führt. Neben der Lage der Emissionsbande(n) sind auch die Lumineszenzlebensdauern für die lumineszierende Komponente charakteristisch.
Zeitaufgelöste Laserinduzierte Fluoreszenzspektroskopie (TRLFS):
Ein wesentlicher Vorteil von Lasern gegenüber Lampen, die gewöhnlich für die Anregung mit Licht eingesetzt werden, ist die Erzeugung stark monochromatischen Lichtes. Daher kann man Proben mit einer definierten Wellenlänge anregen. Ein weiterer Vorteil ist die deutlich höhere Energie, mit der die Probe angeregt wird. Dadurch werden viel geringere Nachweisgrenzen erreicht. Durch die Erzeugung sehr kurzer Lichtblitze (Pulse) im Mikro- bis Femtosekundenbereich ist es außerdem möglich, auch sehr schnelle Prozesse zu untersuchen.
Laser Probe
Spektrograph Kamera PC
Detektor
Laser Probe
Spektrograph Kamera PC
Detektor
Abb. 7: Schematischer Aufbau des LFS-Systems
Die Küvette (Probe) wird in einem dafür vorgesehenen Halter fixiert. Der gepulste Laser regt die Probe mit Licht der Wellenlänge 395 nm an. Im Winkel von 90° wird das emittierte Licht in ein Glasfaserkabel fokussiert. Dieses Glasfaserkabel ist mit einem Spektrograph verbunden, in dem das eintretende Licht durch ein Gitter spektral aufgespaltet wird. Eine CCD – Kamera nimmt dann das Spektrum auf. Spektrograph und Kamera sind mit einem Computer verbunden und werden mittels Software gesteuert.
3. Durchführung Chemikalien:
Informieren Sie sich über Gefahrenhinweise und den Umgang mit folgenden Chemikalien:
- Citronensäure (H3Cit) - Harnstoff (Urea) - Natriumchlorid - Natriumcarbonat - Natriumsulfat - Natriumphosphat - Kaliumchlorid - Calciumchlorid
- Magnesiumsulfat Heptahdydrat - Europium(III)-oxid
Um Rückschlüsse auf die Eu(III)-Speziation in den Urinproben ziehen zu können, werden zunächst Referenzspektren von Eu(III) in synthetischer Urinelektrolytlösung ohne und mit Citronensäure bzw. Harnstoff aufgenommen. Die dazu benötigten Stammlösungen werden zur Verfügung gestellt.
Tab. 5: Herstellung der Messlösungen 1 (V = 10 ml)
Substanz Eu(III) NaCl KCl CaCl2 Na2SO4 Na2CO3 Na3PO4 MgSO4 · 7H2O cSL
(mM) 6.8 2 1 0.1 0.5 0.1 0.5 0.1
cML
(mM) 0.03 150 35 2 7 5 13 2
Verdün-
nung 1: 1: 1: 1: 1: 1: 1: 1:
Zugabe (ml)
Tab. 6: Herstellung der Messlösungen 2 und 3 (V = 10 ml) analog Lösung 1 (s.o.) mit zusätzlich H3Cit ODER Urea
Substanz H3Cit Urea
cSL (mM) 0.1 1
cML (mM) 0.03 500
Verdünnung 1: 1:
Zugabe (ml) pH-Einstellung
Zur Interpretation der spektroskopischen Ergebnisse ist die genaue Bestimmung des pH-Wertes nötig. Die erste Gruppe kalibriert dazu das pH-Meter entsprechend der am Arbeitsplatz
ausliegenden Anleitung. Bestimmen Sie anschließend den pH-Wert der Ihnen zugewiesenen Urinprobe. Geben Sie dann die entsprechende Menge Eu(III) hinzu, um eine Konzentration von 3 · 10-5 M zu erreichen (V = 10 ml), und notieren sie eventuelle pH-Änderungen.
Stellen Sie nun Ihre Messlösungen 1, 2 und 3 auf den pH-Wert (± 0.05 Einheiten) der Urinprobe nach der Eu(III)-Zugabe ein und notieren Sie die endgültigen Werte.
Tab. 7: pH-Werte der Messlösungen Gruppe 1
Lösung
Urinprobe vor Eu(III)- Zugabe
Urinprobe nach Eu(III)- Zugabe
Eu(III)-
Standard ML 1 ML 2 ML 3 pH-
Wert