Philipps-Universität Marburg Fachbereich 15: Chemie
Übung: Experimentalvorträge für Studierende des Lehramts Leitung: Herr Dr. Reiß, Herr Prof. Dr. Neumüller
Wintersemester 2018/2019
Referent: Johannes Bulle (Bulle@students.uni-marburg.de) Datum des Vortrags: 16. Januar 2019, 15 Uhr
Experimentalvortrag OC: „Getränke im Tagesverlauf“
2 Inhaltsverzeichnis
Einleitung ... 3
Konzeptionelle Überlegung des Vortrags: Exemplarisch-imaginärer Tagesablauf ... 3
1. Versuch (Frühstück): Nachweis von Vitamin C in Orangensaft ... 5
2. Versuch (Vormittag): Zuckernachweis in Cola mit der Fehling-Probe ... 9
3. Versuch (Mittagessen, Demo): Enzyme in Fruchtsäften ... 16
4. Versuch (Nachmittag): Antioxidative Eigenschaften von Tee... 20
5. Versuch (Abend): Der Alkohol-Tester ... 28
Didaktisch-methodische Reflexion ... 34
Anhang: Bildquellennachweise des Deckblattes ... 37
3
Einleitung
Getränke sind im Alltag omnipräsent: Neben einer ausgewogenen Ernährung zählt ausreichen- des und regelmäßiges Trinken zu den Grundbedürfnissen des Menschen und nimmt in dieser Hinsicht eine Schlüsselstellung innerhalb des täglichen Lebens ein. Gleichzeitig erweist sich die Welt der Getränke als außerordentlich vielfältig, verdeutlicht man sich nur allein die schier unendliche Variationsbereite an Getränken, die zur täglichen Flüssigkeitszufuhr und Durststil- lung herangezogen werden können (Kaffee, Tee, Fruchtsäfte, Mineralwasser, Alkoholika u.v.m.). Vor diesem Hintergrund scheint in der näheren Untersuchung der chemischen Seite unseres alltäglichen Getränkekonsums ein signifikantes didaktisches Potential zu liegen, wel- ches gleichermaßen Lebenswelt- und Aktualitätsbezug der Lernenden mit fachlich-inhaltlicher Fundierung zu verbinden vermag und darüber hinaus zugleich auch überfachlich im Rahmen einer gesundheitsbewussten Ernährungserziehung eine wichtige Berechtigung einzunehmen scheint (z.B. Problematisierung häufig sehr hohen Zuckergehalts in Soft- und Energydrinks und daraus folgende ernährungsphysiologische Implikationen). Angesichts dessen soll in der vor- liegenden Ausarbeitung bzw. Verschriftlichung des Experimentalvortrages zum Thema „Ge- tränke im Tagesverlauf“ der Versuch unternommen werden, das interessante und vielfältige Thema der Getränkechemie unter einem organischen Schwerpunkt etwas näher zu beleuchten.
Hierbei wird eine prinzipiell zweifache Zielsetzung intendiert: Zum einen soll versucht werden, einen repräsentativen Überblick über möglichst viele verschiedene Arten von Getränken zu er- reichen, u.a. hinsichtlich Fruchtsäften, Softdrinks, alkoholischen Getränken, Aufgussgetränken etc.; gleichzeitig wird aufgrund des explizit organisch-chemischen Fokus versucht, möglichst viele organische Stoffklassen innerhalb der Getränkewelt näher zu begutachten (Vitamine, En- zyme, Zucker, Alkohol etc.) und hierbei nicht zuletzt neben deren fachimmanenter Perspektive immer auch einen Bogen zu schlagen zur Alltagsbedeutung dieser Getränkearten, u.a. in ernäh- rungsphysiologischer Hinsicht. Die Gliederung des Vortrags wie auch der vorliegenden Ver- schriftlichung orientiert sich dabei an einem exemplarisch-imaginären Tagesablauf: So soll zu jeder Tageszeit (Morgens, Vormittags, Mittags, Nachmittags, Abend) ein charakteristisches Getränk herausgegriffen und experimentell näher untersucht werden. Am Schluss der Arbeit werden die zuvor dargestellten Versuche einer eingehenderen didaktisch-methodischen Refle- xion unterzogen und es wird eruiert, inwiefern sich ein Schulbezug durch Verankerung der Experimente im Kerncurriculum herstellen ließe.
Konzeptionelle Überlegung des Vortrags: Exemplarisch-imaginärer Tagesablauf
Als konzeptionelle Grundüberlegung bzw. zugleich Strukturierung und damit als „roter Faden“
des Vortrags wurde versucht, das Thema der Getränkechemie anhand eines exemplarisch-
4 imaginären Tagesablaufs zu rekonstruieren. Die Vorstellung dabei war, dass zunächst unmit- telbar nach dem morgendlichen Aufstehen das Frühstück näher thematisiert würde. Hierbei bot sich an, als charakteristisches Frühstücksgetränk den Orangensaft näher zu beleuchten (→ Ver- such 1: Nachweis von Vitamin C in Orangensaft), da dieser mit zu den beliebtesten Getränken am Frühstückstisch gehört und insbesondere auch für die schulische Zielgruppe der Kinder und Jugendlichen womöglich noch von größerer Alltagsbedeutung ist als z.B. Kaffee o.Ä. Im wei- teren Verlauf des imaginären Tages wurde vorgestellt, dass man vormittags einer sportlichen Aktivität wie bspw. Joggen nachgeht; da im Anschluss an diese nicht selten als Regeneration verbrauchter Energie ein zuckerhaltiger Softdrink konsumiert wird, wurde versucht, dies mit dem zweiten Versuch etwas eingehender zu fokussierten (→ Versuch 2: Zuckernachweis in Cola mit der Fehling-Probe). Im weiteren Tagesverlauf, so die Imagination, nahm anschließend das Mittagessen eine größere Relevanz ein. Hierbei wurde der Fokus v.a. auf das weitgesteckte Themenfeld der Fruchtsäfte gelegt, da diese neben Wasser und Kaffee zu den beliebtesten Ge- tränken der Deutschen zählen (→ Versuch 3: Enzyme in Fruchtsäften).1 Nach dem Mittagessen rückte nun als nächste Mahlzeit die Nachmittagstafel näher in den Blickwinkel. Da hier (neben Kaffee) der Tee in seinen vielfältigen Variationen sicherlich zu den bedeutsamsten Nachmit- tagsgetränken gehört, befasste sich der vierte Versuch dezidierter mit der oft dem Tee zuge- schriebenen gesundheitsförderlichen Wirkung (→ Versuch 4: Antioxidative Eigenschaften von Tee). Am Abschluss des gedanklich sich nun neigenden Tages wie auch zum Ende des Vortra- ges wurde schließlich ein Blick auf typische Getränke des Abends geworfen. Hierzu zählen insbesondere alkoholhaltige Getränkesorten wie Wein, Bier, Spirituosen etc.; exemplarisch wurde hier der Wodka als Vertreter hochprozentiger Alkoholika ausgewählt, um in einem ex- perimentellen Modellversuch die Funktionsweise eines Alkohol-Teströhrchens (dessen Mitfüh- rung im Auto z.B. in Frankreich gesetzlich vorgeschrieben war) zu demonstrieren und zugleich einen Anknüpfungspunkt zu eröffnen hinsichtlich der Sensibilisierung bzgl. des Themas ju- gendlicher Alkoholkonsum bzw. -missbrauch als wichtiges überfachliches Lernziel der Schule (→ Versuch 5: Alkohol-Tester).
1 Vgl. Verband der Deutschen Fruchtsaft-Industrie (Hrsg.): Deutsche Fruchtsaft-Industrie Zahlen & Fakten 2017, Bonn 2018.
5
1. Versuch (Frühstück): Nachweis von Vitamin C in Orangensaft
2Zeitbedarf
Vorbereitung: 5 min Durchführung: 2 min Nachbereitung: 5 min Reaktionsgleichung
Abb. 1: Reaktionsgleichung des Vitamin-C-Nachweises.3
Chemikalien4
Tab. 1: Verwendete Chemikalien.
Geräte und Materialien
- Demo-Reagenzglas mit Reagenz- glasständer
- 50-mL-Becherglas
- Spritzflasche
- Pasteur-Pipette mit Pipettenhütchen - 250-mL-Messkolben
2 Vgl. Bader, H.J./Drechsler, B./Salzner, J./Dogan, B.: Vitamin C als Nahrungsergänzung und Arzneimittelbe- standteil, CHEMKON 8, 2001, V1, S. 190.
3 Eigene Erstellung mit ChemDraw, 27.11.2018.
4 Vgl. HessGISS, V. 22.0 (2017/2018), auch im Folgenden verwendet.
5 Keine HessGISS-Daten verfügbar, stattdessen verwendet: Sigma Aldrich: Sicherheitsdatenblatt zu (L)-Dehydro- ascorbic acid. Online verfügbar: https://www.sigmaaldrich.com/catalog/product/ALDRICH/261556?lang=de&re- gion=DE (letzter Zugriff: 22.01.2019, 09:14 Uhr).
Eingesetzte Stoffe und Produkte
Summenformel Menge H-Sätze P-Sätze Gefahrensym- bole
Schul- einsatz 2,6-Dichlorpheno-
lindophenol-Na-Salz (Tillmans Reagenz)
C12H6Cl2NNaO2(aq) 2 Pipet- ten
OE
Orangensaft 10 mL OE
entmineral. Wasser H2O(l) 160 mL OE
Produkt
Dehydroascorbin- säure5
C6H6O6(aq) geringe
Mengen
6 Aufbau
Pipette mit Tillmans Reagenz
Verdünnter Orangensaft
Abb. 2: Aufbau Nachweis von Vitamin C in Orangensaft.6
Durchführung
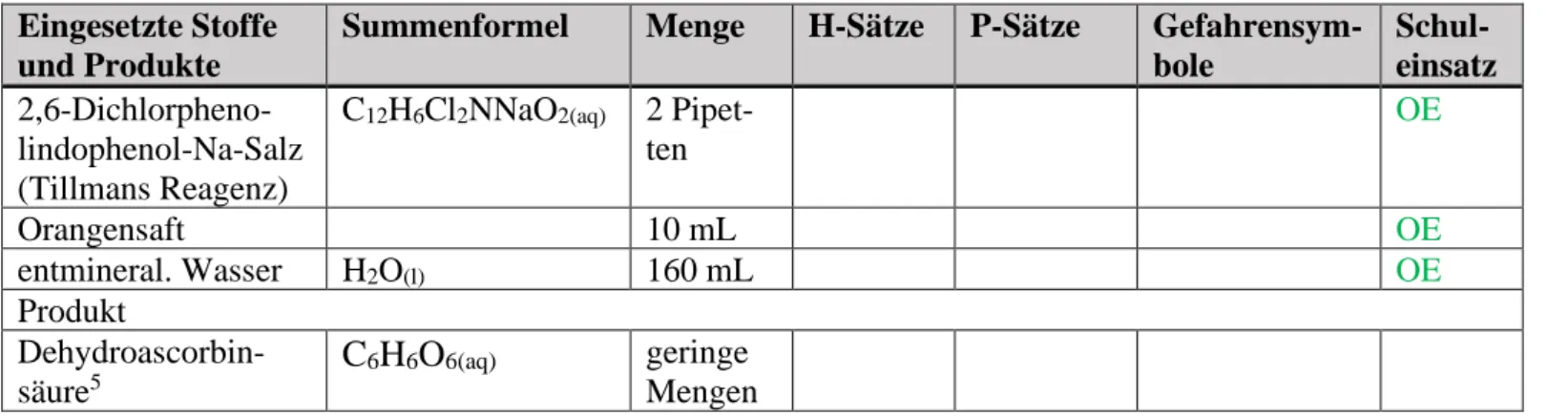
Zu Beginn des Versuchs werden zunächst 10 mL des Orangensaftes in ein 50-mL-Becherglas gegeben und anschließend in einen 250-mL-Messkolben überführt. Anschließend wird der Saft mit 150 mL entmineral. Wasser versetzt. Von diesem so verdünnten Orangensaft werden nun- mehr ca. 10 mL in ein Demo-Reagenzglas gefüllt, bevor schließlich nacheinander insgesamt 2-3 mL der DCPIP-Lösung zugesetzt werden (zwischendurch vorsichtig schwenken).
Beobachtung
Direkt nach dem Entnehmen aus der Flasche besitzt der Orangensaft eine charakteristische gelbe Farbe, deren Intensität durch das anschließende Verdünnen mit Wasser etwas nachlässt.
Die Lösung von Tillmans Reganz wiederum weist eine intensive blaue Farbe auf. Direkt nach der Zugabe des Tillmans Reagenz zum Orangensaft kann eine sofortige Entfärbung beobachtet werden, wobei kurzzeitig noch violette Schlieren zu sehen sind, die jedoch durch das vorsich- tige Schwenken des Reagenzglases nach kurzer Zeit wieder verschwinden. Nach der Zugabe der dritten Pipette Tillmans Reagenz tritt keine Entfärbung mehr ein, die Lösung besitzt nun eine blasse rosa Farbe, die auch durch weiteres Schwenken nicht mehr verschwindet.
Abb. 3: Orangensaft pur (links), mit Wasser verdünnt (Mitte) und nach Zugabe von Tillmans Reagenz (rechts).7
6 Eigene Erstellung mit ChemSketch, 14.04.2019.
7 Eigene Erstellung mit Handykamera, 21.11.2018.
7 Entsorgung
Überschüssiger Orangensaft (verdünnt/unverdünnt) kann in den Abguss gegeben werden. Der mit Tillmans Reagenz versetzte Orangensaft wird neutral den Lösungsmittelabfällen zugeführt.
Fachliche Auswertung der Versuchsergebnisse
Mit dem betrachteten Experiment soll stellvertretend am Beispiel des Orangensaftes ein Nach- weis auf Vitamin C erbracht werden. Als Nachweisreagenz findet das Na-Salz von 2,6-Dich- lorphenolindophenol (DCPIP, Tillmans Reagenz) Verwendung.
O
O
H OH
O H
O H
O H
Abb. 4: Strukturformeln von Tillmans Reagenz (links) und Vitamin C (rechts).8
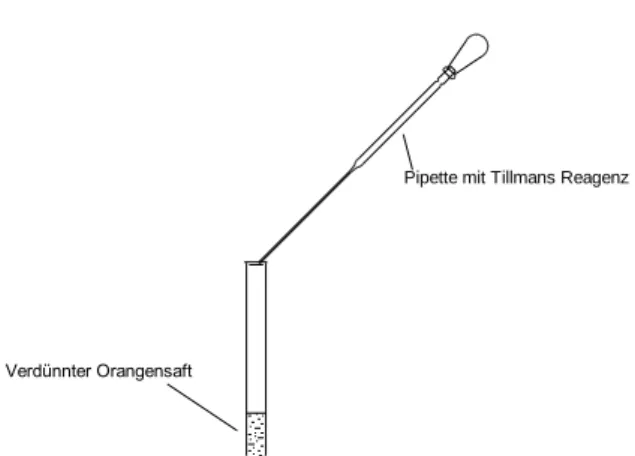
Bei Vitamin C (L-Ascorbinsäure) handelt es sich chemisch gesehen um eine vinyloge Carbon- säure, deren Enolfunktion verantwortlich ist für die signifikante Acidität der Verbindung. Zu- dem weist das Molekül noch zwei stereogene Zentren auf, wobei die L-Variante dem natürlich vorkommenden Vitamin C entspricht. Neben dem sauren Charakter (Ascorbinsäure) kann Vi- tamin C auch als Reduktionsmittel fungieren, da die charakteristische Enol-Funktion durch ihre Fähigkeit zur Abgabe von Elektronen zum Diketon oxidiert werden kann. Tillmans Reagenz wiederum stellt ein ausgeprägtes Oxidationsmittel dar, welches somit mit dem komplementären Reaktionspartner Ascorbinsäure eine Redox-Reaktion eingeht.9
Abb. 5: Redox-Prozesse bei der Reaktion von Vitamin C mit Tillmans Reagenz.7
8 Eigene Erstellung mit Chemdraw, 27.12.2018.
9 Vgl. Butenschön, H. (Hrsg. der Übersetzungsauflage): Vollhardt, K.P.C.; Schore, N.E.: Organische Chemie. 5.
Auflage, Wiley-VCH Verlag, Weinheim, 2011, S. 1244.
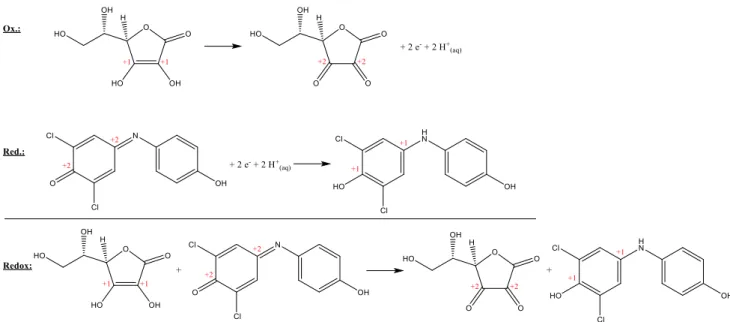
8 Anhand obiger Redox-Gleichungen ist zu erkennen, dass Ascorbinsäure zunächst durch Ab- gabe zweier Elektronen im Sauren zu Dehydroascorbinsäure oxidiert wird, während das im Versuch ursprünglich eingesetzte Natrium-Salz von DCPIP (Tillmans Reagenz) zum ungela- denen Molekül reduziert wird. Bei dieser nichtionischen Verbindung handelt es sich um die farblose Leukoform des Farbstoffes, da sich das delokalisierte π-Elektronensystem durch die Aufnahme der beiden Elektronen verändert hat und nunmehr kein Licht mehr im sichtbaren Spektralbereich absorbiert. Dies ist zugleich der Grund dafür, dass (wie im Versuch beobachtet) das zugesetzte blaue Tillmans Reagenz unmittelbar nach Zugabe zum Vitamin-C-haltigen Orangensaft entfärbt wird und auf diese Weise zugleich die Ascorbinsäure qualitativ nach- weist.10
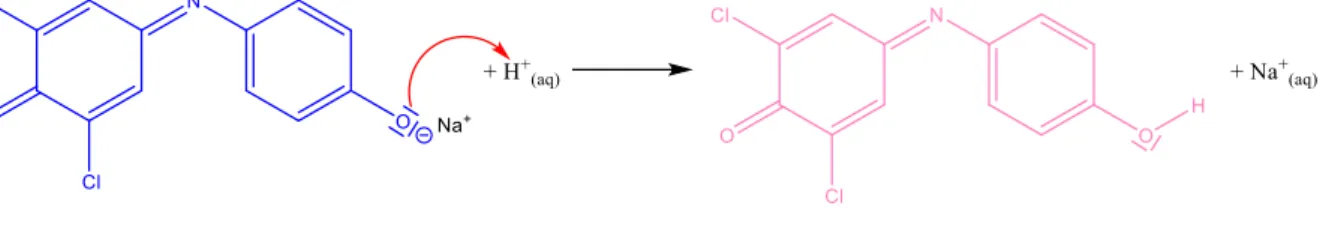
Gleichzeitig erhebt sich die Frage, weswegen die Reaktionslösung nach Zugabe von Tillmans Reagenz im Überschuss eine hellrosa Farbe aufweist: Der Grund für diese Beobachtung liegt darin, dass Tillmans Reagenz nicht nur wie oben als Redox-Reaktionspartner fungieren kann, sondern darüber hinaus einen empfindlichen pH-Indikator darstellt, dessen Farbe sich je nach pH-Wert unterscheidet. So besitzt der Farbstoff als Anion, d.h. auch als hier verwendetes Na- Salz, eine blaue Farbe, was sich durch das für viele Farbstoffe charakteristische Push-Pull-Sys- tem bzw. die ausgeprägte Konjugation und Delokalisation der π-Elektronen erklärt (der Farb- stoff absorbiert gelbes Licht, d.h. er erscheint in der Komplementärfarbe blau). In dem Moment, wie Tillmans Reagenz nun im Versuch im Überschuss zugesetzt wird, d.h. keine Ascorbinsäure mehr zur Verfügung steht und damit eine Reduktion zur farblosen Leukoform unterbunden ist, wird das Anion nun durch die ebenfalls in Lösung befindlichen H+-Ionen protoniert (saurer Geschmack von Orangensaft!) und damit zum nichtionischen Molekül umgesetzt.11
Abb. 6: Protonierungsgleichgewicht von Tillmans Reagenz im Sauren.12
Wie anhand obiger Reaktionsgleichung ersichtlich geht die Protonierung des blauen Anions zugleich mit einem Farbwechsel nach hellrosa einher: Grund hierfür ist, dass durch die Proto- nierung des Farbstoffsystems sich die Struktur des delokalisierten Elektronensystems verändert
10 Vgl. Tietz, J./Harsch, G.: Vitamine – Ein Unterrichtskonzept für den Chemie- und Biologieunterricht, Schüling- Verlag Münster 2009, S. 64.
11 Ebd.
12 Eigene Erstellung mit ChemDraw, 29.12.2018.
9 (eine deprotonierte Phenol-Funktion hat einen stärkeren +M-Effekt als das protonierte Pen- dent), sodass sich der Abstand von HOMO und LUMO vergrößert und das nunmehr absorbierte Licht entsprechend kleinere Wellenlängen aufweist. Aufgrund dessen wird nun energiereiche- res Licht absorbiert, sodass der Farbstoff nun in der Komplementärfarbe Rosa-Rot erscheint.
Durch diese pH-Indikatorfunktion kann zugleich der „saure“ Charakter von Ascorbinsäure/Vi- tamin C im Experiment verifiziert werden.
Bezug des Versuchs zum Vortragsthema
Eine ausreichende Versorgung mit Vitamin C durch Nahrungsaufnahme bzw. Getränke besitzt eine hohe ernährungsphysiologische Bedeutung, da der Mensch (wie andere Wirbeltiere auch) Ascorbinsäure nicht selbst biosynthetisieren kann, weil ihm ein hierzu erforderliches Enzym zur Synthese aus Glucose fehlt. Bei Unterversorgung mit Vitamin C drohen Erkrankungen wie z.B. Skorbut, zudem spielt es eine wichtige Rolle bei der Herstellung von Kollagen. Aus diesem Grund besitzen Vitamin-C-haltige Getränke wie z.B. Orangensaft eine signifikante Bedeutung im Zusammenhang einer ausgewogenen und gesunden Ernährung.13
2. Versuch (Vormittag): Zuckernachweis in Cola mit der Fehling-Probe
14Zeitbedarf
Vorbereitung: 25 min Durchführung: 5 min Nachbereitung: 20 min Reaktionsgleichung
Abb. 7: Reaktionsgleichung Fehling-Probe (Schulversion).15
13 Vgl. Hart, H.; Craine, L.E.; Hart, D.J.; Hadad, C.M.: Organische Chemie. 3. Auflage, Wiley-VCH Verlag, Weinheim, 2007, S. 609.
14 Vgl. Flügel, S.; Sommer, K.: Inhaltsstoffe von Soft- und Energydrinks – ein Schülerpraktikum. In: RAAbits Chemie, II/H, Kap. 13, S. 6 f. von 20 (verändert).
15 Eigene Erstellung mit ChemDraw, 27.12.2018.
10 Chemikalien
Tab. 2: Verwendete Chemikalien.
Geräte und Materialien - großer Glastrichter - Faltenfilter (groß) - Stativmaterial
- 2x 50-mL-Becherglas
- 1000-mL-Becherglas (Wasserbad)
- Reagenzglasklammer - Magnetrührer mit Rührfisch - 2 Pasteurpipetten
- Demo-Reagenzglas und Reagenz- glasständer
Aufbau
Abb. 8: Versuchsaufbau Filtration (links) und anschließende Fehling-Probe (rechts).16
16 Eigene Erstellung mit ChemSketch, 15.04.2019.
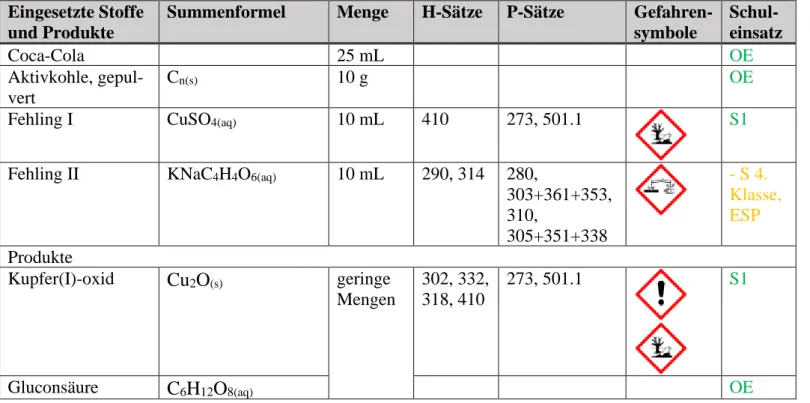
Eingesetzte Stoffe und Produkte
Summenformel Menge H-Sätze P-Sätze Gefahren- symbole
Schul- einsatz
Coca-Cola 25 mL OE
Aktivkohle, gepul- vert
Cn(s) 10 g OE
Fehling I CuSO4(aq) 10 mL 410 273, 501.1 S1
Fehling II KNaC4H4O6(aq) 10 mL 290, 314 280,
303+361+353, 310,
305+351+338
- S 4.
Klasse, ESP Produkte
Kupfer(I)-oxid Cu2O(s) geringe Mengen
302, 332, 318, 410
273, 501.1 S1
Gluconsäure C6H12O8(aq) OE
200 800
1000 mL 400 600
Fehling-I-Lösung Fehling-II-Lösung
Demoreagenzglas mit Filtrat
Wasserbad
100 80
20 40 60 0
AUS AN
LaboBib© U/min
Magnetrührer
050-mL-Becherglas zum Auffangen des Filtrats
30
10 50 mL
20 30
10 50 mL
20 0Becherglas mit Cola (mit
Aktivkohle versetzt)
großer Faltenfilter in Glastrichter
11 Durchführung
Im Vorfeld der eigentlichen Versuchsdurchführung werden zunächst ca. 400 mL Cola in eine 500-mL-Glasflasche gefüllt und anschließend mit mehreren gehäuften Spatellöffeln gepulver- ter Aktivkohle versetzt. Diese Cola-Aktivkohle-Suspension wird sodann in den Trocken- schrank gestellt, der auf eine Temperatur von 60 – 70 °C eingeregelt ist (Erhitzen zur Beschleu- nigung der eigentlichen Reaktion). Zu Beginn des eigentlichen Versuchs werden nun 25 mL der mit Aktivkohle versetzten Cola durch einen großen Faltenfilter filtriert, wobei das Filtrat in einem 50-mL-Becherglas aufgefangen wird. Nach erfolgter Filtration wird das Filtrat anschlie- ßend ca. 2 Daumen breit in ein Demo-Reagenzglas gefüllt und anschließend mit je 10 mL Fehl- ing-I- sowie Fehling-II-Lösung versetzt. Nach einem kurzen vorsichtigen Schwenken des Rea- genzglases wird dieses nun in ein vorbereitetes Wasserbad gestellt, bis eine deutlich sichtbare Reaktion eintritt.
Beobachtung
Die mit Aktivkohle versetzte Cola liegt zu Beginn des Versuchs als schwarze Suspension vor.
Beim anschließenden Filtriervorgang kann beobachtet werden, dass das Filtrat farblos ist, wo- hingegen der Filterkuchen nach wie vor die intensive schwarze Farbe aufweist. Durch die Zu- gabe der türkisblauen Fehling-I-Lösung sowie der farblosen Fehling-II-Lösung inkl. des an- schließenden kurzen Erwärmens im Wasserbad kommt es rasch zur Bildung eines ziegelroten Niederschlages.
Abb. 9: Versuchsbeobachtungen.17
Entsorgung
Der Filterkuchen wird über Nacht trocknen gelassen und anschließend in den Feststoffabfällen entsorgt. Das mit Fehling-I- bzw. Fehling-II-Lösung versetzte Filtrat wird neutral in die flüssi- gen Schwermetallabfälle gegeben.
17 Eigene Erstellung mit Handykamera am 27.11.2018.
12 Fachliche Auswertung der Versuchsergebnisse
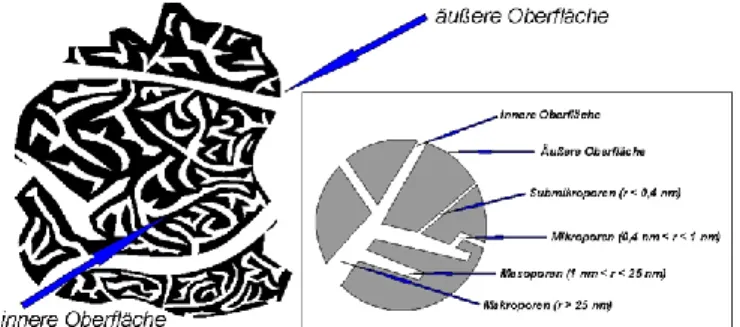
Soft- und Energydrinks enthalten oft eine große Menge an Zucker und Süßstoffen. Diese er- nährungsphysiologisch eher ungünstige Kombination steht jedoch in einer Spannung dazu, dass ebenjene gerade in Zielgruppen jüngeren und mittleren Alters häufig sich großer Beliebtheit erfreuen. Der vorliegende Versuch intendiert daher das Ziel, den Gehalt an Zucker in Cola mit- hilfe der Fehling-Probe qualitativ zu ermitteln. Vor der eigentlichen Versuchsdurchführung muss jedoch die Cola zunächst entfärbt werden, um überhaupt eine positive Fehling-Reaktion im weiteren Fortgang zu identifizieren. Diesem Zweck dient das anfängliche Versetzen mit Aktivkohle bzw. die Filtration.
Abb. 10: Porosität von Aktivkohle (schematisch).18
Die experimentell gewonnene Beobachtung, dass die mit Aktivkohle versetzte Cola bei der Filtration ein farbloses Filtrat ergibt, lässt sich anhand der obigen Abbildung bzgl. der schema- tischen Struktur von Aktivkohle erklären: Es ist ersichtlich, dass Aktivkohle aufgrund ihrer sehr hohen Porosität eine große innere Oberfläche besitzt (ca. 1000 m² pro Gramm) und deswegen ein hervorragendes Adsorptionsmittel darstellt, welches an zahlreichen reaktiven Stellen Ad- sorptions- und Desorptionsprozesse eingehen kann. Durch intermolekulare Wechselwirkungen wie van-der-Waals-Wechselwirkungen können gerade unpolare Moleküle wie die Farbstoff- Moleküle aus der Cola (bestehend aus Zuckerkulör) an der ebenfalls unpolaren Aktivkohle ad- sorbiert werden. Dadurch, dass die Aktivkohle sowie der an ihr adsorbierte Farbstoff während der Filtration als Filterkuchen abgetrennt wird, erklärt sich zudem die Beobachtung, dass das Filtrat klar und farblos ist.19
Mit diesem farblosen Filtrat wird anschließend die Fehling-Probe durchgeführt. Bei Fehling I handelt es sich um eine wässrige Kupfer(II)-sulfat-Lösung, Fehling II hingegen ist eine
18 Röhr, Christian/Holzapfel, Wolfram: Der Einsatz von Aktivkohle bei der Sanierung von Grundwasser und Bo- denluft. In: GUT Gesellschaft für Umwelttechnologie mbH. Online verfügbar: http://www.gutmbh.de/Aktivkoh- leVortrag1.htm (Letzter Zugriff: 28.12.2018, 09:59 Uhr).
19 Vgl. Riedel, E.; Janiak, C.: Anorganische Chemie. 8. Auflage, Walter de Gruyter Verlag, Berlin/New York, 2011, S. 517.
13 alkalische Kalium-Natrium-Tartrat-Lösung; werden beide Lösungen äquimolar vereinigt, kommt es zur Bildung eines tiefblauen zweikernigen Chelat-Komplexes, dessen besonderer Vorteil darin liegt, dass die Cu2+-Ionen so komplexiert sind und nicht, wie sonst unter den vor- herrschenden alkalischen Bedingungen, als unlösliches Cu(OH)2 ausfallen.20
Abb. 11: Fehling-Komplex.21
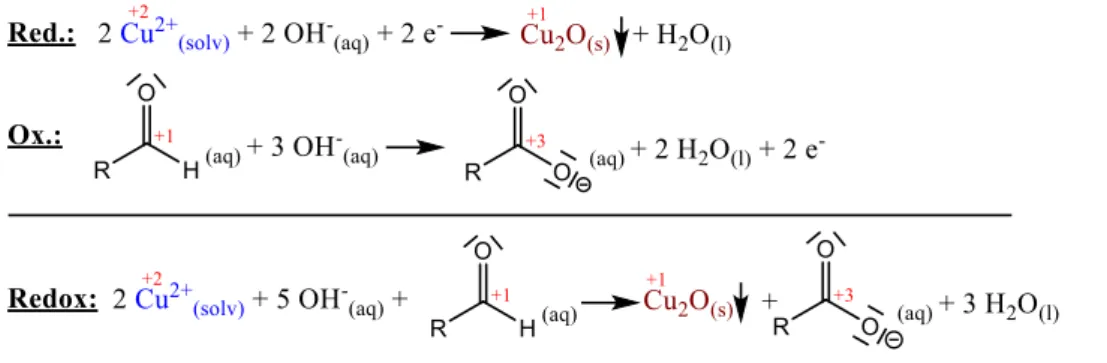
Wird nun das kohlenhydrathaltige Cola-Filtrat in Gegenwart von Fehling I und II erhitzt, kommt es zu einer Redox-Reaktion, in deren Verlauf ziegelrotes Kupfer(I)-oxid gebildet wird, .was als Niederschlag entsprechend eine positive Fehling-Probe anzeigt.22
Abb. 12: Fehling-Redoxgleichung (Schulversion).23
Anhand der Redox-Gleichungen ist ersichtlich, dass die Aldehyd-Funktion des Zuckers zur Al- donsäure oxidiert wird, während gleichzeitig Cu(II) zu Cu(I) reduziert wird. Tatsächlich handelt es sich bei diesem Zucker, wie weiter unten näher thematisiert wird, um Glucose. Es handelt sich dabei somit um eine Oxidation der Glucose zur Gluconsäure, die jedoch voraussetzt, dass nur der Anteil offenkettiger (acyclischer) Glucose auf die oben skizzierte Weise reagiert, da das im Gleichgewicht zur acyclischen Form stehende cyclische Halbacetal keine Oxidation zur Gluconsäure eingehen kann; die mechanistische Umwandlung zwischen cyclischer und acycli- scher Struktur wird dabei sowohl durch Säure wie auch durch Base katalysiert; mit Blick auf
20 Vgl. Breitmaier, E.; Jung, G.: Organische Chemie. 7. Auflage, Georg Thieme Verlag, Stuttgart, 2012, S. 341.
.21 Eigene Erstellung mit Chemdraw, 17.09.2019.
22 Vgl. Vollhardt, K.P.C.; Schore, N.E.: Organische Chemie. S. 1205.
23 Eigene Erstellung mit Chemdraw, 29.12.2018.
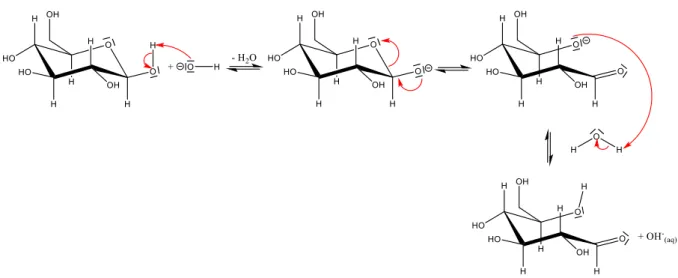
14 die im konkreten Versuch vorherrschenden alkalischen Bedingungen wird unten jedoch der Mechanismus der OH--katalysierten Umlagerung präferiert.24
Abb. 13: Mechanismus des OH--katalysierten Gleichgewichts zw. cyclischer und acyclischer Glucose.25
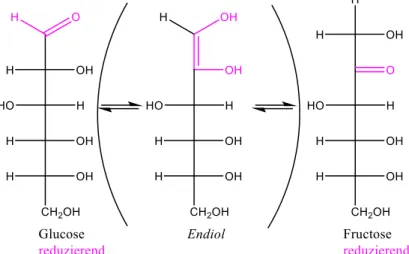
Wie bereits angedeutet, wird durch die Fehling-Probe im betrachteten Experiment das Mono- saccharid Glucose nachgewiesen; dies erklärt sich dadurch, dass die Fehling-Probe dezidiert eine Nachweismöglichkeit für reduzierende Zucker darstellt, d.h. für solche Saccharide, die ein tautomeres Gleichgewicht zwischen cyclischer und acyclischer Form eingehen. Neben Glucose sind jedoch noch Saccharose und Fructose zusätzlich in der Cola enthalten; Saccharose als ein nicht-reduzierendes Saccharid (an der glykosidischen Bindung sind beide anomeren C-Atome beteiligt, sodass keine Gleichgewichtseinstellung mit der offenkettigen Form möglich ist) kann unter den gegebenen Umständen daher nicht nachgewiesen werden. Fructose schließlich ver- dient eine gesonderte Betrachtung: Wie anhand ihrer Strukturformel (s.u.) ersichtlich, stellt sie eigentlich als Ketose ein nicht-reduzierendes Saccharid dar, da die Keto-Gruppe nicht weiter oxidiert werden kann, ohne C-C-Bindungsbrüche herbeizuführen. Tatsächlich jedoch reagiert Fructose als reduzierender Zucker und wird somit auch im betrachteten Experiment nachge- wiesen: Der Grund für diesen auf den ersten Blick bemerkenswerten Umstand liegt darin, dass sich Fructose in die tautomere Glucose umlagern kann, d.h. durch diese Umlagerung aus der nicht-reduzierenden Ketose Fructose die reduzierende Aldose Glucose entsteht. Bei dieser Um- lagerung handelt es sich um eine Lobry-de Bruyn-van Ekenstein-Umlagerung, die einen Spe- zialfall der Keto-Endiol-Tautomerie darstellt (übrigens vergleichbar mit dem ebenfalls tauto- meren Gleichgewicht bei der vinylogen Enol-Funktion der Ascorbinsäure). Hierbei bildet sich als wichtigstes mechanistisches Intermediat der Umlagerung ein Endiol (bzw. unter alkalischen
24 Vgl. Vollhardt, K.P.C.; Schore, N.E.: Organische Chemie. S. 1202 f.
25 Eigene Erstellung mit Chemdraw, 29.12.2018.
15 Bedingungen ein Endiolat), welches sodann zur reduzierenden Aldose weiterreagieren kann.
Die Reaktion wird dabei von Hydroxid-Ionen katalysiert, indem die anfängliche Deprotonie- rung der Fructose den ersten mechanistischen Schritt der tautomeren Umlagerung darstellt.26
Abb. 14: Tautomere Umlagerung der Fructose in die Glucose, durch OH- katalysiert.27
Bemerkung: Die im Vorherigen dargestellte Versuchsauswertung konzentriert sich auf die (in der Schule sehr gut einsetzbare und zur Erklärung der Beobachtungen zweckdienliche) Variante der Oxidation zur Gluconsäure. Nicht separat dargestellt (mit Blick auf den expliziten Schulfo- kus), aber zumindest hingewiesen sei jedoch, dass dies nicht die fachlich korrekte Variante darstellt, sondern stattdessen die Oxidation zum Glucoson: Es konnte mechanistisch aufgeklärt werden, dass die reaktive Substratspezies keineswegs der geringe offenkettige Anteil der Glu- cose ist, sondern stattdessen das durch Umlagerung (s.o.) intermediär entstehende Enolat-Ion.
Dieses reagiert in zwei separaten SET-Reaktionen mit dem Cu(II), wobei zwischenzeitliche Chelat-Komplexe gebildet werden, in denen die eigentlichen Elektronenübertragungen vonstat- tengehen. Auf diese Weise bildet sich schließlich ein Diketon, d.h. im Falle der Glucose das Glucoson.28
Bezug des Versuchs zum Vortragsthema
Soft- und Energydrinks erfreuen sich quer durch alle Altersgruppen, im Besonderen jedoch unter Kindern und Jugendlichen, einer hohen Beliebtheit. Gerade für diese Zielgruppe birgt der größtenteils hohe bis z.T. sehr hohe Gehalt an Zucker und Süßungsmitteln jedoch – neben Vor- teilen wie z.B. schneller Energiezufuhr (vgl. „Sportlergetränk“) – gleichzeitig ein nicht unwe- sentliches gesundheitliches Risiko hinsichtlich Zahnkaries, übermäßigem Zuckerkonsum bis
26 Vgl. Braitmaier, E.; Jung, G.: Organische Chemie. S. 878.
27 Eigene Erstellung mit Chemdraw, 29.12.2018.
28 Vgl. Fleischer, H.: Fehlinterpretation der Fehling-Probe auf reduzierende Zucker – Von der Beobachtung im Chemieunterricht zur Evidenz gegen die Oxidation der Aldehydgruppe. CHEMKON 24, 2017, S. 27-30.
16 hin zu diabetischen Erkrankungen. Aus diesem Grund bildet die (kritische) Auseinandersetzung mit dem Thema Zucker in Softdrinks ein wichtiges Feld eines alltagsnahen Unterrichts und vermittelt zugleich die Chance zur ernährungsbezogenen Aufklärung hinsichtlich maßvollen und verantwortungsbewussten Softdrink-Konsums, ohne Cola und Co. einer (zu) pauschalen Generalaburteilung zu unterwerfen.
3. Versuch (Mittagessen, Demo): Enzyme in Fruchtsäften
29Zeitbedarf
Vorbereitung: 20 min
Durchführung: 15 min + über Nacht stehen lassen Nachbereitung: 10 min
Chemikalien
Tab. 3: Verwendete Chemikalien.
Geräte und Materialien
- 3 Schnappsgläschen (od. ähnliche kleine Gläschen)
- Material zur Herstellung des Frucht- saftes (Messer, Presse, etc.)
29 Vgl. Roth, Daniela/Tribus, Olga/Sommer, Katrin: Fruchtsaft und Gummibärchen. Experimente zur enzymati- schen Hydrolyse von Gelatine. Unterricht Chemie 17, 2006, S. 24 (V1).
30 Die Daten des Eintrags beziehen sich auf die HessGISS-Daten für Gelatine (OE).
Eingesetzte Stoffe und Produkte
Summenformel Menge H-Sätze P-Sätze Gefahren- symbole
Schul- einsatz Gummibärchen
(enthält Gelatine)30
3 Stück OE
Kiwi-Saft je ca.
3 mL
OE
Ananas-Saft OE
Apfelsaft OE
17 Aufbau
Abb. 14: Aufbau Enzyme in Fruchtsäften.31
Durchführung
In drei kleine Schnappsgläschen wird je ein rotes Gummibärchen gelegt und nun mit Kiwi-, Ananas- bzw. Apfelsaft bis zum Rand überschichtet. Sodann wird über Nacht stehen gelassen.
Beobachtung
Zunächst besitzen die in den unterschiedlichen Fruchtsäften liegenden Gummibärchen alle die- selbe Größe. Nach dem Stehenlassen der Proben über Nacht kann beobachtet werden, dass sich das Gummibärchen im Kiwi- und Ananassaft aufgelöst hat, während das Gummibärchen im Apfelsaft hingegen eine erhebliche Größenzunahme durch Aufquellen zeigt.
Abb. 15: Fruchtsäfte am nächsten Tag (links) und aufgequollenes Gummibärchen im Apfelsaft (rechts).32
Entsorgung
Die Fruchtsaftreste können im Ausguss entsorgt werden, das aufgequollene Gummibärchen wird im Hausabfall entsorgt.
Fachliche Auswertung der Versuchsergebnisse
Das unterschiedliche Verhalten der Gummibärchen gegenüber den im Versuch eingesetzten Fruchtsäften (Auflösen/Aufquellen) erklärt sich dadurch, dass die in Gummibärchen enthaltene Gelatine durch Enzyme, die nur in bestimmten Fruchtsaftsorten vorkommen, enzymatisch
31 Eigene Erstellung mit Handykamera am 05.12.2018.
32 Eigene Erstellung mit Handykamera am 06.12.2018.
18 hydrolysiert wird. Bei Gelatine handelt es sich chemisch betrachtet um ein Skleroprotein, wel- ches im Körper v.a. in Knochen, Bindegewebe und Sehnen vorkommt und zugleich die im Or- ganismus am häufigsten vorkommende Proteinklasse darstellt. Typischerweise wird Gelatine hergestellt, indem Kollagen (tripelhelicale Agglomerationen von Polypeptidketten), z.B. aus der Haut bzw. den Knochen von Tieren, unter Hitzeeinwirkung sowie Zugabe von Säure parti- alhydrolysiert wird und durch Bruch der Peptidbindungen innerhalb des Proteins kleinere Pep- tideinheiten entstehen, die wiederum die Gelatine darstellen. Schematisch lässt sich die Struk- turänderung bei der Herstellung von Gelatine aus Kollagen wie folgt skizzieren.33
Abb. 16: Tripelhelicale Struktur des Kollagens (links) und Strukturänderungen bei der thermischen Partialhydro- lyse von Kollagen zu Gelatine (rechts).34
Gummibärchen wiederum bestehen zu einem großen Teil aus (tierischer) Gelatine, d.h. sie cha- rakterisieren sich als Di- und Oligopeptide, die über die charakteristischen Peptidbindungen miteinander verbunden sind und sich vermittels inter- und intramolekularer Wechselwirkungen zu komplexeren Proteinstrukturen zusammenlagern können (Sekundärstruktur etc.). Dass die Gelatine in den Gummibärchen nun wie im Versuch beobachtet durch einige Fruchtsäfte auf- gelöst wird, durch andere jedoch nicht, erklärt sich dadurch, dass Kiwi- und Ananassaft eiweiß- spaltende Enzyme enthalten, die sog. proteolytischen Enzyme. Im Fall der Kiwi handelt es sich hierbei um das Enzym Actinidain, bei der Ananas um Fruchtbromelain (daher die botanische Bezeichnung Bromeliengewächse). Genauer gesagt stellen Actinidain und Fruchtbromelain sog. Endopeptidasen dar, d.h. sie bewirken eine enzymkatalysierte Hydrolyse von Peptidbin- dungen innerhalb der Primärstruktur und zerstören so ein Polypeptid durch Bruch der Pep- tidbindung, woraus kleinere Di- und Oligopeptidstrukturen hervorgehen. Ebendies kann auch im Versuch beobachtet werden: Durch die Endopeptidasen im Ananas- bzw. Kiwisaft wird die im Gummibärchen enthaltene Gelatine schrittweise enzymatisch hydrolysiert bzw. „zerstört“,
33 Vgl. Babel, Wilfried: Gelatine – ein vielseitiges Biopolymer. In: ChiuS 30, 1996, S. 86 f.
34 Ebd., S. 86 u. 90.
19 sodass das Gummibärchen nach einer angemessenen Reaktionsdauer (über Nacht) am nächsten Morgen vollständig aufgelöst ist.35
Abb. 17: Schematische Enzymstruktur des Actinidains; gut erkennbar sind α-Helices und β-Faltblätter sowie Turns und Loops in der Proteinstruktur.36
Da eine solche hydrolytisch-„auflösende“ Reaktion im Fall des Apfelsaftes offenbar unter- bleibt, kann geschlussfolgert werden, dass im Apfelsaft keine entsprechenden proteolytischen Enzyme vorhanden sind. Es stellt sich jedoch abschließend die Frage, warum das Gummibär- chen aufgequollen ist: Diese Beobachtung erklärt sich aus der Fähigkeit der Gelatine, thermo- reversible Gele zu bilden. Dadurch, dass die Polypeptidketten in der Gelatine-Matrix sowohl Dipol-Dipol-Wechselwirkungen als auch Wasserstoffbrückenbindungen eingehen können, kann Gelatine in trockenem Zustand große Mengen an Wasser in sich aufnehmen und durch Wechselwirkungen innerhalb ihrer Struktur „halten“ (ein Effekt, der beim Kochen und Backen mit Gelatine häufig ausgenutzt wird). Dieser Vorgang ist bis zu einer Temperatur von ca. 50 °C thermoreversibel (oberhalb findet thermische Hydrolyse und damit Zerstörung der Gelatine- Matrices statt), d.h. durch Erwärmen und die daraus resultierende stärkere Molekularbewegung der Wasser-Moleküle können die intermolekularen Wechselwirkungen wieder überwunden werden und das zuvor von der Gelatine aufgenommene Wasser wird wieder abgegeben (Hyd- rokolloid). Da der Prozess der Wasseraufnahme jedoch mit einer signifikanten Größenänderung der Gelatine einhergeht, quillt das Gummibärchen bzw. die darin enthaltene Gelatine wie im Versuch beobachtet schließlich auf.37
35 Vgl. Roth, Daniela/Tribus, Olga/Sommer, Katrin: Fruchtsaft und Gummibärchen. Experimente zur enzymati- schen Hydrolyse von Gelatine. Unterricht Chemie 17, 2006, S. 24-26.
36 Screenshot einer Animations-Erstellung mit MS PowerPoint, 28.12.2018.
37 Vgl. Babel, Wilfried: Gelatine – ein vielseitiges Biopolymer. In: ChiuS 30, 1996, S. 92-94.
20 Bezug des Versuchs zum Vortragsthema
Fruchtsäfte spielen eine große Rolle im alltäglichen Getränkekonsum: So bilden sie nach Mi- neralwasser die zweitbeliebteste Getränkesorte in Deutschland, die von 56,6 % der gesamten Bevölkerung regelmäßig konsumiert werden (Stand 2018) und damit noch vor Kaffee und al- koholischen Getränken liegen.38 Die große Beliebtheit der Fruchtsaftgetränke, zu denen neben reinen Fruchtsäften auch Schorlen und Nektare gehören, begründet sich nicht zuletzt in deren großer Vielfältigkeit, insofern Säfte aus nahezu allen Obstsorten gewonnen werden können.
Entsprechend besitzen unterschiedliche Fruchtsäfte auch deutlich unterschiedliche Nährstoff- zusammensetzungen, was im betrachteten Versuch exemplarisch anhand der Stoffgruppe der Enzyme näher untersucht wurde. Gerade im Fall des Bromelains ergeben sich zudem zahlreiche Anknüpfungsmomente auch an alltagsnahe Anwendungen, da diese Cysteinprotease u.a. in der Medizin zur Thrombosebehandlung verwendet wird und zudem auch in Fleischzartmachern Einsatz findet; diese Wirkungen wiederum resultieren unmittelbar als der proteolytischen Ei- genschaft dieses Enzyms und illustrieren damit nachdrücklich die gesunde Rolle von Frucht- säften im Rahmen der Ernährung.39
4. Versuch (Nachmittag): Antioxidative Eigenschaften von Tee
40Zeitbedarf
Vorbereitung: 60 min Durchführung: 5 min Nachbereitung: 30 min Reaktionsgleichung
+5 -1 -2 <Mn2+> -2 -1 0 0
IO3-
(aq) + 2 H2O2(aq) + CH2(COOH)2(aq) + H+(aq) ⇌ 3 H2O(l) + ICH(COOH)2(aq) + 2 O2(g)↑
Abb. 18: Gesamtreaktionsgleichung der Briggs-Rauscher-Reaktion.41
38 Vgl. IfD Allensbach: Ranking der meistgekauften bzw. meistkonsumierten Getränke in der Bevölkerung in Deutschland in den Jahren 2016 bis 2018. Online verfügbar: https://de.statista.com/statistik/daten/stu- die/170892/umfrage/ranking-der-meistgekauften-konsumierten-getraenke/ (Letzter Zugriff: 18.04.2019, 09:03 Uhr).
39 Vgl. Maurer, H.R.: Bromelain: biochemistry, pharmacology and medical use. Cell. Mol. Life Sci. 58, 2001, 1234–1245.
40 Vgl. Höner, K.: Grüner Tee und Co. – antioxidative Eigenschaften von Getränken, MNU 54/6, 2001, S. 347- 352, V. 1 (S. 350) (verändert).
41 Eigene Erstellung mit ChemDraw, 22.01.2018.
21 Chemikalien
Tab. 4: Verwendete Chemikalien.
42 Der Tabelleneintrag bezieht sich auf die HessGISS-Daten für NaIO3 als Feststoff sowie für Schwefelsäure (c ≈ 0,1 mol/L).
43 Der Tabelleneintrag bezieht sich auf die HessGISS-Daten für Malonsäure als Feststoff.
44 Der Tabelleneintrag bezieht sich auf die HessGISS-Daten für MnSO4 als Feststoff.
Eingesetzte Stoffe und Produkte
Summenformel Menge H-Sätze P-Sätze Gefahren- symbole
Schul- einsatz Wasserstoffperoxid-
Lösung (w ≈ 0,35)
H2O2(aq) 10 mL 302, 315,
318, 335, 412
261, 280, 301+312, 305+351+338
S1
entmineral. Wasser H2O(l) 2 mL OE
Stärke-Lösung (w ≈ 0,01)
(C6H10O5)n(aq) 1 mL OE
Natriumiodat-Lö- sung (c ≈ 0,2 mol/L) in Schwefelsäure (c ≈ 0,077 mol/L)42
NaIO3(aq) in H2SO4(aq)
10 mL 272, 302, 317, 334
220, 261, 280, 342+311
S1
Malonsäure (c ≈ 0,3 mol/L)43
CH2(COOH)2(aq) 5 mL 302, 318 260,
305+351+338
S1
Mangan(II)-sulfat- Lösung
(c ≈ 0,04 mol/L)44
MnSO4(aq) 2 mL 373, 411 273 S1
Grüntee-Extrakt (w ≈ 0,01)
1 mL OE
Natriumthiosulfat- Lösung (gesättigt)
Na2S2O3(aq) zur Ent-
sorgung
OE Produkte
Iod I2(aq) geringe
Mengen
312+332, 315, 319, 335, 372, 400
273, 302+352, 305+351+338, 314
S1
22 Geräte und Materialien
- Magnetrührer mit Rührfisch
- 100-mL-Weithals-Erlenmeyerkolben - Uhrglas (zum Abdecken)
- Spritzen und Kanülen (2x 1 mL, 2x 2 mL, 1x 5 mL, 2x 10 mL)
- 250-mL-Becherglas
- 1-mL-Messpipette mit Peleusball - 2x 100-mL-Messkolben
- Wasserkocher - Spatel
- Waage - Spritzflasche Aufbau
Abb. 19: Aufbau Tee-Versuch.45
Durchführung
Als Vorbereitung des Versuchs wird zunächst ein Teebeutel Grüner Tee (hier verwendet: Al- natura Sencha) mit ca. 100 mL kochendem Wasser übergossen und 5 Minuten lang ziehen ge- lassen. Anschließend wird 1 mL dieses Tees mit Hilfe einer Spritze in einen 100-mL-Messkol- ben überführt und in der Folge mit entmineral. Wasser auf ein Gesamtvolumen von 100 mL verdünnt (d.h. Verdünnungsgrad 1:100). Zu Beginn des eigentlichen Versuchs werden im Ab- zug zunächst (je mit Spritzen) die erforderlichen Reaktionslösungen zusammengegeben, d.h.
(in dieser Reihenfolge) 1 mL frisch angesetzte Stärkelösung (w ≈ 0,01), 2 mL entmineral. Was- ser, 10 mL Wasserstoffperoxid-Lösung (w ≈ 0,35), 5 mL Malonsäure-Lösung (c ≈ 0,3 mol/L) sowie 10 mL Natriumiodat-Lösung (0,2 mol/L). Unter kräftigem Rühren (Magnetrührer auf ca.
800 Umdrehungen pro Minute einregeln) werden nun rasch 2 mL der Mangan(II)-sulfat-Lösung (c ≈ 0,04 mol/L) hinzugesetzt. Sobald die Reaktionslösung zum zweiten Mal eine blaue Farbe aufweist, wird schließlich 1 mL des zuvor hergestellten Grüntee-Extraktes hinzugefügt.
45 Eigene Erstellung mit ChemSketch, 15.04.2019.
Kohlenstoffdioxid (freies Gas)
CO2(g) OE
Disauerstoff (freies Gas)
O2(g) 270 220b S1
100 80
20 40 60 0
AUS
ANLaboBib© U/min
Magnetrührer
100 mL 75 100
50
100-mL-Weithals-Erlenmeyer- kolben mit Reagenzien
Rührfisch
23 Beobachtung
Im Reaktionskolben liegt bis zur Zugabe der Mangan(II)-sulfat-Lösung eine klare, farblose Lö- sung vor. Durch die Zugabe der MnSO4-Lösung jedoch kommt es rasch zu einer einsetzenden Farboszillation, die von Tiefblau über Farblos und Gelb wieder ins Blaue zurückschlägt. Die zeitliche Dauer eines vollständigen Oszillations-Zyklus beträgt ca. 15-20 sek. Durch die an- schließende Zugabe des Tee-Extraktes kann beobachtet werden, dass die Farboszillationen zu- nächst aussetzen und die Lösung einige Zeit lang farblos bleibt. Nach etwa 2-3 min setzt die Farboszillation wieder ein, jedoch bedeutend langsamer als zuvor. Nach ca. 10 min nimmt die Lösung schlagartig eine dunkle bis schwarze Farbe an, die Oszillationen sind beendet und es kann die Entwicklung geringer Mengen violetter Dämpfe beobachtet werden.
Abb. 20: Reaktionslösung vor Zugabe der MnSO4-Lösung (links) sowie Farben während der Oszillation.46
Entsorgung
Überschüssige Mengen nicht verbrauchter Malonsäure können neutral in den flüssigen Lö- sungsmittelabfällen entsorgt werden, nicht verbrauchte Mangan(II)-sulfat-Lösung hingegen in den Schwermetallabfällen; nicht umgesetzter Grüner Tee wird in den Abguss gegeben, ebenso die Stärke-Lösung. Die eigentliche Reaktionslösung wird zunächst erhitzt (Entfernen von über- schüssigem H2O2) und anschließend mit Natriumthiosulfat-Lösung umgesetzt (Zerstören des gebildeten Iods), bevor sie schließlich neutral in den Schwermetallabfällen entsorgt wird.
Δ
2 H2O2(aq) → 2 H2O(l) + O2(g)↑ I2(aq/g) + 2 Na+(aq) + S2O32-
(aq) → 2 Na+(aq) + 2 I-(aq) + S4O62- (aq)
Fachliche Auswertung der Versuchsergebnisse Die Briggs-Rauscher-Reaktion
Die Briggs-Rauscher-Reaktion (BR-Reaktion) ist eine 1973 entdeckte Reaktion, die unter Ein- satz von Malonsäure, Wasserstoffperoxid und Iodat unter Mn(II)-Katalyse abläuft und hierbei eine charakteristische Oszillation an Farben zeigt. Die Gesamtreaktionsgleichung der BR-
46 Eigene Erstellung mit Handykamera am 05.12.2018.
24 Reaktion lässt sich anhand der obigen Nettoreaktionsgleichung (vgl. Abb. 18) formulieren: So entsteht aus der Umsetzung von Iodat mit H2O2 im Sauren Iodmalonsäure, Disauerstoff und Wasser; bei dieser Reaktion fungiert Mn(II) als Katalysator, was auch mit der Versuchsbe- obachtung kongruiert, dass der eigentliche Oszillationsprozess erst nach Zugabe der Man- gan(II)-sulfat-Lösung erfolgt. Um jedoch die beobachteten Farben inkl. der eigentlichen Oszil- lation hinreichend erklären zu können, muss auf ein etwas verfeinertes mechanistisches Reak- tionsgeschehen zurückgegriffen werden, welches nachfolgend abgebildet sei.47
Abb. 21: Verfeinertes Reaktionsgeschehen der BR-Reaktion zur Erklärung der Oszillations-Vorgänge.48
Auf den ersten Blick stechen zwei Faktoren ins Auge, die das Reaktionsgeschehen entscheidend beeinflussen: Zum einen lässt sich der Ablauf der BR-Reaktion prinzipiell auf drei separate, jedoch wechselseitig miteinander zusammenhängende Teilprozesse reduzieren, konkret einen radikalischen, einen nichtradikalischen (ionischen) sowie einen Steuerungsprozess. Die Netto- gleichungen aus radikalischem und nichtradikalischem Prozess sind identisch, d.h. summativ erfolgt dieselbe Reaktion, jedoch über unterschiedliche mechanistische Wege und Zwischen- stufen. Besonders bedeutsam ist, dass der radikalische Prozess deutlich schneller abläuft als der nichtradikalische (da jeweils nur SET-Reaktionen vorliegen und keine zwei Elektronen auf ein- mal zu übertragen sind). Die Frage, ob radikalischer oder nichtradikalischer Prozess vorliegt, wird durch den Steuerungsprozess geregelt, da der radikalische Teilprozess nur bei niedriger Konzentration an Iodid-Ionen abläuft, der nichtradikalische Prozess jedoch bei höherer. Die eigentliche Farboszillation lässt sich sodann auf folgende Weise erklären: Zu Beginn der
47 Vgl. Reimann, A.: Die Briggs-Rauscher-Reaktion in Theorie und Experiment, PdN-ChidS 5/43, 1994, S. 43 f.
48 Eigene Erstellung mit Chemdraw, 29.12.2018.
25 Reaktion werden zunächst alle Komponenten zusammengegeben, jedoch erst am Schluss der Katalysator Mangan(II)-sulfat. Dies führt dazu, dass anfänglich die Konzentration an I- noch gering ist, da dieses erst über den Steuerungsprozess gebildet werden muss. Folglich läuft zu diesem Stadium der Reaktion der radikalische Prozess ab. Aufgrund seiner hohen Geschwin- digkeit kommt es nun rasch zu einer Konzentrationserhöhung von Hypoiodiger Säure (HIO), die (wie ersichtlich) nettomäßig aus dem radikalischen Prozess hervorgeht. Diese wiederum wird jedoch im Steuerungsprozess, genauer Gleichung (S1), mit Iodid zu elementarem I2 um- gesetzt. Zu diesem frühen Stadium der Reaktion ist c(HIO) > c(I-), sodass nur I2 ohne Gegen- wart von Iodid vorliegt. Als Konsequenz weist die Reaktionslösung daher eine gelbe Farbe auf (das elementare Iod geht mit verschiedenen organischen Spezies bzw. Wasser vielfältige Charge-Transfer-Verbindungen ein, sodass die Lösung nicht violett, sondern gelb ist). Im An- schluss kommt es jedoch zu einer entscheidenden Veränderung: Da über Gleichung (S2) im Steuerungsprozess aus dem zuvor gebildeten elementaren Iod wieder Iodid (und Iodmalon- säure, die am Ende zu I2 und CO2 decarboxyliert, s. Versuchsbeobachtung) entsteht, nimmt die
I--Konzentration nun sukzessive zu. An einem bestimmten Punkt der Reaktion ist c(I-) > c(HIO), sodass nun I2 in Gegenwart von Iodid vorliegt und zusammen mit der ebenfalls
in Lösung befindlichen Stärke den typischen Iod-Stärke-CT-Komplex ausbildet (Einlagerung von Tri- und Polyiodidionen in die Amylosehelix der Stärke), was letztlich zu einem Umschla- gen der Lösung von Gelb nach Blau führt.49
Abb. 22: Iod-Stärke-CT-Komplex durch Einlagerung von Tri- und Polyiodidionen in die Amylosehelix der in Lösung befindlichen Stärke.50
Nun kommt es zur Entfärbung der blauen Reaktionslösung bzw. zum Farbumschlag von Tief- blau nach Farblos; dies erklärt sich wie folgt: Durch die Zunahme der Iodid-Konzentration ge- mäß (S2) geht der radikalische Prozess ab einem bestimmten Punkt in den nichtradikalischen
49 Vgl. Höner, K.: Grüner Tee und Co. – antioxidative Eigenschaften von Getränken, MNU 54/6, 2001, S. 349.
50 Gerner, A.: Wissenschaftliche Hausarbeit „Filmexperimente im Chemieunterricht – Schwerpunkt Kohlenhyd- rate.“ Online verfügbar: https://www.chids.de/dachs/wiss_hausarbeiten/kohlenhydrate_gerner.html (Letzter Zu- griff: 31.12.2018, 16:23 Uhr), S. 68.
26 über. Dieser verläuft zwar nettomäßig identisch (wieder Bildung von HIO), jedoch wie bereits angedeutet langsamer als das radikalisches Pendent. Als Konsequenz wird nun die für den Steu- erungsprozess erforderliche Hypoiodige Säure nicht rasch genug nachgebildet, sodass das ge- mäß Gl. (S1) gebildete elementare Iod nun nach (S2) schneller abreagiert als es durch (S1) regeneriert werden kann. Damit liegt an einem bestimmten Zeitpunkt nur noch I- ohne Gegen- wart von I2 vor, sodass folglich auch keine Tri- bzw. Polyiodidionen mehr gebildet werden können und sich die Iod-Stärke-Komplexe auflösen: Die Lösung wird farblos. Als letzten Bau- stein des Mechanismus muss nun noch eruiert werden, wie es zur Oszillation kommt: Hierbei ist entscheidend, dass der nichtradikalische Prozess zwar langsam(er) abläuft, aber nichtsdes- totrotz früher oder später genug Hypoiodige Säure (HIO) freigesetzt wird. Diese reagiert gemäß des Steuerungsprozesses (S1) mit dem im Überschuss vorliegenden Iodid ab, sodass die Kon- zentration an I- nunmehr sukzessive abnimmt. Dies führt dazu, dass der nichtradikalische Pro- zess wieder in den radikalischen Prozess übergeht und damit die Reaktionskaskade wieder er- neut von vorne beginnen kann, sodass es insgesamt zur Oszillation kommt. Die Oszillation läuft dabei allerdings nur solange ab, bis sich das Reaktionssystem noch nicht in der Nähe bzw. am Gleichgewichtszustand befindet: An diesem Punkt bleiben die Konzentrationen aller Reaktan- den definitionsgemäß unverändert (identische Geschwindigkeit von Hin- und Rückreaktion), sodass keine periodisch schwankende Änderung der Iodid-Ionenkonzentration mehr auftritt, die überhaupt erst die Oszillation hervorruft.51
Bedeutung des Grünen Tees als Inhibitor der Briggs-Rauscher-Reaktion
Die Beobachtung, dass es durch Zugabe des Grüntee-Extraktes zu einem temporären Aussetzen der BR-Oszillation kommt, kann nur daher rühren, dass der Tee offenbar eine inhibierende Wirkung auf die Reaktionsgeschehnisse der Briggs-Rauscher-Reaktion besitzt. Tatsächlich er- klärt sich dies durch das Vorhandensein von Antioxidantien im Tee, sog. „Radikalfängern“, deren Wirkung darin besteht, freie Radikale im Reaktionsprozess abzufangen und so dem Re- aktionsgeschehen zu entziehen. Im Fall des Grüntees handelt es sich hierbei v.a. um Poly- phenole, z.B. Flavanole, Flavandiole und Phenolcarbonsäuren. Schematisch ließe sich eine sol- che Radikalabfangreaktion auf folgende Weise formulieren.52
51 Vgl. Höner, K.: Grüner Tee und Co. – antioxidative Eigenschaften von Getränken, MNU 54/6 (2001), S. 349.
52 Vgl. Speidel, S./Stobe, C.: Grüner Tee – Der Gehalt an antioxidativen Wirkstoffen in grünem Tee in Abhän- gigkeit von seiner Aufgusstemperatur, PdN-ChiS 4/52, 2003, S. 2f.
27 Abb. 23: Schematische Radikalabfangreaktion am Beispiel des Perhydroxylradikals.53
Im obigen Beispiel fängt ein Catechin-Grundkörper als Antioxidans ein Perhydroxylradikal ab, welches intermediär durch den radikalischen Prozess der BR-Reaktion generiert wird. Hierin zeichnet sich zugleich ab, weswegen die Polyphenole hervorragende Antioxidantien darstellen:
Aufgrund ihrer Fähigkeit, durch Abgabe eines Elektrons zu einem erheblich resonanzstabili- sierten Radikal zu werden (vgl. die große Anzahl an mesomeren Grenzstrukturen, die für das gebildete Catechin-Radikal formuliert werden können), gehen sie anders als das hochenergeti- sche und damit reaktive Perhydroxylradikal selbst keine Folgereaktionen mehr ein. Auf diese Weise werden der Briggs-Rauscher-Reaktionsmischung durch die Zugabe des Grünteeextrak- tes bzw. der darin enthaltenen Antioxidantien während des radikalischen Prozesses wichtige kettentragende Intermediate wie das Perhydroxyl-Radikal entzogen, sodass die mechanistische Reaktionskaskade für einen bestimmten Zeitraum zusammenbricht und die Oszillationen aus diesem Grunde aussetzen. Die beobachtete Farboszillation kommt erst in dem Moment wieder in Gang, wenn alle zugesetzten Antioxidantien abreagiert haben und der radikalische Prozess erneut ablaufen kann. Die Inhibitionswirkung des Tees wiederum variiert stark von der Sorte des verwendeten Produktes sowie seiner Ziehzeit (je länger die Ziehzeit, desto größer der Anteil der in Lösung gegangenen Polyphenole) sowie davon, ob der Teebeutel vor dem Herausnehmen ausgedrückt wird oder nicht.54
Bezug des Versuchs zum Vortragsthema
Tee und im Besonderen grünem Tee wird häufig eine positive gesundheitsfördernde Wirkung zugeschrieben: So soll der regelmäßige Konsum bereits geringer Mengen u.a. das Risiko für Tumor-, Koronalerkrankungen oder auch Erkältungsinfektionen vorbeugen. Dies wird beson- ders auf die im Tee enthaltenen Polyphenole zurückgeführt, welche aufgrund ihrer antioxidati- ven Wirkung (ähnlich wie Vitamin C) gesundheitsschädliche freie Radikale im Körper abfan- gen und so deren negativen Einfluss reduzieren können.55 Ebenjene radikalfangende
53 Eigene Erstellung mit ChemDraw, 29.12.2018.
54 Vgl. Höner, K.: Grüner Tee und Co. – antioxidative Eigenschaften von Getränken, MNU 54/6, 2001, S. 349 f.
55 Vgl. Hümmelgen, M./Schmidt, H./Steinberg, C.: Wie gesund ist grüner Tee? Online verfügbar:
https://www.ndr.de/ratgeber/gesundheit/Wie-gesund-ist-gruener-Tee,gruenertee102.html (Letzter Zugriff:
18.04.2019, 09:42 Uhr).
28 Eigenschaft des Grüntees konnte im Versuch tatsächlich beobachtet werden: Bereits der geringe Verdünnungsgrad von 1:100 des zubereiteten Tee-Extraktes führte zu einer merklichen Inhibi- tion der oszillierenden Briggs-Rauscher-Reaktion und verdeutlichte damit die antioxidative Ei- genschaft des Tees nachdrücklich. Der Vorteil des Grüntees gegenüber dem noch beliebteren schwarzen Tee liegt dabei darin, dass in seiner Herstellung auf eine Fermentation der Teeblätter verzichtet wird und so noch mehr positive sekundäre Pflanzenstoffe wie Catechine, Flavonoide etc. erhalten bleiben.56
5. Versuch (Abend): Alkohol-Tester
Zeitbedarf
Vorbereitung: 20 min Durchführung: 5 min Nachbereitung: 10 min
Reaktionsgleichung
Abb. 24: Reaktionsgleichung Alko-Tester.57
56 Vgl. Theiss, J.: Schwarzer Tee oder grüner Tee: Was ist gesünder? In: Gesunde Ernährung. Online verfügbar:
https://www.freundin.de/kochen-diaet-gesunde-ernaehrung-ernaehrungsmythen-im-check-schwarzer-tee-oder- gruener-tee-was-ist-gesuender-249395.html (Letzter Zugriff: 18.04.2019, 09:25 Uhr).
57 Eigene Erstellung mit ChemDraw, 29.12.2018.
29 Chemikalien
Tab. 5: Verwendete Chemikalien.
Geräte und Materialien - Glasrohr - Watte
- Stativmaterial - Klemme
- große Porzellanschüssel - Löffel
- Spatel
- Glasstab
- Pasteur-Pipette mit Pipettenhütchen - Feststofffilter (klein)
- Tesa-Film - Luftballon
- Haushalts-Trichter (zum Einfüllen des Wodkas)
58 Der Tabelleneintrag ist bezogen auf die HessGISS-Daten für Kaliumpermanganat (w ≈ 0,6 %) mit Schwefel- säure (w ≈ 0,1).
59 Der Tabelleneintrag ist bezogen auf die HessGISS-Daten für Mangan(II)-sulfat als Feststoff.
Eingesetzte Stoffe und Produkte
Summenformel Menge H-Sätze P-Sätze Gefahren- symbole
Schul- einsatz Kaliumpermanga-
nat-Lösung (w ≈ 0,03) in Schwefelsäure (w ≈ 0,1)58
KMnO4(aq) in H2SO4(aq)
3 mL 412, 315, 318, 319, 290, 411
273, 280, 301+330+331, 305+351+338, 309+310
S1
Kieselgel 60 1 g OE
Wodka 5 mL OE
Oxalsäure-Dihydrat (COOH)2∙2H2O(s) zur Ent- sorgung
302, 312, 318
280,
305+351+338
S1
Produkte
Mangan(II)-sulfat- Lösung59
MnSO4(aq) geringe
Mengen
373, 411 273 S1
Kohlenstoffdioxid (freies Gas)
CO2(g) geringe
Mengen
OE
30 Aufbau
Luftballon, gefüllt mit Wodka Glasrohr mit schwefelsaurer KMnO4-Testsubstanz, auf Glasperlen/Kieselgel aufgetragen
Stativ Staivklemme
Abb. 25: Versuchsaufbau Alkohol-Teströhrchen.60
Durchführung
Zur Vorbereitung des Versuchs werden zunächst in einer großen Porzellanschale 5 g Glasperlen sowie 5 g Kieselgel eingewogen und mittels eines Glasstabs behutsam miteinander vermengt.
Unmittelbar zu Beginn der eigentlichen Versuchsdurchführung werden hierzu 3 mL der schwe- felsauren Kaliumpermanganat-Lösung (w ≈ 0,03 in Schwefelsäure, w ≈ 0,1) hinzugefügt und abermals mit dem Glasstab vermengt. Sodann wird in das bereits auf einer Seite mit einem Wattepfropfen verschlossene Glasrohr mittels eines aufgesetzten Feststofffilters soviel dieses Kaliumpermanganat-Kieselgels eingefüllt, bis dieses zu etwa 2/3 gefüllt ist. Sodann wird das Glasrohr auch auf der anderen Seite mit einem kleinen Wattepfropfen verschlossen und in die präparierte Stativ-Apparatur eingespannt. Im Anschluss wird der bereitliegende Luftballon vollgefüllt mit dem zu untersuchenden Wodka und anschließend vorsichtig aufgepustet (nach- her festhalten, damit die Luft nicht wieder entweichen kann). Schließlich wird der Luftballon vorsichtig über das eine Ende des in die Stativapparatur eingespannten Glasröhrchens gezogen und vorsichtig die mit Wodka getränkte („Atem“-)Luft durch das Glasrohr geleitet durch kon- tinuierliches Loslassen des Luftballonverschlusses.
60 Eigene Erstellung mit Chemsketch, 15.04.2019.
31 Beobachtung
Der Wodka liegt als klare farblose Flüssigkeit mit intensivem Geruch nach Alkohol vor. Vor dem Durchleiten des Wodka-Gasstroms besitzt das schwefelsaure Kaliumpermanganat eine charakteristische violette Farbe. Während die Wodka-gesättigte („Atem“-)Luft sodann durch das Glasrohr geleitet wird, kann beobachtet werden, dass die vormalig violette Farbe allmählich ins Braune und schließlich ins Farblose übergeht, am Ende des Versuchs ist das Permanganat- Kieselgel bis auf wenige braune Stellen farblos.
Abb. 26: Permanganat-Kieselgel vor (links) und nach (rechts) dem Durchleiten des Wodka-gesättigten Luft- stroms.61
Entsorgung
Überschüssiger Wodka kann in den Ausguss gegeben werden. Das mit Permanganat versetzte Kieselgel wird anschließend mit Oxalsäure umgesetzt, um evtl. noch nicht abreagiertes Per- manganat zu zerstören (Freisetzung von Kohlenstoffdioxid), und anschließend neutral den Schwermetallabfällen zugeführt.
2 MnO4-
(aq) + 6 H+(aq) + (COOH)2(aq) → 2 Mn2+(aq) + 8 H2O(l) + 10 CO2(g)↑
Fachliche Auswertung der Versuchsergebnisse
Mit dem betrachteten Versuch sollte versucht werden, ein handelsübliches Alkohol-Teströhr- chen, dessen Mitführung im Auto z.B. in Frankreich in der Vergangenheit vorgeschrieben war, exemplarisch nachzubauen, jedoch unter Verwendung von Permanganat und nicht Chromat o.Ä.; die beobachtete Farbänderung im Teströhrchen von Violett nach Braun-Farblos stellt da- bei einen direkten Nachweis des im „Atem“-Gas enthaltenen Alkohols vom Wodka dar. Hierbei findet eine Redox-Reaktion zwischen dem Trinkalkohol (Ethanol) sowie dem schwefelsauren Kaliumpermanganat statt.62
61 Eigene Erstellung mit Handykamera, 05.12.2018.
62 Vgl. Französische Botschaft in Deutschland: Fahrzeugausrüstung: Was in Frankreich Pflicht ist. In: Frankreich- Infos. Online verfügbar: https://de.ambafrance.org/Fahrzeugausrustung-Was-in-Frankreich-Pflicht-ist (Letzter Zugriff: 18.04.2019, 09:30 Uhr).
32 Abb. 27: Redox-Prozesse beim Alkoholtester.63
Das Kaliumpermanganat fungiert in der beobachteten Reaktion als starkes Oxidationsmittel, das im Sauren bis zu Mn(II) reduziert wird. Komplementär wird der im Wodka enthaltene Trin- kalkohol (Ethanol) zur Essigsäure oxidiert, sodass insgesamt obige Reaktionsgleichung formu- liert werden kann. Da Mn(II)-Verbindungen nur eine sehr schwache Fleischfarbe gegenüber dem intensiv violetten Permanganat aufweisen, lässt sich im Experiment nahezu eine Entfär- bung des Teströhrchens beobachten; dass die Farbänderung dabei von violett über (intermediär) braun und schließlich annähernd farblos verläuft, hängt damit zusammen, dass in der Reaktion höchstwahrscheinlich SET-Prozesse stattfinden, sodass intermediär auch Mn(IV)-Verbindun- gen wie bspw. Braunstein etc. gebildet werden; analog erklärt sich, dass am Ende des Versuchs noch einzelne Stellen im Teströhrchen eine braune Farbe durch noch nicht bis zu Mn(II) redu- zierte Mangan-Spezies vorliegen.64
Mechanistisch lässt sich die Ethanol-Oxidation durch Permanganat analog zur Oxidation mit Cr(VI)-Verbindungen formulieren; der genaue Reaktionsmechanismus ist jedoch noch nicht restlos aufgeklärt.
Abb. 28: Esterbildung und -spaltung.65
Zunächst fungiert ein EtOH-Molekül als Nukleophil, das am elektrophilen Mangan-Atom des Permanganats angreifen und unter gleichzeitiger intramolekularer Protonenumlagerungen
63 Eigene Erstellung mit Chemdraw, 29.12.2018.
64 Vgl. Brückner, R.: Reaktionsmechanismen – Organische Reaktionen, Stereochemie, Moderne Synthesemetho- den. 3. Auflage, Springer Spektrum Verlag, Heidelberg, 2015, S. 742 f.
65 Eigene Erstellung mit Chemdraw, 29.12.2018.
33 einen Ester der (im freien Zustand nicht bekannten) Permangansäure bilden kann. Dieser wie- derum wird im nächsten mechanistischen Schritt heterolytisch gespalten, indem unter Abspal- tung zweier H+-Ionen Acetaldehyd und Manganat(V) entstehen und damit hier ein Redox-Pro- zess vorliegt; hierbei handelt es sich aller Wahrscheinlichkeit nach um zwei aufeinanderfol- gende SET-Prozesse. Das so entstehende Manganat(V) ist jedoch im Schwefelsauren nicht stabil, sondern disproportioniert rasch in Manganat(VI) und Manganat (IV), d.h. Braunstein;
Manganat (VI) wiederum, im Alkalischen stabil, unterliegt im Sauren einer erneuten Dispro- portionierung in Manganat(IV) und Permanganat, sodass insgesamt folgende Disproportionie- rungsgleichung formuliert werden kann.66
Abb. 29: Disproportionierung von Manganat(V) im Sauren.67
Im nächsten Schritt addiert sich ein Wassermolekül nukleophil an den intermediären Acetalde- hyd unter Hydratbildung; auch hierbei handelt es sich um einen reversiblen Prozess.
Abb. 30: Hydratbildung von Acetaldehyd unter H+-Katalyse.68
Da das gebildete Hydrat jedoch die Erlenmeyerregel verletzt (zwei geminale Hydroxyfunktio- nen am Kohlenstoff-Atom), stellt es ein reaktives Teilchen dar, das schnell die Reaktion mit einem elektrophilen Reaktionspartner sucht. Es kommt daher erneut zu einem nukleophilen Angriff auf ein zweites Permanganat-Ion.69
Abb. 31: 2. Zweite Esterbildung und -spaltung mit Reaktion zum Produkt Essigsäure.70
66 Vgl. Holleman, A.F./Wiberg, N.: Lehrbuch der Anorganischen Chemie. 81.-90. Auflage, Walter de Gruyter Verlag, Berlin/New York, 1976, S. 907 f.
67 Eigene Erstellung mit Chemdraw, 29.12.2018.
68 Eigene Erstellung mit Chemdraw, 29.12.2018.
69 Vgl. Brückner, R.: Reaktionsmechanismen. S. 743.
70 Eigene Erstellung mit Chemdraw, 29.12.2018.