Research Collection
Doctoral Thesis
Versuche zur Darstellung von Diketenen
Author(s):
Kreis, Walter; Kreis, Walter; Kreis, Walter Publication Date:
1918
Permanent Link:
https://doi.org/10.3929/ethz-a-000090372
Rights / License:
In Copyright - Non-Commercial Use Permitted
This page was generated automatically upon download from the ETH Zurich Research Collection. For more information please consult the Terms of use.
ETH Library
I. M i Drtlis von Hu
IL Die Konstitution é Isoprenhydroliromides.
III. Versudie mit ü heiß-halien Qnhi.
Von der
Eidgenössischen Technischen Hochschule
in Zürich
zur Erlangung der
Würde eines Doktors der
Naturwissenschaften
genehmigte Promotionsarbeit
vorgelegt von
Walter Kreis, dir4- Fachlehrer der Naturwissenschaften,
aus Neukirch-Egnaeh (Thurgau).
Referent: Herr Prof. Dr. H.Staudinger.
Korreferent: Herr Prof. Dr. F. P. Treadwell.
197
ZÜRICH a 1918.
Diss.-Druckerei Qebr. Leemann & Co.
Stockerstr. 64.
Leer Vide Empty
st
MEINEN LIEBEN ELTERN
IN DANKBARKEIT GEWIDMET.
Leer
-Vide
-Empty
Vorliegende Arbeit wurde im chemischen Institut der Eidgenössischen Technischen Hochschule in Zürich ausge¬
führt in der Zeit vom Sommersemester 1916 bis Winter¬
semester 1917/18.
Meinem hochverehrten Lehrer,
Herrn Prof. Dr. H. STAUDINGER,
dem ich die Anregung zu dieser Arbeit verdanke, und unter dessen Leitung dieselbe ausgeführt wurde, möchte ich an dieser Stelle für sein warmes Interesse und die vielseitige Unterstützung, die ermir jederzeit zuteil werden ließ^ meinen herzlichsten Dank aussprechen.
Leer Vide Empty
Versuche zur Darstellung von
Diketenen.
Theoretischer Teil.
Als Diketene werden Verbindungen bezeichnet, welche diereaktionsfähige Ketengruppe >C—C=0 zweimal im Mo¬
lekül enthalten. Nachdem das Studium der von Staudinger1) entdeckten einfachen Ketene eine so reiche Fülle von inter¬
essanten Resultaten zu Tage gefördert hat* schien uns auch die Darstellung von Diketenen wertvoll zu sein. Die ein- fachteten Vertreter dieser Körpergruppe sind folgende:
O = C= C =O dimolekulares Kohlenoxyd
0 = C= C = C= 0 Kohlensuboxyd
0 = C= CH —CH= C =0 einfaches Diketen
\ /
0 = C = C — C= C = 0 Dimethyldiketen C6H5 CqH^
\ /
0 = C =C-C = C =0 Diphenyldiketen
0= C= C=C = C=0 Dikarbonyläthylen
Von diesen allen ist einzig das Kohlensuboxyd bekannt.
Es wurde 1906 von Diels2) und Wolf entdeckt und zeigt in seinem chemischen Verhalten die von obiger Formulierung
!) Staudinger, B. 38 (1905), 1735.
2) Diels h. Wolf, B. 39 (1906), 689.
stellung geschieht nach folgenden drei Methoden.
1. Abspaltung von Alkohol aus Malonestern mit Phos- phorpentoxyd:
C 00 C2H5 CO
! H
CH2 -> C + 2H20 + 2 03H4
I II
C 00 C2H6 CO
2. Abspaltung von Wasser aus Malonsäure mit Phos- pborpentoxyd:
C00 H CO
II
CH2 -> C + 2H20
II
C00 H CO
3. Abspaltung von Halogen3) aus Dibrommalonsäure- chlorid mit Zink:
CO Cl CO
II
CBrä + 2Zn + C + Zn Cl, + Zn Br2
I II
CO Cl CO
Das dimolekulare Kohlenoxyd CO = CO wurde noch nie erhalten. Nach Versuchen von Staudinger4) und Anthes ist es aber ziemlich sicher, daß dasselbe bei der Reaktion
von Oxalylbromid mit Hg primär entsteht, jedoch nicht existenzfähig ist, sondern sofort unter Bildung von CO
zerfällt. '
CO Br CO
J + 2 Hg — 2 HgBr + || — 2 Co
CO Br CO
s) Staudinger u. Bereza, B. 41 (1908), 4461.
*) Staudinger u. Anthes, B. 46 (1913), 1426.
— 9
Meine Arbeiten erstreckten sich auf die drei Glieder:
CO CO CO
CH
I
CH
C—CH, C—CH,
und C
II C
II II II
CO CO CO
iDas nächstliegende war, für diese drei Körper die Methoden, welche zum Kohlemsuboxyd führen, anzuwenden.
Die Wasser- und Alkoholabspaltungsmethode wurde schon von Staudinger versucht, führte aber nicht zum Ziele.
Er ließ P205 auf Bernsteinsäure, Dimethylbernsteiasäure, Fumarsäure und deren Ester einwirken, um zu den ent¬
sprechenden Diketenen zu gelangen.
COOH CO COOC2H5 CO
CH2
II
CH CH2
II CH 1
CH2
—
CH
+ 2H20 und CH2
-> +2C2H0OH
CH 1
COOH
II
CO COOC2H5
II CO
COOH CO COOC2H6 CO
CH-CH3 II
C-CH3 CH.CH3
II C-CH3 CH-CHj
-> 1
C-CH8 + 2H20
und l
CH-CH,
- +2 C2H6OH
C-CH3
COOH
II
CO COOC2H5
II CO
COOH CO COOC2H5 CO
CH
II
c CH
II C II
CH
-+ Il c
+ 2H20 und II • CH
-> || + 2C2H8OH C
COOH
II
CO COOC2H6
II CO
In keinem Falle konnte die Entstehung von Diketen wahrgenommen werden.
Ebenfalls erfolglos zeigte sich die Halogenabspaltungst- methode. Durch Einwirkung von Zink auf Dibrombernstein- säurechlorid und ebenso auf Dichlormaleinsäurechlorid waren
nach Versuchen von Staudinger keine Diketene zu erhalten.
COC1 CO
+ Zn Ol, -+• ZnBr2
CHBr CH
| + 2Zn - |
CHBr CH
II
COC1 CO
COC1 CO
II
CCI c
II + 2Zn -—-> II
CCI c
II
COC1 CO
+ 2 ZnCl2
In dem Dichlormalonylchlorid sind alle Chloratome an ungesättigte Kohlenstoffatome gebunden. Bekanntlich wer¬
den Halogenatome von ungesättigten Kohlenstoffatomen viel fester gebunden als von gesättigten, und aus diesem Grunde wirkt bei dem Dichlormalonylchlorid das Zink nicht chlor¬
abspaltend.
Endlich sei noch ein Versuch von Schlubach erwähnt, der aus Diphenyldjbrombernsteinsäurechlorid durch Einwir¬
kung von Zink zum Diphenyldiketen gelangen wollte.
COC1 CO
I II
C6H6-C-Br C-C6H6
i + 2 Zn -y | + ZnCl3 + ZnBr2
C6H5-C-Br C-C6H6
I II
C0C1 CO
Hier scheiterte die Darstellung des Diketens daran, daß das Ausgangsmaterial, das Dibromdiphenylbeirnstein- säurechlorid nicht erhalten werden konnte.
— 11 —
Ich versuchte nun, eine neuere Methode, die für die Darstellung einfacher Ketene oft Erfolg hatte, für die Di- ketene in Anwendung zu bringen.
Einhorn5) hat durch Einwirkung von Pyridinlösung auf Malonylchloride Malonsäureanhydride dargestellt und die¬
selben als vierfach undzwölffach molekular bezeichnet, z.B.: C2H,
CoHf C
CO
o und
C2HE C2Hf
CO CO
0
Später haben Staudinger6) und Ott durch Erhitzen von
Malonsäurehalbchloriden dieselben Anhydride erhalten und gezeigt, daß sie weder vierfach noch zwölffach molekular sind, sondern amorphe hochmolekulare Produkte repräsen¬
tieren. Bei der pyrogenen Zersetzung gehen diese An¬
hydride unter C02-verlust in Ketene über.
CH3 CH3 C2H5 C,HS
C-
coN
-CO7
^co,
\co
^o
>o
CHSN
CH/
c2h5n c9h/
CO
>C = CO
Diese Methode habe ich aufgegriffen, um zu den Di- ketenen zu gelangen. Im Falle der Äthantetrakarbonsäure,
welche als Ausgangsmaterial für das einfach© Diketen in Betracht kommt, war es aber wahrscheinlicher, daß die Anhydridbildung nicht wie bei den Malonsäuren unter 4-Ring- bildung erfolgt, sondern daß wie bei der Bernsteinsäure die Tendenz zur Bildung eines beständigeren 5-Ringes vor¬
handen ist.
/COOH /COx
CH/ CH/ \
I + | O
CH2V CH2X /
COOH ^CO'
145.
6) Einhorn u. Diesbach, B. 39 (1906), 1222; Einhorn, A. 359 (1908),
«) Staudinger u. Ott, B. 41 (1908), 2208.
COOPL /COOH /CCX /COx
[ —-> 0 | o
cooh/ \cooh \co/ \x)/
Die Darstellung des erwarteten Anhydrids aus Äthan- tetrakarbonsäure ist mir auch gelungen durch Kochen der Säure mit Acetylchlorid. Zum Unterschied von den hoch¬
molekularen Malonsäureanhydriden Einhorns ist das Äthan- tetrakarbonsäureanhydrid monomolekular.
'Mit Wasser bildet es die Äthantetrakarbonsäure zurück:,
.CO. /COx COOHv /COOH
/ XCH/ \ XCH/
O | Of2 H20 =
Nx»/ ^co-/
.cooh/ \oooh
Mit zwei Mol. Anilin reagiert das Anhydrid unter Bildung einer Anilidosäure,
COOHx /CONHCflH6
XCH/
CTT
NHC6H5
CO^ ^COOH
welche beim Erhitzen unter Kohlensäureverlust in das Bern- steinsäureanilid übergeht und beim Destillieren das Phenyl- imid der Bernsteinsäure liefert.
COOHx .CONHC6H5
/C0
NH06HsXCH/ CH2
| -> + 2 C03
.CR CH,
NHCJL CO/ \COOH
XC0 NHC6H5
i
/CO
CH/
\1 NC6H6 -f- Anilin
CH2X
/•-co/
— 13 —
Daß auch in diesem Falle eine Spaltung des Anhydrids
unter C02-Verlust und Bildung von Diketen wahrscheinlich ist, nach folgender Formulierung:
CO
CO CO. ||
x
XCHX
\ CHO | o — - | + 2C02
xCOx
xCOx ||CO
zeigen Versuche, die schon mit 5-Ringen ausgeführt wurden, und bei denen die Zersetzung in ähnlicher Weise verlaufen ist. Z. B. hat Ott7) beim Erhitzen von Chlormaleinsäure^
chlorid die Abspaltung von Phosgen nachgewiesen.8)
CC1X
\o
xCO
Die Versuche, aus dem Anhydrid durch C02-Abspaltung das Diketen zu erhalten, waren aber ohne Erfolg. Die Zersetzungsversuche wurden im absoluten Vakuum und im C02-Strom ausgeführt, jedesmal unter Vorschaltung eines U-Rohres mit Anilin, um das eventuell entstehende Diketen in Bernsteinsäureanilid überzuführen.9)
i) Ott, A. 392 (1912), 253.
8) Eine solche Spaltung beobachtet man auch beim Bernsteinsäure¬
anhydrid, welches bei längerem Sieden C02 verliert. Fittig, B. 30 (1897), 2149.
CH/
\
CH/ \ CH-j-CHa-C-CHa-CHs' >o + | >o — I /\ | + co2
CH3 / CH2 / CO — 0 0 CO
^COX ^COX
») Staudinger: Die Ketene, S. 32.
CO 11
CH + NH2C6H6
CONHC6H5 CH2
CH II .
CO + NH2C6H5
CH2
CONHC6H5
In keinem Falle konnte aber auch nur eine Spur von Bernsteinsäureanilid nachgewiesen werden.
'Es ist auch denkbar, daß Diketenebefähigt sind, 4-Ringe
zu bilden, nach der Gleichung:
HC = 0= 0 HC —C = 0
I
I! IHC =C =O HC —C =O
Um eventuell ein solches Produkt aufzufangen, wurden die Zersetzungsgase noch durch eine mit C02-Ätheir ge¬
kühlte Spiralvorlage geleitet. Es kondensierte sich jedoch nichts darin.
iKetene lagern sich sehr leicht an Schiff'sche Basen
an unter Bildung von /?-Laktamen,10) die sich als gut kri¬
stallisierte Körper bequem isolieren lassen.
(C6H5)2 C = CO (C6H5)2 C-CO C6H5 CH =
NC^H6
C6H5 CH-NC6H5Um ein entsprechendes Anlagerungsprodukt des Di- ketens an Benzylidenanilin zu erhalten, erwärmte ich das Anhydrid der Äthantetrakarbonsäure, gemischt mit Benzy¬
lidenanilin, womit das Keten hätte reagieren können.
CO
II
CH I
+
NC6H5 II CHC6H5
CO- CH-
-NC6H5
— CHC6H5
CH II CO
+ CHC6H5II NC6Hä
CH-
- CO-
— CHC6H5 -NCeH5 10) Staudinger, A. 356 (1907), 95.
- 15 —
Ein solches Anlagerungsprodukt konnte aber auch nicht erhalten werden.
Entweder verläuft die Zersetzung des Anhydrides in
ganz anderer Richtung, oder das primär entstehende Di- keten läßt sich infolge außerordentlich schneller Polymeri¬
sation nicht fassen.
Ich versuchte noch, nach einer Methode, die von
Schneider11) zur Darstellung von Ketenen ausgearbeitet wurde, aus der Athantetrakarbonsäure mit Diphenylketen ein gemischtes Anhydrid zu erhalten, um aus demselben bei der Zersetzung Diketen zu bekommen.
COOH
/COOH
CH
| + 4(C6Hß)2C =CO
CH
cooh/ \cooh
(06HJ2CH— CO - O— COx .CO—O— CO— CH(C6H,)2
\CH/
/CH
(C6H5)2CH- CO—O - OC/ MX) —0—CO -CH(C8H5),
CO-CH(C6H0)2
O = C= CH — CH = C=O +2C02 + 20<
XC0
— CH(CeHB), Pas Diphenylketen übte nur eine wasserabspaltende Wirkung aus, so daß nicht ein gemischtes Anhydrid, son¬dern nur das schon dargestellte Anhydrid entstund.
H\
Die Aldoketene /C — CO (als solches ist auch das W
einfache Diketen zu betrachten), zeigen eine viel größere u) Schneider, Diss. Zürich 1916.
Neigung zur Polymerisation12) als die Ketoketene
>c = co
und sind infolgedessen schwieriger darzustellen.
Aus diesem Grunde versprach die Darstellung des Di- methyldiketens, welches als Ketoketen aufzufassen ist, eher Erfolg.
0 = C= C — C = C =0 CH, CHs
(Es war aber nicht möglich, das Ausgangsmaterial für dieses Diketen, die Dimethyläthantetrakarbonsäure zu er^
halten, weil der entsprechende Ester auch durch wochen¬
langes Schütteln mit Kali nicht verseifbar war. Die Ver¬
seilung erfolgte erst durch achttägiges Kochen. Dabei tritt aber Zersetzung der Säure ein, und man erhält zum größten Teil eine Trikarbonsäure, wie durch Titration festgestellt wurde. Die Trikarbonsäure ging beim Erhitzen in Dimethyl- bernsteinsäure über:
CH3 CH3
I | +C02 COOHN
COOH—C—COOH COOH —C-COOH \CHCH3
[ —- [ —- ! -t-C02
COOH—C— COOH COOH— CH XCHCH3
| COOH/
CH3 CHS
Dieses Verhalten des Esters steht in guter Überein¬
stimmung mit der bekannten Tatsache, daß disubstituierte Malonester13) viel schwerer verseifbar sind wie die mono-
substituierten.
12) Staudinger: Die Ketene, S. 38.
1S) E. Hjelt, B. 29 (1896), 110, 1864;E. Fischer, B. 35 (1902), 844.
— 17 -
COOC2H5 COOC2H5
I I
HRC R1R2C
I I
COOC2H5 COOC2H5
leicht verseifbar schwer verseifbar
COOC2H,x
.COOC,H5C(CH3)-C(CH3)
COOCjHj/ Nx)OC2H5
schwer verseifbar.
AlseinKetoketenkann auchdasDikarbonyläthylen OC = C = C = CO aufgefaßt werden. Um dieses darzu¬
stellen, suchte ich zuerst das Anhydrid der Äthylentetra¬
karbonsäure zu erhalten, aus welchem durch C02-Abspaltung die Bildung des Diketens erfolgen sollte.
CO CO CO
/ :C : \ C
O MI O _.-.> jl + 2C02
\i C: / C
\ / \ / II
; CO : CO CO
Das Anhydrid selbst dürfte ein großes Interesse be¬
anspruchen, weil damit ein neues Kohlenoxyd von der ïlormel C60c gewonnen wäre. Es war von ihlm zu erwarten, daß es, wie das Äthantetrakarbonsäureanhydrid, relativ bestän¬
dig sei. Aber merkwürdigerweise konnte es nie isoliert werden.
Alle Methoden, welche bei der Äthantetrakarbonsäure
zu deren Anhydrid führten, wurden auch bei der Äthylen¬
tetrakarbonsäure angewandt, nämlich:
1. Aethantetrakarbonsäure -|- Acetylchlorid
2. » ~\~ Oxalylchlorid
3. Silbersalz der „ -)- Oxalylchlorid
4. „ + Dyphenlketen.
Äthylentetrakarbonsäure gibt mit Acetylchlorid nicht das gewünschte Anhydrid, sondern verliert wahrscheinlich C02, nach den Analysen zu schließen. Mit Oxalylchlorid entsteht ein braunes, schmieriges Produkt, das den in den folgenden Reaktionen erhaltenen ganz ähnlich ist und, dem hohen Koblenstoffgehalt nach zu schließen, wahrscheinlich ein Zersetzungsprodukt des primär entstandenen Anhydrids ist.
Die besten Resultate versprach die Reaktion des Silber¬
salzes mit Oxalylchlorid, welche bei der Äthantetrakarbon- säure glatt zum Anhydrid führte und bei welcher Neben¬
reaktionen ausgeschlossen waren.
GOC1
AgCOOx /COOAg
C1CO +COC1 AgCOO
/°\
+ COOAg C1CO
CO —O CO«. /CO
CO —O - CO'
O-CO
\co—O —CO
,COx
/CO,o
\co/
c.O +2C02 = 2CO
^CO'
Doch auch hier bestand das Reaktionsprodukt, wie bei der Vorigen Reaktion, aus einer braunen Schmiere, die beim Trocknen in ein sehr hygroskopisches, braunes Pulver überging, dessen Kohlenstoffgehalt für ein Polymères des Dikarbonyläthylens spricht.
— 19 —
Ganzähnliche Eigenschaften besitzt das Polymerisations- produkt des Kohlensuboxyds (C302).14)
DasAnhydrid der Äthylentetrakarbonsäure ist also selbst
unter diesen gelinden Bedingungen nicht beständig, sondern zerfällt sofort weiter, wobei wahrscheinlich primär das Di- keten entsteht, welches sich zu einem hochmolekularen Pro¬
dukt polymerisiert.
Ich versuchte endlich, nach der Methode von Schneider das gemischte Anhydrid mit Diphenylketen herzustellen.
Dabei erhielt ich neben Diphenylessigsäureanhydrid auch wieder dieses schmierige, braune Produkt, ähnlich den vor¬
hergehenden. Wahrscheinlich hat sich hier aus dem ge¬
mischten Anhydrid C60g gebildet, welches sofort in das Polymerisationsprodukt des Diketens weiter zerfallen ist.
COOHv /COOH
COOIF ,C.
+ 4(C6H5)C=rCO
\COOH
(C6H6)2CH-CO-0-COx /CO.O.OO.CH(08H5)S
II /C\
(C6H5)2CH.CO.O.CO/
XCO-0-CO.CH(C6HB),o -CO
,C(X
/CO,
•C-
O + 2C02 + 20<
-co
**) Diels u. Wolf, B. 39 (1906), 691.
/COCH(C6H5)2
-COCH(C6H6)2
Es sei noch erwähnt» daß Hirzel15) nach derselben Methode zu folgendem Diketen zu gelangen suchte,
CH3 —C = C= O CH,
I
CH3 —C =C = O
indem er Dimethyldikarboxyglutarsäure mit vier Mol. Di- phenylketen zur Eeaktion brachte. Er erhielt ein mono¬
molekulares Anhydrid
CH3
C(X j
CH3 —C< >0 CO — G— CO
|\X)/
| | |CH2 resp. O CH2 0
,COv | | (
CH3 -C< >0 CO— C—CO
xco/ t
CH3
Dieses führte aber beim Erhitzen nicht zum gesuchten.
Diketen.
15) Hirzel, Diss. Zürich 1916.
Experimenteller Teil.
Aethantetrakarbonsäure.
Der Tetraäthylester der Äthantetrakarbonsäure wurde dargestellt aus Natriummalonester und Jod nach einer Vor¬
schrift von Bischoff:16) 17,3 g Na, 120 g Malonester und 95,3 g Jod gaben 90 g Ester = 75% Ausbeute. Der Ester zeigte nach dem Umkristallisieren aus Alkohol den Schmelzpunkt 76°.
Die Verseifung des Esters17) geschah durch vierstün¬
diges Kochen mit Natronlauge vom spezifischen Gewicht 1,2.
Nach dem Ansäuern mit Schwefelsäure wurde die Äthan¬
tetrakarbonsäure durch fünf Tage langes Extrahieren mit Äther gewonnen. Ausbeute: 42 g Säure aus 90 g Ester
= 72%. Nach dem Umkristallisieren aus Alkohol zeigte die Säure den Schmelzpunkt 167—169° unter Zersetzung.
Darstellung des Anhydrides der Aethantetrakarbonsäure.
EineLösung von 12 gÄthantetrakarbonsäure in 200ccm
absolutem Äther wurde mit 22 g Acetylchlorid (5 Mol.) zehn Stunden lang am Rückflußkühler mit aufgesetztem Chlorkalziumrohr auf dem Wasserbade gekocht. Nach 1—2 Stunden begann sich das Anhydrid an der Glaswand ab¬
zuscheiden. Erst beim Eindampfen schied sich aber die Hauptmenge des Anhydrids aus. Der Niederschlag wurde abgesaugt und mehrmals mit absolutem Äther nachge¬
waschen, um die etwa noch beigemengte unveränderte Säure in Lösung zu bringen, während das Anhydrid in absolutem Äther unlöslich ist. Ausbeute: 5 g.
!«) Bischoff u. Räch, B. 17 (1884), 2781.
17) Buchner, B. 25 (1892), 1158.
Das Anhydrid, das in Benzol, Ligroin, Chloroform, Schwefelkohlenstoff und absolutem Äther unlöslich ist, wurde
aus reinem Essigester (über P205 destilliert) umkristallisiert.
Beim Erhitzen tritt langsame Verkohlung ein unter Gas¬
entwicklung.
1. 0,3288g gaben 0,5066g C02 u. 0,0364g H20 0,2181 „ „ 0,3400 „ C02
,2267 „ , 0,0263 „ „
Berechnet für C6H206: C =42,35%, H2 = l,18%
Gefunden: 1. C =42,05%, H, = 1,21%
2. C = 42,50%, H2 = 1,27% Molekuiargewichtsbestimmungen in reinem
2.
)
°><Essigester:
Angewandte Substanzen 2,887g 2,631g 2,851g
Essigeatermenge 100 g 100 g 100 g
Siedepunktserhöhung 0,44° 0,40° 0,41°
Mol. Gew. 171,2 171,5 181,5
Berechnet für CeH206 : 170
Aufspaltung des Anhydrides mit Anilin.
1,5 g Anhydrid in Essigester gelöst, wurde mit 1,7 g
(2 Mol.) Anilin versetzt. Nach ein paar Sekunden schied sich unter Erwärmung ein flockiger Niederschlag ab. Dieser wurde abgesaugt. Er ist in Sodalösung leicht löslich und wird durch Ansäuern wieder ausgefällt.
0,1655g Subst. gaben 0,3667g C02 u. 0,0701 g H20 0,2086 „ „ „ 15,4cm^ Ns (20°, 715 mm).
Berechnet für C18H1606N2: C = 60,67%, H2 =4,49 %, N2 = 7,87% Gefunden: C = 60,42%, H2=4,71%, N2 — 8,01%
Diese noch unbekannte Anilidosäure wurde vorsichtig erwärmt, wobei C02-Abspaltung eintrat. Das so erhaltene Produkt wurde aus Alkohol umkristallisiert und erwies sich
— 23 -
durch den Schmelzpunkt 226—227° und Mischproben als identisch mit dem Bernsteinsäureanilid. Beim Destillieren ging die Anilidosäure unter C02- und Anilinabspaltung in einen Körper vom Schmelzpunkt 150° über, der dem Phenyl- imid der Bernsteinsäure entspricht.
Zersetzung des Anhydrids.
a) Im absoluten Vakuum.
3 g Anhydrid der Äthantetrakarbonsäure wurden durch vorsichtiges Erwärmen im absoluten Vakuum zersetzt unter
Vorschaltung eines U-Rohres mit Anilin, um allfällig ent¬
standenes Diketen in Bernsteinsäureanilid überzuführen, und 'einer mit C02-Äther gekühlten Vorlage, um eventuell Poly¬
merisationsprodukte zu kondensieren. Nach beendeter Zer¬
setzung konnte weder ein Kondensat in der Vorlage be¬
merkt, noch im Anilin die Bildung von Bernsteinsäure¬
anilid nachgewiesen werden.
b) ImKohlensäurestrom.
3 g Anhydrid wurden im raschen Kohlensäurestrom unter Vorschaltung eines U-Rohres mit Anilin einer raschen Zersetzung unterworfen. Auch hier konnte kein Anilid nach¬
gewiesen werden.
c) Mit Benzylidenanilin.
1 g Anhydrid wurde mit 2,5 g Benzylidenanilin ge¬
mischt und in einem Reagensglas erwärmt. Nach beendeter Gasentwicklung konnte auch in diesem Falle kein Anlage¬
rungsprodukt mit Diketen isoliert werden.
Aethantetrakarbonsäure und Oxalylchlorid.
4 g Äthantetrakarbonsäure wurden in absolutem Äther gelöst und mit 5,9 g Oxalylchlorid (2l/3 Mol.) versetzt, worauf von selbst Reaktion eintrat und das gebildete An¬
hydrid sich an der Glaswand abschied. Ausbeute: 1,4 g
Anhydrid, das mit dem durch Kochen mit Acetylchlorid erhaltenen identisch ist. (Eigenschaften und Reaktion mit Anilin.)
Silbersalz der Aethantetrakarbonsäure und Oxalylchlorid.
Eine Lösung von 5 g Äthantetrakarbonsäure wurde mit Ammoniak neutralisiert und mit einer Lösung von 16,5 g Silbernitrat versetzt. Der Niederschlag wurde mit Alkohol nachgewaschen und bis zur Gewichtskonstanz im Vakuum getrocknet, was mehrere Tage dauerte.
6,3 g des Silbersalzes wurden mit 2,5 g Oxalylchlorid in 40 cm3 absolutem Äther versetzt. Es trat lebhafte Re¬
aktion ein. Nach Beendigung derselben konnte durch Ex¬
traktion mit Essigester ein Anhydrid isoliert werden, das dem durch die beiden ersten Methoden erhaltenen völlig entspricht. Ausbeute: 1,2 g.
Dimethyläthantetrakarbonester.
Bishoff18) und Räch stellten diesen Ester dar aus Na- triummethylmalonester und Jod:
COOC2H5 COOCgH, COOC2H0
| I
2C (CH3)Na+ J2 = CH3 - C C—CH3 + 2NaJ
i I
COOC2H6 COOC2H5 000,11,
Die geringe Ausbeute von 27°/o, die sie dabei erhielten, erklärten sie sich durch Annahme von Nebenreaktionen.
Indem ich statt Jod Brom anwandte, und dieses unter Kühlung mit Kältemischung zutropfen ließ, um Nebenreak¬
tionen zurückzudrängen, konnte ich die Ausbeute um 8°/o erhöhen. Aus 117 g Methylmalonester erhielt ich 40 g Di¬
methyläthantetrakarbonester = 35°o Ausbeute, vom Siede¬
punkt 170—180° 11 mm (Hauptmenge bei 177°). Unter gewöhnlichem Druck siedet der Ester bei 310—315°. Dabei tritt schwache Gelbfärbung «in.
18) Bischoff u. Räch, A. 234 (1886), T4.
— 25 —
Verseifung des Dimethyläthantetrakarbonesters.
Die Verseifung erfolgt erst durch mehrtägiges Kochen mit alkoholischem* Kali. Die Säure, welche nach dem An¬
säuern mit HCl und fünftägiger Extraktion mit Äther ge¬
wonnen wurde, stellte ein sehr uneinheitliches Produkt dar, das schon beim Erwärmen auf Wasserbadtemperatur C02 abspaltete und bei stärkerem Erhitzen in Dimethylbern- steinsäure überging. Durch- mehrmaliges Lösen in Äther und Ausfällen mit Benzol konnte ein reineres Produkt er¬
halten werden, das sich durch Titration mit n/io Ba (0H)2 nicht als Tetrakarbonsäure, sondern als unreine Trikarbon- säure erwies.
0,0984 g Substanz gaben 0,1638 g C02 und 0,0567 g
H20.
Berechnet fürC8H10O8 (Tetrakarbonsäure): C= 41,03%, H2 =4,27%
„ C7H10O6 (Trikarbonsäure): C = 44,21 %, H2 = 5,26%
„ „ C6HJ0O4 (Dikarbonsäure): C = 49,31%, H2 = 6,85%
Gefunden: C = 45,42%, H2 = 6,4%
Titration: 0,1906 g Subst. erforderten 28,087 cm3 ^ n Ba (OH)2 =
= 2,8 Mol. Ba auf 1 Mol. Säure.
In der Kälte ist der Ester auch durch wochenlanges Schütteln mit Kali nicht verseifbar.
Aethylentetrakarbonsäure.
Der Ester dieser Säure wurde in guter Ausbeute nach einer Vorschrift von Blank19) und Samson erhalten. 100 g Brommalonester in 300g Benzol wurden mit 300g trockenem Kaliumkarbonat 20 Stunden auf dem Wasserbad gekocht.
Ausbeute: 60 g Ester. Dieser wurde verseift durch Ver¬
setzen mit einer Lösung von 100 g KOH in 200 g H20 und 100 g Alkohol. Es schied sich das neutrale, kristall¬
wasserhaltige Kalisalz C608K4.2 H20 aus.20) Um daraus das 19) Blank u. Samson, B. 32 (1899), 860.
20) Bischoff, B. 29 (1896), 1292.
wasserfreie, saure Kalisalz C608H2K221) zu erhalten, wurde eine wässerige Lösung des Neutralsalzes mit Essigsäure angesäuert und das saure Salz durch Zugabe von Alkohol ausgefällt. Dieses wurde aus heißem Wasser umkristallisiert.
Um die Säure22) zu erhalten, wurde das saureK-salzin Benzol suspendiert und während 1—2 Stunden unter Umschütteln ein Strom von trockenem Salzsäuregas durchgeleitet. Nach dem Verdrängen der Salzsäure durch Kohlensäure wurde die Säure mit Äther extrahiert. Schmelzpunkt 164° unter Zersetzung.
Anhydrisierungsversuche.
a) Mit Acetylchlorid.
1 g Äthylentetrakarbonsäure wurde in 25 cem absolutem Äther gelöst und mit 5 g Acetylchlorid zehn Stunden lang auf dem Wasserbad erhitzt, ohne daß sich ein Anhydrid ausschied. Nach dem Verdampfen blieb unveränderte Säure zurück. Auch durch mehrtägiges Kochen mit Acetylchlorid konnte nicht das gesuchte Anhydrid erhalten werden, son¬
dern es entstand eine feste Säure vom Schmelzpunkt 180 bis 184° unter Zersetzung, die eventuell unreine Trikarbon- säure ist. Das Produkt enthielt keine Essigsäure.
1. 0,1832g Subst. gaben 0,2553g C02 und 0,0427 g H20
2. 0,1357 „ „ ., 0,1921,, „ ., 0,0267, „
Gefunden: 1. C = 38,00%, H2 = 2,56%
2. 0 = 38,61%, H2=2,18%
Berechnet für CeO0: C =42,85%, H2 =0%
„ „ C608H4 (unveränd. Säure): C = 35,29%, H2 = 1,96%
„ C^OglL, (Trikarbonsäure): C = 37,5%, Hä = 2,5%
b) Mit Oxalylchlorid.
Äthantetrakarbonsäure reagierte mit Oxalylchlorid unter Braunfärbung. Beim Eindunsten blieb eine dunkle Schmiere
21) Conrad u. Guthzeit, A. 214 (1882), 78.
22) Bischoff, B. 29 (1896), 1291.
— 27 —
zurück, die in Äther gelöst wurde und aus der durch Benzol braune Flocken ausgeschieden wurden, die beim Trocknen ein staubfeines Pulver bildeten. Durch Zersetzung in C02- Strom unter Vorschaltung eines U-Rohres mit Anilin konnte nicht die Entstehung von Diketen konstatiert werden.
Analyse der braunen Flocken:
0,0768g gaben 0,1476 g C02 und 0,0249 g H20
Berechnet für C606: C= 42,85%, H2 =0% Berechnet für (C402)4: C = 60,00%, H2 = 0%
Gefunden: C = 52,34%, H2 = 3,6% c) Silbersalz und Oxalylchlorid.
Zu 57,6 g neutralem Kalisalz C608K4.2 H20 wurden in neutraler Lösung 100 g AgN03 hinzugegeben. Der Kri¬
stallbrei wurde abgesaugt, acht Mal mit Wasser nachge¬
waschen, bis keine Salpetersäure im Filtrat mehr' nach¬
zuweisen war, und hierauf mit Alkohol. Im evakuierten Exsikkator wurde drei Tage lang zur Gewichtskonstanz getrocknet. Ausbeute: 90 g Silbersalz.
Je 6,3 g Silbersalz wurden mit 2,5 g Oxalylchlorid
unter verschiedenen Bedingungen und in verschiedenen Lö¬
sungsmitteln zur Reaktion gebracht.
1.in 25ccm absolutem Äther zwei Tage langin der Kälte stehen gelassen. Reaktion nicht vollständig (chlorhaltig).
2. in 25 ccm absolutem Äther zwei Tage lang auf dem Wasserbad erwärmt. Reaktion vollständig.
3. in 25 ccm reinem Essigester zwei Tage in der Kälte stehen gelassen. Reaktion unvollständig.
4. in 25 ccm Essigester zwei Tage erwärmt. Reaktion vollständig.
In keinem Falle aber konnte ein Anhydrid C60g er¬
halten werden. Die Reaktionsprodukte waren alles braune amorphe Körper wie in Versuch b.
Sie lieferten beim Erhitzen kein Diketen.
0,1714g gaben 0,2975g C02 und 0,0356 g H20 Berechnet für C606: C— 42,85%, H2 =0%
Gefunden: C =47,20%, H2 = 2,27% Werden die 0,0356 g H20 als angezogene Feuchtig¬
keit betrachtet, da ja bei der Reaktion von Oxalylchlorid mit dem Silbersalz kein wasserstoffhaltiger Körper ent¬
stehen kann, und von der Substanzmenge subtrahiert, so erhält man:
0,1358 g Subat. gaben 0,2975 g C02 und 0 g H20 Berechnet fürC402 (CO:C:C:CO):C = 60 %, H2 = 0%
Gefunden: C =59,75%, H, =0%
d) Mit Diphenylketen.
3,46 g Äthylentetracärbonsäure wurden in 50 ccm ab¬
solutein Äther gelöst und mit 14 g Diphenylketen (41/* Mol.) in -einem mit C02 gefüllten Absaugkölbchen fünf Tage stehen gelassen, worauf sich eine Kristallmasse, aus Diphenyl- essigsäureanhydrid bestehend, ausschied. Daneben wurde noch ein schmieriges Produkt gebildet, das den in Versuchb) und c) erhaltenen Produkten ähnlich war, und wie diese nicht das Anhydrid, sondern wahrscheinlich ein Polymeri¬
sationsprodukt des Dikefcens C402 repräsentierte.
Die Konstitution
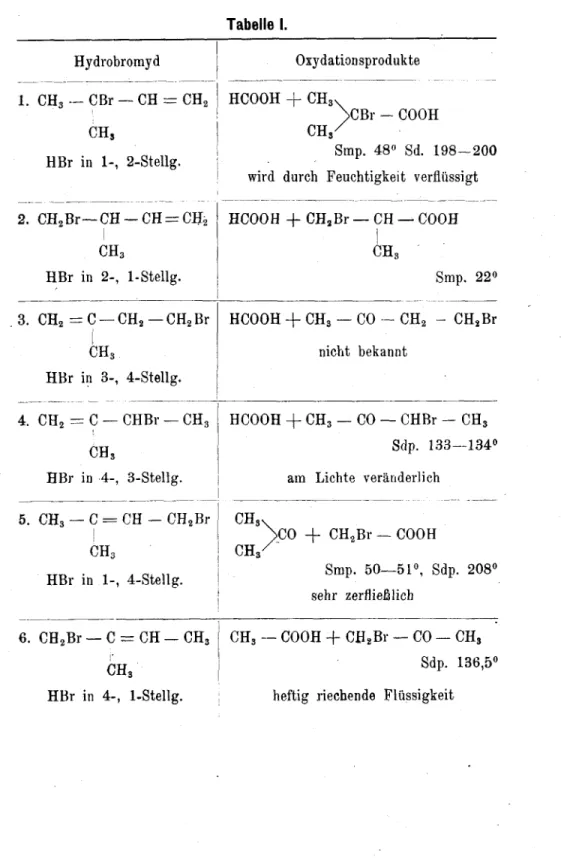
des Isoprenhydrobromids.
Theoretischer Teil.
A, Einleitung.
Das Isopren steht in naher Beziehung zum Kautschuk, in welchen es durch Polymerisation übergeht, und spielt infolgedessen eine wichtige Rolle als Ausgangsmaterial für den synthetischen Kautschuk. Daher ist einegenaue Kenntnis seiner chemischen Reaktionen anzustreben. Ferner ist es
im Hinblick auf die Thiele'sche Theorie1) von den Partial- valenzen interesssant festzustellen, ob dieselbe auch bei den Anlagerungsreaktionen mit Isopren Gültigkeit hat.
Thiele nahm an, daß bei Systemen mit konjugierten Doppelbindungen
12 3 4
C=C—C=C
die Partialvalenzen an den innern beiden Atomen sich gegen¬
seitig absättigen unter Bildung einer sogenannten inaktiven Doppelbindung, so daß nur noch am 1. und 4. Atom Partial¬
valenzen wirksam sind.
12 3 4
C=C—C=C
!) Thiele, A. 306 (1899), 87.
Dadurch erklärt Thiele die Tatsache, daß an System©
mit konjugierten Doppelbindungen Anlagerungen in der Regel in 1-, 4-Stellung erfolgen unter Verschiebung der Doppelbindung nach der Mitte.
Einen tiefern Einblick in den Aufbau des scheinbar komplizierten Kautschukmoleküls zu erhalten, wurde durch die Arbeiten von Harries2) ermöglicht. Dieser erhielt bei der Einwirkung von Ozon auf eine Lösung von Kautschuk in Chloroform ein Oaonid von der Formel Ci0Hi6O6j welches als Spaltprodukte Lävulinsäure und Lävulinaldehyd lieferte, und er nahm an, daß sich bei der Bildung von Kautschuk
aus Isopren zwei Moleküle in 1-, 4-Stellung (im Sinne der Thiele'schen Theorie) aneinanderlagern unter Ringbildung.
CH2—C = CH—CH2
CH2—CH=L— CH2 CH3
ehem.Kautschukmolekul CHS
1
OHO
1
CO CH2
CH2 +
1
CH2 CH2
1
CO
COOH CH3
Lävulinsäure Lävulinaldehyd
2) Harries, B. 37 (1904), 2709; B. 38 (1905), 1195.
CH3
CH2 =C— CH =CH2
CH2 =CH—
C'=
CH,CH3
CH2 —C(CH3)-CH - CH2 CH2 —CH —C(CH3)-CH2
°\ /°
xOx Ozonid