Hinweis
Bei dieser Datei handelt es sich um eine Wissenschaftliche Hausarbeit (1.
Staatsexamensarbeit), die am Fachbereich Chemie der Philipps-Universität Marburg angefertigt wurde.
Weitere Wissenschaftliche Hausarbeiten können auf der Seite http://www.chids.de/veranstaltungen/wiss_hausarbeit.html eingesehen und heruntergeladen werden.
Zudem stehen auf der Seite www.chids.de weitere Versuche, Lernzirkel und Experimentalvortäge bereit.
Dr. Ph. Reiß
Erste Staatsprüfung für das Lehramt an Gymnasien Wissenschaftliche Hausarbeit
im Fach Chemie
Vorgelegt von:
Julia Goppel
Thema:
Stickstoff in Technik und Natur
Gutachter: Dr. Philipp Reiß Datum: 10.04.2008
Inhaltsverzeichnis 2
Inhaltsverzeichnis
Einleitung ... 7
TEIL A: THEORIE ...8
1. Elementarer Stickstoff... 8
1.1 Physikalische Eigenschaften ... 8
1.2 Entdeckung und Namensgebung ... 9
1.3 Physiologisches ... 9
1.4 Chemische Eigenschaften... 10
1.5 Struktur des N2-Moleküls ... 11
1.6 Darstellung von Stickstoff... 13
1.7 Verwendung des elementarem Stickstoff ... 17
2. Ammoniak (NH3) ... 18
2.1 Physikalische Eigenschaften ... 18
2.2 Physiologisches ... 18
2.3 Struktur von Ammoniak... 18
2.4 Chemische Eigenschaften... 19
2.5 Darstellung von Ammoniak ... 22
2.6 Entwicklung der Haber-Bosch-Synthese... 26
3. Ammoniumsalze... 30
3.1 Ammoniumchlorid (Salmiak)... 30
4. Oxide des Stickstoffs ... 31
4.1 Distickstoffmonoxid N2O (Lachgas) ... 32
4.1.1 Physikalische Eigenschaften... 32
4.1.2 Struktur von N2O ... 33
4.1.3 Chemische Eigenschaften... 33
4.1.4 Darstellung von Distickstoffmonoxid (N2O) ... 34
4.2 Stickstoffmonoxid (NO)... 35
4.2.1 Physikalische Eigenschaften... 35
4.2.2 Struktur von Stickstoffmonoxid (NO) ... 36
4.2.3 Physiologisches ... 37
4.2.4 Chemische Eigenschaften... 38
4.2.5 Darstellung von Stickstoffmonoxid (NO)... 40
4.3 Distickstofftrioxid (N2O3) ... 41
4.3.1 Physikalische Eigenschaften... 41
4.3.2 Struktur ... 41
4.3.3 Chemische Eigenschaften... 42
4.3.4 Darstellung von Distickstofftrioxid (N2O3) ... 43
4.4 Stickstoffdioxid (NO2)... 43
4.4.1 Physikalische Eigenschaften... 43
4.4.2 Struktur ... 44
4.4.3 Chemische Eigenschaften... 47
4.4.4 Darstellung von Stickstoffdioxid (NO2) ... 48
4.5 Distickstoffpentaoxid (N2O5) ... 48
4.5.1 Physikalische Eigenschaften... 48
4.5.2 Chemische Eigenschaften... 49
4.5.3 Struktur ... 49
4.5.4 Darstellung von N2O5... 49
4.6 „Nitrose Gase“ in der Atmosphäre ... 50
4.7 Reinigung von Umweltgasen ... 51
5. Sauerstoffsäuren des Stickstoffs ... 53
5.1 Strukturen ... 54
Inhaltsverzeichnis 3
5.2 Darstellung ... 55
5.3 Hydroxylamin NH2OH... 55
5.3.1 Physikalische Eigenschaften... 55
5.3.2 Struktur ... 55
5.3.3 Chemische Eigenschaften... 56
5.3.4 Darstellung von NH2OH... 58
5.3.5 Verwendung von NH2OH... 59
5.4 Salpetrige Säure (HNO2) ... 60
5.4.1 Struktur ... 60
5.4.2 Eigenschaften... 61
5.4.3 Darstellung von Salpetriger Säure (HNO2)... 64
5.5 Salpetersäure (HNO3)... 64
5.5.1 Physikalische Eigenschaften... 64
5.5.2 Struktur ... 65
5.5.3 Physiologisches ... 66
5.5.4 Chemische Eigenschaften... 66
5.5.5 Darstellung von Salpetersäure (HNO3)... 68
5.5.6 „Salpeter(säure)ernte“ in der Vergangenheit ... 70
5.5.7 Nitrate ... 72
5.5.8 Verwendung ... 73
5.5.9 Die historische Entwicklung der Sprengstoffe ... 74
6. Düngemittel ... 78
6.1 Ammoniumsulfat ((NH4)2SO4) ... 78
6.2 Ammoniumnitrat (NH4NO3)... 79
6.3 Harnstoff (CO(NH2)2) ... 80
6.4 Die historische Entwicklung der Düngemittel... 81
7. Der Stickstoffkreislauf... 83
7.1 Atmosphärische Deposition... 85
7.2 Nitrifikation... 85
7.3 Assimilation von Nitrat ... 87
7.3.1 Nitrat wird im Cytosol zu Nitrit reduziert... 88
7.3.2 Reduktion von Nitrit (NO2-) zu Ammonium (NH4+) im Plastiden... 90
7.3.3 Fixierung von NH4+... 91
7.3.4 Die Nitratassimilation in der Wurzel ... 93
7.3.5 Die Nitratassimilation unterliegt einer strengen Kontrolle ... 94
7.3.6 Aminosäuren sind die Endprodukte der Nitratassimilation ... 95
7.4 N2-Fixierung aus der Luft... 96
7.4.1 Symbiose zwischen Knöllchenbakterien und Leguminosen... 96
7.4.2 Austausch von Stoffwechselprodukten zwischen Bakteroid und Wirtszelle ... 99
7.4.3 Stickstoff-Fixierung im Nitrogenasekomplex... 99
7.4.4 Schutz der Dinitrogenase vor Sauerstoff ... 102
7.5 Energiebilanz zwischen N2-Fixierung und Nitratassimilation... 102
7.6 Denitrifikation ... 103
7.7 Tierische Stickstoff-Assimilation am Beispiel Mensch... 104
7.8 Ammonifikation (Protoelyse)... 107
7.9 Anthropogene Beeinflussung des Stickstoffkreislaufs ... 108
TEIL B: DIDAKTISCHE BETRACHTUNG ...110
1. Bildungsgang G8 ... 110
Ziele und Aufgaben des gymnasialen Chemieunterrichts... 110
Ziele und Aufgaben des gymnasialen Biologieunterrichts ... 111
Inhaltsverzeichnis 4
TEIL C: EXPERIMENTELLER TEIL...113
1. Allgemeine Hinweise... 113
1.1 Verwendete pH-Indikatoren ... 113
1.1.1 Indikatorpapier... 113
1.1.2 Methylorange... 113
1.1.3 Phenolphthalein ... 114
1.1.4 Bromthymolblau... 115
1.1.5 Mischindikator... 116
2. Versuche ... 117
2.1 Elementarer Stickstoff... 117
Versuch 1: Quantitativer Nachweis des Luftstickstoffs ... 117
Versuch 2: Nachweis von elementarem Stickstoff ... 120
Versuch 3: Stickstoff-Darstellung aus Ammoniumnitrit... 123
Versuch 4: Stickstoffgewinnung aus der Luft... 125
Didaktische Analyse zu den Versuchen 1-4 ... 127
2.2 Ammoniak... 129
Versuch 5: Ammoniakspringbrunnen ... 129
Versuch 6: Darstellung von Ammoniak aus Ammoniumsalzen ... 130
Versuch 7: Reduktion von Salpetersäure zu Ammoniak... 133
Versuch 8: Die Haber-Bosch-Synthese im Reagenzglas ... 134
Versuch 9: Gleichgewichtslage bei der Ammoniaksynthese ... 137
Versuch 10: Ammoniak-Nachweis mit Neßler-Reagenz ... 140
Didaktische Analyse zu den Versuchen 5-10 ... 143
2.3 Ammoniumsalze... 146
Versuch 11: Bildung von Ammoniumchlorid... 146
Didaktische Analyse zu dem Versuch 11 ... 148
2.4 Stickoxide... 149
Versuch 12: Nachweis von Nitrat durch Ringprobe ... 149
Versuch 13: Luftverbrennung ... 150
Versuch 14: Darstellung von NO2 durch HNO3(konz) und Cu-Späne ... 153
Didaktische Analyse zu den Versuchen 12-14 ... 155
2.5 Sauerstoffsäuren des Stickstoffs... 156
Versuch 15: Salpetrige Säure als Reduktionsmittel ... 156
Versuch 16: Reduktion der Salpetersäure zu Salpetriger Säure... 157
Versuch 17: Reaktion der Salpetersäure mit organischen Verbindungen ... 159
Versuch 18: Darstellung rauchender Salpetersäure ... 161
Versuch 19: Katalytische Verbrennung des Ammoniaks nach dem Ostwaldverfahren163 Versuch 20: Sauerstoffnachweis in Nitraten... 166
Versuch 21: Bestimmung das Nitratgehalts in Flüssigdünger nach Kjeldahl ... 167
Didaktische Analyse zu den Versuchen 15-21 ... 171
2.6 Düngemittel... 173
Versuch 22: Herstellung eines Ammoniumsulfat-Düngers... 173
Didaktische Analyse zu dem Versuch 22 ... 176
2.7 Stickstoffkreislauf ... 177
Versuch 23: Tätigkeit der nitrifizierenden Bakterien... 177
Versuch 24: Bestimmung der Nitrat-Reduktase in Primärblättern von 8-10 Tage alten Sojabohnen (Glycine max)... 181
Versuch 25: Darstellung von Glycin... 183
Versuch 26: Symbiotische N2-Fixierung durch Wurzelknöllchen von Sojabohnen (Glycine max) ... 189
Versuch 27: Ammoniak-Nachweis in Stallmist ... 191
Versuch 28: Stickstoffnachweis in organischen Verbindungen... 192
Didaktische Analyse der Versuche 23-28... 194
Inhaltsverzeichnis 5
TEIL D: ANHANG...196
Zusammenfassung ... 196
Gefahrenhinweise ... 197
Literaturverzeichnis ... 200
Abkürzungsverzeichnis 6
Abkürzungsverzeichnis
Acetyl-CoA Acetyl-Coenzym-A
ADP Adenosindiphosphat
amu atomare Masseneinheit
ATP Adenosintriphosphat
Cyt-b557 Cytochron-b-Typ
E0 Reduktionspotential
e- Elektron
FAD Flavinadenindinukleotid
L Liter
MAK maximale Arbeitsplatzkonzentration
MO Molekülorbitaltheorie
Ox´stufe Oxidationsstufe
ppm parts per million
rpm revolutions per minute
NADH Nicotinamidadenindinukleotid
NADPH Nicotinamidadenindinukleotidphosphat
Einleitung 7
Einleitung
Wenn Menschen das Wort Stickstoff hören, denken viele, dass es sich um etwas Giftiges handelt. Wenn man von der Wortbedeutung ausgeht - ein erstickender Stoff - kann man verstehen, dass einige zu so einer Überlegung kommen. Den wenigsten ist es bewusst, dass Stickstoff eigentlich überall zu finden ist. Wir befinden uns die ganze Zeit in ihm, da er zu 78,09 Volumenprozent[1] (s. Versuch 1: Quantitativer Nachweis des Luftstickstoffs) elementar in der Luft vorhanden ist. Dies ist der größte Teil des auf der Erde vorkommenden Stickstoffs. In gebundenen Zustand ist er sogar in uns Menschen bzw. in allen Lebewesen enthalten. Man findet ihn in Eiweißstoffen. Wir sind darauf angewiesen aus tierischer oder pflanzlicher Nahrung gebundenen Stickstoff in uns aufzunehmen, da er in einer Reihe für uns Menschen essentieller Aminosäuren enthalten ist.
Den größten Teil des gebunden Stickstoffs findet man allerdings in Form von Nitraten, z.B. in großen Lagerstätten in Chile, in denen der sogenannte Chilesalpeter (NaNO3) vorkommt, oder in Indien als Salpeter (KNO3) vorkommt.[1]
Diese wissenschaftliche Hausarbeit beginnt im ersten Kapitel mit dem elementaren Stickstoff. In den weiteren Kapiteln wird auf die technischen Prozesse der Stickstofffixierung eingegangen, z.B. die Darstellung von Ammoniak, einiger Stickoxide, Salpetersäure und Düngemitteln. Im letzten Kapitel wird der Stickstoffkreislauf behandelt.
Teil A: Theorie Elementarer Stickstoff 8
Teil A: Theorie
1. Elementarer Stickstoff
1.1 Physikalische Eigenschaften
Stickstoff steht im „Periodensystem der Elemente“ in der 15. Gruppe mit der Ordnungszahl 7, eine Atommasse von 14 amu und ist ein Nichtmetall. Die Elektronenkonfiguration ist [He]2s22p3 [2]. Bei Normalbedingungen ist Stickstoff ein farb-, geschmack- und geruchloses Gas, das in Form von Distickstoff (N2) vorliegt. Die Dicht von N2 beträgt 1,25046 g/L bei 0 °C, 101,3 k/Pa und 45° geographischer Breite. Sie ist daher geringer als die von Luft (1,2928 g/L), weil Sauerstoff noch mit einer höheren Masse von 1,42895 g/L dazu kommt. Der Siedepunkt des farblosen flüssigen Stickstoffs liegt bei -195,82 °C, der Schmelzpunkt des farblosen festen Stickstoffs bei - 209,99 °C. Im Festkörper bilden die N2-Moleküle eine hexagonal-dichteste Kugelpackung (β-N2).. Bei -237,54 °C existiert noch eine kubisch-dichteste Packung (α-N2). Der Abstand zwischen den beiden Stickstoffatomen beträgt 1,0974 Å und die Dissozationsenergie 945,33 kJ/mol. Teilt man nun diesen Wert auf drei Bindungen auf, hat jede Bindung eine durchschnittliche Dissozationsenergie von 315,11 kJ/mol. Vergleicht man diese mit einer Stickstoff-Wasserstoffbindung, ist sie geringer, da N-H-Bindungen eine Dissozationsenergie von 391 kJ/mol[24] haben. Daraus folgt, dass Stickstoff in Umgebung mit H2 keine thermodynamische Stabilität aufweist, sondern nur kinetische Inertheit.
Stickstoff ist in Wasser halb so gut löslich wie Sauerstoff bei gleichem Druck.
In einem Liter 0 °C kaltem Wasser lösen sich 23,2 cm3 Stickstoff, aber 49,1 cm3 Sauerstoff. Daraus resultiert, dass die vom Wasser ausgetriebene Luft sauerstoffreicher (O2:N2= 1:2), als die atmosphärische Luft (O2:N2 = 1:4) ist. Der Hohe Sauerstoffanteil in Wasser ist von Wichtigkeit für die Atmung der Fische.[3]
Teil A: Theorie Elementarer Stickstoff 9 1.2 Entdeckung und Namensgebung
1772 wurde der Stickstoff von dem englischen Privatgelehrten Henry Cavendish entdeckt, der Luft in einer Apparatur über glühende Holzkohle leitete und das entstandene Kohlenstoffdioxid in Ätzkali (KOH) auffing.
Dabei stellte er fest, dass ein Gas übrig blieb, welches Verbrennungen nicht unterhalten konnte und ein kleineres spezifisches Gewicht als Luft hatte.
Damit hatte er den Stickstoff entdeckt, jedoch kam ihm der schottische Botaniker Daniel Rutherford bei der Publikation zuvor, der im Rahmen einer medizinischen Doktorarbeit eine Reihe von Experimenten durchgeführt hatte.
Er hatte im inneren einer pneumatischen Wanne eine Maus, vom äußeren Luftraum abgeschlossen, gehalten. Die Maus atmete den in der Luft befindlichen Sauerstoff. Das von der Maus bei der Atmung ausgestoßene Kohlenstoffdioxid absorbierte er. Am Ende verblieb eine „Luft“ in der pneumatischen Wanne, die die Maus ersticken lies und die auch keine Verbrennung unterhielt.[4]
Antoine Laurent Lavoisier gab dieser „Luft“ den Namen „Azote“, von ατζωτικος (griech.) „das Leben nicht unterhaltend“. Der deutsche Name bezieht sich auf die gleiche Eigenschaft.[5]
Abbildung 1 Antoine-Laurent Lavoisier (*1743, †1794).[6]
1.3 Physiologisches
Auf alle höheren Lebewesen hat Stickstoff keine wahrnehmbare toxische Wirkung, da die erstickende Wirkung auf Sauerstoffmangel zurück zu führen ist. Im Gegenteil dazu ist er für alle essentiell, da er Bestandteil von Proteinen, Nucleinsäuren und vieler Coenzyme ist.[3]
Teil A: Theorie Elementarer Stickstoff 10 1.4 Chemische Eigenschaften
• Redox-Reaktionen
Stickstoff ist nicht brennbar und unterhält auch keine Verbrennung (s.
Versuch 2: Identifizierung des elementaren Stickstoffs).
Durch die Dreifachbindung im N2-Molekül ist Stickstoff sehr reaktionsträge („inertes“ Gas). Deswegen ist der elementare Stickstoff auch die stabilste unter den Stickstoffverbindungen. Wie bereits erwähnt, braucht man eine Dissozationsenergie von +945,33 kJ/mol um die beiden Stickstoffatome voneinander zu trennen.
Hieraus resultiert, dass die meisten Reaktionsprozesse mit Stickstoff endotherme Prozesse sind, da exotherme Prozesse meist gehemmt sind.
Stickstoff geht mit vielen Nichtmetallen und Metallen bei hohen Reaktionstemperaturen Verbindungen zu Nitriden ein. Die Alkali- und Erdalkalimetalle reagieren leicht und vollständig mit Stickstoff, Lithium schon bei Raumtemperatur.
3 Mg(s) + N2(g) Mg3N2(s) ΔRH = - 461,55 kJ
0 0 +2 -3
6 Li0 (s) + N02(g) 2 Li+1 -33N ΔRH = - 395 kJ Schema 1 Bildung von Nitriden aus Magnesium und Lithium.
Bei Hitze verbinden sich aber auch Metalle wie Aluminium, Titan, Vanadium und Chrom direkt mit Stickstoff zu Nitriden.
Die wichtigsten Reaktionen des Stickstoffs mit Nichtmetallen sind die mit Wasserstoff und Sauerstoff, auf die in den Abschnitten 2, 3 und 4 genauer eingegangen wird.[3]
• Säure-Base-Reaktionen
Stickstoff ist auch zu Reaktionen mit einigen Übergangsmetallen fähig, mit denen er dann Stickstoffkomplexe eingeht. Eine Ruthenium(II)-Verbindung reagiert bei Raumtemperatur unter Bildung eines Komplexes mit Stickstoff, der unter Bildung eines weiteren Komplexes weiteren Stickstoff aufnimmt.
Teil A: Theorie Elementarer Stickstoff 11
2 [Ru(NH3)5(H2O)]2+ + N2 (1 bar)
- 2 H2O [{NH3)5Ru}2N2]4+ N2(Druck) 2 [(NH3)5RuN2]2+
Schema 2 Bildung eines Stickstoffkomplexes mit Ruthenium
Die Bildung von Stickstoffkomplexen stellt einen wichtigen Teil der Stickstofffixierung dar.[7]
1.5 Struktur des N2-Moleküls
Bei Raumtemperatur ist Stickstoff ein Gas und besteht aus N2-Molekülen, die über eine Dreifachbindung miteinander verbunden sind. Hierdurch wird von beiden Stickstoffatomen ein Elektronenoktett erreicht.
N N
Abbildung 2 Lewis-Formel des N2-Moleküls.
Aus der Lewis-Formel geht nicht hervor, dass die drei Bindungen nicht gleichartig sind. Dies lässt sich jedoch gut erkennen, wenn man die an der Bindung beteiligten überlappenden Atom-Orbitale betrachtet. Schaut man die Valenzelektronenkonfiguration, stehen zur Bindung jedem Stickstoffatom drei einfach besetzte p-Orbitale zur Verfügung.
2s
2py 2px 2pz
Hybridisierung
2sp
2p
Schema 3 Valenzelektronenkonfiguration des N2-Moleküls.
Durch Überlappung der beiden sp-Hybridorbitale, die in Richtung der Molekülachse liegen, kommt es zu einer σ-Bindung.
Teil A: Theorie Elementarer Stickstoff 12
z z
y y
x σ-Bindung
π2 π2
π1
π1
Abbildung 3 Schematische Darstellung der Bindungssituation.
Die Bindungssituation lässt sich anhand der MO-Theorie erklären.
2s 2s
2py 2px
σb2s σ∗ 2s πby2p π∗y 2p
πbz2p π∗z 2p
σbx 2p σ∗x 2p
2pz
2py 2pz 2px
Energie
Atomorbitale des N-Atoms Atomorbitale
des N-Atoms
Molekülorbitale des N2-Moleküls
Abbildung 4 Energieniveauschema des N2-Moleküls.[8]
Teil A: Theorie Elementarer Stickstoff 13 Die π-Bindungen kommen durch eine Überlappung der senkrecht zur Molekülachse stehenden py- und pz-Orbitale zustande.
z z
x y y
Abbildung 5 π-Bindung in der xz-Ebene.
z z
x y y
Abbildung 6 π-Bindung in der xy-Ebene.
Die Dreifachbindung im N2-Molekül besteht also aus einer σ-Bindung und zwei π-Bindungen. Hierdurch kommt die hohe Dissozationsenergie von 945,33 kJ/mol[3] zustande.
Die beiden π-Bindungen sind hierbei senkrecht zueinander orientiert. [9]
N2 2 N ΔH° = 945,33 kJ/mol Schema 4 Dissozationsenergie von N2.
1.6 Darstellung von Stickstoff
Großtechnisch wird Stickstoff, neben Sauerstoff und Edelgasen, durch Verflüssigung der Luft, das Linde-Verfahren, gewonnen.
Teil A: Theorie Elementarer Stickstoff 14
Abbildung 7 Schematische Darstellung der Luftverflüssigung nach Linde.[10]
Hierbei wird Luft aus der Umgebung angesaugt, durch einen Verdichter auf 200 bar komprimiert und durch einen Kühler vorgekühlt. Diese abgekühlte Luft wir durch ein Drosselventil wieder auf den ursprünglichen Atmosphärendruck entspannt, wodurch eine Abkühlung stattfindet. Die abgekühlte Luft strömt im Gegenstrom-Wärmeaustauscher der nachkommenden, auch komprimierten Luft entgegen. Dadurch wird auch diese wieder abgekühlt und gelangt so kälter zum Drosselventil als die vorhergehende. Durch ständiges Wiederholen des Vorgangs wird die Luft so weit abgekühlt, bis sie sich schließlich verflüssigt.[11]
Dieses Prinzip beruht auf dem Joule-Thomsen-Effekt. Dehnt sich ein komprimiertes Gas aus wird es dabei abgekühlt. Um die Anziehungskraft zwischen den Gasteilchen zu überwinden, muss bei der Ausdehnung Arbeit geleistet werden, die aus der inneren Energie des Gases entnommen wird.
Hierdurch nimmt die kinetische Energie und damit die Temperatur ab. Nur bei idealen Gasen sind keine Anziehungskräfte zwischen den Gasteilchen vorhanden. Luft verhält sich unter Normalbedingungen wie ein ideales Gas, wird sie aber komprimiert, können die Anziehungskräfte zwischen den Gasteilchen nicht mehr vernachlässigt werden.[12]
Es gilt die Faustregel nach Gleichung 1, dass sich die Luft je Bar Druckunterschied um ¼ °C abkühlt.[13]
Teil A: Theorie Elementarer Stickstoff 15
( )
2. . 273
Anfang Ende Anfang Ende 273
Anfang
t t p p C
C t
μ ⎛ ° ⎞
− = − ⎜⎜⎝ ° + ⎟⎟⎠
Gleichung 1 Berechnung der Luftabkühlung (tAnfang = Anfangstemperatur in °C, tEnde = Endtemperatur in °C, pAnfang = Anfangsdruck in bar, pEnde = Endruck in bar, μ = ¼ Grad pro
bar bei nicht zu hohen Werten von tAnfang.
Durch fraktionierte Destillation lässt sich die flüssige Luft in ihre Hauptbestandteile Stickstoff und Sauerstoff trennen. Dies geschieht großtechnisch in Fraktionierkolonnen, in denen die einzelnen Stufen der Kondensation und Wiederverdampfung erfolgen.
Abbildung 8 Phasendiagramm von Luft.[14]
Flüssige Luft siedet bei -194 °C. Stickstoff ist hier die tiefer siedende Komponente und ist daher im entstandenen Dampf stärker angereichert als Sauerstoff. Durch wiederholendes Verdampfen erhält man reinen Sauerstoff im Destillationsrückstand und reinen Stickstoff im flüchtigen Destillat.[12]
Bei einer Methode der chemischen Stickstoffgewinnung aus der Luft, die heute keine Bedeutung mehr hat, wird Kohle als Sauerstoffbindendes Mittel benutzt. Hierbei wird die Kohle verbrannt. Dabei entsteht Kohlenstoffdioxid und der in der Luft vorhandene Stickstoff bleibt erhalten.
Teil A: Theorie Elementarer Stickstoff 16 4 N2(g) + O2(g) + C(s) 4 N2(g) + CO2(g)
Schema 5 Entfernung des Luftsauerstoffs durch Kohlenstoff.
Kohlenstoffdioxid lässt sich durch eine Behandlung mit Kaliumcarbonat- Lösung,
K2CO3(aq) + CO2(g) + H2O 2 KHCO3(aq) Schema 6 Auswaschen von Kohlenstoffdioxid.
oder unter Druck mit Wasser leicht auswaschen.
Ist zu wenig Luft vorhanden, verbrennt die Kohle nur zu Kohlenstoffmonoxid.
4 N2(g) + O2(g) + 2 C 4 N2(g) + 2 CO Schema 7 Generatorgas-Gleichgewicht.
Das so gewonnene Gemisch wird als „Generatorgas“ bezeichnet und spielte in der Ammoniak-Darstellung eine wichtige Rolle, die in Abschnitt 2.5 beschrieben wird. Der große Nachteil an diesen Verfahren ist, dass man keinen reinen Stickstoff erhält, weil man durch die in der Luft befindlichen Edelgase edelgashaltigen Stickstoff erhält.
Reiner Stickstoff wird aus Stickstoffverbindungen gewonnen. Hierzu wird durch mischen von Lösungen von Ammoniumchlorid und Natirumnitrit Ammoniumnitrit (s. Versuch 3: Stickstoffdarstellung aus Ammoniumnitrit) gewonnen, das dann auf 70 °C erwärmt wird. Dabei entsteht Stickstoff und Wasser.[15]
2 NaNO2(aq) + (NH4)2SO4(aq) 2 NH4NO2(aq) + NaSO4(aq)
NH4NO2(aq) H2O + N2(g)
Schema 8 Darstellung von Stickstoff aus Ammoniumnitrit.
Ein anderes Verfahren, um reinen Stickstoff zu erhalten, ist die thermische Zersetzung von Natriumazid.[16]
2 NaN3(s) 300° C 3 N2(g) + 2 Na(l) Schema 9 Thermische Zersetzung von Natriumazid.
Teil A: Theorie Elementarer Stickstoff 17 Im Labor wird jedoch nicht wie in der Technik Kohle als sauerstoffbindendes Mittel benutzt, sonder Kupfer (s. Versuch 4: Stickstoffgewinnung aus der Luft). Hierbei wird Luft über glühendes Kupfer geleitet.
2 Cu(s) + O2(g) + N2(g) 2 CuO(s) + N2(g) Schema 10 Stickstoffgewinnung aus der Luft.
Auch hier wird wieder edelgashaltiger Stickstoff erhalten.[15]
1.7 Verwendung des elementarem Stickstoff
Durch seine Eigenschaft als inertes Gas wird Stickstoff bei vielen chemischen Reaktionen, bei denen die Substanzen nicht mit Luftsauerstoff oder Wasser in Berührung kommen dürfen, als Schutzgas benutzt. Bei Reaktionen mit Lithium kann Stickstoff nicht als Schutzgas verwendet werden, da Lithium wie bereits erwähnt, bereits bei Raumtemperatur mit Stickstoff reagiert.
Für die Herstellung von Chemikalien wie Ammoniak, Stickstoffoxiden, Salpetersäure, Cyaniden, Amiden und Nitriden ist er essentiell.
In flüssiger Form wird er zum schnellen örtlichen Gefrieren von Gewebsteilen bei einer Augen- oder Hirnoperation, zur Konservierung biologischen Materials (Blut, Samen), in der Chemie als Kühlmittel oder zum raschen Einfrieren von Lebensmitteln genutzt.[17]
Teil A: Theorie Ammoniak (NH3) 18
2. Ammoniak (NH3)
2.1 Physikalische Eigenschaften
Ammoniak ist ein farbloses Gas mit einem stechenden, zu Tränen reizenden Geruch. Der Siedepunkt von flüssigem Ammoniak liegt bei -33,34 °C und der Schmelzpunkt von festem Ammoniak bei -77,76 °C. Im festen Zustand liegt er in farblosen, durchscheinenden Kristallen vor.
In Wasser ist Ammoniak im Gegensatz zu Stickstoff wegen der ausgebildeten Wasserstoffbrücken-Bindungen sehr gut löslich (s. Versuch 5:
Ammoniakspringbrunnen). 1 L Wasser löst bei 0 °C 1176 L Ammoniak und bei 20 °C noch 702 L, dies entspricht einer 35%igen Lösung, die schwach sauer reagiert.[18]
2.2 Physiologisches
Bereits geringe Mengen von 20 ppm NH3 werden vom Menschen wahrgenommen. 100 ppm reizen Augen und Lungenwege. 1,5 – 2,5 g NH3
pro m3 Luft wirken tödlich.
Gelangt Ammoniak in den Magen, verursacht er dort Blutungen und einen Kollaps. Als Gegenmittel dienen Essig-, Wein- oder Zitronensäure.[18]
2.3 Struktur von Ammoniak
Wegen der Valenzelektronenkonfiguration 2s22p3 kann Stickstoff drei kovalente Bindungen eingehen.[19] Die Struktur kann mit dem VSEPR- Konzept erklärt werden. Ammoniak ist tetraedrisch gebaut, damit das freie Elektronenpaar eine Position einnimmt, bei der die Wechselwirkung mit den bindenden Elektronenpaaren so gering wie möglich ist. Dies entspricht einer sp3-Hybridisierung. Der Bindungswinkel beträgt 107°.[20] Drei der vier sp3- Hybridorbitalen des Stickstoffs bilden mit den 1s-Orbitalen des Wasserstoffs σ-Bindungen. Der H-N-H-Bindungswinkel von 107° liegt an dem höheren Raumbedarf des freien Elektronenpaars.
Teil A: Theorie Ammoniak (NH3) 19
N H H H
Abbildung 9 Lewis-Formel des Ammoniaks.
Die Lewis-Formel gibt aber die räumliche Anordnung des Moleküls nicht wieder, hierfür ist die 3D-Ansicht besser geeignet.[19]
N
H H H
Abbildung 10 Räumliche Struktur des Ammoniak-Moleküls.
Die drei Wasserstoffatome schwingen in dem Molekül hin und her. Man bezeichnet diesen Vorgang als Pseudorotation, weil hier Eduktmoleküle durch Aneinandervorbeischwingen von Atomen oder Atomgruppen in Produktmoleküle übergehen. Im Falle des Ammoniaks spricht man auch von
„pyramidaler Inversion“.[21]
N
H H
H
N H H
H N
H H H
planare Übergangsstufe
Schema 11 Pyramidale Inversion des Ammoniaks.
2.4 Chemische Eigenschaften
• Stabilität
Bei Normaltemperatur ist Ammoniak stabil, aber beim Erwärmen in Gegenwart von Katalysatoren, Belichten mit ultraviolettem Licht oder bei elektrischer Entladung zerfällt er in die Elemente.
2 NH3(g) N2(g) + H2(g) ΔRH = + 92,28 kJ Schema 12 Ammoniakzerfall in die Elemente.
Die NH-Dissozationsenergie beträgt 435 kJ/mol.[22]
Teil A: Theorie Ammoniak (NH3) 20
• Reduktionswirkung
In Luft läst sich Ammoniak zwar entzünden, brennt aber nicht. Durch Katalysatoren verbrennt Ammoniak aber schon bei Temperaturen von 300 bis 500 °C in Luft zu Stickoxiden, wovon im Ostwald-Verfahren (Salpetersäure-Herstellung) Gebrauch gemacht wird (s. Abschnitt 5.5.5).
4 NH3(g) + 5 O2(g) 4 NO(g) + 6 H2O(g) ΔRH = -906,11 kJ Schema 13 Umsetzung von Ammoniak mit Luftsauerstoff.
Bei wesentlich höheren Temperaturen verbrennt Ammoniak in reinem Sauerstoff mit fahlgelber Flamme zu Stickstoff und Wasser.
4 NH3(g) + 3 O2(g) 2 N2(g) + 6 H2O(g) ΔRH = -1267,3 kJ Schema 14 Umsetzung von Ammoniak mit reinem Sauerstoff.
Diese Ammoniak-Sauerstoff-Gemische sind bei hohem Druck explosiv.[22]
Auch durch andere starke Oxidationsmittel wie z.B.
Wasserstoffperoxid, Kaliumpermanganat oder Chlor wird Ammoniak leicht zu Stickstoff oxidiert. Leitet man Chlor in gasförmigen Ammoniak oder in eine konzentrierte Ammoniak-Lösung ein, entzündet sich der Ammoniak unter Bildung von Stickstoff und Chlorwasserstoff.[22]
2 NH3(g) + 3 Cl2(g) N2(g) + 6 HCl(g) ΔRH = -461,93 kJ Schema 15 Umsetzung von Ammoniak mit Chlor.
• Oxidations- und Säurewirkung
Eine sehr schwache Oxidations- bzw. Säurewirkung kommt durch die Reaktion des Ammoniaks mit Metallen zum Ausdruck, in dem die Wasserstoffatome durch Metallatome (M) ersetzt werden. Hierdurch entstehen Amide MNH2, Imide M2NH und Nitride M3N.
Bsp. Bildung von Natriumamid:
Teil A: Theorie Ammoniak (NH3) 21 2 Na(s) + 2 NH3(g) 2 NaNH2(s)+ H2(g)
Schema 16 Bildung von Natriumamid.
Beim Erhitzen gehen die Amide der Eralkalimetalle in Imide über und bei stärkerem Erhitzen in Nitride, wobei Ammoniakgas abgespalten wird.
Mg(NH2)2(s) Δ MgNH(g) + NH3(g) 3 MgNH(s) Δ Mg3N2(s) + NH3(g)
Schema 17 Bildung von Magnesiumnitrid aus Magnesiumamid.
Das in den Amiden enthaltene Anion NH2- ist isoelektronisch mit H2O, das in den Imiden NH2- zu OH- und das in den Nitriden N3- zu O2-. Deswegen werden Amide, Imide und Nitride in Wasser sofort zu NH3(aq) und Metallhydroxid zersetzt.[22]
• Basewirkung
Charakteristisch für Ammoniak ist die Wirkung als Brønsted-Base.
Löst man Ammoniak im Wasser bilden sich Ammonium-Ionen, da Ammoniak ein Proton aufnimmt. Die Lösung reagiert hierdurch leicht basisch.
NH3(g) + H2O NH4+(aq) + OH-(aq)
Schema 18 Basenwirkung von Ammoniak in Wasser.
Das Gleichgewicht liegt fast vollständig auf der linken Seite, daher kann man durch Einwirken von Basen (OH-) auf Ammoniumverbindungen Ammoniak erzeugen. Die Gleichgewichtskonstante bei 25 °C hat den Wert
) 75 , 4 pK ( 10 78 , c 1
c
K c . 5 B
NH OH . NH B
3
4 = =
= + − − .
Gleichung 2 pKB-Wert von Ammoniak.
Hieraus resultiert, dass in einer 0,1 molaren wässrige Ammoniak- Lösung weniger als 1 % NH3 dissoziiert ist, während eine
Teil A: Theorie Ammoniak (NH3) 22 Kaliumhydroxid-Lösung von gleicher Konzentration vollständig ionisiert ist.
Daraus ergibt sich, dass es kein undissoziiertes Ammoniumhydroxid (NH4)OH geben kann, sondern dies immer als Ammoniak-Hydrat vorliegt.
Ein sehr starkes basisches Verhalten hat Ammoniak gegenüber starken Säuren. Ammoniakgas reagiert heftig mit Chlorwasserstoff zu Ammoniumchlorid, das als weißer Nebel zu sehen ist.
NH3(g) + HCl(g) NH4Cl(s) Schema 19 Bildung von Ammoniumchlorid.
Das gleiche spielt sich auch in wässriger Lösung ab.
Mit Schwefelsäure bildet Ammoniak Ammoniumsulfat (NH4)2SO4 und mit Salpetersäure Ammoniumnitrat (NH4NO3). Das Gleichgewicht liegt auf der Seite der Ammoniumverbindungen, wird aber bei Erwärmen auf 300 °C auf die Seite des Ammoniaks verschoben, so dass die Ammoniumsalze unter zwischenzeitlicher Dissoziation sublimieren.[22]
2.5 Darstellung von Ammoniak
Im Labor gewinnt man Ammoniak aus Ammoniumchlorid und Calciumhydroxid (s. Versuch 6: Darstellung von Ammoniak aus Ammoniumsalzen),
2 NH4Cl(aq) + Ca(OH)2(aq) 2 NH3(g) + CaCl2(aq) + 2 H2O
Schema 20 Darstellung von Ammoniak aus Ammoniumsalzen.
oder durch die Reduktion von verdünnter Salpetersäure mit Natriumhydroxid- Lösung durch Zink (s. Versuch 7: Reduktion von Salpetersäure zu Ammoniak).
Teil A: Theorie Ammoniak (NH3) 23 HNO3(aq) + 4 Zn(s) + 8 NaOH(aq) + 5 H2O
4 Na2[Zn(OH)4] + NH3(g)
Schema 21 Reduktion von Salpetersäure zu Ammoniak.
Großtechnisch wird Ammoniak aus den Elementen mit dem Haber-Bosch- Verfahren gewonnen (s. Versuch 8: Haber-Bosch-Synthese im Reagenzglas).
3 H2(g) + N2(g) 500 °C, 200 bar, <Kat.> 2 NH3(g) Schema 22 Haber-Bosch-Synthese.
Aus nachfolgender Rechnung geht hervor, dass es sich bei der Ammoniak- Synthese um eine exotherme Reaktion handelt.[23]
N N 2 N ; ΔH = + 945 kJ/mol 3 H H 6 H ; ΔH = 3 . (+ 436 kJ/mol)
2 N + 6 H 2 NH3 ; ΔH = 6 . (- 391 kJ/mol) ΔHf = - 93 kJ/mol
Schema 23 Berechnung der Reaktionsenthalpie der Ammoniaksynthese nach einem Born- Haber-Kreisprozess. [24]
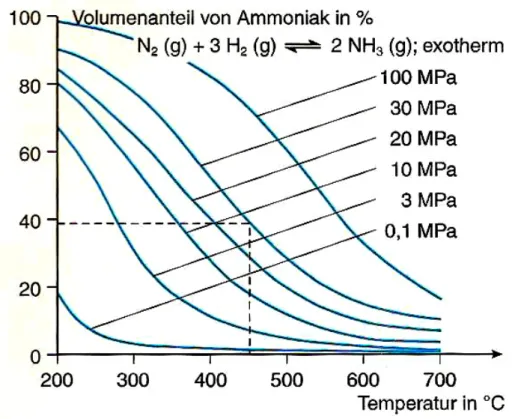
Da die Reaktion exotherm ist, verschiebt sich das Gleichgewicht dieser Reaktion gemäß dem Prinzip des kleinsten Zwangs mit fallender Temperatur (s. Versuch 9: Gleichgewichtslage bei der Ammoniaksynthese) und mit steigendem Druck nach rechts.
Teil A: Theorie Ammoniak (NH3) 24
Abbildung 11 Volumenanteil von Ammoniak im Gleichgewicht bei verschiedenen Temperaturen und Drücken.[25]
Da bei Zimmertemperatur die Geschwindigkeit der Umsetzung unmessbar klein ist (Aktivierungsenergie: 230 kJ/mol) und auch Katalysatoren erst bei mind. 400 °C beschleunigend auf die Reaktion wirken, ist man gezwungen bei Temperaturen von mind. 400 °C und einem hohen Druck von 200 bar zu arbeiten. Hierdurch erreicht man eine Ausbeute von ca. 18 %.[23]
Den für die Reaktion erforderlichen Stickstoff gewinnt man heute aus dem Linde-Verfahren, auf das in Abschnitt 1.6 genauer eingegangen wurde. Der Wasserstoff wird aus Spaltgas, bei dem Kohlenwasserstoffe (Erdöl, Erdgas) mit Wasser bei hohen Temperaturen umgesetzt werden, gewonnen. Man nennt dieses Verfahren Steam-Reforming.
CnH2m + n H2O (n + m) H2(g) + n CO(g) Schema 24 Steam-Reforming.
Das gebildete Kohlenstoffmonoxid wird unter weiterer Bildung von Wasserstoff zu Kohlenstoffdioxid umgesetzt, da CO den Katalysator in der Haber-Bosch-Synthese zerstören kann.
Teil A: Theorie Ammoniak (NH3) 25 CO(g) + H2O CO2(g) + H2(g)
Schema 25 Umsetzung von Kohlenstoffmonoxid mit Wasser.
Früher wurden die Ausgangsstoffe aus der Luft bzw. aus dem Wasser gewonnen. In beiden Fällen wurde Koks bei hohen Temperaturen genutzt, um den Sauerstoff aus der Luft bzw. aus dem Wasser zu entfernen.
4 N2(g)/O2(g) + 2 C(s) 2 CO(g) + 4 N2(g) Generatorgas C(g) + H2O(g) CO(g) + H2(g) Wassergas
Schema 26 Generatorgas- und Wassergas-Gleichgewicht.
Für die Ammoniak-Synthese gibt es zwei unterschiedliche Reaktoren, die aus meterdicken Stahlrohren sind.
Abbildung 12 Kontaktöfen für die NH3-Synthese.[26]
Im Röhrenreaktor sind die Wärmeaustauscherrohre mit mehreren Tonnen Katalysator (Kontaktmasse) umgeben. Im Vollraumreaktor ist der Katalysator durch mehrere übereinander liegende Wärmeaustauscher in schichten getrennt. Die Synthese erfolgt bei 500 °C und 200 bar. Die Zusammensetzung des Katalysators besteht aus Fe2O3, mit geringen Mengen Al2O3, K2O, MgO
Teil A: Theorie Ammoniak (NH3) 26 und CaO. Der eigentliche Katalysator, α- Eisen, bildet sich erst in der Anfahrphase durch Reduktion des Eisenoxids mit H2 bei 400 °C. Das bereits gebildete Ammoniakgas gibt dem in den Wärmeaustauscherrohren befindlichen Gas seine Reaktionswärme ab, wodurch dieses vorgewärmt in den Kontaktraum gelangt. Dort vollzieht sich unter Wärmeentwicklung die Ammoniaksynthese. Daher ist keine Zusatzheizung nötig. Weil der Kontakt zwischen Gas und Katalysator nur eine halbe Minute beträgt, wird nur eine Ausbeute von 11 % erzielt und nicht die volle Gleichgewichtsausbeute von 18 %. Das Ammoniak wird dem aus dem Ofen kommenden Gasgemisch durch Kühlung (Verflüssigung des Ammoniaks) bzw. durch Absorption mit Wasser („Ammoniakwäscher“) entfernt. Das Restgas wird dem Kontaktofen wieder zugeführt.[23]
Abbildung 13 Haber-Bosch-Verfahren (schematisch).[27]
2.6 Entwicklung der Haber-Bosch-Synthese
Schon im 19. Jahrhundert wurde erkannt, dass Stickstoffverbindungen für das Wachstum von Pflanzen essentiell sind. Als Düngemittel wurden daher Wasserstoff- und Sauerstoffverbindungen des Stickstoffs in Form von Ammoniumsalzen und Salpeter (KNO3) genutzt. Der steigende Bedarf von Stickstoffverbindungen ließ viele Chemiker versuchen, den in der Luft vorhandenen Stickstoff in eine Verbindung mit Wasserstoff zu bringen.
Deswegen wurde in 1903 in Norwegen eine Fabrik gebaut, in der die durch Wasserkraft gewonnene Energie genutzt wurde, um einen elektrischen Lichtbogen zu erzeugen, der bei 400 °C Luftstickstoff zu Stickstoffmonoxid oxidierte, das zu Salpetersäure verarbeitet wurde. Da dieses Verfahren aber zu viel Energie benötigte, wird es nicht mehr angewandt.
Teil A: Theorie Ammoniak (NH3) 27 In Deutschland wurde das Kalkstickstoff-Verfahren entwickelt, das bei Temperaturen von 1000 bis 1100 °C den Luftstickstoff mit Calciumcarbid (CaC2) zu Calciumcyanamid (CaCN2) und Kohlenstoff umsetzte.
Ebenfalls begann der Chemiker Fritz Haber unter Mitwirken von Alwin Mittasch und besonders Carl Bosch mit Versuchen im labortechnischen Maßstab. Zwischen 1903 und 1911 erforschte er die Möglichkeiten der Ammoniaksynthese und entwickelte 1913 ein großtechnisches Verfahren, das als Haber-Bosch-Verfahren bezeichnet wird. Dafür erhielt F. Haber 1918 den Nobelpreis für Chemie.
Abbildung 14 Fritz Haber *1868,
†1943.[28]
Abbildung 15 Carl Bosch *1874,
†1940.[28]
Er ermittelte zuerst die besten Reaktionsbedingungen um eine Umsetzung von Luftstickstoff mit Wasserstoff zu Ammoniak zu ermöglichen. Von Walther Nernst erhielt er die Anregung, die Ammoniak-Synthese durch Katalyse unter Hochdruck zu probieren. Als Katalysator benutzte er Platinfolie, fein verteiltes Eisen und Mangan. Das der Ammoniak-Synthese aus den Elementen bestimmte thermodynamische Grenzen gesetzt waren, wurde ihm Ende 1908 klar. Trotzdem gab Haber nicht auf und suchte nach anderen Wegen. Er überlegte, dass noch höhere Drücke angewendet werden mussten, wobei man die Gase, die dann unter Hockdruck stehen, im Kreislauf über den Katalysator leitet und Ammoniak unter Hochdruck abscheitet. Den Erfolg erhoffte er sich durch leistungsfähige Katalysatoren.
Interesse fand Haber bei dem Generaldirektor H. v. Brunck der badischen Anillin- und Sodafabrik (BASF), der ihm den technisch versierten Chemiker Carl Bosch als Mitarbeiter an die Seite stellte. Dieser unterstützte ihn als Erfinder technischer Anlagen. Gemeinsam fanden sie den geeigneten Katalysator aus Osmium und Uran, der bei Temperaturen zwischen 500 °C und 600 °C und Drücken von 10 bis 25 MPa eine größere
Teil A: Theorie Ammoniak (NH3) 28 Reaktionsgeschwindigkeit und eine Ausbeute von ca. 6 % ermöglichte.
Hierauf wurde Patent angemeldet und die BASF sicherte sich den Weltvorrat an Osmium für 400 000 Reichsmark.
Abbildung 16 Ammoniak-Kontaktofen um 1920.[28]
Die Suche nach anderen Stoffen, die zur Katalyse geeignet waren, ging aber weiter. Bis zum Jahre 1912 hatte Alwin Mittasch Versuche mit 6500 Katalysatoren und 2500 unterschiedlichen Kontaktstoffen unternommen. In 1919 betrug die Zahl der Versuche schon 10 000 und die der Kontaktstoffe 4000. Eisen, das Zusätze von Kalium- und Aluminiumoxid enthält, wurde nach dem oxydierenden Schmelzverfahren als geeigneter Katalysator entdeckt.
1911 wurde die erste kleine Versuchsanlage in Betrieb genommen. Als die Ausbeuten stiegen wurde in Oppau von der BASF eine Fabrik erbaut, die in 1915 mit der Produktion begann und eine Tagesammoniakproduktion von 100 t hatte, die durch Erweiterungen auf 35 000 t erhöht wurde.
Da man Ammoniak nicht nur als Dünger, sondern auch zur Salpetersäureherstellung und damit auch zur Herstellung von Explosivstoffen nutzen konnte, konnten die deutsche und die österreichische Regierung den
Teil A: Theorie Ammoniak (NH3) 29 ersten Weltkrieg fortsetzen. Nach Ende des Krieges diente das Haber-Bosch- Verfahren friedlichen Zwecken wie der Düngemittelherstellung.[28]
Teil A: Theorie Ammoniumsalze 30
3. Ammoniumsalze
Ammoniumsalze NH4nXn- (X- = Halogenid, Sulfat, Nitrat, Phosphat, Carbonat, usw.) ähneln in der Struktur, Radius (1,52 Å) und Hydratationsenthalpie (322 kJ) den Kaliumsalzen K+X-. Auch den Oxoniumsalzen (H3O+X-) sind sie sehr ähnlich. Dies ist im Einklang mit dem
„Grimmschen Hybridverschiebungsatz“, wonach Atome durch Aufnahme von n (n = 1,2,3,4) Wasserstoffatomen die Eigenschaften der im Periodensystem um n Ordnungszahl höheren Atome annehmen.[23]
3.1 Ammoniumchlorid (Salmiak)
NH4Cl ist ein farbloses, bitter schmeckendes Salz, das in Wasser gut löslich ist (100 g Wasser nehmen 37,2 g NH4Cl auf) und dort die Struktur angeordneter Oktaeder besitzt. Im Dampf kristallisiert es faserig aus. NH4Cl sublimiert sehr leicht wobei es (ΔH = 176,1 kJ/mol) in NH3 und HCl dissoziiert. Bei Raumtemperatur besitzt es die CsCl-Struktur. Oberhalb von 184,3 °C wandelt sich diese α-Form in die β-Form mit NaCl-Struktur um.
Da Ammoniumchlorid stark korrodierend wirkt, wird zur technischen Darstellung in korrosionsgeschützte Reaktionsgefäße (verbleit, gummiert, Glas oder mit Polyvinylchlorid überzogen) Ammoniakwasser und Salzsäure eingeleitet (s. Versuch 11: Bildung von Ammoniumchlorid).[23]
NH3(aq) + H3O+(aq) + Cl-(aq) NH4Cl(aq) + H2O Schema 27 Bildung von Ammoniumchlorid.
Teil A: Theorie Oxide des Stickstoffs 31
4. Oxide des Stickstoffs
Stickstoff bildet, wie in nachfolgender Tabelle gezeigt, Oxide der Formel NOn
(n = 1, 2, 3) und N2On (n = 1, 2, 3, 4, 5). Stickstoffmonoxid (NO) steht mit Distickstoffdioxid (N2O2), Stickstoffdioxid (NO2)mit Distickstofftetraoxid (N2O4) und Stickstofftrioxid (NO3) mit Stickstoffhexaoxid im Gleichgewicht.[29]
Tabelle 1 Stickstoffoxide. [30]
Oxidationsstufe des Stickstoffs
Oxide NOn Oxide N2On
+1 Distickstoffmonoxid
N2O +2 Stickstoffmonoxid
NO
Distickstoffdioxid N2O2
+3 Distickstoffdrioxid
N2O3
+4 Stickstoffdioxid NO2
Distickstofftetraoxid N2O4
+5 Distickstoffpentaoxid
N2O5
+5 Stickstoffdrioxid NO3
Distickstoffhexaoxid N2O6
Bei Raumtemperatur und einem Druck von 1 bar liegt Distickstofftetraoxid (N2O4) vor, der bei niedrigen Temperaturen größtenteils zu Stickstoffdioxid (NO2) dissoziiert.
N2O4(g) 2 NO2(g)
Schema 28 Dimerisierungsgleichgewicht von NO2.
Im Unterschied dazu liegt Distickstoffdioxid (N2O2) bei Zimmertemperatur ausschließlich als Stickstoffmonoxid (NO) vor, weil sich das Dissoziationsgleichgewicht erst bei sehr tiefen Temperaturen nach links verschiebt.
Teil A: Theorie Oxide des Stickstoffs 32 N2O2(g) 2 NO(g)
Schema 29 Dimerisierungsgleichgewicht von NO.
Distickstoffhexaoxid (N2O6) und dessen Dissoziationsprodukt Stickstofftrioxid (NO3) entstehen nur als reaktive Zwischenprodukte.
Distickstoffmonoxid (N2O), Stickstoffmonoxid (NO) und Stickstoffdioxid (NO2) gehören zu den Gasen, die einzeln isoliert wurden und seit der zweiten Hälfte des 18. Jahrhunderts bekannt sind. Zur allgemeinen Luftverunreinigung tragen die so genannten „Nitrosen Gase“ NOn wesentlich bei.[29]
Mit Ausnahme von Distickstofftetraoxid (N2O4) und Distickstoffpentaoxid (N2O5) sind alle Stickoxide endotherme Verbindungen. Alle Stickoxide sind jedoch endergone Verbindungen (ΔGf = positiv) und sollten daher bei Raumtemperatur aus thermodynamischen Gründen in die Elemente zerfallen.
Aus kinetischen Gründen erfolgt die Zersetzung erst beim Erwärmen.[30]
4.1 Distickstoffmonoxid N2O (Lachgas)
4.1.1 Physikalische Eigenschaften
Distickstoffmonoxid ist ein farbloses und diamagnetisches Gas mit leicht süßlichem Geruch. Bei -88,48 °C siedet es und bei -90,86 °C erstarrt es zu weißen Kristallen (ΔHf = +82,10, ΔGf = +104,2 kJ/mol). In flüssiger Form kommt es in Stahlflaschen in den Handel, da es schwach betäubende Wirkung hervorruft. Kleine eingeatmete Mengen reichen schon, um einen leichten Rausch und Lachkrämpfe auszulösen. Durch die Eigenschaft, Lachkrämpfe herbeizuführen, erhielt Distickstoffmonoxid seinen Trivialnamen „Lachgas“.
In einem Raumteil kaltem Wasser (0 °C) ist N2O mit 1,3052 Liter sehr gut löslich. In 25 °C warmen Wasser löst es sich noch mit 0,5962 Raumteilen. Da es sich außerdem gut in Fetten löst, wird es als Treib- und Lockerungsmittel für Schlagsahne und Speiseeis verwendet.[31]
Teil A: Theorie Oxide des Stickstoffs 33 4.1.2 Struktur von N2O
Der Valenzzustand von N2O ist:
N N O N N O
Schema 30 Valenzelektronenkonfiguration von N2O.
Es ist damit isoster mit CO2.
Der N-N-Abstand beträgt 1,126 Å. Dies liegt zwischen einer N-N- Doppelbindung (1,20 Å) und einer N-N-Dreifachbindung (1,10 Å). Der NO- Abstand beträgt 1,186 Å und liegt damit zwischen einer Einfachbindung (1,36 Å) und einer N-O-Doppelbindung (1,16 Å).[32]
4.1.3 Chemische Eigenschaften
Da N2O die Atmung nicht unterhält, muss bei Narkosen gleichzeitig Sauerstoff gegeben werden. Dagegen wird die Verbrennung leicht entzündlicher Stoffe lebhaft unterhalten. Phosphor, Schwefel, Kohle oder ein glimmender Holzspan verbrennen in N2O wie in Sauerstoff. Wegen des Stickstoffanteils reagieren Gemische aus N2O und Wasserstoff nicht ganz so heftig bei der Knallgasreaktion wie Gemische aus Sauerstoff und Wasserstoff.
N2O(g) + H2(g) N2(g) + H2O ΔRH = -1012,1 kJ Schema 31 Umsetzung von N2O mit H2.
Da N2O bei niedrigen Temperaturen beständig ist und erst bei Temperaturen von 600 °C in die Elemente zerfällt, sind Verbrennungen in N2O schwieriger einzuleiten als in Sauerstoff, weil N2O metastabil ist.
N2O(g) N2(g) + 0,5 O2(g) ΔRH = -82,10 kJ Schema 32 Zerfall von N2O in die Elemente.
Gemische aus N2O und NH3 explodieren heftig.
3 N2O(g) + 2 NH3(g) 4 N2(g) + 3 H2O ΔRH = -1012,1 kJ Schema 33 Explosion von N2O mit NH3.
Teil A: Theorie Oxide des Stickstoffs 34 Bei Raumtemperatur reagiert N2O nicht mit Sauerstoff, Ozon, Halogenen, Alkalimetallen und als Brønsted-Base. Als Lewis-Base kommt N2O in Distickstoffkomplexen vor.
[Ru(NH3)5(H2O)]2+(aq) + N2O(aq) [Ru(NH3)5(N2O)]2+(aq) + H2O
Schema 34 Reaktion von N2O als Lewis-Base.
Gegenüber starken Basen wirkt N2O als Lewis-Säure, wie z.B. bei der Umsetzung zu einem Azid.[32]
NH2-(aq) + N=N=O(aq) [H2N-N=N-O]-(aq) N=N=N-(aq) + H2O Schema 35 Reaktion von N2O als Lewis-Säure.
4.1.4 Darstellung von Distickstoffmonoxid (N2O)
In der Technik wird N2O durch vorsichtiges Erhitzen von Ammoniumnitrat (NH4NO3) zu Ammoniak (NH3) und Salpetersäure (HNO3) umgesetzt, die dann weiter zu Distickstoffmonoxid (N2O) und Wasser zerfallen, dargestellt.
NH4NO3(s) NH3(g) + HNO3(g) N2O(g) + 2 H2O Schema 36 Zersetzung von Ammoniumnitrat bei vorsichtigem Erhitzen.
Bei der Reaktion muss man darauf achten, dass die Temperatur nicht über 300 °C steigt, da Ammoniumnitrat sonst explosionsartig in N2O und Wasser zerfällt.
NH4NO3(s) N2O(g) + 2 H2O ΔRH = -124,1 kJ Schema 37 Zersetzung von Ammoniumnitrat bei über 300 °C.
Im Labor stellt man N2O durch die Umsetzung von Amidoschwefelsäure (H2NSO3H) mit konzentrierter Salpetersäure (HNO3),
H2NSO3H(aq) + HNO3(konz) N2O(g) + H2SO4(aq) +H2O Schema 38 Darstellung von N2O aus Amidoschwefelsäure.
durch Zersetzung von Hyposalpetrigersäure (H2N2O2) H2N2O2(aq) H2O + N2O(g) Schema 39 Zersetzung von Hyposalpetrigersäure.
Teil A: Theorie Oxide des Stickstoffs 35 oder durch die Reduktion Salpetriger Säure (HNO2) mit Hydroxylamin (NH2OH) dar.[33]
HNO+3 2(aq) + NH-1 2OH(aq) +1N2O(g) + 2 H2O
Schema 40 Reduktion von Salpetriger Säure mit Hydroxylamin.
4.2 Stickstoffmonoxid (NO)
4.2.1 Physikalische Eigenschaften
Stickstoffmonoxid ist ein farbloses, paramagnetisches, giftiges Gas (ΔHf = +90,31, ΔGf = +86,6 kJ/mol). Es lässt sich verdichtbar zu einer blauen Flüssigkeit verdichten, die bei -151,77 °C siedet und bei -163,65 °C erstarrt.
In einem Liter Wasser lösen sich nur 0,07 Liter NO.
Trotz des Radikalcharakters liegt das Dimerisierungsgleichgewicht zwischen Stickstoffmonoxid und Distickstoffdioxid auf der linken Seite.
2 NO(g) N2O2(g) ΔRH = -10,5 kJ Schema 41 Dimerisierungsgleichgewicht von NO.
Erst in flüssiger oder fester Form ist NO (diamagnetisch) weitgehend zu N2O2
dimerisiert, das dann ein Gemisch aus cis- und trans-Konformeren bildet. Die cis-Konformation ist hierbei die stabilere.
O
N N
O cis-Konformation
O
N N
trans-Konformation O
Abbildung 17 Konfomere von N2O2.
Bei der Kondensation von NO in Gegenwart von Säuren, wie HCl, SO2, BX3, SiF4, SnCl4, und TiCl4, bildet sich ein Konstitutionsisomer als roter Stoff.[34]
N O
O N
Abbildung 18 Konstitutionsisomer von N2O2.
Teil A: Theorie Oxide des Stickstoffs 36 4.2.2 Struktur von Stickstoffmonoxid (NO)
NO hat eine ungerade Elektronenzahl, was unter den Hauptgruppenoxiden nur noch bei NO2 und ClO2 vorkommt. Nach der Valenz-Bond-Theorie kann der Elektronenzustand wie in folgender Abbildung angeben werden. Der NO- Abstand von 1,14Å liegt zwischen einer Doppelbindung (1,16Å) und einer Dreifachbindung (1,06Å).
N O N O
Schema 42 Valenzelektronenkonfiguration von NO.
Die Bindungsverhältnisse des NO-Radikals (11 Valenzelektronen) lassen sich von dem in Abbildung 19 gezeigten MO-Schema erklären.[34]
Energie σ∗x
π∗y π∗z
πby πbz
σbx
2 p 2 p
2 s 2 s
σbs σ*s
Atomorbitale des N-Atoms
Atomorbitale des O-Atoms Molekülorbitale
des NO-Moleküls
Abbildung 19 Energieniveaudiagramm des NO-Moleküls.[35]
Teil A: Theorie Oxide des Stickstoffs 37 Vergleicht man dieses mit dem Energieniveaudiagramm des N2-Moleküls (s.
Abbildung 4), ist zu erkennen, dass nun ein antibindendes π-MO zusätzlich einfach besetzt ist. Hierdurch erklärt sich die Erniedrigung der Bindungsordnung. Im N2-Molekül ist diese 3 und im NO-Molekül 2,5. Die Bindungsordnung (BO) wird nach
- -
bindende e - antibindende e 2 = BO
Gleichung 3 Berechnung der Bindungsordnung.
berechnet.
Durch Abgabe oder Aufnahme eines Elektrons kann das NO-Molekül ein Teilchen mit gerader Elektronenanzahl werden. Gibt es ein Elektron ab, wird daraus ein Nitrosyl-Kation (NO+), nimmt es ein Elektron auf, wird daraus ein Nitroxyl-Anion (NO-).[34]
• Das Nitrosyl-Kation, in dem Stickstoff die Oxidationsstufe +3 hat, ist isoelektronisch mit CO, N2, CN- und C22-. Wie in der Lewisformel zu sehen ist, enthält es eine Dreifachbindung zwischen N und O mit einer Bindungslänge von 1,06Å.
N O
Abbildung 20 Nitrosyl-Kation.
• Das Nitroxyl-Anion, in dem Stickstoff die Oxidationsstufe +1 hat, ist isoelektronisch mit O2. In der Lewisformel ist zu erkennen, dass zwischen N und O eine Doppelbindung ist.[34]
N O
Abbildung 21 Nitroxyl-Anoin.
4.2.3 Physiologisches
Stickstoffmonoxid verursacht keine physiologische Reizwirkung, jedoch bewirkt es eine Oxidation des zweiwertigen Eisens im Hämoglobin zu

![Abbildung 7 Schematische Darstellung der Luftverflüssigung nach Linde. [10]](https://thumb-eu.123doks.com/thumbv2/1library_info/3958294.1535642/15.892.161.672.112.470/abbildung-schematische-darstellung-luftverflüssigung-linde.webp)
![Abbildung 8 Phasendiagramm von Luft. [ 14 ]](https://thumb-eu.123doks.com/thumbv2/1library_info/3958294.1535642/16.892.233.602.417.762/abbildung-phasendiagramm-von-luft.webp)
![Abbildung 12 Kontaktöfen für die NH 3 -Synthese. [ 26 ]](https://thumb-eu.123doks.com/thumbv2/1library_info/3958294.1535642/26.892.168.662.529.929/abbildung-kontaktöfen-nh-synthese.webp)
![Abbildung 13 Haber-Bosch-Verfahren (schematisch). [ 27 ]](https://thumb-eu.123doks.com/thumbv2/1library_info/3958294.1535642/27.892.162.684.485.677/abbildung-haber-bosch-verfahren-schematisch.webp)
![Abbildung 16 Ammoniak-Kontaktofen um 1920. [28]](https://thumb-eu.123doks.com/thumbv2/1library_info/3958294.1535642/29.892.273.564.196.633/abbildung-ammoniak-kontaktofen-um.webp)
![Abbildung 19 Energieniveaudiagramm des NO-Moleküls. [ 35 ]](https://thumb-eu.123doks.com/thumbv2/1library_info/3958294.1535642/37.892.203.639.469.1126/abbildung-energieniveaudiagramm-des-no-moleküls.webp)
![Abbildung 25 Energieniveaudiagramm des NO 2 -Moleküls. [ 41 ]](https://thumb-eu.123doks.com/thumbv2/1library_info/3958294.1535642/47.892.141.705.114.781/abbildung-energieniveaudiagramm-des-no-moleküls.webp)
![Tabelle 4 Oxide des Stickstoffs und die entsprechenden Säuren. [46]](https://thumb-eu.123doks.com/thumbv2/1library_info/3958294.1535642/56.892.144.697.176.375/tabelle-oxide-stickstoffs-entsprechenden-säuren.webp)