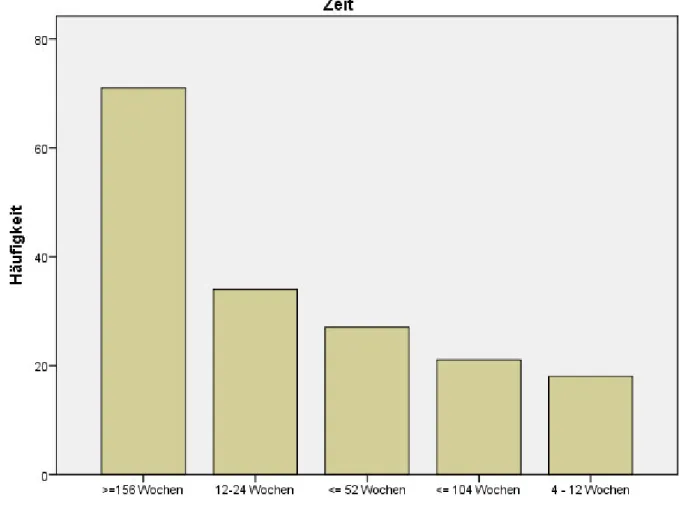
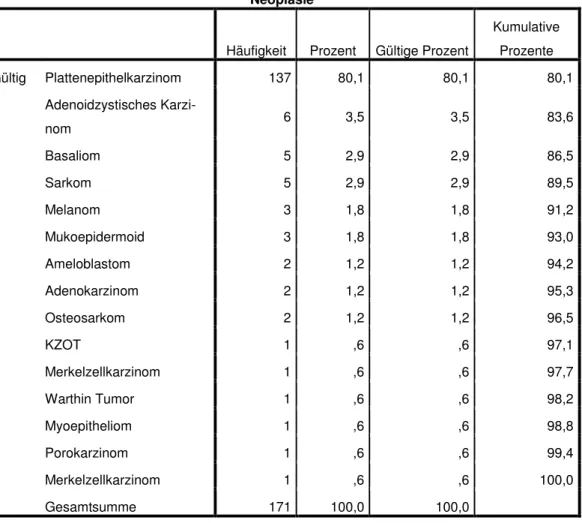
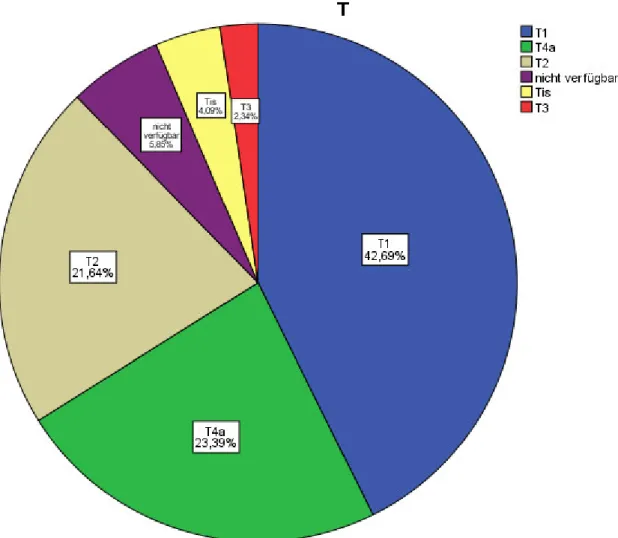
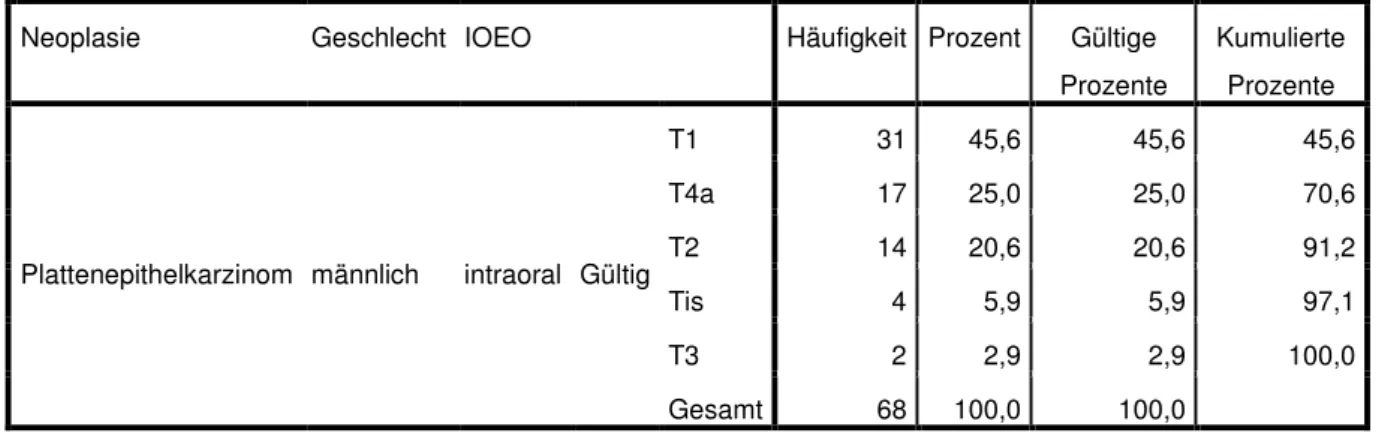
Lebensqualität bei Patienten mit intraoralen Tumoren
Volltext
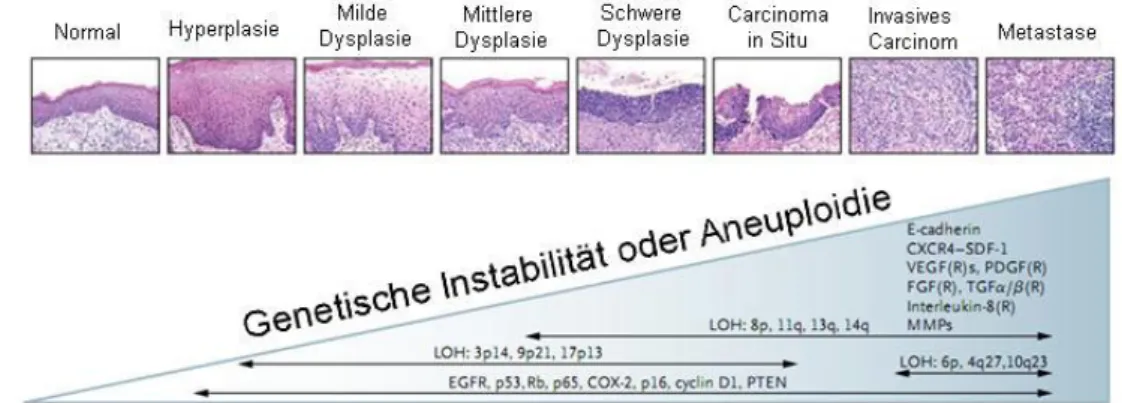
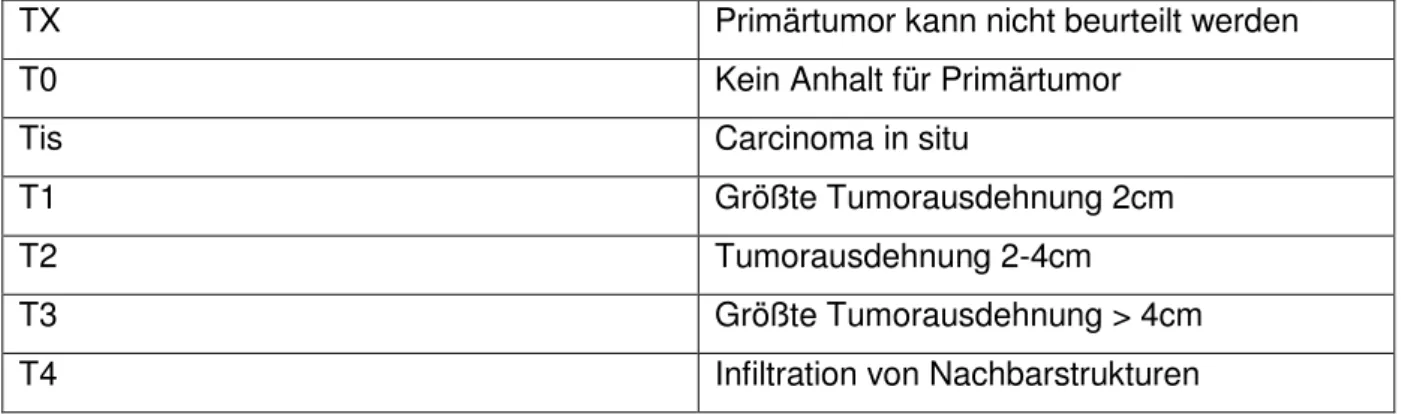
Abbildung
![Abb. 2: Anatomische Darstellung des Halses mit den Grenzen der 6 Neck Levels und der 3 Neck Sublevels, plus Level VII für das superiore Mediastinum [Robbins et al., 2008]](https://thumb-eu.123doks.com/thumbv2/1library_info/4131969.1552112/21.892.109.709.215.1002/anatomische-darstellung-halses-grenzen-sublevels-superiore-mediastinum-robbins.webp)

ÄHNLICHE DOKUMENTE
Ihre Antworten schicken Sie bitte an: Bayerische Landesärztekammer, Redaktion Bayerisches Ärzteblatt, Mühlbaurstraße 16, 81677 München, oder faxen Sie an die Nummer 089 4147-202.
März 2007 kann das freiwillige Fortbil- dungszertifikat der BLÄK wie bisher weiterge- führt werden; das heißt, Ärztinnen und Ärzte können auf Antrag das freiwillige
März 2007 kann das freiwillige Fortbil- dungszertifikat der BLÄK wie bisher weiterge- führt werden; das heißt, Ärztinnen und Ärzte können auf Antrag das freiwillige
März 2007 kann das freiwillige Fortbil- dungszertifikat der BLÄK wie bisher weiterge- führt werden; das heißt, Ärztinnen und Ärzte können auf Antrag das freiwillige
März 2007 kann das freiwillige Fortbil- dungszertifikat der BLÄK wie bisher weiterge- führt werden; das heißt, Ärztinnen und Ärzte können auf Antrag das freiwillige
katheterisieren. Die Spitex muss aber Beratung und Instruktionen leisten und oft dabei sein, um zu schauen, dass es korrekt gemacht wird. In diesen Fällen reichen die 35
März 2007 kann das freiwillige Fortbil- dungszertifikat der BLÄK wie bisher weiterge- führt werden; das heißt, Ärztinnen und Ärzte können auf Antrag das freiwillige
Die Münchener Ärztlichen Anzeigen (MÄA) könnten hier vielleicht mit ihren aktuellen Themen ein Vorbild sein, denn die Ärzte in- teressiert nicht, was deren Repräsentanten le-