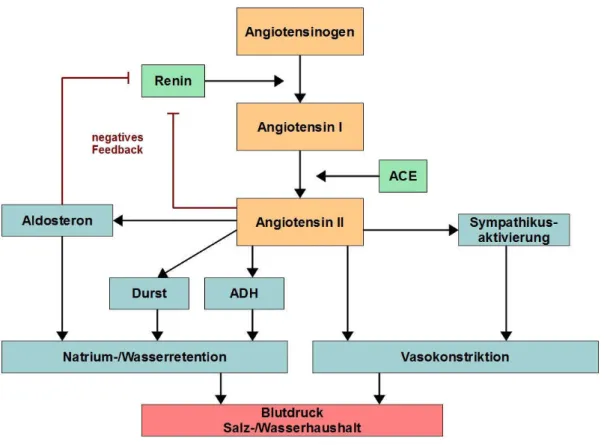
Die Aldo-Keto-Reduktase AKR1B7: Koexpression mit Renin in der Mausniere und Einfluss auf die Reninexpression und -sekretion
Volltext
Abbildung

![Abbildung 3.1: [Gesamtansicht] 3D-Rekonstruktion der Glattmuskelaktin- (rosa), Renin- (grün) und AKR1B7- (rot) Immunreaktivität im repräsentativen Gefäßbaumabschnitt einer Wildtyp-Maus [NS] mit](https://thumb-eu.123doks.com/thumbv2/1library_info/3945369.1534171/50.892.180.717.601.1097/abbildung-gesamtansicht-rekonstruktion-glattmuskelaktin-immunreaktivität-repräsentativen-gefäßbaumabschnitt-wildtyp.webp)
ÄHNLICHE DOKUMENTE
• Prolaktinkonzentrationen im Plasma, die 150 – 200 ng/mL überschreiten weisen auf Prolaktinom als Ursache der Hyperprolaktinämie hin. • Prolaktinkonzentrationen im Plasma,
• Latente Formen der Hyperprolaktinämie, die man im Basalwert allein nicht erfassen kann, die jedoch durchaus negative Auswirkungen auf die Follikel- reifung haben, diagnostiziert
Dies führte zu der Hypothese, dass eine ß 2 -adrenerge Stimulation, auch durch diese Medikamente, über eine Aktivierung des RAS zu einer vermehrten EPO-Produktion führt... Auf
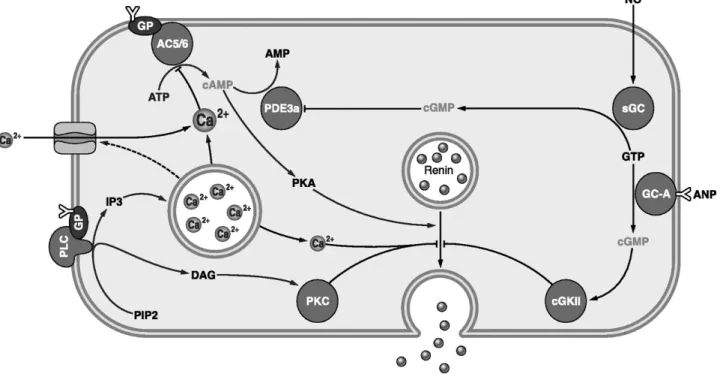
a quantitative polymerase chain reaction had to be developed to measure renin mRNA. Juxtaglomerular cells were isolated and cultured for 2 days under various conditions, and renin
262 (Renal Fluid Electrolyte Physiol. 31): F397-F402, 1992.- To find out whether calmodulin activity could be a common denominator for the cellular control of renin
In our own studies we have found that T P A enhances transmembrane calcium influx into isolated juxtaglomerular cells (Kurtz et al. Despite the uncertainty about the way
[r]
[r]
![Abbildung 3.2: [Gesamtansicht] 3D-Rekonstruktion der Glattmuskelaktin- (rosa) Immunreaktivität im repräsentativen Gefäßbaumabschnitt einer Wildtyp-Maus [NS] mit Darstellung der Glomeruli und der Nierenkapsel (gelb)](https://thumb-eu.123doks.com/thumbv2/1library_info/3945369.1534171/51.892.183.719.79.1086/gesamtansicht-rekonstruktion-glattmuskelaktin-immunreaktivität-repräsentativen-gefäßbaumabschnitt-darstellung-nierenkapsel.webp)
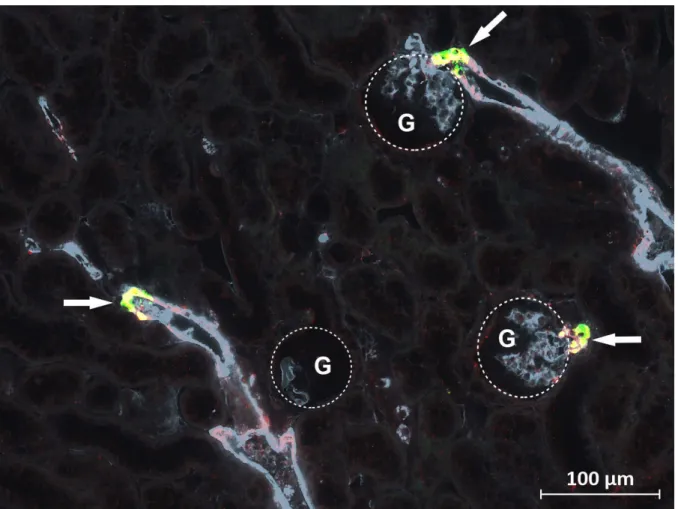
![Abbildung 3.5: [Detailansicht] Immunfluoreszenzfärbung am Paraffinschnitt einer Wildtyp-Maus [NS]](https://thumb-eu.123doks.com/thumbv2/1library_info/3945369.1534171/54.892.94.805.359.929/abbildung-detailansicht-immunfluoreszenzfärbung-paraffinschnitt-wildtyp-maus-ns.webp)
![Abbildung 3.7: [Detailansicht] Immunfluoreszenzfärbung am Paraffinschnitt einer Wildtyp-Maus [HS]](https://thumb-eu.123doks.com/thumbv2/1library_info/3945369.1534171/56.892.93.807.234.802/abbildung-detailansicht-immunfluoreszenzfärbung-paraffinschnitt-wildtyp-maus-hs.webp)
![Abbildung 3.13: [Detailansicht] 3D- Rekonstruktion der Glattmuskelaktin- (rosa) Immunreaktivität mehrerer afferenter Arteriolen einer Aldosteronsynthase-Knockout-Maus mit Glomeruli (gelb) und einer efferenten Arteriole](https://thumb-eu.123doks.com/thumbv2/1library_info/3945369.1534171/62.892.126.755.316.963/abbildung-detailansicht-rekonstruktion-glattmuskelaktin-immunreaktivität-afferenter-arteriolen-aldosteronsynthase.webp)
![Abbildung 3.14: [Detailansicht] 3D- Rekonstruktion der Glattmuskelaktin- (rosa) Immunreaktivität mehrerer afferenter Arteriolen einer Aldosteronsynthase-Knockout-Maus mit Glomeruli (gelb) und einer efferenten Arteriole](https://thumb-eu.123doks.com/thumbv2/1library_info/3945369.1534171/63.892.134.762.342.994/abbildung-detailansicht-rekonstruktion-glattmuskelaktin-immunreaktivität-afferenter-arteriolen-aldosteronsynthase.webp)