Die altersabhängige Entwicklung der Reninexpression in der Connexin 40 und Aldosteronsynthase Doppel-Knockout-Maus
Volltext
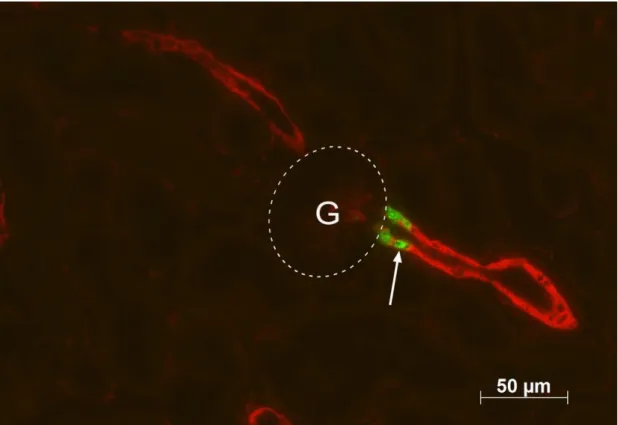
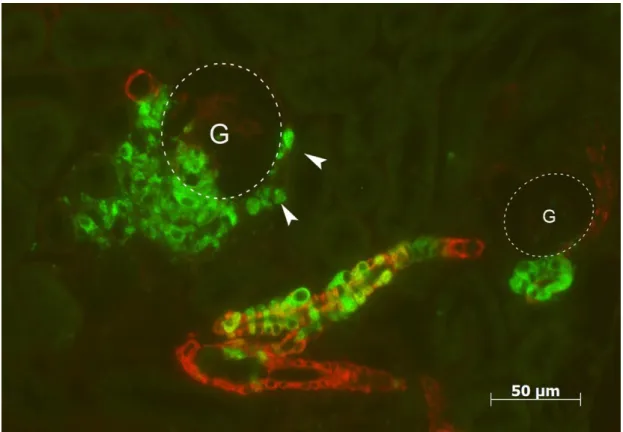
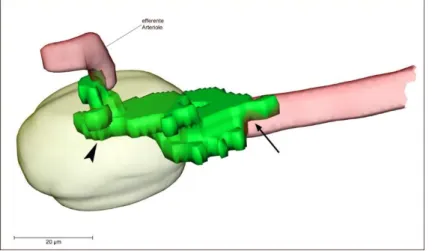
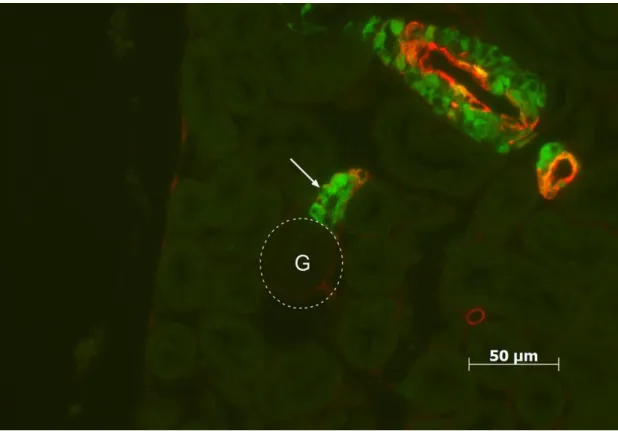
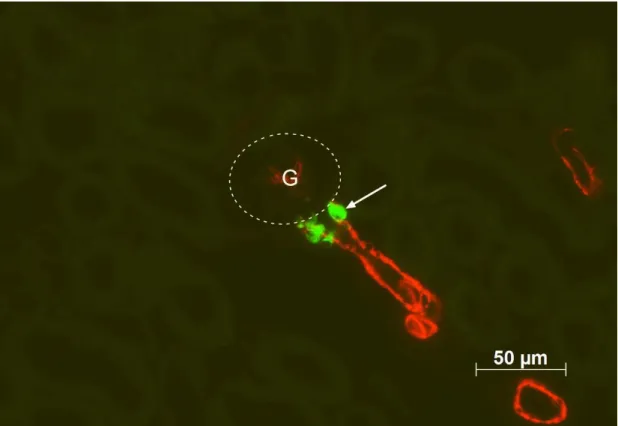
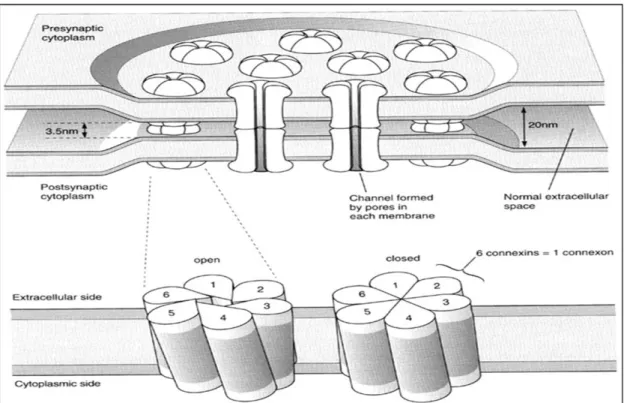
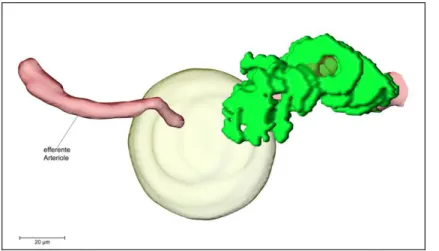
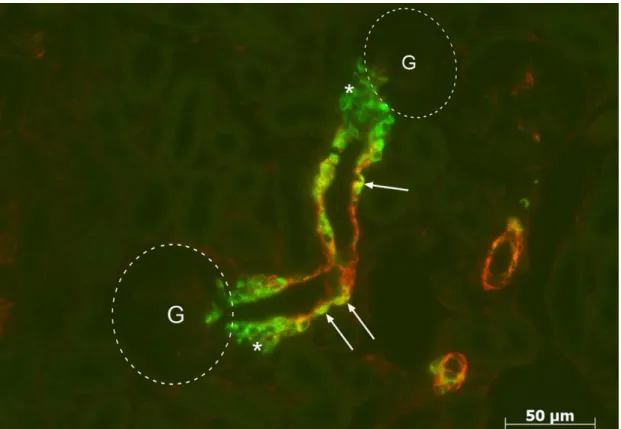
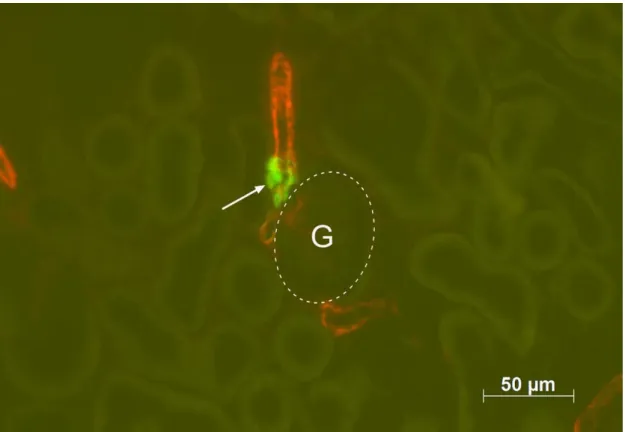
Abbildung
ÄHNLICHE DOKUMENTE
In der ambulanten Versorgung durch Arztpraxen will die AfD die Übernahme einer Praxis für junge Ärzte attraktiver machen und das Abrechnen der Leistungen für die
Male die unten abgebildeten Kästchen mit passender Farbe an, schneide sie aus und klebe Sie passend in das
Gemäß der Spezifikation müssen Obstgärten, die zur Produktion der Äpfel „Jabłka łąckie“ bestimmt sind, in dem unter Punkt 4 bezeichneten geografischen Gebiet liegen.. In
Die von GRABOWSKI (1953, 1956) publizierten Experimente wurden bestä- tigt, und es konnte zusätzlich gezeigt werden, dass A) auch die Expressionsmuster von
[r]
16 Wegen des vielen Schnees erreichte sie ihn erst gegen Sonnenaufgang in seiner Schlafhöhle. 17 Verschlafen schloss er sie in
Es lässt sich annehmen, dass sobald die Rezeptordichte von DDR-2 auf den Chondrozyten steigt, nicht nur MMP-13 hochreguliert wird, sondern auch weniger
So sollte zum Beispiel ein rotes Tape nie auf eine akute Entzündung ge- klebt werden, sondern eher ein kühlendes Blau oder ein heilen- des Grün. Und auch die Farb- gestaltung