UNTER LEITUNG VON PROF. DR. MED. W. HERR DER MEDIZINISCHEN FAKULTÄT
DER UNIVERSITÄT REGENSBURG
Antiangiogenetische Therapie bei
metastasiertem hepatozellulärem Karzinom
Antiangiogenetic therapy in metastatic hepatocellular carcinoma
Inaugural – Dissertation zur Erlangung des Doktorgrades
der Medizin
der
Medizinischen Fakultät der Universität Regensburg
vorgelegt von Iris Walter
2015
AUS DER KLINIK FÜR INNERE MEDIZIN III HÄMATOLOGIE UND INTERNISTISCHE ONKOLOGIE
UNTER LEITUNG VON PROF. DR. MED. W. HERR DER MEDIZINISCHEN FAKULTÄT
DER UNIVERSITÄT REGENSBURG
Antiangiogenetische Therapie bei
metastasiertem hepatozellulärem Karzinom
Inaugural – Dissertation zur Erlangung des Doktorgrades
der Medizin
der
Medizinischen Fakultät der Universität Regensburg
vorgelegt von Iris Walter
2015
Dekan: Prof. Dr. Dr. Thorsten E. Reichert
1. Berichterstatter: Prof. Dr. Albrecht Reichle
2. Berichterstatter: PD Dr. Christina Hackl
Tag der mündlichen Prüfung: 06.06.2016
3
Inhaltsverzeichnis
1 EINLEITUNG ... 9
1.1 HCC: Ä
TIOLOGIE, E
PIDEMIOLOGIE UNDE
INTEILUNG... 9
1.1.1 Pathogenese des hepatozellulären Karzinoms ...11
1.1.2 Risikofaktoren zur Entwicklung eines HCC ...11
1.1.2.1 Hepatitis B Infektion ... 12
1.1.2.2 Hepatitis C Infektion ... 13
1.1.2.3 Alkoholabusus ... 14
1.1.2.4 Nicht-alkoholische Steatohepatitis (NASH) ... 14
1.1.2.5 Andere Erkrankungen ... 15
1.1.3 Leberzirrhose ...15
1.1.4 Früherkennung und Diagnostik des HCC ...16
1.1.5 Histologische Einteilung des HCC ...18
1.1.6 TNM und Score Systeme des HCC ...19
1.1.6.1 TNM System ... 20
1.1.6.2 Stadieneinteilung nach UICC ... 21
1.1.6.3 Stadieneinteilung nach Okuda ... 21
1.1.6.4 CLIP-Score Einteilung ... 22
1.1.6.5 BCLC- Score Einteilung ... 24
1.2 T
HERAPEUTISCHEO
PTIONEN... 26
1.2.1 Operative Therapieoptionen ...28
1.2.1.1 Lebertransplantation ... 28
1.2.1.2 Leberresektionen ... 29
1.2.2 Lokal- ablative Verfahren ...30
1.2.2.1 Radiofrequenzablation (= RFA) ... 31
1.2.2.2 perkutane Ethanolinjektion (PEI) / Essigsäure Ablation (PAI) ... 32
4
1.2.2.3 Transarterielle Chemoembolisation (TACE) ... 32
1.2.3 Strahlentherapie bei hepatozellulärem Karzinom ...33
1.2.3.1 Selektive intraarterielle Radiotherapie (SIRT) ... 33
1.2.4 Chemotherapie bei hepatozellulärem Karzinom ...34
1.2.4.1 Adjuvante/neoadjuvante Chemotherapie nach Resektion oder Ablation ... 34
1.2.4.2 Chemotherapie allgemein ... 34
1.2.5 Target Therapien ...35
1.2.5.1 Sorafenib ... 37
1.2.5.2 Programmed cell death protein 1-Inhibitoren (PD1- Inhibitoren) ... 38
1.2.5.3 Andere Target- Therapien ... 39
1.3 A
USWAHL DERS
TUDIENMEDIKATION... 40
1.3.1 Coxib ...41
1.3.2 Pioglitazone ...42
1.3.3 Capecitabin ...43
1.3.4 Interaktionen ...43
2 MATERIAL UND METHODEN (STUDIENPROTOKOLL) ... 44
2.1 S
TUDIENZIELE... 44
2.1.1 Primäre Studienziele ...44
2.1.2 Sekundäre Studienziele ...44
2.2 A
RT DERS
TUDIE... 45
2.3 P
ATIENTENANZAHL... 45
2.4 Z
EITPLAN... 45
2.5 T
EILNEHMENDES
TUDIENZENTREN... 46
2.6 P
ATIENTENMELDEVERFAHREN... 46
2.7 P
ATIENTENAUSWAHL... 46
2.7.1 Einschlusskritierien ...46
5
2.7.2 Ausschlusskriterien ...47
2.8 M
EDIKATION, B
EHANDLUNGSPLAN UNDD
OSIERVORSCHRIFTEN... 48
2.8.1 Übersicht über den Therapieplan ...48
2.8.2 Antiangiogenetische Therapie ...49
2.8.3 Chemotherapie ...50
2.8.4 Begleit- und Supportivmedikation ...52
2.9 U
NTERSUCHUNGEN... 53
2.10 T
HERAPIEBEWERTUNG... 55
2.10.1Remissionskriterien ...55
2.10.2Sicherheit ...56
2.10.2.1 Definition unerwünschter Ereignisse ... 56
2.10.2.2 Erfassung und Dokumentation unerwünschter Ereignisse ... 57
2.10.2.3 Definition schwerwiegender unerwünschter Ereignisse (=SAE) ... 59
2.10.2.4 Meldung von unerwünschten Ereignissen ... 60
2.11 V
ORZEITIGESS
TUDIENENDE... 60
2.11.1Vorzeitiges Studienende für den Patienten ...60
2.11.2Vorzeitiges Studienende für die gesamte Studie ...61
2.12 D
OKUMENTATION... 61
2.13 D
ATENMANAGEMENT UND STATISTISCHEA
SPEKTE... 62
2.13.1Datenmanagement und statistische Aspekte für die gesamte Studie ...62
2.13.1.1 Statistische Methoden und Fallzahlkalkulation ... 62
2.13.1.2 Auswertbarkeit und Auswertung ... 63
2.13.2Monitoring und Qualitätskontrolle ...64
3 BESCHREIBUNG DES STUDIENKOLLEKTIVES, NEBENWIRKUNGEN UND KASUISTIKEN ... 65
3.1 A
LLGEMEINEP
ATIENTENCHARAKTERISTIKA... 65
3.2 B
EHANDLUNG... 70
6
3.2.1 Behandlung der Stichprobe A ...70
3.2.2 Behandlung der Stichprobe B ...70
3.2.3 Behandlung Stichprobe C ...71
3.3 S
ICHERHEIT UNDV
ERTRÄGLICHKEIT... 72
3.3.1 Nebenwirkungen gesamte Studienpopulation, aufgeteilt in Stichprobe A-C ...72
3.3.2 Schwere unerwünschte Ereignisse der gesamten Studienpopulation ...81
3.4 K
ASUISTIKEN... 83
3.4.1 Best Case ...83
3.4.2 Worst Case Szenarien ...86
4 STATISTIK UND ERGEBNISSE ... 90
4.1 P
ROGRESSIONSFREIESÜ
BERLEBEN... 90
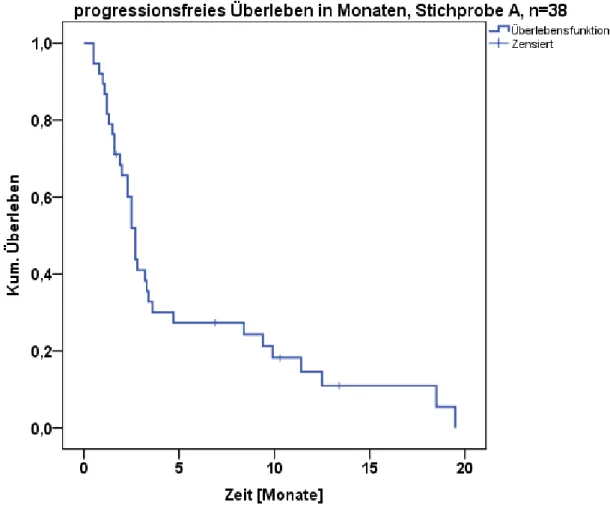
4.1.1 Progressionsfreies Überleben in Monaten Stichprobe A, B und C ...90
4.1.2 PFÜ in Abhängigkeit von der Behandlungsdauer in 2 Gruppen; Stichprobe A ...92
4.2 G
ESAMTÜBERLEBEN DERS
TICHPROBENA, B
UNDC ... 94
4.3 V
ARIABLEN,
WELCHE EINENE
INFLUSS AUF DASG
ESAMTÜBERLEBEN HABEN... 96
4.3.1 Einfluss einer vorhergehenden Operation, Stichprobe A, B und C ...96
4.3.2 Gesamtüberleben in zwei Behandlungsgruppen der Stichprobe A: Einfluss der Behandlungsdauer ...99
4.3.3 Einfluss einer vorangegangen Operation auf das Gesamtüberleben in Abhängigkeit von der Behandlungsdauer ...101
4.3.4 Einfluss der Leberzirrhose auf das Gesamtüberleben bei Patienten mit einer Therapiedauer bis 20 Wochen...102
4.3.5 Einfluss des ECOG Status auf das Gesamtüberleben ...103
4.3.6 Einfluss der Tumorgröße auf das Gesamtüberleben ...105
4.4 V
ARIABLEN OHNEE
INFLUSS AUF DASG
ESAMTÜBERLEBEN... 106
7
4.5 S
CORES
YSTEME... 106
4.5.1 Korrelation der Score-Systeme ...106
4.5.2 CLIP-Score Stichprobe A ...107
4.5.3 Andere getestete Variablen im Log rank – ohne Einfluss auf das Gesamtüberleben ...108
4.6 L
ABORPARAMETER... 110
4.6.1 C-reaktives Protein (CRP) ...110
4.6.1.1 CRP Ausgangswerte ... 110
4.6.1.2 CRP-Verlaufsbeobachtung in zwei Gruppen ... 111
4.6.2 AFP ...114
4.6.2.1 AFP im Serum als prädiktiver Parameter für das Gesamtüberleben... 114
4.6.2.2 AFP- Verlaufswerte im Serum im Zusammenhang mit dem Gesamtüberleben ... 115
4.6.2.3 AFP und progressionsfreies Überleben ... 116
4.6.3 Laktatdehydrogenase (LDH) ...116
4.6.3.1 LDH im Serum vor Therapiebeginn als prädiktiver Parameter für das Gesamtüberleben 116 4.6.3.2 Laktatdehydrogenase (LDH) im Serum vor Therapiebeginn als prädiktiver Parameter für progressionsfreies Überleben (PFÜ) ... 117
5 DISKUSSION ... 121
6 ZUSAMMENFASSUNG ... 140
7 ABSTRACT ... 142
8 ANHANG ... 144
8.1 L
ITERATURVERZEICHNIS... 144
8.2 A
BBILDUNGSVERZEICHNIS... 161
8.3 T
ABELLENV
ERZEICHNIS... 163
8.4 A
BKÜRZUNGSVERZEICHNIS... 165
8.5 SAE B
OGEN... 169
8.6 A
KTIVITÄTSINDEX ZURB
EURTEILUNG DERL
EISTUNGSFÄHIGKEIT NACHWHO
BZW. K
ARNOFSKYINDEX... 171
8
8.7 F
ACHINFORMATIONA
CTOS ®... 172
8.8 F
ACHINFORMATIONA
RCOXIA® ... 176
8.9 F
ACHINFORMATIONX
ELODA®... 184
8.10 E
RKLÄRUNG... 196
8.11 D
ANKSAGUNG... 83
8.12 L
EBENSLAUF... 83
9
1 Einleitung
Im Rahmen dieser Doktorarbeit soll die Frage geklärt werden, ob bei Patienten mit metastastiertem hepatozellulärem Karzinom (HCC), ohne anderweitige Therapieoptionen, eine Krankheitsstabilisierung mittels eines neuen, integrativ antiangiogenetischem/ antiinflammatorischem und immunmodulatorischem Therapiekonzept erreicht werden kann.
Die niedrigdosierte metronome Chemotherapie wird im vorliegenden Therapiekonzept durch die antiangiogenetische/ antiinflammatorische Komponente ergänzt.
Seit mittlerweile 20 Jahren werden niedrigdosierte metronome Chemotherapien und antiangiogenetische/ antiinflammatorische und immunmodulatorische Therapien bei verschiedenen malignen Erkrankungen erfolgreich eingesetzt. Unter metronomer Chemotherapie wird eine kontinuierliche Gabe einer niedrig dosierten oralen Chemotherapie verstanden, welche, durch diese Art der Gabe, vor allem auf die Endothelzellen des Tumors zielt und somit die Gefäßneubildung des malignen Tumors hemmt, dies bei guter Verträglichkeit [143].
1.1 HCC: Ätiologie, Epidemiologie und Einteilung
Das Leberzellkarzinom (HCC) ist ein aggressiver Tumor, der häufig in Zusammenhang mit einer chronischen Lebererkrankung und einer Leberzirrhose auftritt. Bei den primären Lebertumoren ist das hepatozelluläre Karzinom am häufigsten (80-90%), gefolgt vom intrahepatischen Cholangiokarzinom (10-15%).
Selten kommen Sarkome oder Hepatoblastome vor.
Das hepatozelluläre Karzinom ist weltweit gesehen die fünfthäufigste maligne Erkrankung bei Männern und die achthäufigste bei Frauen mit circa 600000 Neuerkrankungen im Jahr 2008 [8, 9], (siehe Tabelle 1 und Abbildung 1).
Aktuell nehmen die Erkrankungsraten in den Industrienationen zu, was vor allem auf eine steigende Verbreitung der Hepatitis C zurückzuführen ist.
10 Tabelle 1: Inzidenzraten des HCC nach Risikogebieten: Modifiziert nach [8]
Risikoklasse Geographisches Gebiet Inzidenz in 100000/Jahr Hochrisikogebiet Asien und Afrika 20-40
Intermediäres Risiko Mittelmeerraum und Japan 8-20 Niedriges Risiko Nordeuropa und Amerika 6
Niedriges Risiko Deutschland 5
Abb. 1: Weltweite altersstandardisierte HCC Inzidenzen, Geschlechtsspezifisch, modifiziert nach [1, 9]
0 10 20 30 40
Ost- Asien Süd-Ost Asien Südeuropa Westeuropa Zentral und Osteuropa Deutschland
Altersstandardisierte Inzidenz HCC per 100000 Einwohner (rosa= Frauen, hellblau =
Männer)
Männer sind 2-5-mal häufiger betroffen als Frauen. Der Altersgipfel liegt in den USA und Nordeuropa zwischen 60-70 Jahren, in den Hochrisikogebieten Asiens zwischen 40-60 Jahren und in Afrika bei 35 Jahren [10]. In Deutschland liegt die
11
altersstandardisierte Inzidenz bei 9,2-10,7/100000 Einwohner für Männer und bei 1,6-3,6/100000 Einwohner für Frauen [9]. Nach WHO Schätzungen im Jahre 2004 sind weltweit etwa 1% der Todesfälle auf ein hepatozelluläres Karzinom zurückzuführen [13].
Trotz einer Vielzahl von Behandlungsmöglichkeiten ist die Prognose schlecht. Je nach Tumorstadium überleben weniger als 15% der Erkrankten länger als 5 Jahre [14].
1.1.1 Pathogenese des hepatozellulären Karzinoms
Ein hepatozelluläres Karzinom entsteht meist auf dem Boden einer chronisch- persistierenden Leberschädigung. Die Karzinogenese ist ein langsamer, mehrstufiger Prozess. Es konnten morphologisch Läsionen festgestellt werden, die als dysplastische Foci (<0,1cm) und dysplastische Knoten (0,1-2cm) definiert wurden.
Aus diesen prämalignen Läsionen entwickelt sich das HCC [17].
Auf molekularer Ebene treten dabei chromosomale Imbalancen auf. Diese führen in knapp 50% der HCC Herde zu einem Verlust von p53, welches mit einem Funktionsausfall seiner antineoplastischen Eigenschaften zu einer Inaktivierung des Retinoblastomgens und dadurch zu einer verstärkten Karzinogenese führt.
Zudem gibt es weitere Alterationen in mehreren Signalwegen, z.B. die Inaktivierung von Tumorsuppressorgenen neben p53 wie IGF-IIIR oder E-cadherin, die Aktivierung von Protoonkogenen (z.B. β-Catenin, MET), und die Über-/ Reexpression von Wachstumsfaktoren wie TGFα, IGF-III oder VEGF[18, 13].
1.1.2 Risikofaktoren zur Entwicklung eines HCC
Häufigste Risikofaktoren für das HCC sind in Deutschland eine chronische Hepatitis C Infektion und Alkoholkonsum. Bei der Hepatitis C Infektion kann seit 20 Jahren eine Zunahme der Inzidenz der chronischen Hepatitis C gesehen werden.
Zeitverzögert treten, nun auf dem Boden der Hepatitis C Leberzirrhosen auf, und
12
parallel vermehrt HCCs [11]. Die Inzidenzen des HCC steigen auch in anderen westlichen Ländern. Hierfür werden neben steigenden Hepatitis-C-Virusinfektionen auch eine Zunahme der nicht-alkoholischen Steatohepatitis als Folge von Diabetes mellitus und metabolischem Syndrom gesehen [12].
Patienten mit Leberzirrhose gleich welcher Ursache, aber auch Patienten mit einer chronischen Hepatitis B- Infektion ohne Zirrhose oder einer nicht-alkoholischen Fettleberhepatitis stellen die Hochrisikogruppe für die HCC Entstehung dar [7].
1.1.2.1 Hepatitis B Infektion
Zirka 80-90% der HCC Patienten in Asien sind HBs-Antigen positiv, in Nordeuropa nur 20-25%. Es ergibt sich ein 100-fach erhöhtes HCC Risiko bei Hepatitis B Infizierten gegenüber nicht-Infizierten.Die HCC Inzidenz bei Hepatitis B-Infizierten beträgt 0,5% und erhöht sich auf 2,5% bei gleichzeitiger Leberzirrhose [19].
Der wichtigste HCC Risikofaktor in Zusammenhang mit der chronischen Hepatitis B Virusinfektion ist die Konzentration der HBV-DNA im Serum. Ab einem Wert von 2000 IU/ml werden vermehrt hepatozelluläre Karzinome identifiziert [20, 21]. Die Zahl der hepatozellulären Karzinome steigt mit zunehmender Viruslast im Serum an [21].
Der Risikoscore REACH- B, klassifiziert das Risiko des Auftretens eines HCC bei bestehender Hepatitis B ohne Leberzirrhose basierend auf Geschlecht, Alter, Serum- ALT Werten, dem HBeAg-Status und der Konzentration der HBV-DNA im Serum.
Zudem wird der Fibrosegrad der Leber mittels Elastometrie gemessen. So kann die 3-, 5-, und 10- Jahres Wahrscheinlichkeit für ein HCC vorhergesagt werden [22]. Bei HBs Ag-positiven Patienten ist ein Polymorphismus des K1F1B- Gens auf Chromosom 1 identifiziert, der mit einem hohen HCC- Risiko bei HBs Ag-positiven Patienten assoziiert ist [24].
13
1.1.2.2 Hepatitis C Infektion
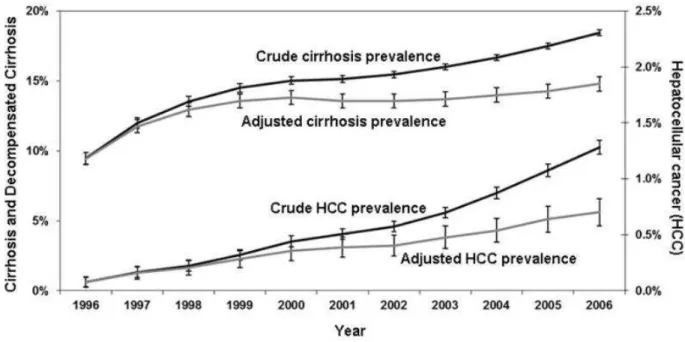
Weltweit sind 25% aller hepatozellulären Karzinome auf eine Hepatitis C Virusinfektion zurückzuführen. Eine Hepatitis C Infektion führt gegenüber Nicht- Infizierten zu einem 20-fach erhöhten HCC Risiko. Die Inzidenz liegt bei gleichzeitiger Leberzirrhose bei 2,8% /Jahr [19]. Bei Leberzirrhose im Stadium nach Child- Pugh A beträgt die jährliche Inzidenz des hepatozellulären Karzinoms 4% (1,6- 5%) [23]. In Abbildung 2 werden die Prävalenzen der Leberzirrhose und des HCCs bei Hepatitis C-Patienten geschlechtsgetrennt aufgezeigt. Ein deutlicher Anstieg der Prävalenz für Leberzirrhose und HCC sind im Verlauf der Jahre beginnend von 1996 bis 2006 zu sehen. Zudem zeigt die Abbildung eine zunehmende Differenz zwischen mathematisch vorhergesagten und tatsächlich eingetretenen Prävalenzen, dies hängt mit den in dieser Periode verbesserten Behandlungsmöglichkeiten der HCC Infektion zusammen.
Abbildung 2: Kanwal, F: "Alter und Geschlechtsgetrennte Prävalenz der Leberzirrhose bei hepatozellulärem Karzinom. Die Fehlerbalken repräsentieren das 95% Konfidenzintervall.
Die Referenzkohorte entspricht der HCV Kohorte von 1996."
14
Analog den Patienten mit chronischer Hepatitis B konnte bei Patienten mit chronischer Hepatitis C ein Polymorphismus auf Chromosom 6 (MICA- Gen, rs 2596542) identifiziert werden, welcher mit einer höheren Inzidenz für ein hepatozelluläres Karzinom bei chronischer Hepatitis C verbunden ist [25]. Die Neuerungen in der Hepatitis C Therapie mittels neuer Proteaseinhibitoren sind seit 2015 leitlinienempfohlen. Bei sehr guter Verträglichkeit kann bei einen großen Teil der so behandelten Patienten mit chronischer Hepatitis C innerhalb einer kurzen Therapiedauer (12-24 Wochen) keine Hepatitis C-Viruslast mehr nachgewiesen werden [144]. Wie sich dies auf die Prävalenz der Leberzirrhose in der Folge auswirkt und damit auf die Entstehung des HCCs in der zirrhotischen Leber kann zum momentanen Zeitpunkt nur vermutet werden.
1.1.2.3 Alkoholabusus
In Europa und Nordamerika stellt chronischer Alkoholabusus einen Hauptrisikofaktor zur Entwicklung eines HCC dar. Im Jahr 2011 starben in Deutschland 73000 Menschen vorzeitig aufgrund erhöhten Alkoholkonsums [1]. Es gibt geschätzte 1,3- 2,5 Millionen Alkoholiker in Deutschland, davon 30% Frauen [2].Der reine Alkoholverbrauch in Deutschland lag 2011 bei 9,6 Litern reinem Alkohol/ Kopf [3].
Bei Patienten, welche eine Hepatitis B oder C Infektion aufweisen oder an einer Nicht-alkoholischer Steatohepatitis erkrankt sind, erhöht sich auch bei moderatem Alkoholkonsum das HCC Risiko signifikant um den Faktor 3,6 (p=0,002) [15].
1.1.2.4 Nicht-alkoholische Steatohepatitis (NASH)
Wenn eine Nicht- alkoholischer Steatohepatitis (NASH) vorliegt, haben Patienten mit Diabetes mellitus ein 2-3 fach erhöhtes HCC Risiko [33]. Eine Steatohepatitis ist mit bis zu 30% Prävalenz die häufigste Lebererkrankung in Europa ist. Bei Vorliegen einer NASH-Zirrhose liegt die jährliche HCC Inzidenz bei 2,6%.
15
Allerdings kann sich ein HCC bei vorliegender NASH auch ohne Zirrhose entwickeln.
Ertle et al. Untersuchten diesbezüglich 150 Patienten mit HCC. Darunter hatten 36 Patienten eine NASH als Grunderkrankung aber nur 19 Patienten davon eine nachweisbare Zirrhose (52,8%). In den Subgruppen mit den Grunderkrankungen Hepatitis B oder C sowie Alkoholischer Hepatitis zeigten hingegen 90% eine Zirrhose. Daraus folgerten die Autoren, dass eine NASH auch in Abwesenheit einer Zirrhose das HCC Risiko erhöht [33].
1.1.2.5 Andere Erkrankungen
Neben den bisher diskutierten Hauptrisikofaktoren stellen auch Stoffwechselerkrankungen wie Hämochromatose, Tyrosinämie, alpha-1- Antitrypsinmangel, primär biliäre Zirrhose (PBC), primär sklerosierende Cholangitis (PSC), Autoimmunhepatitis, Glykogenspeicherkrankheit oder Morbus Wilson, über den Zwischenschritt der Ausbildung einer Zirrhose, Risikofaktoren zur Entstehung eines HCC dar. Auch chemisch- toxischen Substanzen wie Aflatoxinen, Androgenen und Arsen werden karzinogene Wirkung zugeschrieben [10].
1.1.3 Leberzirrhose
Eine Vielzahl von Lebererkrankungen verursachen eine stetige Entzündungsreaktion innerhalb der Leber. Die Entzündung induziert extrazelluläre Matrix. Parallel wird Lebergewebe im Sinne von Regeneratknoten neu gebildet, was zu kontinuierlichen Leberarchitekturveränderungen führt.
Die extrazelluläre Matrix wird hauptsächlich in den hepatischen Sternzellen gebildet.
Sternzellen können sich dabei in Myofibroblasten-ähnliche Zellen transformieren. Als solche produzieren sie vor allem Kollagen Typ I und III. Eine Stimulation zur Produktion von extrazellulärer Matrix erfolgt durch TGF-β, TNF-α, IL-1β und IL-4. Die Fibrosierung schreitet durch die weitere Freisetzung von Zytokinen, Endotoxinen und Lipid-Peroxidaseprodukten fort [34, 35].
16
Ist eine Leberzirrhose entstanden, kann diese wie in Tabelle 2 gezeigt nach der Child-Pugh Klassifikation eingeteilt werden.
Tabelle 2: Klassifizierung der Leberzirrhose nach Child-Pugh
Kriterium 1 Punkt 2 Punkte 3 Punkte
Billirubin (mg/dl) < 2,0 2,0-3,0 >3,0 Albumin (g/dl) >3,5 2,8-3,5 <2,8
Quick (%) > 70 40-70 <40
Enzephalopathie Keine Grad I/II Grad III/IIII Aszites keiner Gering-mittel Deutlich bis
massiv
Anhand der Child-Pugh Klassifikation kann das Ein-Jahres Überleben der Patienten abgeschätzt werden [29].
Tabelle 3: 1-Jahresüberleben in % anhand Child-Pugh Klassifikation
Child-Klassifizierung Punktesumme 1-Jahresüberleben in %
A 5-6 84
B 7-9 62
C 10-15 42
1.1.4 Früherkennung und Diagnostik des HCC
Innerhalb Europas entstehen 80-90% der hepatozellulären Karzinome in einer bereits zirrhotischen Leber. Bei Patienten mit Leberzirrhose sollte deshalb regelmäßig und standardisiert nach einem HCC gesucht werden.
Dies wurde in der Leitlinie für das hepatozelluläre Karzinom im Mai 2013 durch die Expertenkommission festgelegt. Die Empfehlung lautet, dass Patienten mit einer Leberzirrhose regelmäßig Früherkennungsuntersuchungen angeboten werden,
17
solange sie davon profitieren können. Der Abstand zwischen zwei Ultraschalluntersuchungen zur Detektion eines HCC beträgt 6 Monate. Als Tumormarker kann alle 6 Monate eine AFP- Bestimmung erfolgen [20]. Bei einer Zirrhose im Child- Pugh Stadium C liegt eine dekompensierte Leberfunktion vor. Eine systemische HCC Therapie ist hier nicht mehr möglich. Deshalb sollten ab diesem Stadium keine Früherkennungsmaßnahmen mehr durchgeführt werden, es sei denn der Patient befindet sich auf einer Warteliste zur Lebertransplantation [27]. In Abbildung 3 kann das standardisierte Vorgehen zur Früherkennung eines HCC bei Patienten mit Leberzirrhose nachvollzogen werden.
Abbildung 3: modifiziert nach EASL-EORTC clinical practice guidlines:management of HCC. [27]
Flussdiagramm zum standardisierten Vorgehen zur Früherkennung eines HCC bei Patienten mit Leberzirrhose
Raumforderung der Leber im Ultraschall
<1cm 1-2cm >2cm
CT oder MR mit KM
US in 4 Monaten CT oder MR mit
KM
Wachstum oder Änderung Charakterisik
Vorgehen je nach Größe
stabil
ja nein
HCC Biopsie
1 oder 2 typische radiologische HCC Kriterien
1 typisches HCC Kriterium
ja nein
HCC Biopsie
Zu keiner Entscheidung führend
Ist es zu einer Detektion eines HCC gekommen, kann anhand der Einteilung nach BCLC-Score (siehe Tabelle 9) der Patient der passenden Therapie zugeführt
18
werden. Bei Diagnosestellung weisen zwei Drittel der HCC-Patienten keine erhöhten AFP-Werte auf. Jedoch können Serum AFP-Werte über 400ng/ml in Kombination mit dem Nachweis einer intrahepatischen Raumforderung als pathognomonisch angesehen werden. Goldstandard zur Diagnose eines HCC ist weiterhin die Biopsie mit histopathologischer Begutachtung. Bei Raumforderungen von über 2 cm Größe in der zirrhotischen Leber mit gleichzeitig typischem Verhalten in der kontrastmittelverstärkten Bildgebung mittels Computertomographie oder Magnetresonanz-Tomographie oder Ultraschall, kann auf eine Biopsie verzichtet werden [19].
1.1.5 Histologische Einteilung des HCC
Neben dem klassischen HCC gibt es in der Leber noch einige andere Neoplasien.
Eine histologische Einteilung ist Tabelle 4 zu entnehmen, in dieser Studie wurden nur Patienten mit HCC behandelt. Eine Subtypisierung des HCC vor allem zum fibrolamellärem Karzinom sollte vorgenommen werden, da die Patienten mit oft deutlich jünger sind (90% vor dem 35. Lebensjahr) und keine Zirrhose vorliegt [36].
Tabelle 4: histologische Einteilung der Leberneoplasien Epithelial Hepatozelluläres Karzinom (HCC)
Intrahepatisches Cholangiokarzinom (ICC) Gemischt HCC/ICC
Gallengangszystadenokarzinome Hepatoblastome (Kindesalter) Undifferenzierte Karzinome
nichtepithelial Epitheloide Hämangioendotheliome Angiosarkome
Embryonale Sarkome Rhabdomyosarkome Lymphome
19
Das HCC wächst diffus oder als Tumorknoten, diese Knoten können solitär oder multifokal sein. Histopathologisch wird zwischen trabekulärem, pseudo-glandulärem, solidem oder zirrhösen Wachstumsmuster unterschieden.
Das HCC breitet sich vor allem hämatogen und nach Infiltration per continuitatem aus. Bei infiltrativem Wachstum werden in 25% Lebervenenäste und in 70%
Portalvenen infiltriert. Dadurch kann es zur Ausbildung von Tumorthromben und einer weiteren intrahepatischen Metastasierung sowie Fernmetastasen kommen. Ist der Primarius unter 5 cm groß, liegen zu 60% intrahepatische Metastasen vor. Bei einer Tumorgröße von über 5 cm sind intrahepatische Metastasen zu 95%
vorhanden.
Eine extrahepatische Metastasierung findet in folgende Organe statt:
• Lunge 30-50%
• Skelett 5-20%
• Nebenniere 15%
• ZNS 5-15%
• Peritoneum 5-15% [10]
1.1.6 TNM und Score Systeme des HCC
Für die klinische und prognostische Beurteilung des HCCs werden verschiedene Scoresysteme herangezogen. Am gebräuchlichsten sind der CLIP-Score (Cancer of the Liver Italian Program), das Okuda-Stadium, die TMN und BCLC-Klassifikation (Barcelona Clinic Liver Cancer Gruppe).
Andere Scoresysteme wie z.B. der CUPI-Score (Chinese University Prognostic Index), der JIS- Score (Japan Integrated Score) und der GETECH- Score (Groupe dEtude et de Traitement du Carcinome hepatocellulaire) sind weniger gebräuchlich.
20
1.1.6.1 TNM System
Das TNM System wurde für das HCC zuletzt 2010 aktualisiert [5].
Zu den regionären Lymphknoten zählen die hilären Lymphknoten entlang des Ductus choledochus, D. cysticus, der A. hepatica communis und V. portae, zudem Lymphknoten entlang der V. cava inferior oberhalb der Nierenvenen ohne die Lymphknoten unterhalb des Zwerchfells.
Tabelle 5: TNM- Klassifikation des HCC [5]
pT Primätumor
TX Primärtumor kann nicht beurteilt werden T0 Kein Anhalt für Primärtumor
T1 Solitärer Tumor ohne Gefäßinvasion
T2 Solitärer Tumor mit Gefäßinvasion oder multiple Tumore ≤ 5cm T3a Multiple Tumore > 5cm
T3b Tumor mit Befall eines größeren Astes des V. portae oder der Vv. hepaticae T4 Kontinuierliche Tumorinfiltration in angrenzende Organe außer Gallenblase oder
Tumorperforation des viszeralen Peritoneums pN Regionäre Lymphknoten
Nx Regionäre Lymphknoten können nicht beurteilt werden N0 Keine lokoregionären Lymphknotenmetastasen N1 lokoregionäre Lymphknotenmetastasen pM Fernmetastasen
MX Fernmetastasen können nicht beurteilt werden M0 Keine Fernmetastasen
M1 Fernmetastasen
Anhand der TNM-Klassifikation erfolgt die Stadieneinteilung der Tumorerkrankung nach UICC [4, 5, 26].
21
1.1.6.2 Stadieneinteilung nach UICC
Die Internationale Union gegen den Krebs hat für verschiede Tumorentitäten eine Stadieneinteilung je nach prognostischem Verlauf etabliert. Die Stadieneinteilung des HCC ist in Tabelle 6 zu sehen.
Tabelle 6: Stadieneinteilung nach International Union against Cancer (UICC) [26]
Stadium T N M
Stadium I T1 N0 M0
Stadium II T2 N0 M0
Stadium III A T3a N0 M0
Stadium III B T3b N0 M0
Stadium III C T4 N0 M0
Stadium IVA Jedes T N1 M0
Stadium IV B Jedes T Jedes N M1
In Ergänzung zur UICC-Klassifikation existieren weitere, überwiegend klinisch orientierte Klassifikationen, die im Folgenden kurz erläutert werden sollen.
1.1.6.3 Stadieneinteilung nach Okuda
Die Okuda-Klassifikation, erstmalig 1985 beschrieben ist in Tabelle 7 veranschaulicht [28].
22 Tabelle 7: Einteilung nach Okuda. Nach: Okuda K, Ohtsuki T, Obata , et al. Natural history of hepatocellolur carcinoma and prognosis in relation to treatment Cancer 1985, 56: 918-928 Kriterium 0 Punkte 1 Punkt
Leberbefall (%) ≤ 50 > 50
Aszites nein Ja
Bilirubin (mg/dl) ≤ 3 >3 Albumin (g/dl) > 3 ≤ 3
Tabelle 8: Stadieneinteilung nach Okuda [28]
Stadium Punkte 1-Jahresüberleben in %
I 0 39
II 1-2 12
III 3-4 3
1.1.6.4 CLIP-Score Einteilung
In einer 2002 veröffentlichten Arbeit des italienischen Leberkarzinom-Programms, welche die Child-Pugh, die Okuda und die CLIP-Einteilung verglich, zeigte siech eine bessere Prognoseprädiktion durch den, sogenannten CLIP-Score. Hier fließen vier Variablen in die Berechnung ein [30]. Der CLIP-Score wird durch Addieren der Unter- Scores der einzelnen Variablen errechnet wie Tabelle 9 zeigt [6].
23 Tabelle 9: Einteilung des HCC nach CLIP- Score [6]
Variable Punkte
Child- Pugh Stadium
A 0
B 1
C 2
Tumor Morphologie
Uninodular und Befall ≤ 50% 0
Multinodular und Befall ≥ 50% 1
Massiv oder Befall > 50% 2
Alpha Fetoprotein
< 400 µg/l 0
≥ 400µg/l 1
Pfortaderthrombose
Nein 0
ja 1
Daraus kann wie Tabelle 10 zeigt eine Prognose über das mediane Überleben gegeben werden [6]:
24 Tabelle 10: Höhe des CLIP-Score und medianes Überleben in Monaten
CLIP-Score Medianes Überleben in Monaten
0 31
1 27
2 13
3 8
4 2
5 2
6 2
1.1.6.5 BCLC- Score Einteilung
Für die Therapieentscheidung je nach HCC-Stadium wurde die Barcelona Clinic Liver Cancer (BCLC)-Klassifikation etabliert. Dieses Score-System wird von den meisten Zentren verwendet, da es mehrere Faktoren berücksichtigt [39]:
• Performance-Status der Eastern Cooperative Oncology Group (ECOG) (siehe Tabelle 12)
• Klinisch bestimmte Tumorausbreitung (Zahl und Größe Tumorherde, Gefäßinvasion und extrahepatische Ausbreitung)
• Okuda- Stadium
• Portale Hypertension
• Serumbilirubin
• Child- Pugh-Klassifikation
25 Tabelle 11: BCLC Klassifikation
Stadium AZ (WHO)
Tumor Okuda-
Stadium
Leberfunktion
A1-A2 0 Solitär I Child A, normales
Bilirubin, ohne/mit portaler Hypertension
A3 0 Solitär I Child A, erhöhtes Bili
A4 0 3 Herde <3cm I Child A-B
B 0 Groß/multilokulär I-II Child A-B
C 1-2 Gefäßeinbruch/extrahepatisch I-II Child A-B
D 3-4 jedes III Child C
Aufgrund des BCLC-Scores kann eine Therapieentscheidung bei HCC getroffen werden [38].
Nachfolgend wird der Performance- Status der Eastern Cooperative Oncology Group (ECOG) in Tabelle 12 aufgezeigt.
Tabelle 12: Performance- Status der Eastern Cooperative Oncology Group (ECOG).
ECOG Definition
0 Normale uneingeschränkte körperliche Aktivität
1 Mäßig eingeschränkte körperliche Aktivität und Arbeitsfähigkeit, nicht bettlägrig 2 Arbeitsunfähig, weniger als 50% bettlägrig, wachsendes Ausmaß an Pflege und
Unterstützung notwendig
3 Weitgehend unfähig, sich selbst zu versorgen, kontinuierliche Pflege oder hospitalisiert, rasche Progredienz des Leidens, mehr als 50% bettlägrig 4 Voll pflegebedürftig, 100% bettlägrig
26
In der aktuell gültigen deutschen AWMF Leitlinie wird übereinstimmend mit den aktuellen amerikanischen und europäischen Leitlinien die Benutzung der BCLC- Klassifikation empfohlen [20].
1.2 Therapeutische Optionen
Die aktuelle und zuletzt 2010 überarbeitete Behandlungsleitlinie teilt HCC-Patienten in fünf unterschiedliche Krankheitsstadien ein [27]:
• Sehr frühes Stadium =Very early stage = 0
• Frühes Stadium = Early stage =A
• Mittleres Stadium = Intermediate stage =B
• Fortgeschrittenes Stadium = Advances stage = C
• Endstadium = Terminal stage = D
Abbildung 4 veranschaulicht die sich daraus ergebenden klinischen Behandlungsstrategien.
27 Abbildung 4: Therapiealgorythmus HCC. Übernommen aus: EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma
Patienten mit hepatozellulärem Karzinom sollen in einem interdisziplinären Tumorboard vorgestellt werden. Je nach Krankheitsstadium bestehen die Therapiemöglichkeiten der operativen Therapie, der Lebertransplantation, lokal- ablative Verfahren, sowie medikamentöse Therapien.
28
1.2.1 Operative Therapieoptionen
Befindet sich der Patient im Krankheitsstadium „early-stage“ oder „very-early-stage“, können operative Maßnahmen erwogen werden. Es ist eine Lebertransplantation oder eine Leberteilresektion möglich.
1.2.1.1 Lebertransplantation
Bei Patienten mit HCC und bestehender Leberzirrhose ist die Lebertransplantation die optimale Therapieoption aus onkologischer wie auch funktioneller Sicht.
Allerdings ist das Verfahrend durch den bestehenden Organmangel limitiert. Daher dürfen innerhalb des Eurotransplant-Raumes nur HCC-Patienten, deren Tumore innerhalb der sogenannten Milan-Kriterien liegen, zur Lebertransplantation gelistet werden. Die Milan Kriterien sind:
• solitärer HCC Herd ≤ 5cm Größe
• oder bis zu drei Herde mit größtem Herd ≤ 3cm Größe.
2002 wurde die Priorität der Organzuteilung auf das MELD-System (Model for End- stages Liver Disease) umgestellt. Die Einführung des MELD-Scores führte zu einer effektiven Verringerung der Wartelistensterblichkeit [37].
In den MELD-Score fließen folgende Kriterien ein:
• Bilirubin
• INR
• Kreatinin
• Zudem ggf. "exceptional" MELD genannte Extrapunkte
Der MELD-Wert kann maximal 40 Punkte betragen. Je höher der MELD-Wert liegt, desto höher die Priorität des Patienten auf der Warteliste. Da allerdings höhere
29
MELD-Werte i.d.R. erst bei deutlich eingeschränkter Leberfunktion erreicht werden, und HCC Patienten innerhalb der Milan-Kriterien meiste einen (noch) gute Leberfunktion vorweisen, können gelistete Patienten im Rahmen des "e-MELD"
regelmäßige, dreimonatige, Extrapunkte erhalten, solange sie innerhalb der Milan- Kriterien verbleiben [40].
Grundsätzlich kann gesagt werden, dass Patienten mit Leberzirrhose und HCC, falls nicht bereits Lebertransplantationsgelistet, in einem Transplantationszentrum zur Listung vorgestellt werden.
Neuere Studien belegen, dass die Milan-Kriterien durchaus bei ähnlich guten Transplantationsergebnissen noch ausgeweitet werden könnten: beispielsweise entsprechend der UCSF-Kriterien (solitärer Herd unter oder gleich 6,5 cm oder bis zu drei Herden mit größtem Herd unter oder gleich 4,5 cm Größe). Momentan wird dies im Eurotransplan-Raum durch die Anzahl der Spenderlebern limitiert [41]. In Einzelfällen kann ein HCC-Patient außerhalb der Milan-Kriterien von einer Leberlebenspende profitieren. Zur Überbrückung der Wartezeit auf eine Transplantation gewinnen Therapieoptionen zum „Bridging“ wie transarterielle Chemoembolisation (TACE) oder Radiofrequenzablation (RFA) an Bedeutung. Lokal ablative Verfahren können zur Verzögerung des Tumorprogresses führen [41].
Nach Lebertransplantation liegt die 5- Jahres Überlebensrate zwischen 65-80%.
Eine sehr günstige Prognose nach Lebertransplantation ist bei kleinen HCC Herde in der zirrhotischen Leber zu erwarten. Hier ist die Prognose ähnlich gut wie bei nicht- neoplastischen Lebererkrankungen (4-Jahres ÜLR >70%).
1.2.1.2 Leberresektionen
Patienten, die nicht transplantabel sind, beziehungsweise keine Transplantation benötigen, aber mittels lokal-ablativer Verfahren oder Resektion potentiell kurativ behandelt werden können (very-early stage), sollten ggf. nach vorherigem Lokalablativem Verfahren der Resektion zugeführt werden. Voraussetzungen sind Child A oder B Zirrhose mit adäquater Leberfunktion. Bei Patienten mit Tumoren >
5cm und adäquater Leberfunktion sollte eine Resektion durchgeführt werden. Die
30
Indikation zur Resektion eines HCC sollte nur erfolgen, wenn eine R0- Resektion technisch in Betracht kommt. Hierfür ist eine ausführliche präoperative Diagnostik nötig, insbesondere die anatomische Lage des Tumors und die Leberfunktion sind zu berücksichtigen [31]. Bei der Operationsplanung muss die Leberfunktion und das Resektionsausmaß entsprechend abgeschätzt werden. Resektionen im Child-Pugh Stadium B oder C gehen mit einer stark erhöhten Letalität einher. Ebenso sind eine präoperative Leberverfettung, Cholestase oder Leberfibrose mit einzubeziehen. Ein präoperativ durchgeführtes CT-Abdomen mit Volumetrie zur Abschätzung der verbleibenden Lebervolumina ist empfohlen [32]. Bei nicht ausreichendem Restvolumen kann bei HCC Befall nur eines Leberlappens eine Pfortaderteilembolisation erwogen werden. Eine Hypertrophie der nicht-befallenen Leberseite kann eine zweitzeitigen Resektion ermöglichen. Patienten sind hierfür streng zu selektieren [48].
Falls keine Leberpathologie vorliegt, können bis zu 75% Lebervolumen reseziert werden.
Als nicht resezierbar gelten meist Tumoren mit bilobulärem Befall, makrovaskulärer Ausbreitung, Infiltration in Nachbarorgane und metastasierte HCC.
In den letzten Jahren ist die Operationsletalität und Hospitalletalität durch exakteres präoperatives Staging von 10-25% auf 5% gesunken. Die perioperative Morbidität sogenannter Major-Komplikationen wie Nachblutungen, Galleleck, und Pneumonie liegen heute in erfahrenen Zentren bei unter 10% [42].
In Einzelfällen kann mittels lokal ablativer Verfahren ein Down- staging bzw.
Downsizing bei initial inoperablen Tumoren erreicht werden. Hier stehen noch keine genauen Daten zur Verfügung [48].
1.2.2 Lokal- ablative Verfahren
Die lokal-ablativen Verfahren umfassen mehrere Methoden. Allen gemeinsam ist, dass die Tumorherde über einen Gefäßzugang oder direkt punktiert werden und dann mittels Medikamenteninjektion oder thermisch zerstört werden.
31
Perkutane Verfahren eignen sich zum einen für Patienten im Stadium „early –stage“
oder „intermediate-stage“ oder auch zum „Bridging“ bis zu einer Lebertransplantation falls die Milan- Kriterien noch erfüllt sind [43].
1.2.2.1 Radiofrequenzablation (= RFA)
Die Radiofrequenzablation zählt zu den thermoablativen Verfahren. Neben der Radiofrequenzablation zählen auch die Mikrowellenablation, die irreversible Elektorporation (IRE) sowie die Laserablation zu den meist perkutan eingesetzten Methoden. Allen Thermoablativen Verfahren gemeinsam ist, dass über eine Nadelelektrode Energie in den Tumor eingebracht wird. Eine Erwärmung erfolgt bis ca. 105 Grad Celsius. Dies führt zu einer Proteindenaturierung, zum Verschluss kleinerer Gefäße und zur Koagulationsnekrose. Die Radiofrequenz- Ablation sollte aufgrund der Datenlage als Standardmethode zur perkutanen Ablation angesehen werden [44]. Bezüglich der IRE handelt es sich um ein relativ neues Verfahren welches in Zentren bevorzugt durchgeführt wird, es ist in der momentan gültigen Leitlinie allerdings noch nicht empfohlen, da noch keine Vergleichsstudien vorliegen.
Es existieren eine Vielzahl von Studien, die die Wirksamkeit und Rezidivhäufigkeit nach einer RFA mit einer konventionellen Resektion verglichen haben. Hier konnten abhängig von der Patientenselektion, Tumoranzahl und Tumorgröße, sowie der Schwere der Leberzirrhose bei Herden bis 5cm Größe, keine signifikanten Unterschiede gefunden werden [45, 46]. In der RFA Gruppe, wurde weniger schwerwiegende Komplikationen und deutlich geringere Mortalitätsraten festgestellt [47].
Die Entscheidung, ob ein Patient einer Resektion oder einer RFA zugeführt werden sollte, sollte immer in einem interdisziplinären Tumorboard besprochen werden.
Ausmaß der portalen Hypertension, der Leberzirrhose und der Tumorgröße sind hier entscheidend.
32
1.2.2.2 perkutane Ethanolinjektion (PEI) / Essigsäure Ablation (PAI)
Mittels perkutaner Ethanol-oder Essigsäureinjektion wird der Tumor koaguliert. Es wird eine Koagulationsnekrose induziert. Kleine Gefäße verschließen sich, Proteine denaturieren. Dass hepatozelluläres Tumorgewebe häufig weicher und von einer Pseudokapsel umgeben ist, ist von Vorteil. Die PEI/PAI ist kostengünstig, kann häufig wiederholt werden und ist leicht durchführbar [49].
In einer aktuellen Metaanalyse wurde die RFA mit der PEI verglichen. Hier zeigte sich eine Überlegenheit der RFA hinsichtlich einer geringeren Lokalrezidivrate, besseren 1-,3-, und 5–Jahres-Überlebensraten, weniger Nebenwirkungen und weniger Komplikationen. So hat die RFA die PEI aus den meisten Zentren verdrängt [50].
1.2.2.3 Transarterielle Chemoembolisation (TACE)
Die transarterielle Chemoembolisation ist ein häufig eingesetztes Verfahren in der palliativen Behandlung des hepatozellulären Karzinoms. Als Indikationen zur TACE ist ein inoperabler Tumor sowie ein auf die Leber beschränkter Tumorbefall zu sehen Die TACE wird seltener auch als Bridging Verfahren bis zur Lebertransplantation angewendet. Ein Down-sizing hinsichtlich Tumorgröße und damit ggf. eine Möglichkeit der Resektion konnte bewiesen werden [52, 54]. Im Vergleich zu gesundem Lebergewebe oder Lebermetastasen ist das HCC überwiegend arteriell versorgt. Zunächst muss mittels Angiographie festgestellt werden, ob ein sogenannter Tumorblush (arterielle Versorgung des Tumors mittels Kontrastmittel- Blush) vorhanden ist. Ist dies der Fall, kann die TACE durchgeführt werden.
Als Zytostastatika werden häufig im Embolisat Anthrazykline oder Cisplatin benutzt.
Durch die TACE kommt es zu einer hoch konzentrierten Akkumulation der zytotoxischen Substanzen im HCC. Gegebenenfalls können zusätzliche Embolisationsmaterialien verwendet werden. Ein selektiver dauerhafter Verschluss der arteriellen Versorgung des HCC wird hier angestrebt.
33
Laut EASL-Empfehlung nach BCLC-Score sind für die TACE vor allem Patienten im intermediate- Stage geeignet [27]. Eine Überlegenheit der TACE gegenüber „Best- supportive- care“ konnte gezeigt werden [51]. Auch kann eine Kombination verschiedener lokal- ablativer Verfahren sinnvoll sein, z.B. eine Kombination von RFA und TACE [53, 55].
1.2.3 Strahlentherapie bei hepatozellulärem Karzinom
Lebergewebe hat nur eine geringe radiotherapeutische Toleranz. Außerdem besteht bei den meisten Patienten mit hepatozellulärem Karzinom eine schlechte Leberfunktion, was eine Strahlentherapie weitgehend limitiert. In den letzten Jahren wurden moderne Bestrahlungstechniken entwickelt, die relativ hohe Dosen an den Zielort applizieren, ohne umgebendes Gewebe massiv zu schädigen. Hierzu zählen die intensitätsmodulierte Radiotherapie (IMRT), die stereotaktische Bestrahlung (SRT), sowie die bildgestützte Radiotherapie (IGRT) [59]. Eine Protonen- und Kohlenstoffionenbestrahlung wird derzeit in Studien erprobt [58].
1.2.3.1 Selektive intraarterielle Radiotherapie (SIRT)
Die selektive intraarterielle Radiotherapie ist eine Therapieform, die ebenfalls intraarteriell über einen Angiographiekatheter eingebracht wird. Sie zählt zu den Brachytherapien.
Hierbei wird ein β-Strahler in die tumorversorgenden Gefäße eingebracht. Kleine Mikrosphären tragen hierbei den β-Strahler 90Yttrium. Das 90Yttrium zerfällt im Tumorgewebe und emittiert β-Strahlen. Diese haben eine geringe Energie (0,935 MeV) und eine Penetrationstiefe von durchschnittlich 2,5 mm in das Tumorgewebe.
Hierdurch wird umgebendes gesundes Lebergewebe geschont. Voraussetzung zur Durchführung einer SIRT sind Bilirubinwerte unter 2 mg/dl sowie eine maximale Erhöhung der Transaminasen um das 5-fache der Norm.
34
Bei der SIRT ist der embolisierende Effekt geringer als bei der TACE. Da über arterio-venöse Shunts strahlende Partikel in gesundes Lebergewebe oder extrahepatisches Gewebe verschleppt werden und dort Strahlenschäden bedingen können, ist eine entsprechende Shuntsituation zuvor ausschließen.
Die SIRT wurde bisher überwiegend für Patienten mit einem Teilverschluss der V.
portae verwendet. Bei Patienten mit Pfortaderthrombose und Leberzirrhose Child- Pugh Stadium A wurde das mediane Überleben nach SIRT mit 10,4 Monaten angegeben [57].
1.2.4 Chemotherapie bei hepatozellulärem Karzinom
Viele Zytostatika-Regimes sind im Laufe der Zeit in adjuvant/neoadjuvanter Form bis hin zur palliativen Chemotherapie beim hepatozellulären Karzinom getestet worden.
1.2.4.1 Adjuvante/neoadjuvante Chemotherapie nach Resektion oder Ablation
Aufgrund der erhöhten Rezidivrate (70%) nach erfolgter HCC Resektion oder Ablation wurden in der Vergangenheit verschiedene Regimes in Studien getestet.
Leider waren zum einen die Fallzahlen sehr klein, zum anderen ergaben sich widersprüchliche Ergebnisse. So gibt es bisher keine Empfehlung zur Durchführung einer adjuvanten/neoadjuvanten Chemotherapie, auch nicht mittels Interferon oder Sorafenib [56].
1.2.4.2 Chemotherapie allgemein
Zahlreiche Regimes sind zur Behandlung des HCC analysiert worden, meist in kleinen, nicht- randomisierten Phase-II-Studien. Das HCC ist ein relativ chemotherapie- resistenter Tumor. Dies mag daran liegen, dass das HCC eine große Zahl an p-Glycoprotein, Glutathion–S-transferase, Hitzeschockproteine und
35
Mutationen im p53 Gen exprimiert. Zudem ist die zytostatische Therapie häufig durch die zu Grunde liegende Leberfunktionseinschränkung stark limitiert.
Folgende Studien sollen beispielhaft aufgeführt werden, vergleiche auch Tabelle 39:
• Doxorubicin: Mehrere Studien wurden mit Doxorubicin Monotherapie
durchgeführt, (Patientenzahlen n= 106-445, das mediane Überleben lag bei 10,6 Wochen) [60]; Nach Doxorubicin plus Tamoxifen, (n= 38 Phase II Studie) lag das mediane progressiosfreie Überleben bei 7 Monaten [61]
• Fluorpyrimidine plus Leukovorin: Ansprechraten bis 28% [62], allerdings zum Teil auch deutlich niedriger [63]
• Kombinationschemotherapie: GEMOX (medianes Überleben 11,5 Monate) [65], XELOX (Progressionsfreies Überleben 4,1 Monate) [64], FOLFOX (Progressionsfreies Überleben 3 Monate) [66]
Zusammenfassend kann gesagt werden, dass sich über die Jahre kein Chemotherapieregime durchgesetzt hat. Die mittlere Überlebenszeit all dieser Regime ist kurz (4,4-11,6 Monate) und die Nebenwirkungsraten sind hoch.
1.2.5 Target Therapien
Prinzip der Target Therapie ist die direkte Antiangiogenese. Im Stadium C (advanced-stage) einer HCC Erkrankung nach der BCLC Einteilung wird eine molekular gezielte Therapie (Target Therapie) empfohlen [67]. Antiangiogense spielt ab einer Tumorgröße von 1,2 mm eine Rolle. Einzelne Parameter wie Gefäßdichte im Tumor (sichtbar in der histologischen Aufbereitung des Tumors) oder andere pro- angiogenetische Serumparameter (VEGF Spiegel) sind Prognoseparameter im Hinblick auf den Endpunkt Überleben bei HCC [76, 77,78].
Angiogenese und die Signalwege via Raf/MEK/ERK spielen in der Entwicklung des HCC eine große Rolle [105]. Eine Blockade tumorbefördernder Signalwege erschien daher erfolgsversprechend
36
Der Raf/MEK/ERK Signalweg spielt eine herausragende Rolle in der Regulation von Zellproliferation, Überleben der Zelle und Zelldifferenzierung bei HCC und stellt einen möglichen Therapieangriffspunkt dar [105]. Desweiteren ist VEGF- A ein multifunktionales angiogenetisches Zytokin, welches von den Tumorzellen selbst produziert wird. Zudem besitzt es eigene Rezeptoren (VEGFR-1-2, Neuropilin) im Gefäßendothel.
Die Expression der VEGF-mRNA korreliert mit der Vaskularisation im HCC. Durch Ligandenbindung wird der Rezeptor durch Phosphorylierung der Tyrosinkinasen aktiviert.
Dies führt zu:
• Steigerung der mikrovaskulären Permeabilität
• Reprogammierung der Genexpression
• Überlebensförderung der Endothelzellen
• Schutz vor Alterungsprozessen
• Induktion von Angiogenese
• Induktion von Lymphangiogenese
• Induktion von Endothelzellmigration und Teilung [79].
Tumorzellen können pro-angiogenetische Substanzen selbst bilden (z. B.: VEGF).
Dies stimuliert in autokriner und parakriner Weise auch das Tumorwachstum selbst über KDR und Flt-1 Rezeptoren.
Aufgrund der immunmodulatorischen Wirkung von VEGF kann von einer synergistischen Beziehung bei gleichzeitiger anti-angiogenetischer und anti- inflammatorischer Therapie ausgegangen werden. VEGF inhibiert die Ausreifung von CD34+ Zellen zu Dendriten und VEGF Spiegel im Serum können mit dem Grad der Makrophageninfiltration im Tumor korrelieren [80, 81,82].
Ein Medikament mit direkter antiangiogenetischer Wirkung ist Sorafenib.
37
1.2.5.1 Sorafenib
Sorafenib ist ein Multikinase-Inhibitor, welcher die Apoptose induziert und die Proliferation der Tumorzellen hemmt. Er wirkt zum einen auf Rezeptorebene auf die Zielzelle ein sowie über intrazelluläre Signalwege (siehe Abbildung 5).
Er greift an folgenden Zielstrukturen an:
• VEGF-1,-2,-3 = Rezeptor-Tyrosinkinasen der vaskulären endothelialen Wachstumsfaktoren
• Raf-1 + B-Raf = Serin-Threonin-Kinasen
• PDGFR-β = Plättchen-assoziierter Wachstumsfaktor- Rezeptor
• RAF/MEK/ERK- Signalwege
• Flt3 und c-KIT [68]
Abbildung 5: Angriffspunkte des Sorafenib, Übernommen aus: Wilhelm SM, Adnane L., Newell P., et al., “Preclinical overview of sorafenib, a multikinase inhibitor that targets both Raf and VEGF and PDGF receptor tyrosine kinase signaling”
38
Somit besitzt Sorafenib ein duales Wirkprinzip und beeinflusst die Tumor- Angiogenese und die Tumorzellproliferation. Im PLC/PRF/5 HCC Xenograft Maus Model konnte bewiesen werden, dass Sorafenib dosisabhängig das Tumorwachstum inhibiert. Sorafenib induziert Tumorzellapoptose und inhibiert den RAF Signalweg [70].
In der klinischen SHARP Studie wurden 602 Patienten randomisiert. 299 Patienten erhielten Sorafenib, 330 Patienten ein Placebo. Endpunkt der Studie waren HCC- Progress oder Abbruch wegen Nebenwirkungen.
Die Studie wurde nach der zweiten geplanten Interimsanalyse gestoppt, nachdem 321 Patienten verstorben waren, davon 143 in der Sorafenibgruppe. Patienten in der Sorafenibgruppe überlebten im Median 10,7 Monate. Die Patienten der Placebogruppe 7,9 Monate. Dieser Unterschied war mit p<0,001 hochsignifikant.
Nebenwirkungen waren vor allem Durchfall und Hand-Fuß Syndrom [69]. Im Übrigen war die Verträglichkeit der Sorafenib Therapie gut.
Diese Ergebnisse wurden in weiteren Studien bestätigt, so dass Sorafenib aktuell eine Option für Patienten mit fortgeschrittenem hepatozellulärem Karzinom (Fernmetastasen, lokal nicht kontrollierbar) und Leberzirrhose Child-Pugh Stadium A ist [71].
Bei Patienten mit Leberzirrhose Child B oder C konnte kein klarer Überlebensvorteil gesehen werden [72].
1.2.5.2 Programmed cell death protein 1-Inhibitoren (PD1- Inhibitoren)
Eine weitere Möglichkeit der Therapie, welche 2015 erstmals in der Literatur erwähnt wurde, sind PD1- Inhibitoren. Diese wirken vor allem immunmodulatorisch.Eine Überexpression von PD-L1 in HCC Zellen ist mit einer schlechten Prognose assoziiert. Deshalb wurde in einer Phase I/II Studie der monoklonale IgG4- AK PD1- Inhibitor Nivolumab verabreicht. Es wurden 41 Patienten eingeschlossen mit einem Child- Pugh Score von fünf (n=35) oder sechs (n=6), 77% dieser Patienten waren mit Sorafenib vorbehandelt. Zwanzig Patienten waren Hepatitis negativ, 19 Patienten
39
positiv. Ein gutes Ansprechen mit zwei kompletten Remissionen, sieben partiellen Remissionen und 18 stabilen Patienten wurde gesehen [133].
Somit stellt Immunmodulation durch PD1- Inhibitoren bei guten Ansprechraten und akzeptablem Nebenwirkungsprofil einen vielversprechenden Therapieansatz dar.
1.2.5.3 Andere Target- Therapien
Weltweit laufen momentan Studien mit verschiedenen Target- Therapien (Multikinase-Inhibitoren) in verschiedenen Studienphasen. Eine Übersicht gibt Tabelle13 [67].
Tabelle 13: Laufende Studien mit Target Therapie im HCC
Angriffspunkt Medikamentenname Studienphase
EGFR pathway inhibitors
EGFR Erlotinib Phase II/III
EGFR Cetuximab Phase II
EGFR, Her 2 Lapatinib Phase II
VEGF/BEGFR pathway inhibitors
VEGF-A Bevaziczumab Phase II
VEGFR-2 EGFR Vandetabib Phase II
VEGFR-1-3 AZD2171 Phase II
Ras/Raf/ MEK pathway inhibitors
Ras Lonarfanib Phase II
Raf-1, VEGRF-2-3, PDGRF, c- KIT
Sorafenib Approved for advanced HCC
Phase II/III in Combination
40
Angriffspunkt Medikamentenname Studienphase
MEK
PI3K/Akt/PTEN AZD 6244 Phase II
Pathway inhibitors
m- TOR Sirolimus Phase I/II
m- TOR Everolimus Phase I/II
Enhancing apoptosis
TRAIL-R1 Mapatumumab Phase I
Proteasome inhibitors
Proteasomes Bortezomib Phase I
HDAC inhibitoren
HDAC LBH 589 Phase I
HDAC Vorinostat Phase I
1.3 Auswahl der Studienmedikation
In der hier vorliegenden Studie wurden die Medikamente Pioglitazon, Rofecoxib und Capecitabin verwendet. Zunächst wird nun die Rationale dieser Auswahl aufgeführt.
Bei der Auswahl der Therapeutika stellt die Inflammationskontrolle das wichtigste therapeutische Prinizip dar.
So wurde beim metastasierten malignen Melanom eine anti-angiogenetische und anti-inflammatorische Therapie in Kombination mit niedrig dosierter metronomer Chemotherapie versus niedrig dosierter metronomer Chemotherapie alleine verabreicht. Die Ergebnisse zeigten einen signifikanten Unterschied im progressionsfreien Überleben von 2,0 Monaten im anti-inflammatorischen, angiogenetischen Arm versus 1,2 Monaten im Arm mit metronomer Chemotherapie [73]. Insbesondere zeigte sich bei metastasiertem Melanom, dass Inflammationskontrolle (Abfall des C- reaktiven Proteins) mit signifikant verlängertem Überleben verbunden war [73].
41
Diese hochinteressanten Ergebnisse führten zu einer Ausweitung entsprechender klinischer Studien zu antiinflammatorischen/antiangiogenetischer Therapienprinzipien auf weitere fortgeschrittene Tumoren wie dem fortgeschrittenen Magenkarzinom, Prostatakarzinom, multiplen Myelom, endemischen Kaposisarkom (Case-report mit Teilremission) [74], malignen vaskulären Tumoren [75] oder dem metastasiertem Nierenzellkarzinom. Diese Studien zeigten, dass die Modulation von "Hallmarks of Cancer" mit ausschließlich regulatorisch aktiven Substanzen ein hohes Potential in der Behandlung von Patienten in der Palliativphase aufweist [73, 74, 75].
Auch beim Nierenzellkarzinom war das CRP- Ansprechen mit einem signifikant verlängertem Progressions- freien Überleben verbunden [101].
1.3.1 Coxib
Bezüglich der Coxibe sind bisher mehrere Präparate in Studien erprobt worden.
Coxibe hemmen selektiv die Cyclooxygenase 2 (COX-2). Ein Schlüsselenzym der Prostaglandinsynthese. Über COX-2 vermittelte chronische Entzündungsprozesse kann eine karzinogene Wirkung entstehen [90].
In hepatozellulären Karzinomzellen konnten erhöhte COX-2 Spiegel nachgewiesen werden. Die Interaktionen zwischen COX-2 Signalwegen und den Signalwegen EGFR, Met, iNOS spricht für einen hier multimodalen Therapieansatz [86]. Die COX- 2-Inhibition führt zu Apoptose-Induktion und einer Reduktion der Tumorzellproliferation [83]. Zudem wirken Coxibe auch anti-inflammatorisch.
Im Tiermodel konnte Zellzyklusarrest, Apoptose-Induktion und Nekrose-Induktion durch die Gabe eines Coxibes in hepatozellulären Karzinomzellen nachgewiesen werden [88, 89].
Klinisch gibt es bisher nur Einzelfallberichte zu gutem Ansprechen auf eine Coxib- basierte Therapie [84, 85,87].
42
Zu Beginn der Studie wurde Rofecoxib (Vioxx®) verwendet, welches 2004 durch Etoricoxib (Arcoxia®) ersetzt wurde, nachdem Rofecoxib wegen zu hoher kardiovaskulärer Risiken vom Markt genommen werden musste [91].
1.3.2 Pioglitazone
Medikamente aus der Gruppe der Glitazone wirken als PPAR-α/γ Agonisten. Der Rezeptor PPAR-γ (Peroxisome proliferator-activated receptor γ) ist ein nukleärer Transkriptionsfaktor. Er ist ein nukleärer Rezeptor aus der Steroidrezeptorfamilie, und wird durch Liganden aktiviert. Beschrieben ist seine Rolle bei der Adipozytendifferenzierung und der Tumorgenese. Eine Hochregulierung der PPAR- γ- Expression ist bei malignen Tumoren beobachtet worden [121].
Beim Malignen Melanom stellte sich heraus, dass die PPAR-γ- Expression auf Melanomzellen mit einem besonders gutem Ansprechen auf eine Pioglitazon- haltige metronome Therapie verbunden ist [121]. Auch in hepatozellulären Karzinomzellen wurde eine erhöhte PPAR-γ-Expression nachgewiesen.
PPAR-γ-Agonisten hemmen die VEGF-vermittelte Angiogenese und induzieren Apoptose am Gefäßendothel im Tiermodell [92]. Desweiteren wurde bei Diethylnitrosamin-verursachtem HCC im Tiermodell eine Hemmung des Tumorwachstums durch Pioglitazone gesehen [93]. In einer weiteren präklinischen Studie wurde eine Inhibierung der frühen karzinogenen Transformation von Hepatozyten gesehen, allerdings kein Zelltod. Alle Ereignisse korrellierten mit einer Zunahme der Expression von „cyclin-dependent kinase inhibitor p27“ (kip1) [94].
Bei Patienten mit fortgeschrittenem malignem Melanom konnte gezeigt werden, dass das progressions-freie Überleben abhängig von der PPARγ-Expression ist [73]. Eine Absenkung des Serum C-reaktiven Proteins unter immunmodulatorischer Therapie war sowohl beim Melanom als auch beim Nierenzellkarzinom mit einer signifikanten Veränderung des Gesamtvolumens verbunden[73, 101].
43
1.3.3 Capecitabin
Capecitabin ist ein Fluoropyrimidin, welches oral gegeben werden kann. Es wird zügig und vollständig resorbiert und über drei Schritte zur Wirksubstanz 5- Fluorouracil (5-FU) metabolisiert [95]. Der letzte Metabolisierungsschritt wird durch die Thymidin-Phosphorylase katalysiert, die sich in Tumorzellen in höherer Konzentration als in normalen Geweben findet. Dadurch wird eine relative Tumorselektivität der zytotoxischen Wirkung von Capecitabin erreicht [96].
Capecitabin wird in einer Dosierung von 2xtgl 1g pro m2 Körperoberfläche verabreicht. Die Gabe erfolgt über 14 Tage, gefolgt von einer Woche Pause [97].
Die Effektivität von Capecitabin konnte bei Patienten mit hepatozellulärem Karzinom belegt werden. Zudem zeigte es ein geringes toxisches Profil auftretende Nebenwirkungen waren gut zu behandeln [98].
Die metronome niedrigdosierte Chemotherapie mittels Capecitabin wirkt immunmodulatorisch durch Depletion der T- Zellen.
Somit wird die anti-inflammatorische Therapie mit Pioglitazon und Coxibe und mittels Capecitabin als immunmodulatorischem und antiangiogenetischem Partner ergänzt.
1.3.4 Interaktionen
Metronome niedrigdosierte Chemotherapie reguliert Thrombospondin 1 hoch, PPARγ-Agonisten den korrespondierenden Rezeptor CD36. Es muss daher ein synergistischer Effekt zwischen beiden Therapieprinzipien angenommen werden [134].
COX-2 ist regelmäßig in malignen Tumoren stark überexprimmiert, durch Inhibition wird ein antiinflammatorischer/ antiangiogenetischer und immunmodulatorischer Effekt erreicht.
44
2 Material und Methoden (Studienprotokoll)
Im folgenden Teil wird das Studienprotokoll der vorliegenden Studie vorgestellt, sowie ein Überblick über die Studienpopulation gegeben.
2.1 Studienziele
Als Studienziele wurden in der hier vorliegenden Doktorarbeit die Effektivität im Sinne des progressionsfreien Überlebens und die Durchführbarkeit einer Kombinationstherapie mit Etoricoxib, Pioglitazone und Capecitabin bei Patienten mit HCC definiert.
2.1.1 Primäre Studienziele
Das primäre Studienziel umfasst die Bestimmung des progressionsfreien Überlebens.
2.1.2 Sekundäre Studienziele
Als sekundäre Studienziele wurden definiert:
• Die AFP Ansprechrate
• Die Ansprechrate/ Erfassung der Tumorgröße im Verlauf
• Die Gesamtüberlebensrate
• Die Beurteilung der Verträglichkeit der anti-angiogenetischen Therapie in Kombination mit Capecitabin und das Auftreten von schweren Toxizitäten
45
2.2 Art der Studie
In der vorliegenden Studie handelt es sich um eine multizentrische, prospektive nicht-kontrollierte Phase II Studie.
2.3 Patientenanzahl
Die Statistische Fallzahlkalkulation ergab eine Patientenanzahl von 35 Patienten, die hinsichtlich der Zielparameter ausgewertet werden sollten. Es wurden insgesamt 38 Patienten eingeschlossen. Diese Patientenpopulation entspricht der Stichprobe.
Im Verlauf der Studie wurde eine große Anzahl von Patienten für den Studieneinschluss "gescreent", welche die Einschlusskriterien aber nicht erfüllten.
Diese Patienten wurden studienanalog behandelt, da keine Behandlungsalternative außer „best- supportive-care“ zur Verfügung gestanden hätte.
So konnten weitere Therapiedaten gewonnen werden. In der analogen Patientengruppe befanden sich 23 Patienten. Die Eigenschaften der Patientengruppen werden zu einem späteren Zeitpunkt genauer beschrieben.
2.4 Zeitplan
Der Studienplan sah vor, die Patienten im Zeitraum von Januar 2004 bis Januar 2006 zu rekrutieren, mit einem Nachbeobachtungszeitraum von 1 Jahr.
In der Studiengruppe wurden Patienten vom Februar 2004 bis November 2006 rekrutiert.
In der analogen Gruppe wurden Patienten von April 2004 bis Oktober 2006 rekrutiert.
![Abb. 1: Weltweite altersstandardisierte HCC Inzidenzen, Geschlechtsspezifisch, modifiziert nach [1, 9] 0 10 20 30 40Ost- AsienSüd-Ost AsienSüdeuropaWesteuropa Zentral und OsteuropaDeutschland](https://thumb-eu.123doks.com/thumbv2/1library_info/5561544.1689428/12.892.97.795.147.386/weltweite-altersstandardisierte-inzidenzen-geschlechtsspezifisch-modifiziert-asiensüd-asiensüdeuropawesteuropa-osteuropadeutschland.webp)

![Tabelle 5: TNM- Klassifikation des HCC [5]](https://thumb-eu.123doks.com/thumbv2/1library_info/5561544.1689428/22.892.106.797.402.991/tabelle-tnm-klassifikation-des-hcc.webp)
![Tabelle 6: Stadieneinteilung nach International Union against Cancer (UICC) [26]](https://thumb-eu.123doks.com/thumbv2/1library_info/5561544.1689428/23.892.101.790.328.677/tabelle-stadieneinteilung-nach-international-union-cancer-uicc.webp)